实验室常用的干燥剂及干燥的气体
高中化学常用干燥剂有哪些?

高中化学常用干燥剂有哪些?1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
常用来干燥氢气、氧气和甲烷等气体。
5等实验室中常用的干燥剂及其特性实验室中常用的干燥剂及其特性①,价格便宜,吸水能力强,干燥速度较快。
吸水最终吸水产物为(30℃以下)Ca(OH)2因②个结晶水的硫酸钠(Na2SO4·10H2O)。
因其吸水容量大,且为中性盐,对酸性或碱性有机物都可适用,价格便宜,因此应用范围较广。
但常先用它来作初步干燥,除去大然③:白色粉末状,吸水容量大,吸水后形成带不同数目结晶水的硫酸镁)。
最终吸水产物为对各种有机物均不起化学反应,故为常用干燥剂。
特别是那些不能用无水④无水硫酸钙(CaSO4):白色粉末,吸水容量小,吸水后形成2CaSO4·H2O(100℃以下)。
虽然硫酸钙为中性盐,不与有机化合物起反应,但因其吸水容量小,没有前述几种干燥剂应用广泛。
由于硫酸钙吸水速度快,而且形成的结晶水合物在100℃以下较稳定,所以凡沸点在100℃以下的液体有机物,经无水硫酸钙干燥后,不必过滤就可以直接蒸馏。
如甲醇、乙醇、乙醚、丙酮、乙醛、苯等,用无水硫酸钙脱水处理效果良好。
⑤无水碳酸钾(K2CO3):白色粉末,是一种碱性干燥剂。
其吸水能力中等,能形成带两个结晶水的碳酸钾(K2CO3·2H2O),但是与水作用较慢。
常见无机干燥剂的应用
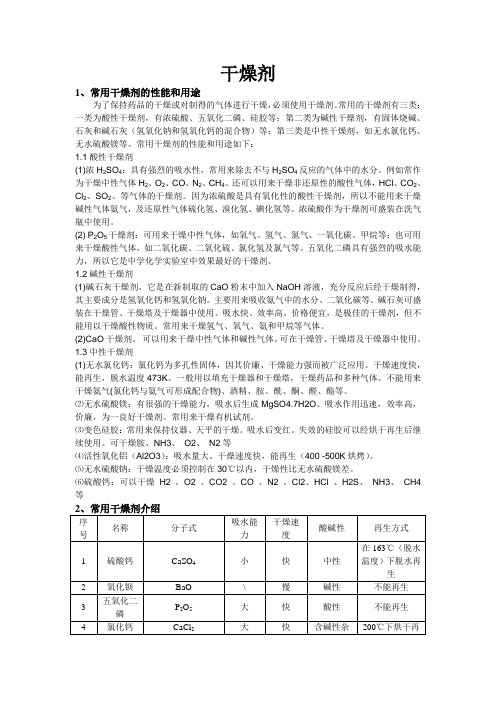
干燥剂1、常用干燥剂的性能和用途为了保持药品的干燥或对制得的气体进行干燥,必须使用干燥剂。
常用的干燥剂有三类:一类为酸性干燥剂,有浓硫酸、五氧化二磷、硅胶等;第二类为碱性干燥剂,有固体烧碱、石灰和碱石灰(氢氧化钠和氢氧化钙的混合物)等;第三类是中性干燥剂,如无水氯化钙、无水硫酸镁等。
常用干燥剂的性能和用途如下:1.1酸性干燥剂(1)浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为干燥中性气体H2、O2、CO、N2、CH4、还可以用来干燥非还原性的酸性气体,HCl、CO2、Cl2、SO2、等气体的干燥剂。
因为浓硫酸是具有氧化性的酸性干燥剂,所以不能用来干燥碱性气体氨气,及还原性气体硫化氢、溴化氢、碘化氢等。
浓硫酸作为干燥剂可盛装在洗气瓶中使用。
(2) P2O5干燥剂:可用来干燥中性气体,如氧气、氢气、氮气、一氧化碳、甲烷等;也可用来干燥酸性气体,如二氧化碳、二氧化硫、氯化氢及氯气等。
五氧化二磷具有强烈的吸水能力,所以它是中学化学实验室中效果最好的干燥剂。
1.2碱性干燥剂(1)碱石灰干燥剂。
它是在新制取的CaO粉末中加入NaOH溶液,充分反应后经干燥制得,其主要成分是氢氧化钙和氢氧化钠。
主要用来吸收氨气中的水分、二氧化碳等。
碱石灰可盛装在干燥管、干燥塔及干燥器中使用。
吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
常用来干燥氢气、氧气、氨和甲烷等气体。
(2)CaO干燥剂。
可以用来干燥中性气体和碱性气体。
可在干燥管、干燥塔及干燥器中使用。
1.3中性干燥剂(1)无水氯化钙:氯化钙为多孔性固体,因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨气(氯化钙与氨气可形成配合物)、酒精、胺、酰、酮、醛、酯等。
⑵无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
实验室常用的干燥剂有哪些

实验室常用的干燥剂有哪些
2016-06-12 13:13来源:内江洛伯尔材料科技有限公司作者:研发部
实验室常用的干燥剂
1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H
2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
党用来干燥氢气、氧气、氨和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、 O2、 N2等
6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2、O2、CO2、CO、N2、Cl2、HCl 、H2S、NH3、CH4等。
常用干燥剂有哪些

高中常用枯燥剂有哪些?1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反响的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的枯燥剂。
2、无水氯化钙:因其价廉、枯燥能力强而被广泛应用。
枯燥速度快,能再生,脱水温度473K。
一般用以填充枯燥器和枯燥塔,枯燥药品和多种气体。
不能用来枯燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的枯燥能力,吸水后生成MgSO4.7H2O。
吸水作用迅速,效率高,价廉,为一良好枯燥剂。
常用来枯燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格廉价,是极佳的枯燥剂,但不能用以枯燥酸性物质。
常用来枯燥氢气、氧气和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的枯燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可枯燥胺、NH3、O2、N2等6、活性氧化铝〔Al2O3〕:吸水量大、枯燥速度快,能再生〔400 -500K烘烤〕。
7、无水硫酸钠:枯燥温度必须控制在30℃以内,枯燥性比无水硫酸镁差。
8、硫酸钙:可以枯燥H2 。
O2 。
CO2 。
CO 、N2 。
Cl2、HCl 、H2S、NH3、CH4等1 实验室中常用的枯燥剂及其特性实验室中常用的枯燥剂及其特性①无水氯化钙〔CaCl2〕:无定形颗粒状(或块状),价格廉价,吸水能力强,枯燥速度较快。
吸水后形成含不同结晶水的水合物CaCl2·nH2O〔n=1,2,4,6〕。
最终吸水产物为CaCl2·6H2O 〔30℃以下),是实验室中常用的枯燥剂之一。
但是氯化钙能水解成Ca(OH)2 或Ca(OH)Cl ,因此不宜作为酸性物质或酸类的枯燥剂。
同时氯化钙易与醇类,胺类及某些醛、酮、酯形成分子络合物。
如与乙醇生成CaCl2·4C2H5OH、与甲胺生成CaCl2·2CH3NH2,与丙酮生成CaCl2·2(CH3)2CO 等,因此不能作为上述各类有机物的枯燥剂。
实验室常用的干燥剂及干燥的气体.

实验室常用的干燥剂及干燥的气体(1)按干燥剂的酸碱性可分为酸性干燥剂、中性干燥剂和碱性干燥剂三类:①酸性干燥剂包括浓硫酸、五氧化二磷、硅胶等。
②中性干燥剂有无水氯化钙等。
③碱性干燥剂包括碱石灰、氧化钙、固体氢氧化钠等。
(2)气体干燥剂的选择:①被干燥气体和干燥剂的酸碱性应一致。
②被干燥气体和干燥剂之间不发生反应。
如NH3易与CaCl2作用生成CaCl2·8NH3,故NH3不能用CaCl2干燥。
(3)常见气体的干燥与被干燥的气体:液态干燥剂装置固态干燥剂装置常见干燥剂:浓硫酸、无水氯化钙、碱石灰可干燥的气体浓硫酸:H2、O2、Cl2、SO2、CO2、CO、CH4、N2等无水氯化钙:H2、O2、Cl2、SO2、CO、CO2、CH4、HCl等碱石灰:H2、O2、CH4、NH3等不可干燥的气体浓硫酸:NH3、H2S、C2H4、HBr、HI等无水氯化钙:NH3等碱石灰:Cl2、HCl、H2S、SO2、CO2、NO2等无水硫酸铜(胆矾经过加热脱水处理后的白色粉末,化学式CuSO4,一遇水变蓝)通常实验用作证明有无水分存在。
无水硫酸铜在化学工业中用来制取其它铜盐的重要原料。
主要用于船底防污漆原料,干燥剂,催化剂等方面。
初中化学常见干燥剂有浓H2SO4、NaOH固体、CaO固体、碱石灰(CaO和NaOH 固体),无水氯化钙,五氧化二磷。
另:①,干燥剂的选择,既要看干燥剂的性质还要看所干燥物质的性质,如浓硫酸,是酸所以不能干燥碱性气体;另外浓硫酸还具有强氧化性,因此不能用来干燥还原性的物质,如H2S, HI ,HBr等②对液体干燥剂来说,一般装在洗气瓶中(气体从长管进,短管出).而固体干燥剂装在干燥管或U形管中.。
实验室中常用的干燥剂及其特性

实验室中常用的干燥剂及其特性①无水氯化钙(CaCl2):无定形颗粒状(或块状),价格便宜,吸水能力强,干燥速度较快。
吸水后形成含不同结晶水的水合物CaCl2·nH2O(n=1,2,4,6)。
最终吸水产物为CaCl2·6H2O (30℃以下),是实验室中常用的干燥剂之一。
但是氯化钙能水解成Ca(OH)2 或Ca(OH)Cl ,因此不宜作为酸性物质或酸类的干燥剂。
同时氯化钙易与醇类,胺类及某些醛、酮、酯形成分子络合物。
如与乙醇生成CaCl2·4C2H5OH、与甲胺生成CaCl2·2CH3NH2,与丙酮生成CaCl2·2(CH3)2CO 等,因此不能作为上述各类有机物的干燥剂。
②无水硫酸钠(Na2SO4):白色粉末状,吸水后形成带10个结晶水的硫酸钠(Na2SO4·10H2O)。
因其吸水容量大,且为中性盐,对酸性或碱性有机物都可适用,价格便宜,因此应用范围较广。
但它与水作用较慢,干燥程度不高。
当有机物中夹杂有大量水分时,常先用它来作初步干燥,除去大量水分,然后再用干燥效率高的干燥剂干燥。
使用前最好先放在蒸发皿中小心烘炒,除去水分,然后再用。
③无水硫酸镁(MgSO4):白色粉末状,吸水容量大,吸水后形成带不同数目结晶水的硫酸镁MgSO4·nH2O (n=1,2,4,5,6,7)。
最终吸水产物为MgSO4·7H2O(48℃以下)。
由于其吸水较快,且为中性化合物,对各种有机物均不起化学反应,故为常用干燥剂。
特别是那些不能用无水氯化钙干燥的有机物常用它来干燥。
④无水硫酸钙(CaSO4):白色粉末,吸水容量小,吸水后形成2CaSO4·H2O (100℃以下)。
虽然硫酸钙为中性盐,不与有机化合物起反应,但因其吸水容量小,没有前述几种干燥剂应用广泛。
由于硫酸钙吸水速度快,而且形成的结晶水合物在100℃以下较稳定,所以凡沸点在100℃以下的液体有机物,经无水硫酸钙干燥后,不必过滤就可以直接蒸馏。
常用干燥剂及其使用

实验室常用干燥剂及其使用除去固体、液体或气体内少量水分的方法称干燥。
有机实验中几乎所做的每一步反应都会遇到试剂、溶剂和产品的干燥问题,所以干燥是实验室中最普通但最重要的一项操作。
如果试剂和产品不进行干燥或干燥不完全,将直接影响有机反应、定性分析、定量分析、波谱鉴定和物理常数测定的结果。
干燥方法可分为物理方法与化学方法两种。
物理方法有吸附(包括离子交换树脂法和分子筛吸附法)、共沸蒸馏、分馏、冷冻、加热和真空干燥等,化学方法按去水作用的方式又可分为两类:一类与水能可逆地结合生成水合物,如氯化钙、硫酸钠等;一类与水会发生剧烈的化学反应,如金属钠、五氧化二磷等。
下面按有机物的物理状态介绍各种干燥的方法和实验操作。
1.固体的干燥(1)晾干:将待干燥的固体放在表面皿上或培养皿中,尽量平铺成一薄层、再用滤纸或培养皿覆盖上,以免灰尘沾污,然后在室温下放置直到干燥为止,这对于低沸点溶剂的除去是既经济又方便的方法。
(2)红外灯干燥:固体中如含有不易挥发的溶剂时,为了加速干燥,常用红外灯干燥。
干燥的温度应低于晶体的熔点,干燥时旁边可放一支温度计,以便控制温度。
要随时翻动固体,防止结块。
但对于常压下易升华或热稳定性差的结晶不能用红外灯干燥。
红外灯可用可调变压器来调节温度,使用时温度不要调得过高,严防水滴溅在灯泡上而发生炸裂。
(3)烘箱烘干:实验室内常用带有自动温度控制系统的电热鼓风干燥箱,其使用温度一般为50~300℃,通常使用温度应控制在100~200℃的范围内。
烘箱用来干燥无腐蚀、无挥发性、加热不分解的物品。
切忌将挥发、易燃、易爆物放在烘箱内烘烤,以免发生危险。
(4)干燥器干燥:普通干燥器一般适用于保存易潮解或升华的样品。
但干燥效率不高,所费时间较长。
干燥剂通常放在多孔瓷板下面,待干燥的样品用表面皿或培养皿装盛,置于瓷板上面,所用干燥剂由被除去溶剂的性质而定。
1. 变色硅胶是使用较普遍的干燥剂,其制备方法是:将无色硅胶平铺在盘中,在大气中放置几天,任其吸收水分,以减少应力,如果部分干燥的硅胶有内应力,浸入溶液中即会发生炸裂,变成更小的颗粒状,当吸收的水分使它质量增了原质量的1/5时,浸入20%氯化钴的乙醇溶液中,15~30分钟后取出晾干,再置于250~300℃的烘箱中活化至恒重,即得变色硅胶。
高中化学常用干燥剂

高中化学常用干燥剂(总3页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除高中化学常用干燥剂有哪些?1、浓H2SO4:具有强烈的吸水性,常用来除去不与H2SO4反应的气体中的水分。
例如常作为H2、O2、CO、SO2、N2、HCl、CH4、CO2、Cl2等气体的干燥剂。
2、无水氯化钙:因其价廉、干燥能力强而被广泛应用。
干燥速度快,能再生,脱水温度473K。
一般用以填充干燥器和干燥塔,干燥药品和多种气体。
不能用来干燥氨、酒精、胺、酰、酮、醛、酯等。
3、无水硫酸镁:有很强的干燥能力,吸水后生成。
吸水作用迅速,效率高,价廉,为一良好干燥剂。
常用来干燥有机试剂。
4、固体氢氧化钠和碱石灰:吸水快、效率高、价格便宜,是极佳的干燥剂,但不能用以干燥酸性物质。
常用来干燥氢气、氧气和甲烷等气体。
5、变色硅胶:常用来保持仪器、天平的干燥。
吸水后变红。
失效的硅胶可以经烘干再生后继续使用。
可干燥胺、NH3、 O2、 N2等6、活性氧化铝(Al2O3):吸水量大、干燥速度快,能再生(400 -500K烘烤)。
7、无水硫酸钠:干燥温度必须控制在30℃以内,干燥性比无水硫酸镁差。
8、硫酸钙:可以干燥H2 。
O2 。
CO2 。
CO 、N2 。
Cl2、HCl 、H2S、NH3、 CH4等1 实验室中常用的干燥剂及其特性实验室中常用的干燥剂及其特性①无水氯化钙(CaCl2):无定形颗粒状(或块状),价格便宜,吸水能力强,干燥速度较快。
吸水后形成含不同结晶水的水合物CaCl2·nH2O(n= 1,2,4,6)。
最终吸水产物为CaCl2·6H2O (30℃以下),是实验室中常用的干燥剂之一。
但是氯化钙能水解成Ca(OH)2 或Ca(OH)Cl ,因此不宜作为酸性物质或酸类的干燥剂。
同时氯化钙易与醇类,胺类及某些醛、酮、酯形成分子络合物。
如与乙醇生成CaCl2·4C2H5OH、与甲胺生成CaCl2·2CH3NH2,与丙酮生成CaCl2·2(CH3)2CO 等,因此不能作为上述各类有机物的干燥剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室常用的干燥剂及干燥的气体
(1)按干燥剂的酸碱性可分为酸性干燥剂、中性干燥剂和碱性干燥剂三类:
①酸性干燥剂包括浓硫酸、五氧化二磷、硅胶等。
②中性干燥剂有无水氯化钙等。
③碱性干燥剂包括碱石灰、氧化钙、固体氢氧化钠等。
(2)气体干燥剂的选择:
①被干燥气体和干燥剂的酸碱性应一致
②被干燥气体和干燥剂之间不发生反应。
如NH易与CaCl2作用生成
CaCl2 • 8NH3,故NH不能用CaCl2干燥。
(3)常见气体的干燥与被干燥的气体: 液态干燥剂装置
固态干燥剂装置
常见干燥剂:浓硫酸、无水氯化钙、碱石灰
可干燥的气体
浓硫酸:H、Q、Cl2、SO、CO、CO CH、N2等
无水氯化钙:H、O2、Cl2、SO、CO CO、CH、HCl 等
碱石灰:冲、O、CH、NH3 等
不可干燥的气体
浓硫酸:NH、HS C2T、HBr、HI 等
无水氯化钙:NH等
碱石灰:Cl2、HCl、HS、SO、CO、NO等
无水硫酸铜(胆矶经过加热脱水处理后的白色粉末,化学式CuSO4,—遇水变蓝)通常实验用作证明有无水分存在。
无水硫酸铜在化学工业中用来制取其它铜盐的重要原料。
主要用于船底防污漆原料,干燥剂,催化剂等方面。
初中化学常见干燥剂有浓H2SO4 NaOF固体、CaO固体、碱石灰(CaO和NaOH 固体),无水氯化钙,五氧化二磷。
另:①,干燥剂的选择,既要看干燥剂的性质还要看所干燥物质的性质,如浓硫酸,是酸所以不能干燥碱性气体;另外浓硫酸还具有强氧化性,因此不能用来干燥还原性的物质,如H2S, HI ,HBr等
②对液体干燥剂来说,一般装在洗气瓶中(气体从长管进,短管出)•而固体干燥剂装在干燥管或U形管中.。
