铬-锰及其化合物
实验七、八 铬、锰、铁、钴、镍

实验9 铬、锰及其化合物的性质一、实验目的掌握铬、锰主要氧化态化合物的性质。
二、实验原理1、铬及其化合物的性质Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2Cr 2O 72-Cr 3+Cr 2+Cr 1.33-0.41-0.91-0.74E A 0/VE B 0/VCrO 42-Cr(OH)3Cr(OH)2Cr-0.13-1.1-1.4在酸性介质中,+2氧化态具有强的还原性,+6氧化态具有氧化性,Cr 3+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为Cr 2O 72-;在碱性介质中,+6氧化态稳定(CrO 42-)。
Cr 2O 3和Cr (OH )3显两性。
Cr 3+Cr(OH)34]-((绿色)--铬(VI )最重要的化合物为K 2Cr 2O 7,在水溶液中Cr 2O 72-和CrO 42-存在下列平衡:Cr 2O 72-CrO 42-+2H 2OH+2+(橙红色)(黄色)在碱性溶液中,[Cr(OH)4]-可以被过氧化氢氧化为CrO 42-。
在酸性溶液中CrO 42-转变为Cr 2O 72-。
Cr 2O 72-与过氧化氢反应能生成深蓝色的CrO 5,由此可以鉴定Cr 3+。
2、Mn价电子结构3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2+在酸性溶液中的稳定性大于在碱性溶液中:酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化Mn 2+H 2O7Mn2+NaBiO 3H+Na +Bi 3+MnO 4-25145+++5+2+碱性介质:Mn 2+2+OH -Mn(OH)2(白色沉淀)O 2MnO(OH)2(棕色)Mn (IV )化合物重要的是MnO 2,在酸性溶液中具有氧化性。
Mn (VI )化合物重要的是MnO 42-,Mn (VII )化合物重要的是MnO 4-E A 0/VE B 0/VMnO 4-MnO 42-MnO 2MnO 4-MnO 42-MnO20.562.260.560.60MnO 42-存在于强碱溶液中,在酸性,中性环境中均发生歧化。
实验报告_铬_锰

一、实验目的1. 了解铬和锰的物理性质、化学性质及反应特点;2. 掌握铬和锰在酸、碱、盐溶液中的反应规律;3. 分析铬和锰在工业生产中的应用。
二、实验原理1. 铬(Cr):铬是一种银白色金属,具有光泽,熔点高,硬度大。
铬在常温下不与氧气、水反应,但在高温下能与氧气反应生成Cr2O3。
铬具有多种氧化态,其中+3价和+6价较为稳定。
铬的氧化还原反应如下:(1)氧化反应:Cr + 2H2O2 + 4H+ = Cr2O72- + 4H2O(2)还原反应:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O2. 锰(Mn):锰是一种银白色金属,具有光泽,熔点高,硬度大。
锰在常温下不与氧气、水反应,但在高温下能与氧气反应生成MnO2。
锰具有多种氧化态,其中+2价和+4价较为稳定。
锰的氧化还原反应如下:(1)氧化反应:Mn + 2H2O2 + 2H+ = MnO2 + 2H2O(2)还原反应:MnO2 + 4H+ + 2e- = Mn2+ + 2H2O三、实验仪器与药品1. 仪器:试管、烧杯、酒精灯、滴管、试管夹、铁架台、滤纸、蒸馏水等。
2. 药品:铬粉、锰粉、硫酸、盐酸、氢氧化钠、氯化钠、氯化钾、硫酸铜、硫酸铁、硫酸亚铁、硫酸锰、硫酸钾等。
四、实验步骤1. 铬的氧化还原反应实验:(1)取一支试管,加入少量铬粉;(2)加入少量硫酸,搅拌至铬粉溶解;(3)滴加少量氢氧化钠溶液,观察溶液颜色变化;(4)滴加少量硫酸,观察溶液颜色变化。
2. 锰的氧化还原反应实验:(1)取一支试管,加入少量锰粉;(2)加入少量硫酸,搅拌至锰粉溶解;(3)滴加少量氢氧化钠溶液,观察溶液颜色变化;(4)滴加少量硫酸,观察溶液颜色变化。
3. 铬和锰的置换反应实验:(1)取一支试管,加入少量铬粉;(2)加入少量硫酸铜溶液,观察溶液颜色变化;(3)取一支试管,加入少量锰粉;(4)加入少量硫酸铜溶液,观察溶液颜色变化。
铬锰氮耐热钢化学成分

铬锰氮耐热钢化学成分
铬锰氮耐热钢是一种具有优异耐热性能的特种钢材,其化学成分对其性能具有重要影响。
本文将从铬、锰和氮三个方面介绍铬锰氮耐热钢的化学成分。
一、铬的作用
铬是铬锰氮耐热钢中的主要合金元素之一,其含量通常在10%到30%之间。
在铬锰氮耐热钢中,铬的主要作用是增加钢的耐热性能和耐腐蚀性能。
铬能够与钢中的其他元素形成稳定的氧化膜,提高钢的耐腐蚀性能。
此外,铬还能够在高温下形成稳定的碳化物,增加钢的耐热性能。
二、锰的作用
锰是铬锰氮耐热钢中的另一个重要合金元素,其含量通常在0.5%到2%之间。
锰的主要作用是增强钢的强度和韧性。
锰能够与铁形成固溶体,强化钢的晶格结构,提高钢的强度。
此外,锰还能够与硫形成硫化锰,抑制钢中的硫脆性,提高钢的韧性。
三、氮的作用
氮是铬锰氮耐热钢中的一个重要合金元素,其含量通常在0.05%到0.3%之间。
氮的主要作用是增加钢的强度和硬度。
氮能够与铁形成固溶体,强化钢的晶格结构,提高钢的强度和硬度。
此外,氮还能够与铬形成氮化铬,增加钢的耐热性能。
铬锰氮耐热钢的化学成分对其性能具有重要影响。
铬能够增加钢的耐热性能和耐腐蚀性能,锰能够增强钢的强度和韧性,氮能够增加钢的强度和硬度。
因此,在铬锰氮耐热钢的制备过程中,合理控制化学成分的含量是至关重要的。
只有合理调配这三个元素的含量,才能获得具有优异耐热性能的铬锰氮耐热钢。
附:铬锰氮耐热钢的化学成分示意表
元素含量
铬 10%-30%
锰 0.5%-2%。
铬,锰及其化合物的相关性质的实验报告

铬,锰及其化合物的相关性质的实验报告铬、锰及其化合物的相关性质1。
了解铬和锰的各种常见化合物的形成和性质2.掌握铬和锰的各种氧化态之间的转化条件。
3。
了解铬和锰化合物的氧化还原以及介质对氧化还原产物的影响1.Cr用于还原Cr3+或Cr2O72-,天蓝色Cr2+2 Cr+Zn = 2cr+znCr2O 72-+4zn+14h+= 2cr 2+4zn 2++3+2+2++7h 20灰绿色由于+cr2s3在水中完全水解:2cr 3+3s 2-+6h2o = 2cr(OH)3++3 H2S在碱性溶液中,[铬(OH) 4]-具有很强的还原性,可被氧化成CrO 42-: 2[铬(OH)4]-+33在酸性溶液中,只有强氧化剂如K2S2O8+或高锰酸钾才能将Cr3氧化成Cr2O 3 72-:+2CR 3+3S2O 82-+7H2O = Cr2O 3 72-++6 so42-+14h+,Cr2O72-是强氧化剂。
例如:k2cr2o7+14hcl(浓缩)= 2c rcl 3+3c L2+2kcl+7h2o重铬酸盐的溶解度大于铬酸盐。
因此,当向重铬酸盐溶液中加入银离子、铅离子、钡离子等离子体时,通常会产生铬酸盐沉淀。
例如: Cr2O72-+4ag ++ H2O = 2ag 2 cro 4(砖红色)+2h+Cr2O 72-+2ba 2 ++ H2O = 2bacro 4(黄色)+2h+在酸性溶液中,Cr2O 72-和H2O2可以生成深蓝色加合物CrO5,但它不稳定,会迅速分解为铬和氧如果提取到乙醚或戊醇中,它会更加稳定。
主要反应为:3+cr2o 72-+4h 202+2h+= 2cro(O2)(深蓝)+5h 20cro(O2)2+(C2 H5)2O = cro(O2)2(C2 H5)2O(深蓝)4 cro(O2)2+12h+= 4c R3+7o 2+9 cr2o 72-+4h 202+2h+= 2cro(O2)(深蓝)2.锰锰(氢氧化物)2在浓硫酸中易被氧化。
【一轮视导】铬、锰、钒、钴、镍及其化合物

(1)硫酸溶矿主要反应的化学方程式为_______。为提高溶矿速率,可采取的措施_______(举1例)。
(2)加入少量MnO2的作用是_______。不宜使用H2O2替代MnO2,原因是_______。
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=_______mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是_______。
已知:①雷尼 暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
(2)Cr(Ⅲ)在酸性条件下以Cr3+存在,碱性条件下以Cr(OH)3、[Cr(OH)4]-(或CrO )存在。
①Cr3+在酸性条件下是稳定的,只能被强氧化剂氧化,如:
2Cr3++3PbO2+H2O===3Pb2++Cr2O +2H+。
但在碱性条件下能被氧化成CrO ,2Cr3++3H2O2+10OH-===2CrO +8H2O。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧键的数目为_______。
(3)“氧化”中,用石灰乳调节 , 被 氧化为 ,该反应 离子方程式为_______( 的电离第一步完全,第二步微弱);滤渣的成分为 、_______(填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。 体积分数为_______时, (Ⅱ)氧化速率最大;继续增大 体积分数时, (Ⅱ)氧化速率减小的原因是_______。
3MnO +4H+===2MnO +MnO2↓+2H2O
(3)KMnO4的性质
热稳定性差,通常保存在棕色试剂瓶中:4KMnO4+2H2O 4MnO2↓+3O2↑+4KOH。
①在酸性介质中,MnO 具有强氧化性,可以氧化Fe2+、Cl-、H2C2O4、H2O2等,本身被还原为Mn2+。
(完整版)铬、锰及其化合物的性质(精)

铬、锰及其化合物的性质一、实验目的掌握铬、锰主要氧化态化合物的性质。
二、实验原理1、铬及其化合物的性质Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2Cr 2O 72-Cr 3+Cr 2+Cr1.33-0.41-0.91-0.74E A 0/VE B 0/VCrO 42-Cr(OH)3Cr(OH)2Cr-0.13-1.1-1.4在酸性介质中,+2氧化态具有强的还原性,+6氧化态具有氧化性,Cr 3+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为Cr 2O 72-;在碱性介质中,+6氧化态稳定(CrO 42-)。
Cr 2O 3和Cr(OH )3显两性。
Cr 3+Cr(OH)34]-((绿色)--铬(VI )最重要的化合物为K 2Cr 2O 7,在水溶液中Cr 2O 72-和CrO 42-存在下列平衡:Cr 2O 72-CrO 42-+2H 2O H +2+(橙红色)(黄色)在碱性溶液中,[Cr(OH )4]—可以被过氧化氢氧化为CrO 42-。
在酸性溶液中CrO 42-转变为Cr 2O 72-。
Cr 2O 72-与过氧化氢反应能生成深蓝色的CrO 5,由此可以鉴定Cr 3+。
2、Mn价电子结构3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2+在酸性溶液中的稳定性大于在碱性溶液中:酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化Mn 2+H 2O7Mn2+NaBiO 3H+Na +Bi 3+MnO 4-25145+++5+2+碱性介质:Mn 2+2+OH -Mn(OH)2(白色沉淀)O 2MnO(OH)2(棕色)Mn (IV )化合物重要的是MnO 2,在酸性溶液中具有氧化性。
Mn(VI )化合物重要的是MnO 42-,Mn (VII )化合物重要的是MnO 4-E A 0/VE B 0/VMnO 4-MnO 42-MnO 2MnO 4-MnO 42-MnO20.562.260.560.60MnO 42-存在于强碱溶液中,在酸性,中性环境中均发生歧化。
讲义-铬、锰、铁、钴、镍及其化合物的性质和反应-土木专业
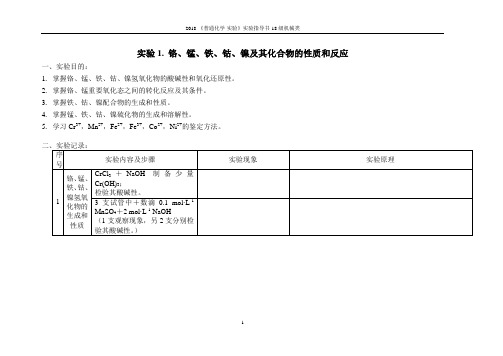
实验1. 铬、锰、铁、钴、镍及其化合物的性质和反应
一、实验目的:
1.掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2.掌握铬、锰重要氧化态之间的转化反应及其条件。
3.掌握铁、钴、镍配合物的生成和性质。
4.掌握锰、铁、钴、镍硫化物的生成和溶解性。
5.学习Cr3+,Mn2+,Fe2+,Fe3+,Co2+,Ni2+的鉴定方法。
三、注意事项:
1.在制备Mn(OH)2沉淀时,一定要用长滴管深入到溶液底部,将NaOH溶液挤出。
2.Cr(OH)3的颜色是灰绿色,容易被Cr3+的颜色掩盖,要注意观察。
加入NaOH溶液的速度不能太快,否则难以观察到沉淀
的生成。
3.在检验Ni(OH)2沉淀酸碱性时,要用比较强的氧化剂将其氧化。
四、思考题
1. 在Co(OH)3 中加入浓HCl,有时会生成蓝色溶液,加水稀释后变为粉红色,试解释之。
2. K2Cr2O7溶液中加入Pb(NO3)2和AgNO3溶液会发生什么反应?
五、实验体会和建议。
常见金属元素及其化合物—铬锰铁元素及其化合物的性质识用

可氧化物种 SO32- I- Cl-
H2S
Fe2+ Sn2+
产物
SO42- I2 Cl2 S 或 SO42- Fe3+ Sn4+
溶液的酸度不同, MnO4- 被还原的
产物不同
2MnO4 5SO32 6H 2Mn2 5SO24 3H2O 2MnO4 3SO32 H2O 2MnO2 3SO24 2OH2MnO4 SO32 2OH (浓) 2MnO24- SO24 H2O 2MnO4 5H2C2O4 6H 2Mn2 10CO2 8H2O
MnO2↓+ 2MnO4- + 2H2O
当以氧化剂(如氯气)作用于锰酸盐的溶液时,锰酸盐 可以变为高锰酸盐。
2MnO42- +Cl2
2MnO4- + 2Cl-
K2MnO4
①暗绿色晶体; ②在浓碱性溶液中稳定存在; ③在水溶液中易歧化。
3MnO24 4H MnO2 2MnO4 2H2O
3MnO24
铁的重要 化合物
氯化铁 FeCl3
颜色和 状态 密度
(g·cm-3) 熔点/℃
受热时 的变化
黑褐色 层状晶体
2.898
306 371℃时沸腾,
部分分解, 100℃时已显著 挥发,见光还
原为 FeCl2。 FeCl3·6H2O 37℃熔化, 100℃挥发, 250℃分解出
Fe2O3 等
硝酸铁 Fe(NO3)3·
2 Mn2+ + 5 S2O82- + 8 H2O = 2 MnO4- + 10 SO42- + 16 H+ 2 Mn2+ + 5 H5IO6 = 2 MnO4- + 5 HIO3 + 7 H2O + 6 H+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铬,锰及其化合物
1. 铬
在酸性条件下,用锌还原Cr3+或Cr2O72-,均可得到天蓝色的Cr2+
2Cr3++Zn =2Cr2++Zn2+
Cr2O72-+4Zn +14H+=2Cr2++4Zn2++7H2O 灰绿色的Cr(OH)3呈两性:
Cr(OH)3+3H+=Cr3++3H2O
Cr(OH)3+OH-=[Cr(OH)4]-(亮绿色)
向含有Cr3+的溶液中加入Na2S并不生成Cr2S3,因为Cr2S3在水中完全水解:
2Cr3++3S2-+6H2O =2Cr(OH)3+3H2S
在碱性溶液中,[Cr(OH)4]-具有较强的还原性,可被H2O2氧化为CrO42-:2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O 但在酸性溶液中,Cr3+的还原性较弱,只有象K2S2O8或KMnO4等强氧化剂才能将Cr3+氧化为Cr2O72-:
2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+在酸性溶液中,Cr2O72-是强氧化剂,例如:
K2Cr2O7 +14HCl(浓)=2CrCl3+3Cl2+2KCl +7H2O 重铬酸盐的溶解度较铬酸盐的溶解度大,因此,向重铬酸盐溶液中加Ag+、Pb+、Ba2+等离子时,通常生成铬酸盐沉淀,例如:
Cr2O72-+4Ag++H2O =2Ag2CrO4(砖红色)+2H+
Cr2O72-+2Ba2++H2O =2BaCrO4(黄色)+2H+
在酸性溶液中,Cr2O72-与H2O2能生成深蓝色的加合物CrO5,但它不稳定,会很快分解为Cr3+和O2。
若被萃取到乙醚或戊醇中则稳定得多。
主要反应为:Cr2O72-+4H2O2+2H+=2CrO(O2)2(深蓝)+5H2O
CrO(O2)2+(C2H5)2O =CrO(O2)2(C2H5)2O(深蓝)
4CrO(O2)2+12H+=4Cr3++7O2+6H2O
此反应用来鉴定Cr(Ⅵ)或Cr(Ⅲ)。
2. 锰
Mn(OH)2易被氧化
Mn2++2OH-=Mn(OH)2(s)(白色)
2Mn(OH)2+O2=2MnO(OH)2(s)(棕色)在浓硫酸中,MnSO4与KMnO4反应可生成深红色的Mn3+(实际是硫酸根的配合物):
MnO4-+4Mn2++8H+=5Mn3++4H2O
Mn3+可存在于浓硫酸中,若酸度降低,则Mn3+歧化为Mn2+和MnO2:2Mn3++2H2O =Mn2++MnO2(s)+4H+
在中性或近中性的溶液中,MnO4-与Mn2+反应生成MnO2:
2MnO4-+3Mn2++2H2O =5MnO2(s)+4H+在酸性介质中,MnO2是较强的氧化剂,本身被还原为Mn2+:
2MnO2+2H2SO4(浓)== 2MnSO4+O2+2H2O
MnO2+4HCl(浓)== MnCl2+Cl2+2H2O
后一反应用于实验室中制取少量氯气。
在强碱性溶液中,MnO4-能发生下列反应,生成浅蓝色的不稳定的MnO3-,
并放出氧气:
2MnO4-=2MnO3-+O2
MnO3-进一步歧化反应:
2MnO3-=MnO42-+MnO2
在强碱条件下,强氧化剂能把MnO2氧化成绿色的MnO42-
2MnO4-+MnO2+4OH-=3MnO42-+2H2O
MnO42-只在强碱性(pH>13.5)溶液中才能稳定存在,在中性或酸性介质中,MnO42-发生歧化反应:
3MnO42-+4H+=2MnO4-+MnO2+2H2O
在有硝酸存在下,Mn2+可被NaBiO3或PbO2氧化成MnO4-,例如:
5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na+ + 7H2O。
