实验十、d区元素(铬,锰,铁,钴,镍)化合物的性质与应用
铬锰铁钴镍实验报告

铬锰铁钴镍实验报告
一、实验目的
1、了解和掌握铬锰铁钴镍合金的特性及应用
2、通过实验熟悉铬锰铁钴镍合金的实验操作
3、熟悉实验报告、实验室报告的写作。
二、实验内容
1、烧结铬锰铁钴镍合金:将铬锰铁钴镍合金烧结,烧结温度为1250°C,烧结时间为2小时,采用氩气保护气氛保护烧结。
2、形态、显微组织的观察:观察形态变化,利用金相显微镜观察熔体组织及少量金属材料的显微组织。
3、物理性能测试:采用硬度测试及抗拉强度、塑性模量三项物理性能参数测试,确定物理性能。
4、化学分析:采用光谱分析方法进行化学成分分析。
三、实验结果
1、实验结果:烧结后的铬锰铁钴镍合金形态漂亮,显微组织完好,未能观察到明显的不良晶粒组织等。
2、物理性能测试:硬度为47~49HRC,抗拉强度为530MPa,塑性模量为200Gpa。
3、化学分析:铬含量为8.9%,锰含量为20.2%,铁含量为9.3%,钴含量为3.6%,镍含量为57.9%。
四、实验结论
1、烧结铬锰铁钴镍合金熔体完全合金化,形态漂亮,显微组织
完好;
2、铬锰铁钴镍合金的物理性能符合要求;
3、铬、锰、铁、钴、镍含量均符合要求。
有关“d区元素性质实验”思考题的解答

有关“d区元素性质实验”思考题的解答有关“d区元素性质实验”思考题的解答与P区元素性质实验相比较,学生对d区元素性质实验问题的回答,多感觉有一些把握不准。
这是因为大家对这些化合物接触及了解的都少,且其不遵守所谓“规律性”的现象也较多的缘故。
因而,这部分内容也是一个学习上的难点。
一、“铬、锰、铁、钴、镍实验”思考题1.试总结铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
在低价的Cr(OH)3、Mn(OH)2、Fe(OH)2、Co(OH)2、Ni(OH)2中,只有Cr(OH)3有显著的两性,其余都表现为碱性(只与酸反应,而不与NaOH反应)。
比较他们的还原性,其中Fe(OH)2和Mn(OH)2的还原性最强(能被空气中的氧气氧化)。
对高价的H2CrO4、HMnO4、Fe(OH)3、Co(OH)3、Ni2O3·H2O来说,前两个H2CrO4和HMnO4表现为酸性,后3个通常表现为碱性。
这些高价的化合物都有氧化性,但其中Fe(OH)3的氧化性最弱、H2CrO4、HMnO4次之(已相当强)、Co(OH)3、Ni2O3·H2O 的氧化性最强。
2. 在Co(OH)3中加入浓HCl,有时会生成蓝色溶液,加水稀释后变为粉红色,试解释之。
Co(OH)3与浓HCl的反应并不只是一个简单的酸碱反应。
由于Co3 有强氧化性,能被Cl-离子还原成Co2 ,而Co2 离子又以配离子[CoCl6]4-的形式在溶液中存在。
所以反应方程式为:2Co(OH)3 6H14Cl- = 2[CoCl6]4- Cl2 6H2O。
其中的配离子[CoCl6]4-为蓝色。
由于配离子[CoCl6]4-并不稳定,加水稀释使溶液中Cl-离子浓度降低时,又有[Co(H2O)6]2 配离子(粉红色)生成。
反应为,[CoCl6]4-6H2O = [Co(H2O)6]2 6Cl-。
这就是溶液又变成粉红色的原因。
3. 在K2Cr2O7溶液中分别加入Pb(NO3)2和AgNO3溶液会发生什么反应?由于Cr2O72-在水溶液中实际存在有下述平衡,Cr2O72- H2O = 2 CrO42- 2H 。
d区元素实验报告

d区元素实验报告D区元素实验报告引言:D区元素是指周期表中的3d元素,包括钛、铬、锰、铁、镍、铜和锌等。
这些元素具有独特的化学性质和广泛的应用价值。
本实验旨在通过对D区元素的实验研究,深入了解它们的特性和反应行为。
实验一:钛的物理性质及应用钛是一种轻质、高强度的金属,具有优异的耐腐蚀性和生物相容性。
在实验中,我们首先测量了钛的密度和熔点,结果显示钛的密度为4.54g/cm³,熔点为1668℃。
这些物理性质使得钛广泛应用于航空航天、医疗器械和化工等领域。
例如,钛合金是航空航天工业中常用的结构材料,其轻量化和高强度的特性使得飞机和火箭等载具更加高效和安全。
实验二:铬的化学性质及反应铬是一种重要的过渡金属,具有多种化合价和氧化态。
在实验中,我们观察了铬与氧气的反应,发现铬能够与氧气形成铬酸盐。
这种反应具有重要的应用价值,例如在铬酸盐电池中,铬被氧化为铬酸盐,从而产生电能。
此外,铬还常用于镀铬工艺,使得金属表面具有耐腐蚀性和装饰性。
实验三:锰的氧化还原反应锰是一种具有多种氧化态的元素,其氧化还原反应广泛存在于自然界和工业生产中。
在实验中,我们观察了锰的氧化还原反应,发现锰能够在不同氧化态之间转变。
例如,锰的二氧化物(MnO2)可以在酸性条件下被还原为锰离子(Mn2+),而锰离子则可以被氧气氧化为高氧化态的锰酸盐。
这些氧化还原反应在电池、催化剂和水处理等方面具有重要的应用。
实验四:铁、镍和铜的电化学性质铁、镍和铜是常见的D区元素,它们在电化学反应中具有不同的特性。
在实验中,我们通过测量它们的电极电势和电导率,研究了它们的电化学性质。
结果显示,铁具有较高的电极电势和电导率,而镍和铜的电极电势和电导率相对较低。
这些性质使得铁在电化学工业中常用于阴极保护和电池制造,而镍和铜则广泛应用于电子产品和电镀工艺中。
实验五:锌的腐蚀反应锌是一种常见的D区元素,具有良好的防腐蚀性能。
在实验中,我们观察了锌与酸的反应,发现锌能够与酸产生氢气和相应的盐。
实验铬锰铁钴镍

实验铬锰铁钴镍
铬锰铁钴镍是五种过渡金属元素的合金体系,也是永久磁性材料的重要组成部分。
实验铬锰铁钴镍的目的在于通过控制不同元素的比例,制备出具有特定磁性和力学性能的材料,进一步研究其结构和性能的关系,探索其应用领域。
材料制备
本实验选用四种不同的元素,分别是铬(Cr),锰(Mn),铁(Fe),钴(Co)和镍(Ni)。
按照预先设计的比例,参考不同元素的熔点和化学性质,将所需量的元素权称入高纯氩气保护下的石墨舟中,并在高温条件下进行熔炼。
待材料熔融彻底混合后,快速倒入预制的不锈钢模具中,然后冷却到室温,取出经过预处理后的样品大块。
实验方法
样品大块经过精细磨削后,切成厚度为1mm左右的薄片。
然后将切割好的材料片进行精细抛光,使其表面产生光泽。
将抛光后的试样进行监控磁测量实验,分析材料磁性和结构特征。
同时,在电子显微镜下观察模具中心区域的显微组织,探究材料的晶体结构和晶粒形态。
实验结果
通过磁性测试实验,得到样品的磁化曲线,进一步计算出样品的饱和磁感应强度、剩余磁感应强度和矫顽力等参数,并进行综合比较。
实验结果表明,Fe-Co合金的磁性能最强,且具有较高的矫顽力和剩余磁感应强度。
Cr-Ni合金的磁性最弱,而且矫顽力和剩余磁感应强度较小。
通过电子显微镜观察样品的显微组织,可见样品的晶体结构为典型的面心立方晶系,并且晶粒大小均匀。
不同的元素比例会影响材料晶界的数量和性质,从而影响材料的磁性能和力学性能。
例如,增加钴元素的含量,可以改善材料的磁性能,然而也会导致硬度和强度的降低。
结论。
铬锰铁钴镍化学实验报告

铬锰铁钴镍化学实验报告实验名称:铬锰铁钴镍的化学实验实验目的:学习铬锰铁钴镍的化学反应过程,掌握氧化还原反应的基本原理和实验方法。
实验原理:铬、锰、铁、钴、镍在氯离子存在下可以发生氧化还原反应,制得不同价态的离子。
其中钴和镍的反应比较显著。
在实验中,可以通过加入碘离子来判断钴和镍是否反应。
实验仪器:试管、酒精灯、滴管、移液管、玻璃棒等。
实验材料:铬酸钾、硫酸、氯化锰、氢氧化钠、氯化铁、氯化钴、氯化镍、碘化钾、稀盐酸、蒸馏水等。
实验步骤:1、先准备好实验设备和材料,将不同金属的氯化物分别放入试管中。
2、分别向试管中加入稀盐酸,使其溶解。
3、加入一小块氢氧化钠固体,使溶液中的金属离子氢氧化沉淀形成。
4、观察反应现象,用玻璃棒挑取一些沉淀物,其颜色就反映了离子的价态。
5、分别向试管中滴加氯化铵,如果出现白色沉淀,则说明金属离子没有完全沉淀,需要继续滴加。
如果滴加一定量仍未出现白色沉淀,则说明其他金属已经完全沉淀,只有钴或镍未沉淀。
6、接下来分别向试管中滴加碘化钾,如出现蓝色沉淀,则表明钴或镍存在。
7、最后可以加入一些稀盐酸,在升华过程中观察物质颜色和形态。
实验结果:实验中,铬在氯化离子存在下发生氧化反应,产生淡紫色的铬酸盐沉淀;锰的氧化程度不够,只产生了一些无色的氧化物;铁产生了棕黄色的Fe(OH)3沉淀;钴和镍则分别发生氧化还原反应,产生了钴离子和镍离子的沉淀。
实验结论:通过实验,我们学习了五种金属的化学反应过程及其产生的离子。
同时,我们也学会了如何使用实验工具和方法,掌握氧化还原反应的基本原理和实验方法。
这对我们进一步深入学习化学知识,提高实验技能有重要意义。
铬、锰、铁、钴、镍及其化合物的性质和反应实验报告
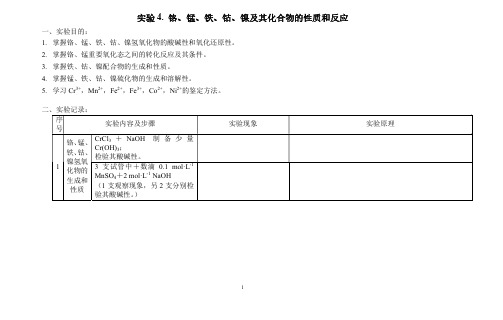
实验4. 铬、锰、铁、钴、镍及其化合物的性质和反应
一、实验目的:
1.掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2.掌握铬、锰重要氧化态之间的转化反应及其条件。
3.掌握铁、钴、镍配合物的生成和性质。
4.掌握锰、铁、钴、镍硫化物的生成和溶解性。
5.学习Cr3+,Mn2+,Fe2+,Fe3+,Co2+,Ni2+的鉴定方法。
1
2
3
4
三、注意事项:
1.在制备Mn(OH)2沉淀时,一定要用长滴管深入到溶液底部,将NaOH溶液挤出。
2.Cr(OH)3的颜色是灰绿色,容易被Cr3+的颜色掩盖,要注意观察。
加入NaOH溶液的速度不能太快,否则难以观察到沉淀
的生成。
3.在检验Ni(OH)2沉淀酸碱性时,要用比较强的氧化剂将其氧化。
四、思考题
教材中2、3、5题。
五、实验体会和建议
5。
d区元素实验报告
d区元素实验报告导语:本实验旨在通过对d区元素的实验研究,了解它们的特性和化学性质。
本报告将从实验前的准备工作,实验过程,实验结果和实验分析四个方面进行介绍。
1. 实验前的准备工作在进行实验前,我们需要对所选取的d区元素进行深入的了解和准备。
首先,我们选择了铁、铬和钴这三种典型的d区元素。
通过查阅相关资料,我们了解到它们的原子结构和主要化学性质。
此外,我们还准备了实验所需的试剂和仪器。
2. 实验过程实验过程分为三个部分,分别是测定浓度、判定铁离子和比较颜色。
首先,我们需要测定不同浓度的盐酸溶液,以便后续实验的准确操作。
其次,我们将通过化学反应将铁离子与铬离子进行区分,并通过一系列的试剂反应进行判定。
最后,我们将比较铁、铬和钴溶液的颜色,并根据颜色的差异进行区分。
3. 实验结果通过实验,我们得到了一系列的数据和观察结果。
首先,我们测定了不同浓度盐酸溶液的具体浓度值,并得到了相关的浓度曲线。
其次,在判定铁离子与铬离子的实验中,我们观察到了不同试剂对反应的影响,从而将两者区分开来。
最后,通过比较溶液的颜色,我们成功地将铁、铬和钴溶液进行了区分。
4. 实验分析通过实验结果的分析,我们得出了以下结论。
首先,我们发现浓度与溶液颜色之间存在某种关联,高浓度溶液颜色较浓,低浓度溶液颜色较淡。
其次,判定铁离子和铬离子的实验中,我们发现两者对试剂的反应性不同,可以通过这种差异进行区分。
最后,通过比较溶液的颜色,我们可以辨别出铁、铬和钴溶液。
结语:通过本次实验,我们深入了解了d区元素的特征和化学性质。
我们通过实验过程的操作和数据观察,获得了准确的实验结果,并得出了一些有关d区元素的相关结论。
此次实验的成功不仅提升了我们的实验技能,也进一步增加了我们对化学实验的理解和科学素养。
通过实验报告的撰写和总结,我们更好地巩固了实验过程和结论的把握,为今后更深入的研究奠定了基础。
实验铬锰铁钴实验报告
一、实验目的1. 掌握铬锰铁钴合金的制备方法。
2. 了解铬锰铁钴合金的物理和化学性质。
3. 分析铬锰铁钴合金的性能特点,为实际应用提供参考。
二、实验原理铬锰铁钴合金是一种高强度、高韧性的合金材料,主要由铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)和镍(Ni)五种元素组成。
通过调整元素的比例,可以改变合金的性能,使其适用于不同的领域。
三、实验材料与仪器1. 实验材料:铬、锰、铁、钴、镍金属粉末,氮气保护气氛炉,还原剂(如碳粉)。
2. 实验仪器:电子天平,磁力搅拌器,高温炉,金相显微镜,X射线衍射仪(XRD),扫描电镜(SEM),能谱仪(EDS)。
四、实验步骤1. 称取适量的铬、锰、铁、钴、镍金属粉末,按一定比例混合均匀。
2. 将混合好的金属粉末放入氮气保护气氛炉中,加热至一定温度,保持一定时间,使金属粉末充分反应。
3. 反应结束后,取出合金,冷却至室温。
4. 将合金进行切割、打磨、抛光,制备成金相样品。
5. 利用金相显微镜观察合金的微观组织结构。
6. 利用XRD、SEM和EDS分析合金的物相组成、晶体结构和元素分布。
7. 测试合金的力学性能,如抗拉强度、屈服强度、延伸率等。
五、实验结果与分析1. 合金微观组织结构:通过金相显微镜观察,发现铬锰铁钴合金的微观组织主要由晶粒、析出相和夹杂物组成。
随着合金成分的改变,晶粒尺寸和析出相的形态发生变化。
2. 物相组成:利用XRD分析,发现铬锰铁钴合金主要由固溶体和析出相组成。
固溶体主要由铬、锰、铁、钴和镍五种元素形成,析出相主要有金属间化合物和氧化物。
3. 力学性能:测试结果表明,铬锰铁钴合金具有较高的抗拉强度、屈服强度和延伸率。
随着合金成分的改变,力学性能发生变化。
例如,增加钴的含量可以提高合金的韧性。
4. 元素分布:利用SEM和EDS分析,发现铬锰铁钴合金中的元素分布较为均匀,无明显偏析现象。
六、结论与建议1. 铬锰铁钴合金具有较高的强度、韧性和耐腐蚀性,适用于航空航天、汽车工业、能源等领域。
铬锰铁钴镍 实验报告
铬锰铁钴镍实验报告
《铬锰铁钴镍实验报告》
实验目的:
本实验旨在研究铬锰铁钴镍合金的物理和化学性质,以及其在工业生产中的应用。
实验材料:
铬锰铁钴镍合金样品、实验设备、化学试剂等。
实验步骤:
1. 准备合金样品,清洁表面。
2. 测量合金样品的密度、硬度、熔点等物理性质。
3. 进行化学性质测试,如耐腐蚀性、磁性等。
4. 研究合金在高温、高压等条件下的性能表现。
5. 分析实验结果,探讨合金的应用前景。
实验结果:
通过实验,我们得出了铬锰铁钴镍合金的密度、硬度、熔点等物理性质数据,
以及其在不同环境条件下的化学性质表现。
实验结果表明,该合金具有优异的
耐腐蚀性和磁性,适用于高温、高压等恶劣环境下的使用。
同时,该合金还具
有良好的加工性能,可以用于制造航空航天、汽车、机械设备等领域的零部件。
结论:
铬锰铁钴镍合金具有广泛的应用前景,其优异的物理和化学性质使其成为工业
生产中不可或缺的材料。
通过本次实验,我们对该合金的性能有了更深入的了解,为其在工业领域的应用提供了重要的参考依据。
综上所述,铬锰铁钴镍合金的实验报告得出了积极的结论,为该合金的应用和研究提供了有力的支持。
希望通过今后的进一步研究,能够更好地发挥该合金在工业生产中的作用,为人类社会的发展做出更大的贡献。
d区元素实验报告
学而不思则罔思而不学则殆一、实验目的1、掌握铬、锰、铁、钴、镍主要氧化态的化合物的重要性质及各氧化态之间相互转化的条件2、试验并掌握铁、钴、镍配合物的生成及性质二、实验步骤、现象、实验原理(解释)、结论(表格形式)1、铬的化合物的重要性质(1)铬(Ⅵ)的氧化性→Cr2O72-转化为Cr3+在0.1mol/L K2Cr2O7溶液中,加入少量还原剂,观察颜色变化,写出反应方程式。
还原剂现象原理H2O2溶液由橙黄色变为紫色Cr2O72-+3H2O2+8H+==2Cr3++7H2O+3O2↑Na2SO3Cr2O72-+3SO32-+8H+==2Cr3++3SO42-+4H2O注:若现象不明显,可适当加入硫酸,酸化溶液,提高重铬酸根的氧化能力(2)铬(Ⅵ)的缩合平衡→Cr2O72-与CrO42-的相互转化在K2Cr2O7溶液中逐滴加入2mol/L NaOH溶液,使Cr2O72-转化为CrO42-。
再在所得溶液中逐滴加入1mol/L H2SO4溶液,使CrO42-转化为Cr2O72-。
溶液原来的颜色加入硫酸加入氢氧化钠橙黄色橙色黄色Cr2O72-+H2O ←→CrO42-+H+实验照片(3)氢氧化铬(Ⅲ)的两性在Cr3+溶液中逐滴加入NaOH溶液,观察沉淀物颜色。
将沉淀分两份,分别与酸、碱反应,观察现象。
Cr3+现象原理加入NaOH 生成灰绿色沉淀Cr3++3OH-==Cr(OH)3↓加入酸沉淀溶解,溶液呈紫色Cr(OH)3+3H+==Cr3++3H2O加入碱沉淀溶解,溶液呈亮绿色Cr(OH)3+OH-==[Cr(OH)4]-(4)铬(Ⅲ)的还原性→CrO2-转化为CrO42-在溶液中加入氧化剂,水浴加热,观察现象。
氧化剂现象原理H2O2亮绿色溶液变为黄色2CrO2-+3H2O2+2OH-==2CrO42-+4H2O(5)重铬酸盐和铬酸盐的溶解性分别在Cr2O72-和CrO42-溶液中,各加入少量Pb(NO3)2、BaCl2和AgNO3,观察产物的颜色和状态,比较并解释实验结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MnO易发生歧化反应: 3MnO42-+2H2O===2MnO4-+MnO2+4OHK2MnO4可被强氧化剂(如Cl2)氧化为 KMnO4 . MnO4-具强氧化性,它的还原产物与溶液的 酸碱性有关。在酸性,中性或碱性介质中, 分别被还原为Mn2+, MnO2和MnO42- .
实验十、
d区元素(铬,锰,铁,钴,镍) 化合物的性质与应用
一、 实验目的
1. 熟悉d区元素主要氢氧化物的酸碱性及氧化 还原性 2. 掌握d区元素主要化合物的氧化还原性。 3. 掌握Fe,Co,Ni配合物的生成何性质及其 在离子鉴定中的应用。 4. 掌握Cr,Mn,Fe,Co,Ni混合离子的分离 及鉴定方法。
3. Fe、Co、 Ni重要化合物的性质
Fe(OH)2(白色)和Co(OH)2(粉色)除具有碱性外,均具有还原 性,易被空气中O2所氧化。 4Fe(OH)2+O2+2H2O===4Fe(OH)3 4Co(OH)2+O2+2H2O===4Co(OH)3 Co(OH)3(褐色)和Ni(OH)3(黑色)具强氧化性,可将盐酸中的 Cl-离子氧化成Cl2 . 2M(OH)3+6HCl(浓)===2MCl2+Cl2+6H2O (M为Ni, Co) 铁系元素是很好的配合物的形成体,能形成多种配合 物,常见的有氨的配合物,Fe2+, Co2+, Ni2+离子与NH3 能形成配离子,它们的稳定性依次递增。
2Ba2++Cr2O72-+H2O===2BaCrO4(柠橙黄色)+2H 4Ag++Cr2O72-+H2O===2Ag2CrO4(砖红色)+2H+ 2Pb2++Cr2O72-+H2O===2PbCrO4(铬黄色)+2H+ 这些难溶盐可以溶于强酸(为什么?) 在酸性条件下,Cr2O72-具有强氧化性,可氧化乙醇, 反应式如下: 2Cr2O72-(橙色)+3C2H5OH+16H+===4Cr3+(绿 色)+3CH3COOH+11H2O 根据颜色变化,可定性检查人呼出的气体和血液中是 否含有酒精,可判断是否酒后驾车或酒精中毒。
BaCrO4, Ag2CrO4, PbCrO4,的Ksp值 分别为1.17×10-10, 1.12×10-12, 1.8×1014,均为难溶盐。因CrO42-与Cr2O72-在 溶液中存在平衡关系,又Ba2+, Ag+, Pb2+ 重铬酸盐的溶解度比铬酸盐溶解度大,故 向Cr2O72-溶液中加入Ba2+, Ag+, Pb2+离 子时,根据平衡移动规则,可得到铬酸盐 沉淀:
二、 实验原理
Cr,Mn和铁系元素Fe,Co,Ni为第四周期的ⅥB,ⅦB,ⅧB族元素。 它们的重要化合物性质如下。 1. Cr重要化合物的性质。
Cr(OH)3(蓝绿色)是典型的两性氢氧化物,Cr(OH)3与NaOH反应所得的 绿色NaCrO2具有还原性,易被H2O2氧化生成黄色Na2CrO4 Cr(OH)3+NaOH===NaCrO2+2H2O 2NaCrO2+3H2O2+2NaOH===2Na2CrO4+4H2O 铬酸盐与重铬酸盐互相可以转化,溶液中存在下列平衡关系: 2CrO42-+4H2O2+2H+===2CrO(O2)2+5H2O 蓝色CrO(O2)2在有机试剂乙醚中较稳定。 利用上述一系列反应,可以鉴定Cr3+, CrO42-,和Cr2O72-离子。
2. Mn重要化合物的性质
Mn(OH)2(白色)是中强碱,具有还原性,易被空气 中O2所氧化: 4Mn(OH)2+O2===4MnO(OH)2(褐色)+2H2O MnO(OH)2不稳定分解产生MnO2和H2O-。 在酸性溶液中,二价Mn2+很稳定,与强氧化 剂(如NaBiO3, PbO2 ,S2O82-等)作用时,可生 成紫红色 MnO4- 离子: 2Mn2+ +5NaBiO3+14H+====2MnO4+5Bi3++5Na++7H2O 此反应用来鉴定Mn2+离子。
铁系元素还有一些配合物,不仅很稳定,而且具有特殊颜色,根 据这些特性,可用来鉴定铁系元素离子如三价Fe3+与黄血盐 K4[Fe(CN)6]溶液反应,生成深蓝色配合物沉淀: Fe3++K++[Fe(CN)6]4-===K[Fe(CN)6Fe] (蓝色) 二价Fe2+离子与赤血盐K3[Fe(CN)6]溶液反应,生成深蓝色配合物沉淀: Fe2++K++[Fe(CN)6]3-=== K[Fe(CN)6Fe] (蓝色) 二价Co2+与SCN-离子作用,生成蓝色配离子: Co2++4SCN-===[Co(SCN)4]2-(蓝色) 当溶液中混有少量Fe3+离子时,Fe3+与SCN-作用生成血红色配离子: Fe3++nSCN-===[Fe(SCN)n](3-n)(n=1~6) 少量Fe3+的存在,干扰Co2+离子的检出,可采用加掩蔽剂NH4F(或NaF) 的方法,F-离子可与Fe3+结合形成更稳定,且无色的配离子[FeF6]3-, 将Fe3+离子掩蔽起来,从而消除Fe3+的干扰。 [Fe(SCN)n]3-n+6F-===[FeF6]3-+(3-n)SCNNi2+在氨性或NaAc溶液中,与丁二酮肟反应生成鲜红色螯和物沉淀。 利用铁系元素所形成化合物的特征颜色来鉴定Fe3+, Fe2+, Co2+和Ni2+ 离子。
三、实验步骤
1.氢氧化物的酸碱性 2.化合物的氧化还原性 3.金属离子的水解性
下次实验
三氯化六氨合钴的制备
在无水状态下,FeCl2与液NH3形成[Fe(NH3)6]Cl2,此配合 物不稳定,遇水即分解: [Fe(NH3)6]Cl2+6H2O===Fe(OH)3+4NH3· H2O+2NH4Cl Co2+与过量氨水作用,生成[Co(NH3)6]2+ 配离子: Co2++6 NH3· H2O===[Co(NH3)6]2++ H2O [Co(NH3)6]2+ 配离子不稳定,放置空气中立即被氧化成 [Co(NH3)6]3+ 4[Co(NH3)6]2++O2+2H2O===4[Co(NH3)6]3++4OH二价Ni2+与过量氨水反应,生成浅蓝色[Ni(NH3)6]2+配离子。 Ni2++6 NH3· H2O===[Ni(NH3)6]2++6 H2O
