铁钴镍的性质
实验二十四:第一过渡系元素(二)(铁、钴、镍)
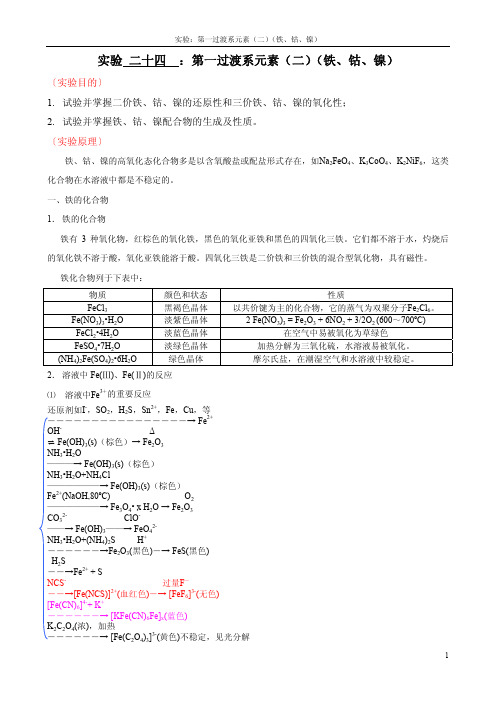
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
整理铁、钴、镍的性质

实验六 铁、钴、镍的性质一、实验目的1、 试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe 还有+6 1、Fe 2+、Co 2+、Ni 2+的还原性 (1)酸性介质Cl 2 + 2Fe 2+(浅绿)=2Fe 3+(浅黄)+2Cl -(2)碱性介质铁(II )、钴(II )、镍(II )的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co (OH )2也能被空气中的氧气慢慢氧化。
2、Fe 3+、Co 3+、Ni 3+的氧化性由于Co 3+和Ni 3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH )通常由Co (II )和Ni(II)的盐在碱性条件下用强氧化剂(Cl 2、Br 2)氧化得到。
Fe 3+易发生水解反应。
Fe 3+具有一定的氧化性,能与强还原剂反应生成Fe 2+。
白色粉红绿色黑色Co(OH)2Co(OH)3Fe(OH)2Fe(OH)3还原性增强氧化性增强Ni (OH )2Ni (OH )33、配合物的生成和Fe 2+、Fe 3+、Co 2+、Ni 2+的鉴定方法 (1)氨配合物Fe 2+和Fe 3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co 2+或Ni 2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+或[Ni(NH 3)6]2+。
不过[Co(NH 3)6]2+不稳定,易氧化成[Co(NH 3)6]3+。
(2)氰配合物Fe 3+,Co 3+,Fe 2+,Co 2+,Ni 2+都能与CN -形成配合物。
使亚铁盐与KCN 溶液作用得Fe(CN)2沉淀,KCN 过量时沉淀溶解。
第一过渡系元素(二)——铁、钴、镍

第一过渡系元素(二)——铁、钴、镍铁、钴、镍是第一过渡系元素中应用广泛的三种金属。
它们都具有相似的化学性质和金属特性,因此在很多方面都有类似的应用。
下面我们就来看看这三种金属的特性和应用。
铁(Fe)是地球上广泛存在的元素,人类使用铁的历史已经有几千年了。
铁是一种重要的结构材料,它的强度和硬度很高,并且具有很好的可塑性和可焊性。
此外,铁还有很好的耐腐蚀性能。
由于其性能稳定、价格低廉,因此广泛应用于制造汽车、船舶、建筑等领域。
此外,铁还应用于电力行业,比如铁芯变压器核心、电缆等。
铁还是一种重要的磁性材料,被广泛应用于制作各种永磁体。
钴(Co)是一种稀有金属,它具有高强度、高耐磨性、高熔点等特性,因此被广泛应用于军工、航空航天等领域。
钴还是一种重要的磁性材料,被广泛用于制作磁记录材料、计算机硬盘等。
钴还被广泛应用于医疗行业,如制作人工骨骼、人工关节等。
钴的化合物被用作化学反应催化剂、生物体内一些酶的结构成分等。
镍(Ni)是一种有色金属,与铁、钴类似,具有高强度、高耐腐蚀性、高温性等特性。
镍是一种重要的合金元素,被广泛用于制造高强度的合金钢、高温合金、耐腐蚀合金等。
比如,合金钢通常采用镍铬或镍铬钼合金,具有较高的强度和硬度,广泛应用于汽车、船舶、机械制造等领域。
此外,镍还被广泛应用于电镀行业,用于制作各种饰品、厨房用具、电器外壳等。
镍的化合物也被广泛用作催化剂、电池材料等。
除了以上的应用,铁、钴、镍还有很多重要的应用,如铁和镍被用于生产不锈钢、硬质合金等材料,钴被用于生产永磁体、高温涂层等材料。
此外,在新能源、电子信息、医疗等领域,铁、钴、镍的应用也越来越广泛。
总之,铁、钴、镍是第一过渡系元素中应用广泛的三种金属,它们的性质相似,应用领域也有很大的交叉。
随着科技的不断发展和应用需求的不断变化,铁、钴、镍的应用也会不断扩展和深化。
铁钴镍的性质实验报告

铁钴镍的性质实验报告铁钴镍的性质实验报告引言:铁钴镍是一种重要的合金材料,具有优异的力学性能和磁性能。
本实验旨在通过一系列实验方法,探究铁钴镍的性质,包括其熔点、硬度、磁性等方面的特点。
实验一:熔点测定首先,我们使用熔点测定仪器对铁钴镍进行熔点测定。
实验中,我们选取了多个不同比例的铁钴镍样品进行测试。
通过逐渐升温,观察样品的熔化情况,最终确定了铁钴镍的熔点范围。
实验结果显示,铁钴镍的熔点在XXXX℃到XXXX℃之间。
实验二:硬度测试接下来,我们使用洛氏硬度计对铁钴镍进行硬度测试。
在实验中,我们选取了不同比例的铁钴镍样品,并按照一定的压力标准进行测试。
实验结果显示,铁钴镍的硬度随着钴和镍的含量增加而增加,其中钴含量对硬度的影响更为显著。
这表明,钴元素在铁钴镍合金中起到了增强硬度的作用。
实验三:磁性测试最后,我们进行了磁性测试,以了解铁钴镍的磁性特点。
实验中,我们使用霍尔效应磁场测量仪对铁钴镍样品进行测试。
实验结果显示,铁钴镍在外加磁场作用下表现出显著的磁性,且磁性随着钴和镍含量的增加而增强。
这表明,铁钴镍合金具有良好的磁导率和磁饱和磁感应强度。
讨论:通过以上实验,我们对铁钴镍的性质有了一定的了解。
首先,在熔点测定实验中,我们确定了铁钴镍的熔点范围。
这对于合金的熔融加工和应用具有重要意义。
其次,在硬度测试中,我们发现钴元素对铁钴镍的硬度具有较大的影响。
这为铁钴镍合金在制造高强度材料方面提供了理论依据。
最后,在磁性测试中,我们观察到铁钴镍具有较强的磁性,这与其在电子和磁性材料领域的广泛应用密切相关。
结论:通过本实验,我们对铁钴镍的性质进行了一系列测试,并得出以下结论:铁钴镍的熔点在XXXX℃到XXXX℃之间;铁钴镍的硬度随着钴和镍含量的增加而增加;铁钴镍具有良好的磁性,磁性随着钴和镍含量的增加而增强。
这些结果为铁钴镍合金的制备和应用提供了重要的参考。
进一步研究方向:尽管本实验对铁钴镍的性质进行了初步的探究,但仍有许多方面可以进一步研究。
铁钴镍合金材料参数

铁钴镍合金材料参数
摘要:
1.铁钴镍合金材料的概述
2.铁钴镍合金材料的参数
3.铁钴镍合金材料的应用
正文:
铁钴镍合金材料是一种由铁、钴和镍三种金属元素组成的合金,因其具有优良的磁性能、耐腐蚀性和高温性能,被广泛应用于磁性材料、电子元器件、化工设备等领域。
了解铁钴镍合金材料的参数对于选择和使用这种材料具有重要意义。
1.铁钴镍合金材料的概述
铁钴镍合金,简称铁镍钴合金,是一种具有铁磁性的合金。
它的主要成分是铁、钴和镍,此外还可能包含少量的碳、铜等元素。
这种合金在磁性能、耐腐蚀性和高温性能方面表现优异,因此在许多领域都有广泛的应用。
2.铁钴镍合金材料的参数
铁钴镍合金的参数主要包括化学成分、物理性能和机械性能。
(1)化学成分:铁钴镍合金的主要成分是铁、钴和镍,它们的含量决定了合金的磁性能、耐腐蚀性和高温性能。
此外,合金中还可能含有少量的碳、铜等元素,它们的含量会影响合金的性能。
(2)物理性能:铁钴镍合金的物理性能主要包括密度、熔点、电阻率等。
这些性能对于了解合金的性质和选择合适的应用场合非常重要。
(3)机械性能:铁钴镍合金的机械性能主要包括硬度、抗拉强度、延伸率等,这些性能决定了合金在加工和使用过程中的稳定性和耐用性。
3.铁钴镍合金材料的应用
铁钴镍合金在许多领域都有广泛的应用,包括磁性材料、电子元器件、化工设备等。
了解铁钴镍合金的参数有助于选择合适的材料和优化产品性能。
总之,铁钴镍合金材料因其优良的磁性能、耐腐蚀性和高温性能而在许多领域得到广泛应用。
了解这种材料的参数对于选择和使用具有重要意义。
整理 铁 钴 镍的性质

实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质+ 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-Cl2(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,2也能被空气中的氧气慢慢氧化。
最后成为红棕色的氢氧化铁。
Co(OH)22、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH),NiO(OH)与浓盐酸反应分别生成Co(II)3和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。
新实验十一铁、钴、镍的性质

实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质Cl2 + 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co(OH)2也能被空气中的氧气慢慢氧化。
2、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+ 不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。
铁钴镍元素性质

实验二铁钴镍元素性质浙江工业大学化材学院李远理论介绍:1.铁钴镍性质相近, 称为铁系元素(铁磁性物质)2.Fe、Co、Ni 的电子构型为3d64s2.3d74s2.3d84s2(Cr: 3d54s1、Mn: 3d54s2 引导学生从电子组态分析元素的常见氧化态)一目的要求1.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)、Ni(III)的氢氧化物和硫化物的生成与性质。
2.了解Fe2+的还原性和Fe3+的氧化性3.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)和Ni(III)的配合物的生成和性质4.了解Fe(II)、Fe(III)、Co(II)和Ni(II)等离子的鉴定方法二基本操作1.离心机的使用: 先调零、开电源、调时间3-4min、调转速2000 rpm, 结束后要调零2.定性实验的试剂滴加练习巩固3.通风橱的使用(饱和硫化氢、浓盐酸等)三主要仪器和药品1仪器: 离心机, 烧杯(200mL), 试管, 离心试管, 试管夹, 滴管2药品:铜片, 铁屑, (NH)2Fe(SO4)2·6H2O( 固), KCl(固) , NH4Cl(固), HCl(2 mol•L-1, 6 mol•L-1, 浓), H2SO4(1mol•L-1), HAc(2mol•L-1), NaOH(2 mol•L-1, 6mol•L-1), 氨水(2mol•L-1, 6mol•L-1, 浓), K4[Fe(CN)6](0.1 mol•L-1), K3[Fe(CN)6](0.1mol•L-1), CoCl2(0.1mol•L-1), NiSO4(0.1mol•L-1), (NH)2Fe(SO4)2(0.1mol•L-1), KI(0.1 mol•L-1), FeCl3(0.1 mol•L-1), CuSO4(0.1mol•L-1), KSCN(0.1 mol•L-1, 1mol•L-1), NaF(1 mol•L-1), 溴水, H2O2(3%), CCl4, 丙酮, 丁二酮肟, 碘化钾-淀粉试纸等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁钻鎳的性质SANY 标准化小组#QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN# 实验六铁.钻.操的性质一、实验目的1.试验并学握铁、钻、银氢氧化物的生成和氣化还原性质:2、试验并学握铁、钻、規配合物的生成及在离子鉴定中的作用。
二、实验原理铁.钻.铢常见氧化值:+2和+ 3另外Fe还有+61.Fe:\ Co:\ N F•的还原性(1)酸性介质Cl2 + 2Fe:* (浅绿)=2Fe>(浅黄)+2CF(2)碱性介质铁(II).钻(II)、银(II)的盐溶液中加入碱.均能得到相应的氢氧化物。
Fe(OH):易被空气中的氧气氧化.往往得不到白色的氢氧化亚铁,而是变成灰绿色.最后成为红棕色的氢氧化铁。
Co (0H),也能被空气中的氧气慢慢氧化。
2.Fe3\ Co"、N广的氧化性由于C&和都具有强氧化性.C O(OH)3,N I O(OH)与浓盐酸反应分别生成Co(II)和小⑴),并放出氯气。
CoO(OH)和NiO(OH)通常由Co (II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2. BrJ氧化得到。
Fe5•易发生水解反应。
Fe”具有一定的氧化性.能与强还原剂反应生成Fe二3.配合物的生成和FeH Fe”、Co:\ Ni>的鉴定方法(1)氮配合物Fe>和Fe"难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH):和Fe(OH),沉淀。
将过虽的氨水加入C。
〉或N产离子的水溶液中.即生成可溶性的氨合配离子[C O(NHJF或不过[C O(NHJF不稳定,易氧化成[C O(NH3)J5\(2)氨配合物Fe3\ CoH Fe:\ Co:\ N广都能与Cf形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过址时沉淀溶解。
FeS0:+2KCN=Fe (CN):+K:SO;Fe (CN):^1KCN=K. [Fe (CN)』从溶液中析出來的黄色晶体是K.[Fe(CN)d - 3H:0•叫六鼠合诜(II)酸钾或亚铁软化钾.俗称黄血盐。
在黄血盐溶液中通入氯气(或用其它氧化剂)•把Fe (II)氧化成Fe (III),就得到夫執合铁(IH)酸钾(或铁瓠化钾)K,[Fe (CN)Jo2 K;[Fe(CN)J+Cl2=2 K3[Fe (CN)S J+2KC1它的晶体为深红色,俗称赤血盐。
赤血盐在碱性溶液中有氧化作用。
Fe%[Fe(CN)胪离子反应可以得到普鲁士蓝沉淀.而[FegW离子与Fe>离子反应得到滕氏蓝沉淀。
实验证明两者是相同的物质,都是六辄合亚铁酸铁(III) o钻和傑也可以形成辄配合物,用辄化钾处理钻(II)盐溶液,有红色的熬化钻析出,将它溶于过址的KCN溶液后.可析出紫色的八鼠合钻(H)酸钾晶体。
该配合物很不稳定,将溶液稍加热,就会发生下列反应:2 [Co (CN) 6 广・良0=2 [Co (CN) e] ^20H>H:所以[Co (CN) 6广是一个相、*1强的还丿京剂。
而[Co (CN) s]、稳定的多。
(3)离子鉴定①Fe"的鉴定K- + F』十[Fe(CN)s]H = KFe[Fe(CN)<](蓝色沉淀)(普鲁士蓝)Fe> + n SCN•二[Fe (NCS) n]w(ifa红色)②Co>的鉴定Co2* + SCN~ = Co(NCS) ?"(戊醇中显蓝色)③N芒的鉴定鲜红色(4)CoCl:6H:0粉红色,无水CoCi:蓝色,硅胶干燥剂中作指示剂。
粉红CoCl:6H:0—325K—> 紫红CoCl^O—313K—> 蓝紫CoClAO—393K—> 蓝CoCi:•仁Fe的防腐一铁钉发蓝3Fe + NaNO: +5NaOH=3Na:FeO: + XH, + H:06 NacFeO: + NaNO:+ 5H:0= 3Na:FeO 十XH, +7 NaOHNaiFeOc + NacFeO+ 2H:0= FeO + 4NaOH三、仪器与试剂试管虽筒烧杯试管夹电炉酒精灯石棉网离心机点滴板表【trinu圮璃镶子滴管HCl (2rool/L 6mol/L 浓)t HN03 (6mol/L) • H:S0. (3mol/L 6mol/L) , HAc (6mol/L) • NaOH (2mol/L6mol/L) , NHJLO (2mo】/L 6mob z L) . NH.C1 (lmol/L) . NHPe(SO.):(0, lmol/L) • Na:S (0f lmol/L) • KSCX(0, lmol/L) • Ks[Fe(CN)d (0, lmol/L) • Ki[Fe(CN)s] (0, lmol/L) • KNO:(饱和),FeCh (0, lmol/L) • CoCi:(0, lmol/L lmol/L s) ■ NiSO. (0, lmol/L) • HQ,二乙酰二脖混合液(IL 溶液中含有600gNaOH+60gNaN02) t 氯水.澳水,NHF (s) 9 Zn粒,乙醸•戊醇.酚猷.淀粉・KI试纸•砂纸.铁钉.回形针• E笔,细佚丝。
四、实验步骤1.二价铁.钻.磔氢氧化物的生成和还原性(1)Fe"的还原性酸性介质在盛有lnil氮水的试管中加3滴6mol/L腳0储液后淌加NH.Fe(SOi):^液•观察现盘(若现象不明显.设法检验Fe>) •写出反应方程式。
Cl: + 2F』(浅绿)=2Fe” (浅黄)+2C「②贼性介质取4支试管.在一试管中加蒸怖水和lml 3mol/L比SO;点沸后加入少虽的NH;Fe(SO;)2晶休是之溶解. 然后将•溶解液均分为3等份(A、B. C. ) o在另一支试管中加6mol/L NaOH溶液•点沸。
冷却后立即长漓管吸取NaOH 液并伸入A试管溶液底部.慢慢放出溶液(注总避免摇动帶入空气),观察开始生产近乎白色的Fe(OH)2沉淀.防止一段时间后观察•溶液颜色的变化.反应液留作下面实验用。
按上述同样方法产生Fe(OH),沉淀后迅速在B. C试管中加入2mol/L HC1和2mol/LNaOH溶液.立即观察现歛,写出反应方程式。
F』+ 20VC = Fe(OH):(白色沉淀)Fe(OH): + 0: +2H:0 = 4Fe(OH)5(棕红色)反应迅速(2) Co:\ N严的还原性① 向盛有少ft 0, lmol/L CoCl:ift液中2mol/LNaOH iff液至生成粉红色沉淀。
将沉淀分成3份:一份加6mol/L HCb另一份加溶液•剩余一份放至实验结束.观察沉淀有何变化解禅现象并吗出反应方程式。
Co2* + 20H- = Co (0H):(粉红色沉淀)Co (OH): + 2H*= Co'+ 2H:02C O(0H)2 + H:0: = 2CoO(OH)(棕色沉淀)+2比0Co(OHX在HNO,中溶解不显眷在酸性溶液中用H0还原可提岛溶解性,反应如下:2C O(OH)5 + HQ十4H* - 2Co a* + 6H30 + 03 4C O(0H)2 + 0c =4CoO(OH) + 2H:0 (棕褐色沉淀)缓慢需加热②向盛冇少昴L NiSOjft液中滴加2mol/LNaOH 液至沉淀.将沉淀分3份:•份加6mol/L HCb另一份加H:0:溶液•剩余一份放至实验结束.观察沉淀有何变化此时再向放宜的涪液中滴加淑水,有有何现象写出反咸方程式。
Ni2+ + 20H' = Ni(0H)2(绿色沉淀)Ni(OH): + 2H*= Ni3* + 2H:02Ni(0H): + HA = 2NiO(OH)(黑色沉淀)+2比02Ni‘ + 60H' + Br: = 2Ni (OH),(黑色沉淀)+ 2Br'2.三价铁.钻.铢氢氧化物的生成和氧化性<1)在一试管中混合少虽L FeCh和2mol/LNaOH至生成沉淀,观察产物的颜色和状态。
离心分离.向沉淀中加入少址浓HC1.搅拌并观察沉淀是否溶解设法检验产物°Fe3* + 30H- = Fe(OH)s(棕色沉淀)Fe (OH) 3 +3HC1 = FeCl: + 3H:0<2) 在两支试管中分别加入少虽CoCi,和NiSO,溶液.然后分别加数滴漠水•有无变化之后滴入6mol/LNaOH •溶液•观察沉淀的生成及颜色.分别离心后加入少量浓HC1.检验反应产物(如何检骏)写出对应的反应方程式。
2Co" + 60H' + Br: = 2Co (OH) 3 + 2Br "2Co (OH) 3 + 6HC1 = 2CoCl: + 6H:0 + Cl:(遇淀粉KI 试纸变蓝色)2Ni,+ 60S + Br: = 2Ni(OH〉s + 2Br"2Ni(0H)3 + 6HC1 = 2NiCl: + 6H:0 + Cl:根据上述实验结果.列表比较二价利三价Fe、Co. Ni氢氧化物的颜色、氧化还原稳定性及生成条件。
3.配合物的生成与性质及离子鉴定<1)Fe= Co二Ni2*与氨水反应①向少S 0, lmol/L FeCh溶液中加入适ft 6mol/L 有何现象之后再加入过址氨水,有无变化F0难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)、沉淀。
将过虽的毎水加入Co'或NF离子的水溶液中.即生成可溶性的甄合配离子[Co(XHJ』>或[Nigjm 不过[Co(NHjy不稳定、易被空中的氧气氧化成[Co(NH3)d5\②取少虽浓NHHO于试管中•加入lml 0, lmol/L CoClziff液,迅速摇匀后观察济液颜色的变化•为什么液面颜色变化较快Co:>6 NH5• H:0 =[C O(NHJ6]・6H:04 [Co (NH3)J:* + a +2H:0 = 4[C O(NH5)S]3++10H'③在lml 0, lmol/L CoCl2溶液中,加入几lmol/L NH.C1和过虽的6mol/L NH:H:0,观察溶液颜色的变化,静迓片刻.再观察溶液的颜色。
Co:>2NH:• H:0= Co (OH): I +2NH.>2H:0加氮化镀的目的是使Co (OH):沉淀在浓氮水中完全溶解。
④取0, lmol/L CS0謫加浓MHO观察溶液的颜色•再加入过虽:的浓NHJW)•观察产物的颜色°然后将•溶液分成4份,分别加lml 3mol/L H:SO.. 2mol/LXaOH .比0稀释.加热点沸.观察它们有何变化,综合实验结果.说明擁麺配合物的稳定性。
写出上述反应的反应方程式「Ni:>6 NH3• H:0 =[Ni (W si "*6^0[NKWsl2-稳定性较商。
