铁钴镍元素性质
实验二十四:第一过渡系元素(二)(铁、钴、镍)
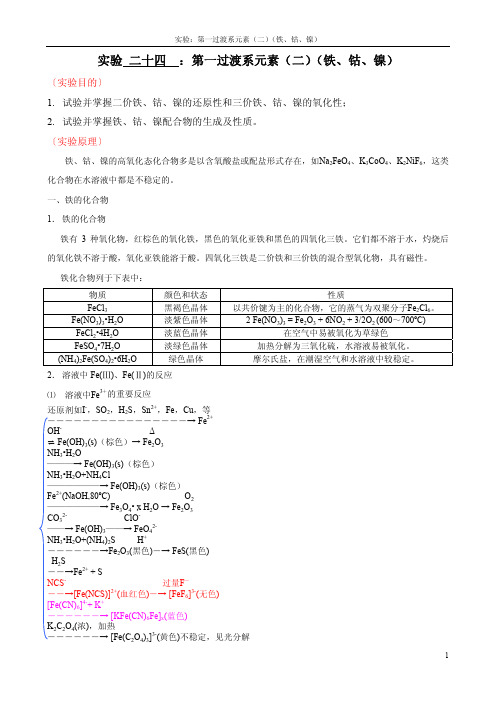
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
镍及其主要化合物的物理化学性质

世上无难事,只要肯攀登镍及其主要化合物的物理化学性质镍是元素周期表中第Ⅷ族的元素,其在元素周期表中的位置决定了镍及其化合物的一系列物理化学特性,镍的许多物理化学性质与危钴、铁相似;由于在元素周期表中与铜毗邻,因此在亲氧和亲硫性方面又较接近铜。
(一)镍的主要物理化学性质镍是一种银白色的金属,在20℃时的密度为8.908g.cm-3,熔点(1453℃)时液体镍的密度为7.9g·cm-3, 1500℃为7.76g·cm-3,其他镍产品的密度(g.cm-3)分别为:铸镍8.8,电镍8.9,镍丸8.4,化学纯致密镍9.04±0.03。
在20℃时镍的比电阻为6.9×10-6Ω/cm.镍基合金虽然广泛用于热元件,但由于易氧化的原因纯镍实际上无此用途。
热电性与铁、铜、银、金属不同,较铂为负,所以在冷端的电流由铂流向镍,因此,以镍作为热电元件时可产生高的电钢产动势。
室温下工业用镍最大饱和极化强度为0.61T,最低矫顽力为1.5A/cm,是许多磁性物料(由高导磁率的软磁合金至高矫顽磁性,它确定了镍磁性器件工作的上限温度。
单位体积的镍能吸收4.15 倍体积的氢气。
镍的原子序数28,原子量58.71,熔点(1453±1)℃,沸点2732℃。
镍在大气中不易生锈,能抵抗苛性碱的腐留尼旺岛蚀。
大气实验结果表明,99%纯度的镍在20 年内不生锈痕,无论在水溶液或溶盐内镍抵抗苛性碱的能力都很强;沸腾的50%苛性钠溶液中每年的蚀速度不超过25µm,对于盐类溶液,只容易受到氧化性盐类(如氧化高铁或次氧酸铁盐)的侵蚀。
在空气或氧气中,镍的电极位为-0.227V,25℃时为-0.231V,若溶液中有少量杂质,尤其是有硫存在时,镍即显著钝化。
(二)镍的主要化合物及其性质镍的化合物在自然界里有三种基本形态,即镍的氧化物、硫化物和砷化物。
它的氧化物有氧化亚镍(NiO)、四氧化三镍(Ni2O3)。
元素周期表中的过渡金属元素及其性质研究

地壳中过渡金属元素的种类和分布
地壳中过渡金属元素的开采难度和成本
地壳中过渡金属元素的应用领域和价值
地壳中过渡金属元素的丰度排名
过渡金属元素在自然界中的分布:主要存在于地壳中,如铁、铜、锌等
开采方法:根据元素性质和矿床类型选择合适的开采方法,如露天开采、地下开采等
镍的化合物:硫酸镍、氯化镍、硝酸镍等
Hale Waihona Puke 铜元素:原子序数29,位于元素周期表第四周期
铜的物理性质:红色金属,具有良好的导电性和导热性
铜的化学性质:在空气中稳定,不易氧化,但在高温下可与氧气反应生成氧化铜
铜的化合物:包括氧化铜(CuO)、硫酸铜(CuSO4)、氯化铜(CuCl2)等,具有不同的物理和化学性质
汇报人:
元素周期表中的过渡金属元素及其性质研究
目录
添加目录标题
过渡金属元素概述
过渡金属元素的物理性质
过渡金属元素的化学性质
常见过渡金属元素及其化合物
过渡金属元素在自然界中的存在和开采
添加章节标题
过渡金属元素概述
过渡金属元素位于周期表的第4、5、6周期
过渡金属元素包括铁、钴、镍、铜、锌、钼、钨、钽、铌、钌、铑、钯、银、金、铂、汞等
过渡金属元素在工业上广泛应用,如铁、铜、铝等
过渡金属元素在生物体内具有重要作用,如铁、锌等
过渡金属元素在环保领域也有广泛应用,如铬、锰等
过渡金属元素在化学实验中常用作催化剂,如镍、铂等
过渡金属元素的物理性质
过渡金属元素的原子结构:原子半径、电离能、电子亲和能等
电子排布:过渡金属元素的电子排布规律和特点
原子结构对物理性质的影响:如熔点、沸点、导电性等
副族金属-铁钴镍及其化合物

系列三副族金属专题2 铁钴镍及其化合物铁、钴、镍三种元素由于性质接近,故统称为铁系元素;铁、钴、镍都是中等活泼的金属元素,化合物性质比较接近,但也存在差异。
这与它们的电子层结构有关。
1.铁、钴、镍及其化合物性质的相似性2.铁、钴、镍及其化合物性质的差异(1)金属单质性质的差异(2)铁、钴、镍的氧化物和氢氧化物①铁、钴、镍氧化物和氢氧化物的基本性质注:①表示在碱性条件下不具有氧化性。
①比较与总结(1)在酸性溶液中,Fe2+、Co2+、Ni2+分别是铁、钴、镍离子的稳定状态。
高价态的铁(①)、钴(①)、镍(①)在酸性溶液中都有很强的氧化性,空气中的O2能将酸性溶液中的Fe2+氧化成Fe3+,但不能将Co2+、Ni2+氧化成Co3+和Ni3+。
(2)在碱性介质中,铁的最稳定价态是+3,而钴、镍的最稳定价态仍是+2,在碱性介质中,将低价态的Fe(①)、Co(①)、Ni(①)氧化成高价态比酸性介质中容易。
4.高铁盐的制备在酸性介质中,FeO 2-4(高铁酸根离子)是一种强氧化剂,一般氧化剂很难把Fe 3+氧化成FeO 2-4,但在强碱性介质中,Fe(①)却能被一些氧化剂(如NaClO)所氧化:2Fe(OH)3+3ClO -+4OH -===2FeO 2-4+3Cl -+5H 2O ,将Fe 2O 3、KNO 3和KOH 混合并加热共融,生成紫红色的高铁酸钾:Fe 2O 3+3KNO 3+4KOH=====① 2K 2FeO 4+3KNO 2+2H 2O 。
5. 检验Fe 2+和Fe 3+时的注意事项(1)检验Fe 2+时不能先加氯水后加KSCN 溶液,也不能将加KSCN 后的混合溶液加入到足量的新制氯水中(新制氯水可能氧化SCN -)。
(2)Fe 3+、Fe 2+、Cl -同时存在时不能用酸性KMnO 4溶液检验Fe 2+(Cl -能还原酸性KMnO 4,有干扰)。
(3)检验Fe 2+、Fe 3+的其他方法①检验Fe 2+最好、最灵敏的试剂是铁氰化钾K 3[Fe(CN)6]:3Fe 2++2[Fe(CN)6]3-===Fe 3[Fe(CN)6]2↓(蓝色)。
实验十、d区元素(铬,锰,铁,钴,镍)化合物的性质与应用

MnO易发生歧化反应: 3MnO42-+2H2O===2MnO4-+MnO2+4OHK2MnO4可被强氧化剂(如Cl2)氧化为 KMnO4 . MnO4-具强氧化性,它的还原产物与溶液的 酸碱性有关。在酸性,中性或碱性介质中, 分别被还原为Mn2+, MnO2和MnO42- .
实验十、
d区元素(铬,锰,铁,钴,镍) 化合物的性质与应用
一、 实验目的
1. 熟悉d区元素主要氢氧化物的酸碱性及氧化 还原性 2. 掌握d区元素主要化合物的氧化还原性。 3. 掌握Fe,Co,Ni配合物的生成何性质及其 在离子鉴定中的应用。 4. 掌握Cr,Mn,Fe,Co,Ni混合离子的分离 及鉴定方法。
3. Fe、Co、 Ni重要化合物的性质
Fe(OH)2(白色)和Co(OH)2(粉色)除具有碱性外,均具有还原 性,易被空气中O2所氧化。 4Fe(OH)2+O2+2H2O===4Fe(OH)3 4Co(OH)2+O2+2H2O===4Co(OH)3 Co(OH)3(褐色)和Ni(OH)3(黑色)具强氧化性,可将盐酸中的 Cl-离子氧化成Cl2 . 2M(OH)3+6HCl(浓)===2MCl2+Cl2+6H2O (M为Ni, Co) 铁系元素是很好的配合物的形成体,能形成多种配合 物,常见的有氨的配合物,Fe2+, Co2+, Ni2+离子与NH3 能形成配离子,它们的稳定性依次递增。
2Ba2++Cr2O72-+H2O===2BaCrO4(柠橙黄色)+2H 4Ag++Cr2O72-+H2O===2Ag2CrO4(砖红色)+2H+ 2Pb2++Cr2O72-+H2O===2PbCrO4(铬黄色)+2H+ 这些难溶盐可以溶于强酸(为什么?) 在酸性条件下,Cr2O72-具有强氧化性,可氧化乙醇, 反应式如下: 2Cr2O72-(橙色)+3C2H5OH+16H+===4Cr3+(绿 色)+3CH3COOH+11H2O 根据颜色变化,可定性检查人呼出的气体和血液中是 否含有酒精,可判断是否酒后驾车或酒精中毒。
铁钴镍元素性质

实验二铁钴镍元素性质浙江工业大学化材学院李远理论介绍:1.铁钴镍性质相近, 称为铁系元素(铁磁性物质)2.Fe、Co、Ni 的电子构型为3d64s2.3d74s2.3d84s2(Cr: 3d54s1、Mn: 3d54s2 引导学生从电子组态分析元素的常见氧化态)一目的要求1.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)、Ni(III)的氢氧化物和硫化物的生成与性质。
2.了解Fe2+的还原性和Fe3+的氧化性3.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)和Ni(III)的配合物的生成和性质4.了解Fe(II)、Fe(III)、Co(II)和Ni(II)等离子的鉴定方法二基本操作1.离心机的使用: 先调零、开电源、调时间3-4min、调转速2000 rpm, 结束后要调零2.定性实验的试剂滴加练习巩固3.通风橱的使用(饱和硫化氢、浓盐酸等)三主要仪器和药品1仪器: 离心机, 烧杯(200mL), 试管, 离心试管, 试管夹, 滴管2药品:铜片, 铁屑, (NH)2Fe(SO4)2·6H2O( 固), KCl(固) , NH4Cl(固), HCl(2 mol•L-1, 6 mol•L-1, 浓), H2SO4(1mol•L-1), HAc(2mol•L-1), NaOH(2 mol•L-1, 6mol•L-1), 氨水(2mol•L-1, 6mol•L-1, 浓), K4[Fe(CN)6](0.1 mol•L-1), K3[Fe(CN)6](0.1mol•L-1), CoCl2(0.1mol•L-1), NiSO4(0.1mol•L-1), (NH)2Fe(SO4)2(0.1mol•L-1), KI(0.1 mol•L-1), FeCl3(0.1 mol•L-1), CuSO4(0.1mol•L-1), KSCN(0.1 mol•L-1, 1mol•L-1), NaF(1 mol•L-1), 溴水, H2O2(3%), CCl4, 丙酮, 丁二酮肟, 碘化钾-淀粉试纸等。
铁钴镍合金材料参数

铁钴镍合金材料参数铁钴镍合金材料参数——为高性能应用而生引言:在现代科技发展迅猛的时代,材料科学作为一门重要学科,不断推动着各个领域的进步。
铁钴镍合金作为一类重要的功能材料,因其独特的物理和化学性质,在航空航天、汽车制造、电子设备等领域中得到了广泛应用。
本文将深入探讨铁钴镍合金的参数特征、性能优势以及发展前景,并回顾其应用历程,以帮助读者全面理解这一主题。
一、铁钴镍合金材料参数的简介1.1 化学成分铁钴镍合金是指以铁、钴和镍为基本元素的合金材料。
根据不同比例和添加元素的差异,可以获得不同类型的铁钴镍合金。
常见的铁钴镍合金包括Fe-Co-Ni、Fe-Co-Ni-Cu、Fe-Co-Ni-Mo等。
1.2 结构特点铁钴镍合金具有面心立方结构或体心立方结构,这使得它们在高温和低温环境中都能保持良好的稳定性。
由于其晶粒细小,具有优异的力学性能和耐腐蚀性能。
二、铁钴镍合金材料参数的性能优势2.1 优良的热稳定性铁钴镍合金具有出色的高温稳定性,可以在高温环境下长时间工作而不失效。
这使得它们在航空航天领域中得到广泛应用,如发动机涡轮盘、喷气发动机叶片等部件。
2.2 良好的机械性能铁钴镍合金拥有优秀的机械性能,高韧性和抗拉强度。
这使得它们在制造领域中应用广泛,如汽车发动机部件、工具和模具等。
2.3 良好的磁性能铁钴镍合金具有优良的磁性能,具有高磁导率和低磁滞损耗。
这使得它们在电子设备领域中得到广泛应用,如传感器、电感器和电机。
三、铁钴镍合金材料参数的应用前景铁钴镍合金由于其出色的性能,被广泛应用于许多领域,并具有广阔的前景。
3.1 新能源领域随着新能源汽车的兴起,铁钴镍合金作为电池材料备受关注。
其优异的导电性和循环稳定性,使之成为锂离子电池和燃料电池的理想选择。
3.2 航空航天领域铁钴镍合金在航空航天领域具有重要的地位。
其出色的高温稳定性和机械性能,使之成为制造航空发动机、航天器结构件以及高温陶瓷基复合材料的理想材料。
为什么只有铁,钴,镍三种元素具有磁性?

为什么只有铁,钴,镍三种元素具有磁性?展开全文在所有的八十种金属元素中,有四种金属在室温下具有铁磁性(磁性),它们分别是铁、钴、镍、钆(gá);此外,在超低温下,有五种金属是铁磁性的,它们分别是铽、镝、钬、铒和铥。
因此,并不是只有铁钴镍三种元素具有磁性,那为什么我们都认为只有铁钴镍三种元素具有磁性呢?居里温度:掌控磁性材料磁性有无的临界温度居里温度(Curie temperature,Tc),又称磁性转变点,是指磁性材料中自发磁化强度降到零时的温度,是铁磁性或亚铁磁性物质转变成顺磁性物质的临界点。
温度低于居里温度时,磁性材料有磁性,但一旦温度高于该物质的居里温度,该物质的磁性就会消失,成为顺磁性物质,不具有磁性。
不同磁性材料的居里温度不同,如铁的居里温度为786℃、钴的居里温度为1070℃、镍的居里温度为376℃、钆的居里温度为20℃。
由上可知:钆虽然也可以有磁性,但当温度高于20℃时,磁性就会消失。
在地球上,20℃是很常见的温度,甚至算是低温,因此要想保持钆的磁性需要对其严加看护,不然一不小心磁性就会消失,变成一块毫无吸引力的“废铜烂铁”。
此外,作为一种稀土材料,钆在地壳中的含量仅为0.000636%,储量少、开采难度大,注定其难以为众人所知,因此钆很少被列为磁性物质。
虽然在铁磁性材料中难以大放异彩,但在某些特殊领域,钆被寄于重任。
•钆有最高的热中子俘获面,可用作核反应堆的控制棒和中子吸收棒。
•由于一种材料在受到磁场作用成为磁性组织时放热,磁性消失是又会吸热,利用这一性质,用钆盐经磁化制冷可获得接近绝对零度的超低温。
世间金属八十种,为何偏偏只有铁钴镍钆之原子核外要有未成对的电子1907年,法国科学家外斯提出了铁磁性假说,较为系统地解释了铁磁现象出现的本质原因和规律,假说大致可分为两点:铁磁物质内部存在很强的“分子场”,在“分子场”的作用下,原子磁矩趋于同向平行排列,即自发磁化至饱和,称为自发磁化;铁磁体自发磁化分成若干个小区域,这些自发磁化至饱和的小区域被称为磁畴,由于各个磁畴的磁场方向各不相同,其磁性彼此相互抵消,所以物体对外不显磁性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁钴镍元素性质浙江工业大学化材学院郝刚一目的要求1.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)、Ni(III)的氢氧化物和硫化物的生成与性质。
2.了解Fe2+的还原性和Fe3+的氧化性3.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)和Ni(III)的配合物的生成和性质4.了解Fe(II)、Fe(III)、Co(II)和Ni(II)等离子的鉴定方法二基本操作1、离心机的使用:先调零、开电源、调时间3-4min、调转速2000 rpm,结束后要调零2、定性实验的试剂滴加练习巩固3、通风橱的使用(饱和硫化氢、浓盐酸等)三主要仪器和药品1仪器:离心机,烧杯(200mL),试管,离心试管,试管夹,滴管2药品:铜片,铁屑,(NH)2Fe(SO4)2·6H2O( 固),KCl(固) ,NH4Cl(固),HCl(2 mol•L-1,6 mol•L-1,浓),H2SO4(1mol•L-1),HAc(2mol•L-1),NaOH(2 mol•L-1,6mol•L-1),氨水(2mol•L-1,6mol•L-1,浓),K4[Fe(CN)6](0.1 mol•L-1),K3[Fe(CN)6](0.1mol•L-1),CoCl2(0.1mol•L-1),NiSO4(0.1mol•L-1),(NH)2Fe(SO4)2(0.1mol•L-1),KI(0.1 mol•L-1),FeCl3(0.1 mol•L-1),CuSO4(0.1mol•L-1),KSCN(0.1 mol•L-1,1mol•L-1),Na F(1 mol•L-1),溴水,H2O2(3%),CCl4,丙酮,丁二酮肟,碘化钾-淀粉试纸等。
四实验内容1.铁、钴、镍的氢氧化物的生成和性质(1)Fe(OH)2的生成和性质制备除氧气的FeSO4溶液和NaOH溶液,再制备Fe(OH)2Fe2+(浅绿)+2OH-=Fe(OH)2↓(白)Ps:较难!NaOH溶液滴管不可在液面上!Fe(OH)2加HCl溶液Fe(OH)2(白↓)+ 2H+=Fe2+(浅绿)+ 2H2OFe(OH)2加NaOH溶液Fe(OH)2(白↓)+ OH-→无明显变化,说明不发生发应Fe(OH)2在空气中静置Fe(OH)2(白↓)+ O2 + 2 H2O =4 Fe(OH)3↓(棕红)(2)Co(OH)2的生成和性质制备Co(OH)2(慢慢滴加)Co2+(粉红)+Cl-+ OH-=Co(OH)Cl ↓(蓝)Co(OH)Cl(蓝)+ OH-=Co(OH)2↓(粉红)总反应:Co2+(粉红)+ 2OH-=Co(OH)2↓(粉红)Co(OH)2中加HCl溶液Co(OH)2(粉红↓)+2 H+=Co2+(粉红)+2 H2OCo(OH)2加NaOH溶液Co(OH)2(粉红↓)+ OH-→无明显变化,说明不发生发应Co(OH)2在空气中静置Co(OH)2(粉红↓)+ O2 +2 H2O =4 Co(OH)3↓(褐,读作氢氧化高钴)Ps:该反应变化较慢比前面Fe(OH)2变化慢!(3)Ni(OH)2的生成和性质制备Ni(OH)2Ni2+(绿)+Cl-+ OH-=Ni (OH)Cl ↓(缺省)Ni(OH)Cl(蓝)+ OH-=Ni (OH)2↓(粉红)总反应:Ni2+(绿)+ 2OH-=Ni (OH)2↓(苹果绿)Ni(OH)2中加HCl溶液Ni (OH)2(苹果绿↓)+2 H+=Ni 2+(绿)+2 H2ONi(OH)2加NaOH溶液Ni (OH)2(苹果绿↓)+ OH-→无明显变化,说明不发生发应Ni(OH)2在空气中静置Ni (OH)2(苹果绿↓)+ O2 + H2O →无明显变化,说明不发生发应结论:(比较酸碱性和氧化还原性)酸碱性:Fe2+、Co2+、Ni2+的氢氧化物呈碱性还原性:Fe(OH)2 > Co(OH)2 > Ni (OH)2(4)Fe(OH)3的生成和性质FeCl3溶液中滴加NaOH溶液Fe3+(黄)+3OH-=Fe(OH)3↓(棕),检查酸碱性pH=10Fe(OH)3中加HCl溶液Fe(OH)3(棕↓)+3H+=Fe3+(黄)+3H2O由于水解,生成[Fe(H2O)5(OH)] 2+Fe(OH)3中加NaOH溶液Fe(OH)3(棕↓)+ OH-→ 无明显变化,说明不发生发应(5)Co(OH)3的生成和性质CoCl2溶液中加几滴溴水,再加入NaOH溶液2Co2+(粉红)+Br2+6 OH-=2Co(OH)3↓(褐)+2Br-Co(OH)3加浓HCl加热反应:2 Co(OH)3(褐↓)+6HCl(浓)== 2 Co(粉红)+4Cl-+Cl2+6H2O Ps:Co(III)具有氧化性,用淀粉KI试纸检验产物,试纸变蓝。
(6)Ni(OH)3的生成和性质NiSO4溶液中加几滴溴水,再加入NaOH溶液2Ni2+(绿)+ Br2 + 6OH-=2 Ni(OH)3↓(黑,读作氢氧化高镍)+2Br-Ni(OH)3加浓HCl2 Ni(OH)3(黑↓)+ 6HCl(浓)= 2 Ni2+(粉红)+4Cl-+Cl2+6H2O同理,Ni(III)具有氧化性,用淀粉KI试纸检验产物,试纸变蓝。
该反应不需要加热结论:(比较酸碱性和氧化还原性)酸碱性:Fe3+、Co3+、Ni3+的氢氧化物呈碱性氧化性:Fe(OH)3 < Co(OH)3 < Ni (OH)32.铁盐的性质(1)Fe2+的还原性① KMnO4溶液酸化后滴加FeSO4MnO4-(紫)+5 Fe2+(淡绿)+8 H+=Mn2+(肉色)+5Fe3+(黄)+4H2O滴加K4[Fe(CN)6]溶液K++ Fe3++[Fe(CN)6]4-=KFe [Fe(CN)6]3↓(蓝)Ps:该反应为Fe3+的鉴定方法②FeSO4溶液酸化后加入H2O22Fe2+(淡绿)+2H++ H2O2=2 Fe3+(黄)+2H2O滴加KSCN溶液Fe3++nSCN-=[Fe(SCN)n]3-n,n=1-6,均为血红色Ps:Fe3+鉴定方法③在碘水中加2滴淀粉,再滴加FeSO4溶液I2+ Fe2+(淡绿)→无明显变化,说明不发生发应Ps:φθI2/I-=0.535V, φθFe3+/ Fe2+=0.771V④在碘水中加2滴淀粉,再滴加K4[Fe(CN)6]溶液I2(灰)+[Fe(CN)6]4-(黄)=I-+[Fe(CN)6]3-(红)另解:深蓝色褪去??结论:(比较几种还原剂还原性的强弱)还原性:Fe2 + < I- < [Fe(CN)6]4-(2)Fe3+的氧化性①FeCl3溶液中加入KI溶液,再加2滴淀粉2 Fe3+(黄)+2 I-=2 Fe2+(淡绿)+ I2(灰)K4[Fe(CN)6]溶液中加入KI溶液,再加2滴淀粉[Fe(CN)6]3-+ I-→无明显变化,说明不发生发应②FeCl3溶液中加入H2S溶液2 Fe3+(黄)+H2S =2 Fe2+(淡绿)+ S↓(黄)+2H+( 变浑浊)③1mL FeCl3溶液中浸入一小片铜(该反应最先做,最终分三个色层,很漂亮,做完铜片要回收。
)2 Fe3+(黄)+Cu =2 Fe2+(淡绿)+ Cu2+结论:(比较几种氧化剂氧化性的强弱)氧化性:Fe3+ > I2 > [Fe(CN)6]3-3. Fe(II)、Co(II)、Ni(II)的硫化物的性质(1)FeSO4溶液酸化后滴加H2S溶液,有什么变化?加入NH3·H2O呢?Fe2+(淡绿)+ H2S + 2NH3·H2O =FeS↓(黑)+2NH4+ + 2H2OFeS中滴加HCl溶液FeS(黑↓)+2H+=Fe2+(淡绿)+ H2S(2)CoCl2溶液中,酸化后滴加H2S溶液有什么变化?加入NH3·H2O呢?Co2+(粉红)+ H2S + 2NH3·H2O =CoS↓(黑)+2NH4++2H2OCoS溶液中滴加HCl溶液CoS(黑↓)+H+→无明显变化,说明CoS不溶于酸(3)NiSO4溶液中酸化后滴加H2S溶液,有什么变化?加入NH3·H2O呢?Ni2+(绿)+ H2S + 2NH3·H2O =NiS↓(黑)+2NH4++2H2ONiS中滴加HCl溶液NiS(黑↓)+H+→无明显变化,说明NiS不溶于酸4.铁、钴、镍配合物的生成和性质(1) K4[Fe(CN)6]和K3[Fe(CN)6]溶液中分别加入NaOH[Fe(CN)6]4-→ 无明显变化,说明不发生发应[Fe(CN)6]3-→无明显变化,说明不发生发应Ps:离子浓度太低,离子积太小( < K sp )!!!(2) CoCl2溶液中加NH4Cl溶液和过量的氨水Co2+(粉红)+ 6NH3·H2O =[Co(NH3)6]2+(土黄)+6H2O放置(暴露于空气中)4[Co(NH3)6]2+(土黄)+O2+2H2O =4[Co(NH3)6]3+(颜色加深, 红褐)+4OH-(3)NiSO4溶液中加入少量NH3·H2O2Ni2+(绿)+ 2NH3·H2O+SO42-=Ni2(OH)2SO4↓(浅绿)+2NH4+加NH4Cl溶液和NH3·H2ONi2(OH)2SO4(浅绿↓)+ 4NH3·H2O+2NH4+=4[Ni (NH3)6]2+(蓝)+2 SO42-+6H2O 比较:Co(NH3)62+和Ni(NH3)62+结论:稳定性Ni(NH3)62+ > Co(NH3)62+(4)在FeCl3溶液中加入2滴KSCNFe3+ +n SCN-=[Fe(SCN)n]3-n,n =1-6,均为血红色Ps:Fe3+鉴定方法滴加NaF(剧毒!!!操作一定要小心!F-离子的络合性极强, 人与HF接触,会和人身体中的金属元素反应,造成巨大损伤。
举个例子说明它有多强,在血红色的硫氰化铁中加入NaF,颜色褪去,根本检测不到Fe3+的存在了。
)[Fe(SCN)] 3-n +6F-=[FeF6]3-+ n SCN-(5) CoCl2溶液中加少量KSCN (s),再加入几滴丙酮Co2+(粉红)+4 SCN-=[Co(SCN )4]2-(蓝)(6) NiSO4溶液中几滴NH3·H2O,再加入丁二酮肟Ni2+(绿)+2DMG =Ni(DMG)2↓ (鲜红色,玫瑰红) +2H+。
