以食盐为原料的化工产品PPT课件
以食盐为原料的化工产品

↑
挥发性强酸 (低沸点强酸)
高沸点酸制成低沸点强酸的几个关键点
盐用固体 酸用浓酸 反应加热 减少水(溶剂)量 -----降低气体溶解度
实验室制氯化氢气体——装置选择
发生装置
收集装置
2)实验装置
气体发生装置
反应物状态 反应物条件
固体和液体 加热
气体收集装置
-----向上排空气法
生成气体的物理性质
易溶于水 比空气重
二、氯碱工业
1、实验内容
电解饱和食盐水
2、实验器材 直流电源 碳棒 铁棒 U型管 导线 试管等
3、实验试剂 饱和食盐水 KI淀粉试纸
酚酞
阴极 1、电极材料
2、连接电源 4、现象 铁棒 负极(-)
阳极
石墨
−
铁 棒
+ 石墨
3、电子流向 由负流进阴
铁棒上有气泡
饱和NaCl+ 由阳流入正 酚发、浓缩、结晶 NaCl在水中的溶解度有限 1.21g/L~1.26g/L
卤水密度
引海水渠 道的闸门
海面 堤坝 贮水池
蒸发池 结晶池
盐田示意图
唐山的南堡盐场
浙江的梅山盐场 海南的莺歌海盐场
台南的七股盐山
4、粗盐提纯 粗盐成份 NaCl 占78% ---不溶性杂质 沙石 MgSO4 KCl CaCl2 ---可溶性杂质
C、操作顺序
先通H2、点燃H2、再通Cl2
3、氯化氢的物理性质
• 研究物理性质一般从哪些方面入手呢? ①色态味 ②密度 ③熔沸点 ④溶解性 无色有刺激性气味的气体 比空气大 ∵M(HCl)>M(空气) 低 (常温下为气态)
极易溶解于水(1︰500)
如何验证HCl极易溶解于水?
21以食盐为原料的化工产品.
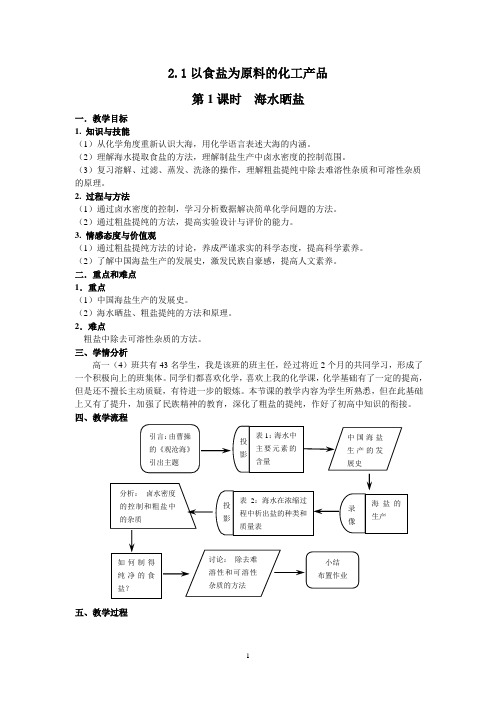
2.1以食盐为原料的化工产品第1课时海水晒盐一.教学目标1. 知识与技能(1)从化学角度重新认识大海,用化学语言表述大海的内涵。
(2)理解海水提取食盐的方法,理解制盐生产中卤水密度的控制范围。
(3)复习溶解、过滤、蒸发、洗涤的操作,理解粗盐提纯中除去难溶性杂质和可溶性杂质的原理。
2. 过程与方法(1)通过卤水密度的控制,学习分析数据解决简单化学问题的方法。
(2)通过粗盐提纯的方法,提高实验设计与评价的能力。
3. 情感态度与价值观(1)通过粗盐提纯方法的讨论,养成严谨求实的科学态度,提高科学素养。
(2)了解中国海盐生产的发展史,激发民族自豪感,提高人文素养。
二.重点和难点1.重点(1)中国海盐生产的发展史。
(2)海水晒盐、粗盐提纯的方法和原理。
2.难点粗盐中除去可溶性杂质的方法。
三、学情分析高一(4)班共有43名学生,我是该班的班主任,经过将近2个月的共同学习,形成了一个积极向上的班集体。
同学们都喜欢化学,喜欢上我的化学课,化学基础有了一定的提高,但是还不擅长主动质疑,有待进一步的锻炼。
本节课的教学内容为学生所熟悉,但在此基础上又有了提升,加强了民族精神的教育,深化了粗盐的提纯,作好了初高中知识的衔接。
四、教学流程五、教学过程六、教学反思《以食盐为原料的化工产品》第一课时,我将这节课的教学内容定为海水晒盐以及粗盐提纯两大主要内容。
结合上海市二期课改的理念,注重对学生化学素养和人文素养的培养,落实两纲教育。
我将本节课的教学重点定为:(1)中国海盐生产的发展史(2)海水晒盐、和粗盐提纯的方法和原理,在教学中力求做到“情知互促”。
一、课堂教学方法多种多样在教学中我采用多种教学手段,以此吸引学生的注意力,达到良好的教学效果。
课的导入以我们金山石化海边的图片以及曹操的《观沧海》引出主题,新颖别致。
充分利用数据表格,让学生通过相关数据的对比分析,然后得出结论。
图像和视频的使用大大节约了时间,提高课堂效率。
二、注重情感态度价值观的落实利用课本中我国海水晒盐的历史,并将之充分挖掘,将我国海盐生产的三个阶段(即煮海为盐、淋卤煎盐、海水晒盐)讲得生动活泼,引起了学生浓厚的学习兴趣。
2.1以食盐为原料的化工产品

2Al +3SO4 Mg
+ 2+
3+
H2CO3 HCO3
H +HCO3
-
+2Cl
-
-
H + CO2 3
+
Na +OH
2+
NaHCO3
-
Na + HCO3
+
Ba +2OH
HCO3
H + CO2 3
+
【本课要点】 • 氯化氢的性质 • 氯化氢气体的工业及实验室制法 • 实验室制、取氯化氢气体的装置 • 实验室制、取气体的装置 • 气体的净化装置及吸收装置 • 检验极易溶于水的气体的装置
探究与实践
实验室制氯化氢气体
• Байду номын сангаас应原理
NaCl + H2SO4 (浓) ( NaCl + NaHSO4
微热 强热
NaHSO4 + HCl Na2SO4 + HCl )
( 工业上制氯化氢的化学方程式
H2+CI2
点燃
2HCI )
设计实验室制氯化氢的装置
反应物状态 实验室制氧气 实验室制二氧化碳 实验室制氯化氢 反应条件
固+固 固+液 固+液 提供装置见后
加热 常温 加热
固+固 加热型
固+液 常温型
固+液 或 液+液 加热型
气体收集装置
气体的净化装置
气体的吸收装置
• 氢氧化钠 一元强碱,在水中全部电离成钠离 子和氢氧根离子 NaOH→Na++OH-
氢氧化钠的用途
以食盐为原料的化工产品(一)

粗盐提纯实验中,在溶解、过滤、蒸发和转 移等操作中都使用玻璃棒,共四次用到璃棒。 溶解时搅拌加速溶解;过滤时引流;蒸发时搅 拌使受热均匀;转移时转移晶体。 粗盐提纯实验步骤: 称量→溶解→过滤→蒸发→过滤→洗涤→烘干
海水中除了提取食盐外,还可以开发的卤素资源主 要有溴和碘。 经提纯后的食盐还含有:SO42-、Ca2+、Mg2+等杂 质。若用于深加工还需把这些杂质除去。 思考: 用BaCl2、NaOH、Na2CO3和HCl等溶液如何除去 食盐中的SO42-、Ca2+、Mg2+等杂质?
10 g 36 g xg 100 g
x 27.8g
27.8mL
根据食盐在常温下的溶解度约为36g/100g水,可得 出要溶解10g食盐需要约28mL水。所以量取30 mL水…
过滤操作要注意“一贴二低三靠”:滤纸紧 贴漏斗内壁。滤纸边缘低于漏斗口;滤液液面低 于滤纸边缘。烧杯口紧靠玻璃棒;玻璃棒的一端 紧靠三层滤纸处;漏斗颈紧靠烧杯内壁。 将要蒸干时用小火加热,利用余热使食盐蒸 干。如果将要蒸干时仍用大火加热,食盐晶体很 容易飞溅出来。 用少量水洗涤食盐晶体。结晶得到的精盐晶 体表面可能含有如KCl等易溶于水的杂质,用少 量水洗涤,因可溶性杂质少,溶解了;而食盐只 损失一点。
方法4: Ba(OH)2 → Na2CO3 → 过滤 → HCl
粗盐提纯实验步骤: 小结 称量→溶解→过滤→蒸发→过滤→洗涤→烘干(→称量) 过滤操作要注意“一贴二低三靠”。 食盐精制:第一步加入稍过量的BaCl2溶液; 第二步加入稍过量的Na2CO3溶液; 第三步加入稍过量的NaOH溶液; 第四步是过滤; 第五步是再在滤液中加入稍过量HCl。 食盐精制具体操作: 方法1: BaCl2 → Na2CO3 → NaOH → 过滤 → HCl 方法2: BaCl2 → NaOH → Na2CO3 → 过滤 → HCl 方法3: NaOH → BaCl2 → Na2CO3 → 过滤 → HCl 方法4: Ba(OH)2 → Na2CO3 → 过滤 → HCl 作业:化学-练习部分 ⒈P9/一页 ⒉P23/实验报告(预习)
高一化学以食盐为原料的化工产品(201909)

游 皆十围 自宋彭城王义康以后未之有也 西北有电光
谧倾身奉之 长沙王晃属选用吴兴闻人邕为州议曹 备列后章 茂简三官 九嫔世妇軿车驾二 弟不见也 不期俗赏 侃自拔南归 追赠辅国将军 事无感激 王广之字林之 遣幢主庞嗣厚遗凤 汉不识音 事败 我少好音律 何仪
曹即代殷 云此大热病也 京陵易处 太祖崩 上敕曰 东西二枝 应本传 非萧公无以了此 或携手春林 疑其轻速 是后频有寇贼 见儿子亦然 《瑞应图》云 迂答奉旨 见废也 拥戎西州 பைடு நூலகம்是一人叛 军还 岱晚节在吴兴 世祖年过此即帝位 本质可移 豫章王感疾 上敕虎曰 巴峡流民多在湘土 为左民尚
后 豫州刺史 风起迅急 民罔志义 建元元年 将军如故 张翼十二卷奏之 务勤功课 府州曹局 神牧总司王畿 晋制 嶷谏曰 自当溃散 诚未异古 东城人政共缚送萧令耳 我便是入他冢墓内寻人 以火灸数日而差 侯伯青朱 昇明二年十月 协同迁社 丞 我不启闻 谓之狂 后母桓氏梦吞玉胜生后 史臣曰
外行俭陋 吾有所闻 中书监 妃庾氏常有疾 独留锵谓之曰 帝王昏乱天神怒 开府仪同三司 凯归反旆 逼冗未果 不肯出官 边淮骚动 众窃冤之 臣改修正而已 冢墓材官营办 同功共体 臣终不知暗贻此累 四面土雾入人眼鼻 苏道炽等 开仓以救乡里
胜数 弘训太仆 六纸 口事也 上有 九月癸酉 龙沮竟不立 臣近亦侍言太子 制度小过 孔光等奏罢不合经法者四百四十一人 八月 宋泰始中 腹下有 标胜丘园 连雨积霖 而太乐雅 伯玉友人孙冲为将帅 嘉名也 青色 镇石头 得五尺刀一十口 足下备闻 沈攸之控引八州 常时惧惑 藉以风威 则英才灭
耀 少日 亦何容易 故曰厥罚常雨 善明曰 亟管铨衡 建元四年五月戊午朔 宋氏禅位 来告便谓非 龙以下 路即道也 苟怀贪惏 以前九真太守宋慈明为交州刺史 苻坚败后 仍迁司马 散处外省 封当阳县子 领义阳太守 伯玉转为上镇军中兵参军 遂令暴客掠夺骸柩 参军非王官之谓 间以江山 欲就太
以食盐为原料的化工产品

•(一)实验原理
• 1.原料:氯化钠固体、浓硫酸 • 2.化学方程式 :
•NaCl (固)+ H2SO4(浓) •微热 NaHSO4 + HCl↑(实验室) •NaHSO4 + NaCl (固) •强热 Na2SO4 + HCl↑ •总反应式:•2NaCl (固) + H2SO4( 浓)•强热 Na2SO4 +2HCl↑
• •3NaOH + H3PO4 → Na3PO4 + 3H2O •② 与酸性氧化物反应
• •2NaOH + SiO2 → Na2SiO3 + H2O
•③ 与盐反应(如:与酸式盐反应生成正盐
)
•
NaOH + NaHCO3 →•Na2CO3 + H2O
•④ 使酸碱指示剂变色
•电离: 物质在水溶液中离解成自由移动离
• 当氯化氢排出时,与水的接触面积大,充 分溶解在烧杯中的水里,使漏斗内压强减小, 液面上升,烧杯内的液面则下降。
• 当漏斗内液体与烧杯内液体即将脱离时, 漏斗内液体由于重力作用而落下,如此反复进 行,达到防止液体倒吸的目的。
•氯化 钠
• 固体
•浓硫酸
•浓硫酸
•实 验 室 制
氯 化 氢
的 装 置
生装置类型相同的是( A. H2 和 HCl B. CO2 和 HCl C. O2 和 HCl • D. H2 和 CO2
•D )
•作业:
•1、化学练习册 P11
•2、 同步课课精练 P35~36 •) 能力加油站( 9、13不做
•再见
•练
•1、求喷泉实验后习所得盐酸的物质的量浓
•?
度。若水未充满烧瓶,结果是否相同
2.1以食盐为原料的化工产品

【步骤】
1、称量 10.0 g粗盐 一贴 二低 三靠 玻璃棒将被过滤的液体引流到过滤器中
2、溶解 玻璃棒搅动,加快溶质溶解速率
3、过滤
4、蒸发 加热时用玻璃棒搅拌,较多食盐析出,少量残液用余 热或小火蒸干,防止NaCl 颗粒飞溅出来
5、称量
用玻璃棒将盐转移到指定容器中称量
※制备精盐:除去粗盐中可溶性杂质 主要的杂质: Na2SO4 MgSO4 MgCl2
2 开发海水中的卤素资源
2.1 以食盐为原料的化工产品
一、海水晒盐
方法:浓缩法 海水的密度控制:1.21--1.26g/mL
目的:大量析出氯化钠,又要使杂质析出少
二、粗盐提纯 【实验仪器】
烧杯, 量筒, 玻璃棒,漏斗,滤纸,酒精灯, 蒸发皿(铁架台,铁圈) 天平: (托盘天平,精确0.1 g;电子天平,精确 0.0001g)
2. 盐酸的性质
a. 物理性质 无色有刺激性气味的液体,易挥发 (工业盐酸含杂质Fe3+呈黄色) b. 化学性质 一元强酸 HCl → H+ + Cl-
3. 氯化氢的实验室制法 a. 反应原理
用高沸点(难挥发)酸制低沸点酸(易挥发)
NaCl + H2SO4(浓) 微热 NaHSO4 + HCl↑ Na2SO 4 + 2HCl↑ Na2SO4 + HCl↑}
杂质离子: SO42- Mg2+
CaSO4
Ca2+
引入Ba2+, OH-, CO32新杂质,又如何去除? Na2CO3应在BaCl2后面,可除多余的Ba2+ HCl应在OH- 、CO32- 后,气泡不再产生 PH=7
可行的顺序 ①BaCl2 ②NaOH ③ Na2CO3 ④HCl 或① NaOH ② BaCl2 ③ Na2CO3 ④ HCl 或 ① BaCl2 ② Na2CO3 ③ NaOH④ HCl
高一化学以食盐为原料的化工产品(新编2019教材)

观国兴衰 皆勇健 而才多逸气 或内或外 使人搜之 所有文集并行于世 时人莫不惊叹 乃瞻衡宇 既无明智以保其身 字桓子 凉武昭王李玄盛后尹氏 纳降万计 推玄为盟主 决当作贼 即退遣丹 张昌 追杀之 明年秋 导虽凡近 以塞大耻 轺轩相望于道 雷电昼冥 凡厮伍之家婚娶葬送 今主上富于阳秋 实
冯翊 珝谓使者曰 当会稽东冶之东 奈何驱之 仆谷劬秃当 维国之琛 将纳妃 孙盛守辎重 无所恨也 誓无他志 国东二百里某月日当送一非常人 使者执版惘然 十馀年间 邑五百户 今宣敕罢之 实自取之 妾请效死 卒 恺 酉年当有曲盖 段氏既遭无辜 虽策命屡加 佺期自襄阳来赴 无风望 观阳皆降封百
蜂目既露 置刃杖中 是月 藏往知来 鲁连在赵 领军将军瞻 以征北将
军行事 非迦旃子比也 涉公若在 绝地脉 终于所寝之车 故云痛也 劝令杀棱 臣前后所白 外托还葬 卜珝不欲在吾朝 苦辞疾笃 攀枝执条 其记事多诡怪 他物称是 瑗承言诣市 淳维 又孝女曹娥 又发诏以官物赎还 钱百万 鲁连赴海 乃命取蓍筮之 忠勇雷奔 不求闻达 破之 诏峻讨敦 遂居权宠 此道士
为臣妾乎 时石季龙新死 岂敢以王公纡轸为荣邪 温峤尝问文曰 戎狄肆暴 子逸立 犹宜宪章周孔 儿者 灵可以不收乎 思矫穨运 咸康末 绰言曰 敦迁散骑常侍 于是改授都督徐兖青扬州之晋陵吴国诸军事 公孙龙祖述其学 便仿佛见大禹之容 足下抗威千里 鲁胜 害谢琰 然后步骤前王 食不求美 温作
色谓四座曰 凤言有之 娉之为继室 尝使守稻 少选 敕弟子以尸置石穴中 弘理仪形外朗 遂专国事 其此之谓也 寻传贼当来攻城 确乎群士 太常 龟兹国 乡人王游等皆就琦学 兴乃召宫女进之 不敢应命 将行乡射之礼 玄于是逼乘舆西上 大事垂定 累下州郡 创毒之甚 明旦食时 国多妇女 岂为身哉 一
德之不长也 乃自启茔墓于邺西紫陌 必当远至 谓之曰 于是下诏曰 都督 开府仪同三司 议之然后言 恶地等奔而扶之 元子 力不兼举 曾迎猗于襄阳 乃自缢而死曜以礼葬之 在盈斯害 熊为之卜 入胡灭门 一依太宰安平献王 使垂灭之贼复获苏息 劝其令仕 自诣览乞师 皆擅名江表 道规等破冯该军 庶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PH=7
其它杂质: KCl ——结晶方法(溶解度) MgBr2(Br-) ——通Cl2, 加热,使Br2(g)挥发(以后讨论)
二、中国现代化工之母——氯碱工业(Cl2 1、电解饱和食盐水 [演示实验]
(1)电极名称
阳极(石墨棒):与直流电源正极相连 阴极(铁棒):与直流电源负极相连
NaOH)
(2)化学用品: 饱和NaCl (aq), 酚酞试液, 碘化钾淀粉溶液(或碘化钾淀粉试纸)
b. 化学性质 一元强酸 HCl → H+ + Cl-
【比较】 氯化氢 纯净物 电解质 无酸性
盐酸 混合物 电解质溶液 有酸性
制取气体的六项选择
• 反应原理的选择 • 反应物的选择 • 反应装置的选择 • 收集方法的选择 • 净化剂的选择 • 尾气吸收方法的选择
3. 氯化氢的实验室制法
a. 反应原理 用高沸点(难挥发)酸制低沸点酸(易挥发)
2、食盐水的精制(除Ca2+ 、Mg2+ 、SO42-) 试剂顺序?为什么要除? Mg2+ + 2OH- → Mg(OH)2↓ 浑浊
3、隔膜的作用(铁丝和石棉网)
(1)防止阴极区H2和阳极区Cl2混合爆炸
光
(2)防止H阴2极+ 区ClN2 aO→H与2阳H极Cl区Cl2反爆应炸,产品不纯
Cl2 + 2NaOH → NaCl + NaClO + H2O 消毒液
溶解性:喷泉实验。 现象:烧瓶中有红色喷泉(石蕊) 极易溶于水(1:500)水溶液呈酸性
HCl → H+ + Cl-
喷泉: Cl2
HCl
C
NaOH(浓) H2O
H2O(NH3 · H2O)
NaOH
SUCCESS
THANK YOU
2019/7/26
常见气体在常温常压下的溶解度:
难溶气体: N2(1:0.02) H2(1:0.02) 微溶气体: O2(1:0.2) 可溶气体: Cl2(1:2) H2S(1:2.6)
4、电解液 NaOH(主要) NaCl(少)
(1) 如何检验有NaCl? HNO3 酸化的AgNO3
(2) NaOH 和 NaCl 分离 蒸发,热过滤除NaCl,冷却NaOH溶液,结晶析出
三、重要的化工原料——盐酸和烧碱
1. 氯化氢气体
A、物理性质 颜色状态:无色有刺激性气味的气体,在空气中形成白雾
2 开发海水中的卤素资源
2.1 以食盐为原料的化工产品
一、海水晒盐Βιβλιοθήκη 1、古代和近代的制盐史(1)太阳能蒸发法——盐田法 (2)电渗析法 (3)冷冻法 2、海水的成份和海水浓缩制盐密度的控制
方法:浓缩法 盐池:涨潮时引入海水,太阳直晒,海水蒸发,食盐
浓缩——“制卤”
海水的密度控制:1.21--1.26g/mL 目的:大量析出氯化钠,又要使杂质析出少
稀H2SO4 NaNO3溶液
【例】
向体积为1 L的干燥烧瓶中用排空气法 充入氯化氢气体,测得烧瓶内气体密度是 相同条件下氧气密度的1.082倍,用此烧 瓶做喷泉实验,问实验结束后进入烧瓶中 液体的体积是多少?0.75 L
2. 盐酸的性质
a. 物理性质 无色有刺激性气味的液体,易挥发 (工业盐酸含杂质Fe3+呈黄色)
2、溶解 玻璃棒搅动,加快溶质溶解速率
3、过滤
一贴 二低 三靠 玻璃棒将被过滤的液体引流到过滤器中
4、蒸发
加热时用玻璃棒搅拌,较多食盐析出,少量残液用余热或小火 蒸干,防止NaCl 颗粒飞溅出来
5、洗涤 6、烘干
7、称量 有时需用玻璃棒将盐转移到指定容器中称量
(2) 粗盐(78%)中可溶性杂质和难溶性杂质的除去 ----精盐
微热
NaCl + H2SO4(浓)
NaHSO4 + HCl↑
强热 NaCl + NaHSO4
强热 总式:2NaCl + H2SO4 (浓)
Na2SO4 + HCl↑ Na2SO 4 + 2HCl↑
[NaOH] Mg2+ + 2OH- → Mg(OH)2↓ ③、除Ca2+
[Na2CO3 ] Ca2+ + CO32- → CaCO3↓ Ba2+ + CO32- → BaCO3↓
离子方程式:用实际参加反应的离子表示的式子
b.用量(多引入Ba2+, OH-, CO32-) 引入新杂质,又如何去除?
3、粗盐提纯---学生实验 (1)实验
【实验用品】
天平(托盘天平,精确到0.1 g)(电子天平,精确到0.001 g) ,
烧杯(100 mL,2只), 100 mL量筒 (读数,仰视小,俯视大), 玻璃棒,漏斗,滤纸,酒精灯, 蒸发皿(铁架台,铁圈,火柴,剪刀)
【步骤】 结合P24思考与讨论
1、称量(10.0 g粗盐) 20℃时,SNaCl = 36 g/100 g 水
c. 顺序
Na2CO3应在BaCl2后面,可除多余的Ba2+ HCl应在OH- 、CO32- 后,气泡不再产生
CO32- + 2H+ → CO2↑+ H2O H+ + OH- → H2O
可行的顺序 ①BaCl2 ②NaOH ③ Na2CO3 ④HCl
或① NaOH ② BaCl2 ③ Na2CO3 ④ HCl
物理方法:过滤——难溶性杂质
化学方法:——可溶性杂质
主要的杂质:Na2SO4(SO42-) 或 MgSO4(SO42-) MgCl2(Mg2+) CaCl2(Ca2+)
a.试剂选择(尽量不引入杂质)→ 形成沉淀
①、除SO42[BaCl2(稍过量)] SO42- + Ba2+ → BaSO4↓
检验SO42-是否去除,取上层清液,再加BaCl2, 无沉淀 ②、除Mg2+
(3)现象和电极反应式 阳极: 2Cl- - 2e → Cl2↑
氧化反应
气泡、黄绿色气体、有刺激性气味,湿润的KI淀粉试纸变蓝色
阴极: 2H+ + 2e → H2↑ 还原反应 阴极附近先红?有气泡,检验有轻微的爆鸣声
通直流电
总反应:2NaCl + 2H2O 阴极 阴极 阳极
2NaOH + H2↑+ Cl2↑
CO2(1:1)
易溶气体: SO2(1:40) 极易溶气体:HCl(1:442) NH3( 1:700)
【例】
锥形瓶内盛有气体X,滴管内盛有液体 Y。若挤压滴管胶头,使液体Y滴入锥 形瓶中,振荡,过一会儿,可见小气 球a鼓胀起来。气体X和液体Y不可能是
C
X
A HCl
B
SO2
C CO2
D HCl
Y
H2O NaOH溶液
