100t干化质量热量平衡图
干燥过程得物料平衡与热平衡计算

—热损失
式中为湿物料进出干燥器时得比热
蒸发水分所需得热量为:
若忽略湿物料中水分带入系统中得焓,上式简化为:
此时热效率可表示为:
6、等焓干燥过程:
等焓干燥过程(绝热干燥过程):气体放出得显热全部用于湿分汽化。规定如下:
不向干燥器补充热量 ;
折合成标煤量=667384、6/29302=22、8kg/h
那么,需要向干燥系统供应多少热风呢?首先需要确定热风得初始温度,现按初始风温t1=300℃与400℃分别计算,忽略热空气中得水分,需要得绝干空气量L。
当t1=300℃时,L×1、01×300=667384、6得L=2202、6kJ/h
这样,加热空气带走热2202、6×1、01×60=133476、9kJ/h占20%
(3)干燥产品流量
物料平衡
则,
式中,分别为物料进与出干燥器得湿基含水量。需要指出得就是,干燥产品就是相对于而言得,并不就是绝干物料,只就是含水量较小。所以一般称为干燥产品,以区别于绝干物料。
例题:在一连续干燥器中,将每小时2000湿物料由含水量3%干燥至0、5%(均为湿基),以热空气为干燥介质,空气进出干燥器得湿度分别为0、02及0、08,假设干燥过程无物料损失,试求水分蒸发量,新鲜空气消耗量与干燥产品量。
水分蒸发热520560kJ/h占78%
其她热损失占2%
以上已接近等焓干燥,即:
热空气释放出得显热=2202、6×1、01×(300-60)=533910、2kJ/h
与水分蒸发汽化热=498000kJ/h两者比较相近。
当t1=400℃时,解得L=1610、6kg/h。
这时,加热空气带走热为97603、9kJ/h,占总热量得14、6%。
第3讲 干燥过程的物料平衡和热平衡

w ml
100 v 2 v2 c ml cw 100 100
(6-41)
(3) 在干燥器中对干燥介质的补充加热量qad
如专设的电加热器、蒸汽加热或烘干兼粉磨系统中研磨体摩 擦、碰撞产生的热量等。
2、干燥器的热量支出: (1) 废气带走的热量q2
q 2 lI 2
(2) 物料离开干燥器带走的热量qm2
物料带走热量qm2 运输设备带走热量qc
1、进入干燥器的热量
(1) 干燥介质带入的热量q1
q1 lI1
式中,l为蒸发1kg水时干燥介质的用量,(kg/kg水); I1为干燥介质进入干燥器时的热含量,(kJ/kg)。 (2) 湿物料带入的热量qml (6-39)
Gw2 w c ml t1 (6-40) mw 式中,t1为物料进入干燥器时的温度,C; cw为水的比热容,近似可用4.19kJ/(kg.C); Gw2为离开干燥器的物料量,kg/h; cmlw为湿基水分在v2(%)、温度为t1C时物料的比热容,看作 绝干物料的比热容 cm和相应水分比热容的加权平均值,即 q m1 c w t1
理论 干燥 过程
q ad q m q c q1 0
qad q m qc q1 0
理论干燥过程:没有热损失,干燥介质 的用量及热耗最小,热效率最高。
用热空气作干燥介质时
蒸发每千克水需用的干空气量l及热耗q0分别为: 1 1 l0 0 0 (kg干空气 / kg水) x 2 x1 x 2 x 0
(6-28) (6-29)
(三) 干燥过程中水分蒸发量的计算
1、用干基水分计算 令u1(%)和u2(%)为干燥前后物料的干基水分,Gd为绝干物料 量(kg/h),则每小时在干燥器中蒸发的水分量为:
化工原理 干燥讲解

【例8-1】讨论:
t (℃)
20
80%
100 1.85%
H 0.0117 0.0117
I (kJ/kg) 49.69 (小) 131.85 (大)
经过加热,↓,湿空气吸湿能力增大,是一种很好的
载湿体; I↑, 湿空气热焓增大,是一种很好的
载热体;
所以,新鲜空气进入干燥器之前需要预热
∵空气价廉易得,∴热空气是最常用的干燥介质
36
【例8-1】常压下的空气,
t1=293K, 1 = 80% 时, t2=373K, 求 H2 , 2 , I2
求 H1 , I1
解: (1) t1=293K=20℃ ,
1 = 80%,p总 =101.3kPa,
t1 = 20℃ , 算得:ps1=2.338kPa
p1 = 1 ps1
H1
三
最
边 )
等水汽分压线-水平线
右 )
+
温度坐标 常压下湿空气的 H-I 图(p251) 湿度坐标
(p196) 29
H-I 图由以下线群组成:
①等湿线(等H 线),范围 0~0.2 kg/kg(绝干气); ②等焓线(等I 线),范围 0~680 kJ/kg(绝干气); ③等温线(等t 线),范围 0~250℃;
0.622 p总
p1 p1
H1
0.622
p 1 s1 p总 1 ps1
0.622 0.8 2.338 101.3 0.8 2.338
0.0117kg/kg绝干气
IH1 (1.01 1.88H1)t1 2490 H1 (1.01 1.88 0.0117) 20 2490 0.0117 49.8 kJ/kg 绝干气
干燥过程的物料平衡与热平衡计算

⼲燥过程的物料平衡与热平衡计算⼲燥过程的物料与热平衡计算1、湿物料的含⽔率湿物料的含⽔率通常⽤两种⽅法表⽰。
(1)湿基含⽔率:⽔分质量占湿物料质量的百分数,⽤ω表⽰。
(2)⼲基含⽔率:由于⼲燥过程中,绝⼲物料的质量不变,故常取绝⼲物料为基准定义⽔分含量。
把⽔分质量与绝⼲物料的质量之⽐定义为⼲基含⽔率,⽤χ表⽰。
(3)两种含⽔率的换算关系:2、湿物料的⽐热与焓(1)湿物料的⽐热m C湿物料的⽐热可⽤加和法写成如下形式:式中:m C —湿物料的⽐热,()C kg J ο?绝⼲物料/k ;s C —绝⼲物料的⽐热,()C kg J ο?绝⼲物料/k ;w C —物料中所含⽔分的⽐热,取值4.186()C kg J ο?⽔/k(2)湿物料的焓I '湿物料的焓I '包括单位质量绝⼲物料的焓和物料中所含⽔分的焓。
(都是以0C ο为基准)。
式中:θ为湿物料的温度,C ο。
3、空⽓的焓I空⽓中的焓值是指空⽓中含有的总热量。
通常以⼲空⽓中的单位质量为基准称作⽐焓,⼯程中简称为焓。
它是指1kg ⼲空⽓的焓和它相对应的⽔蒸汽的焓的总和。
空⽓的焓值计算公式为:或()χχ2490t 1.881.01I ++=式中;I —空⽓(含湿)的焓,绝⼲空⽓kg/kg ;χ—空⽓的⼲基含湿量,绝⼲空⽓kg/kg ;1.01—⼲空⽓的平均定压⽐热,K ?kJ/kg ;1.88—⽔蒸汽的定压⽐热,K ?kJ/kg ;2490—0C ο⽔的汽化潜热,kJ/kg 。
由上式可以看出,()t 1.881.01χ+是随温度变化的热量即显热。
⽽χ2490则是0C ο时kg χ⽔的汽化潜热。
它是随含湿量⽽变化的,与温度⽆关,即“潜热”。
4、⼲燥系统的物料衡算⼲燥系统的⽰意图如下:(1)⽔分蒸汽量W按上述⽰意图作⼲燥过程中的0⽔量与物料平衡,假设⼲燥系统中⽆物料损失,则:2211χχG LH G LH +=+ ⽔量平衡式中:W —单位时间内⽔分的蒸发量,s kg /;G —单位时间内绝⼲物料的流量,/s 绝⼲物料kg ;21H H ,—分别为⼲燥介质空⽓中的进⼊和排出⼲燥器的⽔分含量,绝⼲空⽓⽔/kg kg ;L —单位时间内消耗的绝⼲空⽓量,s /kg 绝⼲空⽓。
化平衡第七课时平衡图像

(3)当降低温度时,C的质量分数增大,
吸 热反应。 则A的转化率 增大 ,逆反应是____
2、图中表示外界条件(t、p)的变化对下列反应 的影响:L(固)+G(气) 2R(气) ΔH>0,y轴表示的是: ( B )
A 、平衡时,混合气中R的百分含量 B 、平衡时,混合气中G的百分含量 C、 G的转化率 D 、L的转化率
达平衡状态且V正>V逆的点是 C点 。
【自我评价与反思】
1、确定平衡点, 2、定温——做辅助线 3、比较转化率——判断移动方向
NO 转 化 率
B C 0
A
D
E
T
【回忆与反思】
v
V正
V逆
V
V(正)
c
V(逆)
3
2
C A
B
图3
t
图2
NO 转 化 率
图1
T
1
B C 0
A
E
D T
图4
【总结:解题思路】
1. 步 骤
(3). 作判断:
根据图象中表现的关系与所学规律相 对比,作出符合题目要求的判断。
【回忆与反思】
t
C%
T2 P2 T1 P2 T1 P1
A 转 化 率
等温线
1.01107Pa
1.01106Pa
1.01105Pa
0
图4
t
0
T
图5
温度
2.原 则
(1) “先拐先平,数值大”原 在化学平衡图象中,先出现拐点的反应则先 则
t
【练习】对于 m A (g) + n B (g) 有如图7所示的变化,则: ①p1与 p2 的关系是 P2 > P 1 ;
热传导和热平衡的图表分析

03
热平衡原理
热平衡定义
热平衡是指在没有外界影响的条件下,物体内部各部分之间的热状态趋于稳定,达到热量平衡 的状态。
热平衡是热力学中的一个基本概念,用于描述系统内部热量的传递和平衡。
在热平衡状态下,系统内部的温度、压力等参数达到稳定状态,不再发生变化。
热平衡原理在工程、科学和日常生活中有着广泛的应用,如建筑物的保温、散热设计,发动机 的热管理,以及人体的温度调节等。
通过实例分析,可以深 入理解热传导和热平衡 在电子设备中的应用, 为优化设备性能提供依 据。
实例四:生物体的热传导和热平衡分析
生物体的热传导机制:生物体内温度分布不均,导致热量从高温部位向低温部位传递, 维持体温恒定。
热平衡状态:生物体通过产热和散热的平衡,保持体温稳定,适应环境温度变化。
图表实例解析:通过具体图表展示生物体在不同环境温度下的产热、散热情况,以及热 平衡状态的变化。
单击此处添加副标题
热传导和热平衡的图表分
析
汇报人:XX
目录
01 02 03 04 05 06
添加目录项标题
热传导原理
热平衡原理
热传导和热平衡的图表分析方法
热传导和热平衡的图表实例解析 图表分析在热传导和热平衡中的意
义与价值
01
添加目录项标题
02
热传导原理
热传导定义
热传导是热量从高温物体向低温物体传递的过程 热传导可以通过固体、液体和气体进行 热传导的速率与物质的导热系数、温度差和传热面积有关 热传导是热量传递的三种方式之一,其他两种方式为热对流和热辐射
热平衡状态
定义:系统内部各部分之间达到热平衡状态,温度不再发生变化 条件:系统内部各部分之间没有热交换 意义:热平衡原理是热传导和热平衡分析的基础 应用:在工程领域中广泛应用于传热分析、热设计等方面
高中化学课程课件 化学反应速率、平衡图像

(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是__A__。
A.t0~t1
B.t2~t3
C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状 态,请在图中画出反应速率的变化曲线。 答案
2.全程速率—时间图像 例如:Zn与足量盐酸的反应,化学反应速率随时间的变化出现如图所示 情况。
化学反应速率、平衡图像
学习 目标
1.系统掌握速率、平衡图像的分析方法。 2.加深外因对化学反应速率影响的理解。 3.能正确解答实际工业生产中有关图像的问题。
考点一 常规图像分类突破
思维模型构建
典型图像示例 1.瞬时速率—时间图像 (1)当可逆反应达到一种平衡后,若某一时刻外界条件发生改变,都可能 使速率—时间图像的曲线出现不连续的情况,根据出现“断点”前后的 速率大小,即可对外界条件的变化情况作出判断。如图:
态的是__a___。
(2)已知c点时容器中O2浓度为0.04 mol·L-1,则50 ℃时,在α型沥青混凝
25x2 土中CO转化反应的平衡常数K=__1_-__x_2__(用含x的代数式表示)。
(3)下列关于题图的说法正确的是__B_D___(填字母)。 A.CO转化反应的平衡常数:K(a)<K(c) B.在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要大 C.b点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高 D.e点转化率出现突变的原因可能是温度升高后催化剂失去活性
0.6 mol-0.3 mol 2 L×10 min
=0.015
mol·L-1·min-1,v(H2)=0.045 mol·L-1·min-1,C错误;
图丙表示平衡时氨气含量与氢气起始物质的量关系,曲线上各点都处于
100T转炉物料平衡及热平衡计算
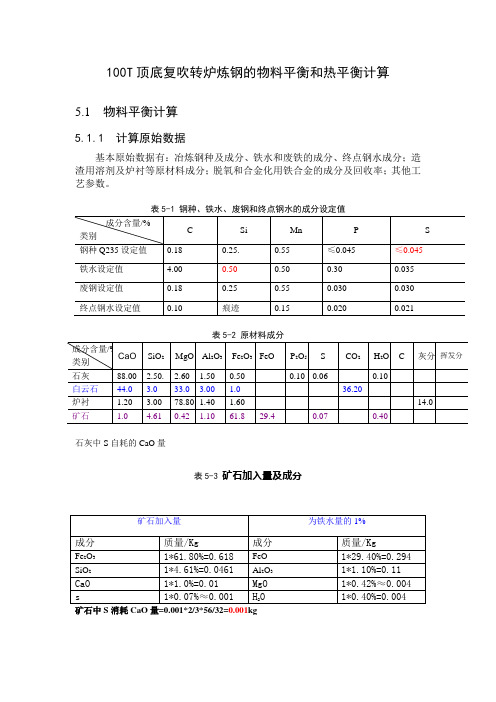
100T顶底复吹转炉炼钢的物料平衡和热平衡计算5.1 物料平衡计算5.1.1 计算原始数据基本原始数据有:冶炼钢种及成分、铁水和废铁的成分、终点钢水成分;造渣用溶剂及炉衬等原材料成分;脱氧和合金化用铁合金的成分及回收率;其他工艺参数。
表5-2 原材料成分石灰中S自耗的CaO量表5-3 矿石加入量及成分矿石中S消耗CaO量=0.001*2/3*56/32=0.001kg5.1.2物料平衡的基本项目收入项有:铁水、废钢、溶剂(石灰、矿石、轻烧白云石)、氧气、炉衬蚀损、铁合金。
支出项有:钢水、炉渣、烟尘、渣中铁珠、炉气、喷溅。
5.1.3 计算步骤以100㎏铁水为基础进行计算。
第一步:计算脱氧和合金化前的总渣量及其成分。
总渣量包括铁水中元素氧化,炉衬腐蚀和加入溶剂的成渣量。
其各项成渣量分别列于表5-5~表5-7。
总渣量及成分如表5-8所示:铁水中元素氧化量表5-5 铁水中元素的氧化产物及其成渣量①由CaO还原出的氧量;计算出铁水中S消耗CaO量=0.009×56/32=0.016㎏。
表5-6 炉衬腐蚀的成渣量表5-7 加入溶剂的成渣量①.石灰加入量:石灰加入量=()()有效CaO CaO R SiO %2∑∑-⨯=(1.171*3.2-0.657)/(88.0%-3.2×2.50%) =(3.747-0.657)/0.8 =3.09/0.8 =3.863kg∑(SiO 2)=铁水[Si]生成(SiO 2)+炉衬、矿石、白云石带入(SiO 2);=1.071+0.009+0.046+0.045=1.171㎏;∑(CaO )=白云石、矿石、炉衬带入(CaO )-铁水、矿石中S 消耗CaO 量;=0.66+0.01+0.004-0.001-0.016=0.657㎏;因设定终渣碱度R=3.2:%CaO 有效=石灰中(%CaO )-碱度R ×石灰中(% SiO 2)=88.0%-3.2×2.50%表5-8 总渣量及其成分渣Σω(FeO)=15%(表5-4),故总渣量为7.4/86.75%=7.4/86.75%=8.53㎏。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
11015
干燥基 d
29.96
干燥无灰 基
daf 54.17
4.17
7.53
16.64 30.07
3.37
6.09
1.18
2.14
0.055 0.099
收到基 af
5.99 0.83 3.33 0.67 0.24 0.01
40%水分 (换算)
17.98 2.50 9.98 2.02 0.71 0.03
3.52 47.24
6.13 43.11 13.31
80.00
40
48.96 6.36 44.68 13.79
88.51 24.95
9.79 1.27 8.94 2.76 0.75 179
29.38 3.82
26.81 8.27 6.84 1636
湿污泥 含水率% 温度℃ 处理量(t/d) 质量(kg/h) 热量(MJ/h)
输入总热量(MJ/h)
11018
100t/d污泥热干化质能平衡图
散热损失 热量(MJ/h) 热损失率%
541 5.00 取值
圆盘干燥机 SDK-370D 100t/d污泥处
尾气(空气、蒸汽) 温度℃ 压力 MPa 焓(kj/kg) 空气质量(kg/h) 热量(MJ/h) 湿度(kg/kg)
90 微负压 1867.97 4166.67 水分质量(kg/h) 2777.78 7783 0.67
干污泥 温度℃ 含水率% 质量(kg/h) 热量(MJ/h)
100 40
1388.89 其中:绝干污泥 256 干泥比热
833.33 1.05
冷凝水 温度℃ 压力 MPa 焓(kj/kg) 质量(kg/h) 热量(MJ/h)
150 0.5 632.00 3854.17 2436
输出总热量(MJ/h)
2010年12月吉林生活污泥
1
碳
Car
%
2
氢
Har
%
3
氧
Oar
%
4
氮
Nar%5硫源自Sar%6
Cl
Clar
%
1
全水分
Mar
%
2
分析水
%
3
挥发份
V
%
4
固定碳
FC
%
5
灰分
Aar
6 高位发热量 Qgr
MJ/kg
7 低位发热量 Qnet
MJ/kg
kcal/kg
空干基 ad
28.91 4.02
16.05 3.25 1.14 0.05
80 20 100 4166.67 0
饱和蒸汽 温度℃ 压力 MPa 焓(kj/kg) 质量(kg/h) 热量(MJ/h)
180 0.6 2805.00 3854.17 10811
蒸汽消耗率(t/t污泥)
0.925
载气 温度℃ 压力 MPa 焓(kj/kg) 质量(kg/h) 热量(MJ/h)
20 常压 49.7 4166.67 207.08
