铁的氢氧化物的制备
高中化学实验铁的氢氧化物和铁盐的性质实验报告练习新人教必修

铁的氢氧化物和铁盐的性质实验报告一、实验名称:铁的氢氧化物和铁盐的性质二、实验目的:1.掌握氢氧化铁、氢氧化亚铁的制备。
2.认识铁盐和亚铁盐之间的转化及其检验。
三、实验准备:四、实验步骤:五、实验现象:【反思交流】1、有什么方法是氢氧化钠与硫酸亚铁反应的现象更明显?2、检验二价铁和三价铁离子,还有哪些方法?2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.设N A为阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,11.2LSO3中含有原子数为2N AB.用浓盐酸分别与MnO2、KClO3反应制备1molCl2,均转移电子2N AC.将0.1molNH4NO3溶于适量的稀氨水,溶液恰好呈中性,溶液中NH4+数目小于0.1N A D.2molNO和1molO2充分反应后,所得混合气体的分子数小于2N A2.已知2FeSO4高温Fe2O3+SO2↑+SO3↑,某同学设计利用如图装置分别检验产物中的气体。
下列有关表述错误的是()A.用装置甲高温分解FeSO4,点燃酒精喷灯前应先向装置内通一段时间N2 B.用装置乙可检验分解产生的SO2,现象是石蕊试液先变红后褪色C.按照甲→丙→乙→丁的连接顺序,可用装置丙检验分解产生的SO3D.将装置丁中的试剂换为NaOH溶液能更好的避免污染环境3.改变下列条件,只对化学反应速率有影响,一定对化学平衡没有..影响的是A.催化剂B.浓度C.压强D.温度4.室温下,下列各组离子在指定溶液中能大量共存的是()A.能使甲基橙变红的溶液:Na+、Ca2+、Br-、HCO3-B.+-c(H)c(OH)=1×10-12的溶液:K+、Na+、CO32-、AlO2-C.0.1 mol·L-1KFe(SO4)2溶液:Mg2+、Al3+、SCN-、NO3-D.0.1 mol·L-1Ca5NH4(NO3)11溶液:H+、Fe2+、Cl-、SO42-5.设NA为阿伏加德罗常数值。
氢氧化亚铁和氢氧化铁

学与思
1. Fe(OH)2在空气中加热能得到FeO吗?若要得到氧化亚 铁,应该怎么做?
不能。Fe(OH)2在空气中被氧化,最得Fe2O3
(1)与酸反应
①与非氧化性酸(盐酸、稀硫酸)反应
Fe(OH)2 Fe(OH)3都是难溶性碱,你能写出它们 和盐酸、稀硫酸反应的化学程式和离子方程式
吗?
} Fe(OH)2+ 2HCl = FeCl2+H2O
Fe(OH)2+H2SO4 =FeSO4+H2O
Fe(OH)2 + 2H+ = Fe2++2H2O
3.铁的氢氧化物的化学性质
(2)稳定性
4Fe(OH)2+O2+2H2O=4Fe(OH)3
加热Fe(OH)3 △
2Fe(OH)3 = Fe2O3 + 3H2O
思考: 如果是在空气中加热Fe(OH)2呢?
也是Fe2O3
△
4Fe(OH)2+O2 = 2Fe2O3+4H2O
(4)图中____能____(填“能”或“不能”)较长时间看到Fe(OH)2白色沉淀。 (5)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方 程式为___4_F__e_(O__H_)_2_+__O__2 _+_2_H_2_O__=__4__F_e_(_OH)3
2.如图所示,当容器A中的 反应开始后,若分别进行 下列操作,请回答有关问 题:
试管和 溶液内 的空气
3.1.2铁的氢氧化物、铁盐教学设计2023-2024学年高一上学期化学人教版(2019)必修第一册

- 收集并分析铁的氢氧化物和铁盐在生活中的应用实例,如水处理、医药、农业等。
- 探讨铁的氢氧化物和铁盐在可持续发展中的作用。
鼓励学生在课后进行自主学习,深入研究铁的氢氧化物和铁盐的相关知识。通过阅读拓展材料,提高对铁的氢氧化物和铁盐的认识,了解其在各个领域的应用。同时,学生可以结合所学知识,开展小课题研究,培养科学探究能力和创新思维。
4. 在作业布置方面,我发现部分学生对写作和报告类作业存在困难,可能是因为他们缺乏有效的写作技巧和方法。为了提高学生的写作能力,我计划在课后提供一些写作指导和范文,并组织写作工作坊,让学生有机会互相学习和改进。
2. 学生在兴趣方面,可能对实验操作、化学现象产生好奇心,对铁的氢氧化物和铁盐在实际生活中的应用感兴趣。在学习能力上,学生具备一定的自主学习能力和合作学习能力,但个体差异较大。在学习风格上,部分学生喜欢通过实验、观察和动手操作来学习,而另一部分学生则更倾向于从理论层面理解知识点。
3. 学生可能遇到的困难和挑战:一是对铁的氢氧化物和铁盐的性质、制备过程的理解,特别是结构与性质关系的把握;二是在实验操作过程中,可能会出现操作不规范、观察不仔细等问题;三是将所学知识应用到实际生活中的能力,如何将理论知识与生活实际相结合,解决实际问题。
- 纳米Fe(OH)3的催化性能
- 催化氧化、还原反应
4. 铁的氢氧化物和铁盐在工业废水处理中的作用
- 絮凝剂、氧化剂
- 优点:絮凝效果好、氧化性强
- 缺点:过量使用可能导致水质恶化、腐蚀设备
5. 铁的氢氧化物和铁盐在可持续发展中的作用
- 环境保护、医药、工业等领域
- 废水处理、资源利用、绿色化学发展
针对以上分析,教师在本节课的教学过程中应关注学生的个体差异,激发学生的学习兴趣,引导学生主动探究,并提供适当的指导,帮助学生克服困难和挑战,提高学生的学科素养。
《铁的重要化合物》教学设计(省级优质课获奖案例)

《铁的重要化合物》教学设计
一、教学目标
(一)知识和技能
1.了解FeO、Fe2O3、Fe3O4的性质和应用。
2.掌握铁的氢氧化物的化学性质和制备方法。
3.能够检验溶液中的Fe3+,了解溶液中的Fe2+ 验证。
(二)过程与方法
1.初步学会从氧化还原的角度研究物质性质的方法。
2.通过灰绿色沉淀成因的探究过程,培养学生的证据意识和实验探究、证实证伪的方法,
提高学生的科学素养。
3.通过自学和自主建构活动,培养学生掌握获取和加工信息的能力和方法。
(三)情感态度与价值观
1.通过各项实验探究,培养小组交流合作意识,增强学生对化学学习的热情。
2.培养学生务实求真、勇于探索的科学态度,感受化学在社会生活中的应用价值。
二、教学重点和难点
(一)教学重点:铁的氢氧化物的性质及灰绿色沉淀成因的探究、Fe3+的检验
(二)教学难点:氢氧化亚铁的制备
三、教学方法
自主建构式、问题探究式
四、教学手段及用具
(1)实验仪器:井穴板、试管、胶头滴管、锥形瓶、三通管、橡胶管、橡胶塞、铁架台、石棉网、酒精灯、火柴、止水夹。
(2)实验药品:氧化亚铁、氧化铁、四氧化三铁、氯化铁溶液、硫酸亚铁溶液、氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、二氧化锰、双氧水、分液漏斗、铁粉、稀硫酸、煤油。
五、教学过程
六、板书设计
第三章第二节三、铁的重要化合物
(一)铁的氧化物的性质
(二)铁的氢氧化物的性质和制备
(三)铁盐和亚铁盐
1.Fe3+的检验。
铁的氧化物 氢氧化物(第2课时)(解析版)
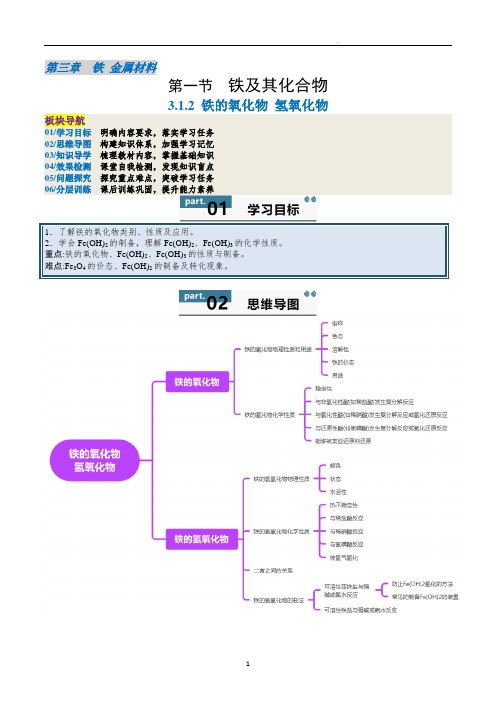
第三章铁金属材料第一节铁及其化合物3.1.2 铁的氧化物氢氧化物板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养1.了解铁的氧化物类别、性质及应用。
2.学会Fe(OH)2的制备,理解Fe(OH)2、Fe(OH)3的化学性质。
重点:铁的氧化物、Fe(OH)2、Fe(OH)3的性质与制备。
难点:Fe3O4的价态、Fe(OH)2的制备及转化现象。
一.铁的氧化物1.铁的氧化物物理性质和用途化学式 FeO Fe 2O 3 Fe 3O 4 俗称 铁红 磁性氧化铁 色态 黑色粉末 红棕色粉末 黑色晶体 溶解性 难溶于水 难溶于水 难溶于水 铁的价态 +2价+3价+2价,+3价 用途油漆、涂料、油墨、橡胶的红色颜料做磁性材料,如录音磁带、电讯器材2.铁的氧化物化学性质 (1)稳定性①FeO:不稳定,易被氧化,6FeO+O 22Fe 3O 4①Fe 2O 3和Fe 3O 4:比较稳定(2)与非氧化性酸(如稀盐酸)发生复分解反应 ①FeO :FeO+2H +Fe 2++H 2O①Fe 3O 4:Fe 3O 4+8H +Fe 2++2Fe 3++4H 2O ①Fe 2O 3:Fe 2O 3+6H +2Fe 3++3H 2O(3)与氧化性酸(如稀硝酸)发生复分解反应或氧化还原反应 ①FeO :3FeO+10H ++NO 3-3Fe 3++NO↑+5H 2O①Fe 3O 4:3Fe 3O 4+28H ++NO 3-9Fe 3++NO↑+14H 2O①Fe 2O 3:Fe 2O 3+6H +2Fe 3++3H 2O(4)与还原性酸(如氢碘酸)发生复分解反应或氧化还原反应 ①FeO :FeO+2H +Fe 2++H 2O①Fe 3O 4:Fe 3O 4+8H ++2I -3Fe 2++I 2+4H 2O ①Fe 2O 3:Fe 2O 3+6H ++2I-2Fe 2++I 2+3H 2O(5)能够被某些还原剂还原 ①H 2:FeO+H 2Fe+H 2O①CO :Fe 2O 3+3CO 2Fe+3CO 2(高炉炼铁的主反应) ①C :Fe 3O 4+2C 3Fe+2CO 2↑④Al :2Al+Fe 2O 32Fe+Al 2O 3(铝热反应)二.铁的氢氧化物1.实验探究——【实验3-1】p67实验装置实验原理Fe3++3OH-===Fe(OH)3↓;Fe2++2OH-===Fe(OH)2↓(白色)、4Fe(OH)2+O2+2H2O===4Fe(OH)3实验用品FeCl3溶液、FeSO4溶液、NaOH溶液;试管、长胶头滴管实验步骤在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液。
铁的氢氧化物制备++课件-2025学年高一上学期化学人教版(2019)必修第一册+

态存在于矿石中。
第1课时 铁的氢氧化物
Fe(OH)2和Fe(OH)3
课程学习目标
1 掌握Fe(OH)2、Fe(OH)3的制备原理。
2 能初步分析氢氧化亚铁沉淀实验现象的变化原因, 提出可能的假设,通过分析推理加以证实或证伪, 形成证据意识,并对Fe(OH)2的制备实验进行改进。
实验改进3
归纳总结 制备Fe(OH)2的注意事项
(1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液 底部,并慢慢挤出NaOH溶液。 (3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
一、Fe(OH)2和Fe(OH)3制备
3.实验室制备Fe(OH)2如图所示:
(1)实验操作:在试管中加入少量的FeSO4 溶液,然后各滴入NaOH溶液。
现象分析
白色
灰绿色
红褐色
查阅资料
一、Fe(OH)2和Fe(OH)3制备
(2)现象与结论:图乙实验中先观察到有_白__色__沉__淀__生成,在 空气中迅速变成灰__绿___色,最后变成红__褐___色,有关反应的化学 方 程 式 _F_e_S_O__4+_2_N__a_O_H__=_=_=_N__a_2S__O_4_+_F_e_(O__H_)_2_↓_(白__色__)___________; ________4_F_e_(_O_H__)_2+__O__2+__2_H__2O__=_=_=_4_F_e_(_O_H__)3______________。
铁的化合物

铁三角
Fe
Fe3+
2+
〔3〕Fe2+的检验?
〔1〕参加碱液〔或氨水〕,先生成 白 色沉淀,又迅速转变为 灰绿 色,最后 变为 红褐 色沉淀的溶液中含有Fe2+
〔2〕滴入KSCN溶液,溶液颜色不变, 参加硝酸等强氧化剂后,溶液颜色变为 血红色则溶液中含有Fe 2+
铁及其化合物转化关系
Fe3O4
制备Fe3O4 做油漆、涂 料、炼铁原料
做磁铁、炼 铁原料
二、铁的氢氧化物
1、Fe(OH)3及Fe(OH)2的制备
实验3-9:在FeCl3、FeSO4分别参加NaOH溶
液
红褐色沉淀
先产生白色絮状沉淀, 迅速变为灰绿色沉淀, 最后变为红褐色沉淀
讨论:
氢氧化亚铁实际是白色的固体,为什么在实验 中几乎观察不到白色,而最终沉淀变成了红褐 色呢?
二、铁的氢氧化物
1、Fe(OH)3及Fe(OH)2的制备
实验3-9:在FeCl3、FeSO4分别参加NaOH溶 液
红褐色沉淀
先产生白色絮状沉淀, 迅速变为灰绿色沉淀, 最后变为红褐色沉淀
FeCl3 + 3NaOH = Fe(OH)3+ 3NaCl
FeSO4 + 2NaOH =
Fe(OH)2 + Na2SO4 4OF2e+(2OHH2O) 2 +
Al
Al2O3
AlO2-
Al(OH) 3
Al3+
3.在氯化铁和氯化铜的混合溶液中参加过量的 Fe粉,假设充分反响后溶液的质量没有改变, 则原混合溶液中Fe3+和Cu2+物质的量之比为多 少?
2﹕7
特别注意:
高中化学新教材同步教案必修第一册第3章第1节第1课时铁的单质氧化物和氢氧化物

第三章 铁 金属材料第一节 铁及其化合物第1课时 铁的单质、氧化物和氢氧化物[核心素养发展目标] 1.结合生活中的铁制品应用,了解单质铁、铁的氧化物的性质及用途,培养化学服务社会的责任意识。
2.通过探究实验,认识铁单质与水蒸气反应的条件,对比钠与水的反应,加深对微观原子结构决定物质宏观性质的认识,培养宏观辨识与微观探析的能力。
3.通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
一、铁的单质1.铁元素的存在及使用(1)存在:铁在自然界中可以以单质形态(陨铁)存在,但主要以+2价和+3价化合物的形态存在,地壳中含量居第四位,仅次于氧、硅和铝。
(2)工业炼铁的原理(以Fe 2O 3为例) 3CO +Fe 2O 3=====高温2Fe +3CO 2。
2.铁的物理性质铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁体吸引。
其熔、沸点较高,熔点:1 535 ℃、沸点:2 750 ℃,密度:7.86 g·cm -3。
3.铁的化学性质(1)与某些非金属单质、酸和盐溶液反应化学性质化学方程式举例①Fe 与非金属单质反应②Fe 与非氧化性酸反应(H 2SO 4) Fe +H 2SO 4===FeSO 4+H 2↑ ③Fe 与盐溶液反应(CuSO 4)Fe +CuSO 4===Cu +FeSO 4结论:Fe 在反应中作还原剂,遇到较强的氧化剂(如Cl 2等)生成+3价铁的化合物,遇到较弱的氧化剂(如稀硫酸等)生成+2价铁的化合物。
(2)实验探究铁粉与水蒸气的反应实验装置操作现象用火柴点燃肥皂液,听到爆鸣声,证明生成了H2实验结论在高温下,铁能与水蒸气反应,化学方程式为3Fe+4H2O(g)=====高温Fe3O4+4H2提示:湿棉花的作用是受热时提供反应所需的水蒸气。
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质()(2)氯化亚铁既可由铁与盐酸反应制取也可由铁与氯气化合制取()(3)由于钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2()答案(1)×(2)×(3)×利用如图装置也可以实现Fe与水蒸气的反应(1)反应开始时,应先点燃处的酒精灯,其目的是,若点燃顺序反了,可能有什么后果?提示b用水蒸气排装置内的空气①Fe与O2生成了Fe3O4,无法与水蒸气反应;②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸。
