[教学设计]第三章第一节晶体的常识(晶胞)知识分享.docx
第三章第一节 晶体的常识

第一节晶体的常识1、认识晶体和非晶体的本质差异,明白晶体的特征和性质。
2、了解获得晶体的途径。
3、明白晶胞的概念,学会晶胞中微粒数的计算方法(均摊法),能依照晶胞的结构确定晶体的化学式。
晶体与非晶体[学生用书P35]1、晶体与非晶体的本质差异23、晶体的特点(1)自范性①定义:晶体能自发地呈现多面体外形的性质。
②形成条件之一:晶体生长速率适当。
③本质原因:晶体中粒子在微观空间里呈现周期性的有序排列。
(2)各向异性:许多物理性质(强度、导热性、光学性质等)常常会表现出各向异性。
(3)有序性:外形和内部质点排列的高度有序、(4)熔点:有固定的熔点。
1、判断正误(正确的打“√”,错误的打“×")。
(1)晶体有自范性但其微粒排列无序、()(2)晶体具有各向同性,非晶体具有各向异性。
()(3)晶体有固定的熔点、()(4)熔融态物质快速冷却即可得到晶体。
( )(5)熔融的硝酸钾冷却可得晶体,故液态玻璃冷却也能得到晶体。
( )(6)粉末状的固体也有估计是晶体。
( )答案:(1)×(2)× (3)√(4)× (5)× (6)√2、下列物质中属于晶体的是________。
A、橡胶B、玻璃C、食盐ﻩD、水晶E、塑料ﻩF、胆矾解析:固体有晶体和非晶体之分,晶体是内部微粒(原子、离子或分子)在空间按一定规律呈周期性有序排列构成的具有规则几何外形的固体,如食盐、冰、金属、水晶、大部分矿石等都是晶体;非晶体中内部粒子的排列则相对无序,如玻璃、橡胶等都是非晶体。
答案:CDF1、晶体与非晶体的区别(1)依据是否具有自范性晶体具有自范性,能自发地呈现多面体的外形,而非晶体不具有自范性。
(2)依据是否具有各向异性晶体具有各向异性,在不同方向上质点排列一般是不一样的,而非晶体不具有各向异性。
(3)依据是否具有固定的熔、沸点晶体具有固定的熔、沸点,给晶体加热时,当温度升高到某温度时便马上熔化或汽化,在熔化过程中,温度始终保持不变,而非晶体没有固定的熔、沸点。
晶体的常识(教案)

晶体的常识(全套教案)第一章:引言教学目标:1. 让学生了解晶体的基本概念和特点。
2. 培养学生对晶体研究的兴趣。
教学内容:1. 晶体的定义:晶体是由原子、分子或离子按照一定的规律排列形成的固体物质。
教学活动:1. 引入话题:通过展示晶体的图片,引导学生思考为什么晶体具有规则的形状。
2. 讲解晶体定义和特点:通过PPT或板书,详细讲解晶体的定义和特点。
3. 讨论:让学生举例说明生活中常见的晶体,并分析其特点。
教学评价:1. 检查学生对晶体定义和特点的理解程度。
2. 观察学生在讨论中的参与情况和思考能力。
第二章:晶体的结构教学目标:1. 让学生了解晶体结构的基本类型。
2. 培养学生对晶体结构的理解和分析能力。
教学内容:1. 晶体结构的基本类型:立方晶系、六方晶系、四方晶系、正交晶系和单斜晶系。
2. 晶体结构的表示方法:晶胞、晶格和空间群。
教学活动:1. 讲解晶体结构的基本类型:通过PPT或板书,讲解各种晶体结构的特点和实例。
2. 展示晶体结构的图片和模型:让学生直观地了解晶体结构的形状和结构特点。
3. 练习:让学生分析给出的晶体结构图,判断其属于哪种基本类型。
教学评价:1. 检查学生对晶体结构的基本类型的理解和记忆。
2. 观察学生在练习中的操作情况和分析能力。
第三章:晶体的生长教学目标:1. 让学生了解晶体生长的原理和过程。
2. 培养学生对晶体生长的理解和观察能力。
教学内容:1. 晶体生长的原理:溶液蒸发、熔体冷却、离子注入等。
2. 晶体生长过程:成核、生长和成熟阶段。
教学活动:1. 讲解晶体生长的原理:通过PPT或板书,讲解晶体生长的原理和过程。
2. 演示晶体生长实验:进行晶体生长实验,让学生观察和记录晶体生长的过程。
3. 讨论:让学生分析晶体生长的速度和形状受到哪些因素的影响。
教学评价:1. 检查学生对晶体生长的原理和过程的理解程度。
2. 观察学生在实验中的观察和记录能力。
第四章:晶体的性质教学目标:1. 让学生了解晶体的一些基本性质。
高中化学选择性必修二 第3章第1节物质的聚集状态与晶体的常识教学设计下学期

第三章 晶体结构与性质 第一节 物质的聚集状态与晶体的常识本节从实验室常见的固体引入,介绍了自然界中绝大多数固体都是晶体,晶体与非晶体的本质区别和性质上的差异。
晶体呈现多面体的外形是由于晶体中的粒子在微观空间里呈现周期性有序排列的结果。
通过以铜晶体和铜晶胞为例,介绍了晶胞的概念和晶胞与晶体的关系。
教学时要注意运用多种教学媒体帮助学生理解教学内容,并让学生主动参与学习活动。
重点:晶体与非晶体的区别;晶体的自范性、各向异性,结晶的方法、对晶胞的认识 难点:晶体与非晶体的区别、对晶胞的认识多媒体调试、讲义分发【新课导入】20世纪前,人们以为分子是所有化学物质能够保持其性质的最小粒子,物质三态的相互转化只是分子间距离发生了变化,分子在固态只能振动,在气态能自由移动,在液态则介乎二者之间。
【讲解】物质不同聚集状态的特点20世纪初,通过X射线衍射等实验手段,发现许多常见的晶体中并无分子。
例如,氯化钠、石墨、二氧化硅、金刚石以及各种金属等。
气态和液态物质也同样不一定都由分子构成。
例如,等离子体是由电子、阳离子和电中性粒子(分子或原子)组成的整体上呈电中性的气态物质;又如,离子液体是熔点不高的仅由离子组成的液体物质。
此外,还有更多的物质聚集状态,如晶态、非晶态,以及介乎晶态和非晶态之间的塑晶态、液晶态等。
这些事实表明,描述的物质三态间的相互转化模型显然过于简单了。
【学生活动】除了三态,还有更多的物质聚集状态,如等离子体、离子液体、晶态、非晶态,以及介乎晶态和非晶态之间的塑晶态、液晶态等。
【设疑】阅读[科学▪技术▪社会]中的等离子体、液晶。
总结等离子体、液晶态的概念、特征及应用。
【总结】1.等离子体(1)概念:气态物质在高温或者在外加电场激发下,分子发生分解,产生电子和阳离子等。
这种由电子、阳离子和电中性粒子组成的整体上呈电中性的物质聚集体称为等离子体。
(2)特点:等离子体具有良好的导电性和流动性。
(3)应用运用等离子体显示技术可以制造等离子体显示器;利用等高子体可以进行化学合成;核聚变也是在等离子态下发生的等。
《晶体的常识》教案最全版

《晶体的常识》教案最全版第一章:引言1.1 教学目标让学生了解晶体的基本概念和特点。
激发学生对晶体研究的兴趣。
1.2 教学内容晶体的定义与分类晶体的基本特点晶体的重要性1.3 教学方法讲授法:介绍晶体的基本概念和特点。
互动法:引导学生讨论晶体的实际应用。
1.4 教学资源课件:展示晶体的图片和实例。
视频:播放晶体生长的实验过程。
1.5 教学步骤1. 导入:通过展示晶体图片,引发学生的好奇心。
2. 讲解:介绍晶体的定义、分类和基本特点。
3. 实例分析:分析晶体的实际应用。
4. 讨论:引导学生探讨晶体的重要性。
5. 总结:强调本节课的重点内容。
第二章:晶体的定义与分类让学生了解晶体的定义和分类。
2.2 教学内容晶体的定义晶体的分类:原子晶体、离子晶体、分子晶体和金属晶体2.3 教学方法讲授法:讲解晶体的定义和分类。
2.4 教学资源课件:展示晶体的定义和分类。
2.5 教学步骤1. 复习:回顾上一节课的内容。
2. 讲解:讲解晶体的定义和分类。
3. 示例:展示不同类型的晶体实例。
4. 练习:让学生区分不同类型的晶体。
5. 总结:强调本节课的重点内容。
第三章:晶体的基本特点3.1 教学目标让学生了解晶体的基本特点。
3.2 教学内容晶体的周期性结构晶体的点阵参数晶体的对称性讲授法:讲解晶体的基本特点。
互动法:引导学生探讨晶体的对称性。
3.4 教学资源课件:展示晶体的基本特点。
3.5 教学步骤1. 复习:回顾上一节课的内容。
2. 讲解:讲解晶体的周期性结构、点阵参数和对称性。
3. 示例:展示晶体的对称性实例。
4. 练习:让学生分析晶体的对称性。
5. 总结:强调本节课的重点内容。
第四章:晶体的重要性4.1 教学目标让学生了解晶体的重要性。
4.2 教学内容晶体在材料科学中的应用晶体在自然界中的分布晶体在现代科技领域中的应用4.3 教学方法讲授法:讲解晶体的重要性。
互动法:引导学生探讨晶体在实际应用中的重要性。
4.4 教学资源课件:展示晶体的重要性和应用实例。
2021-2022学年人教版高中化学选修三教学案:第三章 第一节 晶体的常识 Word版含答案

第一节晶体的常识—————————————————————————————————————[课标要求]1.了解晶体的初步学问,知道晶体与非晶体的本质差异。
2.学会识别晶体与非晶体的结构示意图。
3.把握晶胞的概念以及晶胞中粒子个数的计算方法。
1.晶体具有自范性、各向异性和固定的熔点。
2.习惯接受的晶胞都是平行六面体,相邻晶胞之间没有空隙,全部晶胞平行排列,取向相同。
3.立方晶胞顶点上的粒子为8个晶胞共有,棱上的粒子为4个晶胞共有,面上的粒子为2个晶胞共有。
晶体与非晶体1.晶体与非晶体的本质差异自范性微观结构晶体有原子在三维空间呈周期性有序排列非晶体无原子排列相对无序2.获得晶体的三条途径(1)熔融态物质凝固。
(2)气态物质冷却不经液态直接凝固(凝华)。
(3)溶质从溶液中析出。
3.晶体的特性(1)自范性:晶体能自发地呈现多面体外形。
(2)各向异性:晶体在不同方向上表现出不同的物理性质。
(3)固定的熔点。
4.晶体与非晶体的测定方法测定方法测熔点晶体有固定的熔点,非晶体没有固定的熔点牢靠方法对固体进行X-射线衍射试验1.推断正误(正确的打“√”,错误的打“×”)。
(1)晶体有自范性但其微粒排列无序()(2)晶体具有各向同性,非晶体具有各向异性()(3)晶体有固定的熔点()(4)熔融态物质快速冷却即可得到晶体()答案:(1)×(2)×(3)√(4)×2.下列叙述中,不正确的是()A.从硫酸铜饱和溶液中可以析出硫酸铜晶体B.具有规章几何外形的固体不肯定是晶体C.晶体与非晶体的根本区分在于是否具有规章的几何外形D.具有各向异性的固体肯定是晶体解析:选C晶体与非晶体的根本区分在于其内部粒子在空间中是否按肯定规律做周期性重复排列。
溶质从溶液中析出是得晶体的一条途径,A项正确;晶体所具有的规章几何外形、各向异性和固定的熔点是其内部粒子规律性排列的外部反映,因此D项正确,C项错误。
晶体结构与性质知识点

第三章晶体构造与性质第一节晶体的常识【知识点梳理】一、晶体与非晶体1、晶体与非晶体① 晶体:是内部微粒〔原子、离子或分子〕在空间按一定规律做周期性重复排列构成的物质。
② 非晶体:是内部的原子或分子的排列呈杂乱无章的分布状态的物质。
2、晶体的特征〔1〕晶体的根本性质晶体的根本性质是由晶体的周期性构造决定的。
① 自范性:a.晶体的自范性即晶体能自发的呈现多面体外形的性质。
b.“自发〞过程的实现,需要一定的条件。
晶体呈现自范性的条件之一是晶体生长的速率适当。
② 均一性:指晶体的化学组成、密度等性质在晶体中各局部都是一样的。
③ 各向异性:同一晶体构造中,在不同方向上质点排列一般是不一样的,因此,晶体的性质也随方向的不同而有所差异。
④ 对称性:晶体的外形与内部构造都具有特有的对称性。
在外形上,常有相等的对称性。
这种一样的性质在不同的方向或位置上做有规律的重复,这就是对称性。
晶体的格子构造本身就是质点重复规律的表达。
⑤ 最小内能:在一样的热力学条件下,晶体与同种物质非晶体固体、液体、气体相比拟,其内能最小。
⑥ 稳定性:晶体由于有最小内能,因而结晶状态是一个相对稳定的状态。
⑦ 有确定的熔点:给晶体加热,当温度升高到某温度便立即熔化。
⑧ 能使X射线产生衍射:当入射光的波长与光栅隙缝大小相当时,能产生光的衍射现象。
X射线的波长与晶体构造的周期大小相近,所以晶体是个理想的光栅,它能使X射线产生衍射。
利用这种性质人们建立了测定晶体构造的重要试验方法。
非晶体物质没有周期性构造,不能使X射线产生衍射,只有散射效应。
〔2〕晶体SiO2与非晶体SiO2的区别① 晶体SiO2有规那么的几何外形,而非晶体SiO2无规那么的几何外形。
② 晶体SiO2的外形与内部质点的排列高度有序,而非晶体SiO2内部质点排列无序。
③ 晶体SiO2具有固定的熔沸点,而非晶体SiO2无固定的熔沸点。
④ 晶体SiO2能使X射线产生衍射,而非晶体SiO2没有周期性构造,不能使X射线产生衍射,只有散射效应。
选修三-第三章-第一节-晶胞

晶胞
学习目标:
1、了解晶体和晶胞的关系
2. 会计算晶胞中的粒子数,试确定晶体 的化学式
3. 结合数学思想解决
的问题
一、晶胞 1.概念
晶胞是描述晶体结构的基本单元。 2.结构 习惯采用的晶胞都是平行六面体,晶体是由无பைடு நூலகம்晶 胞“无隙并置”而成。
平行六 面体
无隙并置
氯化铯晶体:CsCl
1
1
体心:1
(1)平行六面体晶胞
A= 1 B= 4 ×1/8=1/2
A2B
确定化学式
A= 4 ×1/4=1 B= 8 ×1/8=1 C= 1
ABC
拓展练习1:
某晶胞结构如 图所示,晶胞中 各微粒个数分别 为:
铜___3_____个 钡___2_____个 钇___1_____个 氧___7_____个
氯化铯晶胞
氯化钠晶体:NaCl
NaCl晶胞
二、根据晶胞的结构,确定晶体的化学式
晶体化学式确定—— 晶胞内不同微粒的个数最简整数比
氯化铯晶胞
晶胞中粒子个数计算规律
晶胞 顶角 棱上 面上 中心
立方体 1/8 1/4 1/2 1
请看:
4
8 51
棱边:1/4
1
3 73
62
2
4
面心:1/2
2
顶点:1/8
(2)正三棱柱
顶点: 1/12 面心: 1/2 (上、下)棱:1/4 中棱: 1/6
(3)六棱柱晶胞 分析此晶胞中有
个原子
顶点: 1/6 面心: 1/2
体心: 1
练习:2001年报道的硼和镁形成的化合物刷新了金属
化合物超导温度的最高记录。如图所示的是该化合物
高中化学人教版选修3教案-3.1 晶体的常识
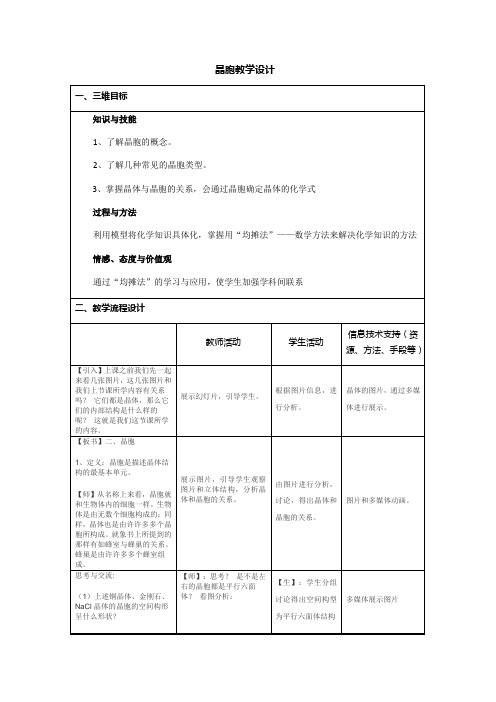
(1)上述铜晶体、金刚石、NaCl晶体的晶胞的空间构形呈什么形状?
(2)在上述晶体中,晶胞是如何排列的?晶胞之间是否存在空隙?
【师】:思考?是不是左右的晶胞都是平行六面体?看图分析:
【生】:学生分组讨论得出空间构型为平行六面体结构
【生】:不是所有的晶胞都是平行六面体,应该是大多数是平行六面体。
多媒体展示图片
【板书】2、晶胞的特点:
(1)大多是平行六面体。
(2)排列方式:“无隙并置”
【板书】3、计算晶体化学式或晶胞中粒子数的一般方法——均摊法
下面我们一起来看一个小视频来分析一下。
【师】:通过视频我们可以明显的看出顶点的原子是被八个晶胞所拥有,所以我们可以得出结论:
【板书】⑴顶点——同时为8个晶胞所共有——每一个晶胞拥有:1/8;
【随堂练习】
练习1:现在我们一起再来回顾一下在一个氯化钠晶胞里是13个钠离子,多少14氯离子?
生:不是
氯离子:8*1/8+6*1/2=4
钠离子:1+12*1/4=4
【学与问】
金属钠:8×1/8+1 =2
金属锌:8×1/8+1 = 2
晶体碘:(8×1/8+6×1/2)×2 = 8
金刚石:8×1/8+6×1/6+4 = 8
【师】:在立方晶胞中,粒子可能出现在到下这几个位置:
【师】:当原子位于顶点时这个原子将被八个晶胞所共用,就像我手中的八个晶胞模型一样,每一个晶胞只拥有该原子的1/8.
【生】:氯离子:8个顶点各有一个,6个面上各有一个,一共是14个铜原子。
钠离子:12在棱的中点1个在体心
共13个
顶点:1/8
棱上:?
面心:?
晶胞教学设计
一、三维目标
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[ 教学设计 ] 第三章第一节晶体的常识(晶胞)
江苏省如东高级中学张霞
教学设想
从教材看,本章首先从人们熟悉的固体出发,把固体分为晶体和非晶体两大类,引出了晶体的特征和晶胞的概念。
晶胞是描述晶体结构的基本单元,是研究晶体结构的最基本概念,教
科书利用图片、比喻等方式介绍了晶体与晶胞的关系,并通过例子介绍了如何计算晶胞中所含的
原子数。
本教案选择《晶胞》作为学生自主学习的课题,试图利用多媒体课件和形象比喻等教学方式,使学生建构起晶胞的概念,通过动手制作晶胞模型并把自己制作的晶胞模型拼凑成晶体
模型,体会晶胞与晶体之间的关系;再以课本上的问题设置矛盾,通过学生自学讨论,教
师的适当点拨,总结归纳出一个晶胞中平均所含粒子个数的计算方法,在此过程中,提升学生的
空间想象能力。
一、教学目标分析
知识与技能
1.了解晶体与晶胞的关系,体会由晶胞“无隙并置”构成晶体的过程。
2.通过自学讨论,掌握不同晶胞中平均所含粒子个数的计算方法。
过程与方法
1.运用多种教学媒体,借助形象的比喻,帮助学生建构抽象的空间结构。
2.知道研究晶体结构的一般方法。
情感态度和价值观
1、进一步形成求真务实、勤于思考的科学态度;形成敢于质疑、勇于创新的科学精神。
二、教学内容分析
对本节教学内容的处理方法:利用多媒体演示若干晶体和晶胞,组织学生讨论晶体与晶胞的关系,动手制作晶胞模型,引导学生建立以晶胞为基本结构研究晶体的思想,结合课本
图 3-7 铜晶胞,展示实物模型,提出问题:为什么说一个晶胞里只含 4 个铜原子?学生自学、
讨论并归纳出立方晶胞中平均所含粒子个数的计算方法,然后设置问题:如果为三棱柱晶胞
或者六棱柱晶胞,又该如何计算?举一反三,巩固了学生对空间结构的理解和计算。
最后利用课本学与问与课后习题3,进行训练反思。
三、教学过程设计
[ 多媒体演示 ](1)不同类型的晶体图片:玛瑙、水晶、碘等;
( 2)同一晶体,不同大小的图片。
[ 学生活动 ] 回忆前面所学的晶体的知识,观察图片,并讨论:同一类型的晶体,大小不同,外观是否相同?
[ 设置问题情境 ] 如果我们把一块金刚石敲碎,就会得到小金刚石,如果小金刚石继续不停的敲碎,最后得到的是什么呢?
[ 学生讨论、教师点拨]最后可以得到晶体的最基本结构单元。
大的晶体可以看成是许多这样的重复单位重叠起来的,或看成是数量巨大的这些最基本单元紧密的堆积起来的。
[ 多媒体演示 ] 大大小小的金刚石图片。
金刚石的外观、空间结构以及晶胞结构图片。
[ 师生总结 ] 我们把这种描述晶体结构的基本单元叫做晶胞。
它是保持晶体规则多面体外形的
最小单位。
晶体就是由无数个晶胞经过“无隙并置”而成的。
[ 学生活动 ] 利用提供的纸、小木棍等工具,制作小的立方晶胞(按教师给定的尺寸),并将
每 8 个同学所做的晶胞进行组合,要求尽可能结合紧密。
讨论晶胞与晶体的关系,体会晶胞无隙并置构成晶体的过程。
[ 设置问题情境 ] 图中所示金属铜的一个晶胞,它是一个立方体,含 4 个铜原子,但是从图中
我们看到有 14 个铜原子,这是怎么回事?为什么说一个晶胞里只含 4 个铜原子呢?请同学
们结合课本内容,先自己寻找出晶胞中所含原子个数的计算方法,然后以前后桌 4 个人一小组,讨论你们的结论是否正确。
[学生活动 ] 自学、结论、交流。
[学生活动 ] 以一个小组为代表,汇报讨论的结果,其他小组同学来判断是否正确,对不完整的地方进行补充,并归纳出最简洁的计算方法。
[师生总结 ]( 1)所有晶胞都是平行六面体,晶体可以看作是晶胞在三维空间里共面堆积
而成。
每个晶胞的上、下、左、右、前、后共有六个与之共面的晶胞。
(2)处于晶胞顶点的粒子,同时为 8 个晶胞所共有,每个粒子只有 1/8 属于晶
胞;处于棱上的粒子,同时为 4 个晶胞所共有,每个粒子只有 1/4 属于晶胞;
处于面上的粒子,同时为两个晶胞所共有,每个粒子只有 1/2
属于晶胞;处于晶胞内部的粒子,完全属于该晶胞。
[ 思维拓展 ] 在计算晶胞中所含平均原子数时,我们已经知道如果为立方结构,则有 1/8,1/4,1/2 和1,若换为六棱柱状呢?三棱柱又如何呢?
[ 学生活动 ] 结合图片提供的结构,讨论交流得出六棱柱和三棱柱中所含平均原子个数的计
算。
六棱柱为 1/6, 1/3, 1/2 和 1,而三棱柱为 1/12, 1/6, 1/2 和 1。
[训练反思 ]教材 P66 学与问:图 3-9 依次是金属钠、金属锌、碘、金刚石晶胞的示意图,
数一数它们分别平均含几个原子。
[ 巩固练习 ] 教材 P67 习题 3.下图的晶胞中各含有几个原子?
教后反思:
晶胞,是连接宏观晶体与微观原子之间的桥梁。
晶胞是晶体微观结构的最基本单元,要
研究晶体,必须先了解晶胞。
虽然本教学案例侧重自主讨论的学习方式,但在教学过程中,
了多幅晶体和晶胞的图片,比如让学生自己动手制作晶胞模型并拼制成晶体模型,以使学生对晶胞有一个比较形象和具体的认识,然后再进行问题情境的创设(即晶胞中显示的原子是否全部为此晶胞所包含?),使学生比较顺利的完成了自主学习的任务,在此基础上,又进行了一定的变化,把立方晶胞拓展到棱柱晶胞,使学生对问题的认识得到深化,同时也完成了化学知识和技能方面的自我建构。
