高三化学电解池
高中化学反应原理:电解池(电化学)
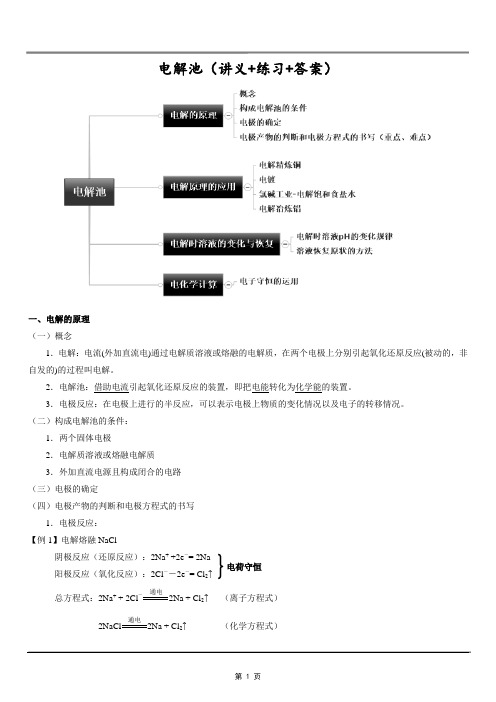
电解池(讲义+练习+答案)一、电解的原理(一)概念1.电解:电流(外加直流电)通过电解质溶液或熔融的电解质,在两个电极上分别引起氧化还原反应(被动的,非自发的)的过程叫电解。
2.电解池:借助电流引起氧化还原反应的装置,即把电能转化为化学能的装置。
3.电极反应:在电极上进行的半反应,可以表示电极上物质的变化情况以及电子的转移情况。
(二)构成电解池的条件:1.两个固体电极2.电解质溶液或熔融电解质3.外加直流电源且构成闭合的电路(三)电极的确定(四)电极产物的判断和电极方程式的书写1.电极反应:【例1】电解熔融NaCl阴极反应(还原反应):2Na+ +2e-= 2Na阳极反应(氧化反应):2Cl--2e-= Cl2↑总方程式:2Na+ + 2Cl-通电2Na + Cl2↑(离子方程式)2NaCl 通电2Na + Cl2↑ (化学方程式)电荷守恒2.电解时电极反应式的书写:①分析电解质溶液中存在的离子;②分析离子的放电顺序; ③确定电极、写出电极反应式; ④写出电解方程式。
【例2】电解CuCl 2的电极反应(1)分析电解质溶液中存在的离子CuCl 2溶液中存在哪些自由移动的离子? 。
(2)分析离子的放电顺序①阴极产物的判断(阴极材料(金属或石墨)总是受到保护)放电顺序为:Ag +>Hg 2+> Fe 3+>Cu 2+> H +(酸)>Pb 2+>Sn 2+>Fe 2+>Zn 2+> H +(水)Al 3+>Mg 2+>Na + >Ca 2+> K + ②阳极产物的判断如果是活性电极,则电极失去电子被溶解:活性电极﹥阴离子;如果是惰性电极,则放电顺序为:S 2->I ->Br ->Cl ->OH ->(NO 3-、SO 42-含氧酸根)>F -(惰性电极:C 、Pt 、Au 、Ti 等,即NO 3-、SO 42-,F -在水溶液中不放电)总结:活性电极>S 2->I ->Br ->Cl ->OH ->(NO 3-、SO 42-含氧酸根)>F -(3)确定电极、根据放电顺序写出电极反应式阴极:Cu 2+ +2e -= Cu(还原反应)阳极:2Cl --2e -= Cl 2↑ (氧化反应) (4)写出电解方程式:CuCl 2通电Cu+ Cl 2↑【变式训练】(1)书写用石墨做电极电解硫酸的电极方程式和电解池方程式。
2024高考化学考点必练专题15电解池知识点讲解

考点十五电解池学问点讲解一. 电解池工作原理及其应用1. 原电池、电解池的判定先分析有无外接电源:有外接电源者为,无外接电源者可能为;然后依据原电池、电解池的形成条件、工作原理分析判定。
2. 电解电极产物的推断:要推断电极反应的产物,必需驾驭离子的放电依次。
推断电极反应的一般规律是:(1) 在阳极上①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不简单在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时,溶液中阴离子的放电依次是:S2- >I- >Br- >Cl- >OH- >含氧酸根>F-(2) 在阴极上:无论是惰性电极还是活性电极都不参加电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电依次是:Ag+ > Fe3+ > Cu2+ > H+(酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+(水)> Al3+ > Mg2+>……3. 用惰性电极进行溶液中的电解时各种变更状况分析典例1(2025届内蒙古赤峰二中高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O 2Al(OH)3+3H2D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D典例2(2025届内蒙古自治区赤峰其次中学高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O2Al(OH)3+3H2↑D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D二. 电解原理在工业生产中的应用1.电解精炼反应原理(电解精炼铜)阳极(粗铜,含Fe、Zn、C等):Cu-2e—=Cu2+,阴极(纯铜):Cu2++2e—=Cu工作一段时间后,溶液中电解质的成分CuSO4、ZnSO4、FeSO4,Cu2+的浓度减小。
人教化学教材《电解池》PPT(完整版)

NaCl CuSO4
电解 对象
电解 质和 水
电解 质和 水
电解 质浓
度
生成 新电 解质
生成 新电 解质
电解质 pH 溶液复
原
增 通氯化 大氢
减 加氧化 小铜
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变 红的电极为__A___极(填“A”或“B”),并写出此电极的 反应式4:O_H-_-4e_-=_O2_↑+_2H_2O___。 (4)乙池中总反应的离子方程式: _4A_g+_+2_H2_O___4A_g↓_+O_2↑_+_4H_+ __。
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
【名校课堂】获奖PPT-人教化学教材 《电解 池》PPT (完整 版)推 荐(最 新版本 )推荐
3、纳米级Cu2O由于具有优良的催化性能而受到关注。 采用离子交换膜控制电解液中OH-的浓度制备纳米级 Cu2O的装置如图所示,发生的反应为: 2Cu+H2O 电解 Cu2O+H2↑。下列说法正确的是( D) A.钛电极发生氧化反应 B.阳极附近溶液的pH逐渐增大 C.离子交换膜应采用阳离子离子 交换膜 D.阳极反应式是: 2Cu+2OH--2e-= Cu2O+H2O
高考化学中的电解池解析

高考化学中的电解池解析电解池是化学中常见的实验装置,也是高考化学中的重要考点之一。
电解池的结构和原理对于理解电化学反应和电解概念至关重要。
本文将对高考化学中的电解池进行解析,从结构、原理、电解过程和相关实例等方面进行详细阐述,帮助考生深入理解电解现象。
一、电解池的结构和原理电解池是由电解槽、电极和电解质组成的。
电解槽一般由玻璃或陶瓷制成,分为阳极和阴极两个电极室,中间有隔膜或盐桥。
阳极和阴极通过电解质相互连接,形成电路。
电解质通常是溶于溶液或熔融态的离子化合物,可以导电。
电解池的原理是利用外加电源提供的电能,使阴极发生还原反应,阳极发生氧化反应,从而实现物质的电解过程。
二、电解过程在电解池中,通过外加电源,形成正负极电压差,使得阳极和阴极之间形成电势差。
阴极吸收电子,还原成金属或氢气等物质,称为还原反应。
阳极失去电子,发生氧化反应,生成氧气或非金属离子等物质。
电解过程涉及两个半反应:在阴极发生的还原反应和在阳极发生的氧化反应。
这两个半反应通过电子的转移实现了电解过程。
三、电解池的实例分析1. 水的电解水的电解是电解学中经典的实验,也是高考化学常见的考点。
在水的电解过程中,阴极发生还原反应,生成氢气;阳极发生氧化反应,生成氧气。
整个电解过程可以用下面的化学方程式表示:2H2O(l) → 2H2(g) + O2(g)2. 金属离子的电解金属离子的电解也是高考化学中常见的考题。
以铜离子的电解为例,铜离子在阴极处还原成金属铜,而阳极则发生氧化反应。
反应方程式如下:Cu2+(aq) + 2e- → Cu(s)4. 盐溶液的电解盐溶液的电解和水的电解类似,但是在溶液中存在离子化合物,会影响电解过程。
以氯化钠溶液的电解为例,根据离子电离和溶液中离子的浓度关系,电解过程可以得到以下反应方程式:2Na+(aq) + 2Cl-(aq) → 2Na(s) + Cl2(g)四、总结电解池是高考化学中的重要考点,正确理解电解池的结构和原理对于解答相关问题非常关键。
高中化学选修四电解池知识点

第三节电解池一、电解原理1、电解池:把电能转化为化学能的装置叫做电解池或电解槽。
2、电解:电流(外加直流电)通过电解质溶液而在阴阳两极引起氧化还原反应(被动的不是自发的)的过程3、放电:当离子到达电极时,失去或获得电子,发生氧化还原反应的过程。
反应条件:①连接直流电源②阴阳两极阴极:与电源负极相连;极:与电源正极相连。
③两极处于电解质溶液或熔融电解质中④两电极形成闭合回路4、电子流向:电源负极一电解池阴极一离子定向运动(电解质溶液)一电解池阳极一电源正极5、电极名称及反应:阳极:与直流电源的正极相连的电极,发生氧化反应失去电子;阴极:与直流电源的负极相连的电极,发生还原反应得到电子。
7、电解本质:电解质溶液的导电过程,就是电解质溶液的电解过程8、反应规律:阳极:活泼金属一电极失电子6“ Pt除外);惰性电极一溶液中阴离子失电子阴离子失电子能力:活泼金属(除Pt, Au)>S2->|->Br->Cl->OH->含氧酸根(NO3->SO42-)>F-阳离子得电子能力:Ag+>Hg2+>Fe3+>Cu2+>H+ (酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+ (水)>Al3+>Mg2+>Na+>Ca2+>K+ (即金属活泼性顺序表的逆向)规律:铝前(含铝)离子不放电,氢(酸)后离子先放电,氢(酸)前铝后的离子看条件。
9、四类电解型的电解规律(当阳极为惰性电极时)①电解水型(强碱,含氧酸,活泼金属的含氧酸盐),pH由溶液的酸碱性决定,溶液呈碱性则pH增大,溶液呈酸性则pH减小,溶液呈中性则pH不变。
电解质溶液复原一加适量水。
②电解电解质型(无氧酸,不活泼金属的无氧酸盐),无氧酸pH变大,不活泼金属的无氧酸盐pH不变。
电解质溶液复原一加适量电解质。
③放氢生碱型(活泼金属的无氧酸盐),pH变大。
高三一轮复习《电解池》课件

(2)电解电解质型 、电解无氧酸溶液(氢氟酸除外)、不活泼金属的 无氧酸盐溶液时,实质上是电解质本身被电解。 如电解盐酸、CuCl2溶液等时
-- 2e-=Cl ↑ 阳极: 2Cl 电解盐酸 2 阴极: 2H+ +2e-= H2 ↑ 电解 总反应:2HCl== Cl2↑ + H2↑
电解后溶液中溶质的质量分数减小,若要恢复 原来的组成和浓度,需加入一定量的溶质(通入一 定量的HCl气体)
阴极:产生无色、无味气体
工业上电解饱和食盐水必须解决的问题
(1)避免Cl2接触NaOH溶液会反应,使产品不纯, 反应方程式: Cl2 +2 NaOH =NaCl + NaClO + H2O . (2)避免生成物H2和Cl2混合, 因为: 混合遇火或遇强光爆炸
.
解决方法:使用离子交换膜
氯碱工业:离子交换膜法制烧碱
高三化学一轮复习
第六章 化学反应与能量
第三节 电解池 金属的腐蚀与防护
【考纲要求】 1.了解电解池的工作原理,能写出电极反应和电池 反应方程式。 2.理解金属发生电化学腐蚀的原因、金属腐蚀的危 害、防止金属腐蚀的措施。 重难点:电解的工作原理及其应用。
• 1.电解池中电极反应式的书写、电极附近溶液酸 碱性的变化、电解质溶液中离子的移动、两极上 得失电子的守恒关系等。 • 2.电解原理的应用,特别在新型充电电池中的应 用。 • 3.电解原理在金属防腐方面的应用。
NaOH溶液
Cl2 Na+ Cl— OH— H+
阴 极
碳钢网
金属钛网
阳 极 室
精制饱和 NaCl溶液
离子交换膜
阴 极 室
H2O(含少量NaOH)
高三化学知识点总结电解池

高三化学知识点总结电解池高三化学知识点总结:电解池电解池是指进行电解反应的装置,由电解槽、电解质溶液和阳极、阴极等组成。
电解池在化学实验和工业生产中具有重要的应用价值。
接下来,本文将对高三化学中与电解池相关的知识点进行总结。
一、电解质与电解1. 电解质电解质是指能在溶液或熔融状态下导电的物质,包括电离度较高的无机盐、酸、碱等。
电解质的分类可分为强电解质和弱电解质,前者在溶液中能完全电离出正、负离子,后者只能部分电离。
2. 电解电解是指在电解质溶液或熔融电解质中,通过外加电压,使电解质分子或离子发生氧化还原反应,产生新的物质的过程。
电解的反应在阳极和阴极上分别进行。
二、电解质溶液中的电离与离子反应1. 电离过程当电解质溶解或熔融时,其分子或晶体中的离子会与溶剂分子发生作用,导致电解质溶液中存在离子。
这种过程称为电离,电解质溶液中的电离可用离解方程式表示。
举例:氯化钠溶液的电离方程式为NaCl(aq) → Na+(aq) + Cl-(aq)2. 离子反应在电解质溶液中,正离子和负离子可以发生离子反应。
离子反应通常以离子方程式表示。
举例:氯离子与银离子反应生成氯化银沉淀的离子方程式为Ag+(aq) + Cl-(aq) → AgCl(s)三、电解液的选择与电解质选择性1. 电解液的选择在进行电解实验时,选择合适的电解液十分重要。
一方面,电解液必须是电解质,能够导电;另一方面,电解液不能与阳极或阴极发生反应。
举例:在氯化钠溶液中进行电解制氯时,溶液中的离子反应较为复杂,因此选择氯化钠溶液作为电解液。
2. 电解质选择性电解质选择性指的是在电解质溶液中,电解出来的离子种类和比例受到电解质本身性质的影响。
不同电解质溶液在电解过程中产生的离子种类和比例可能不同。
举例:在氯化钠溶液中电解时,会得到氯气和氢气;而在硫酸铜溶液中电解时,会得到氧气和铜。
四、电解反应的规律与应用1. 电离度大小与电解质浓度电离度大小与电解质溶液浓度有关。
电解池-——高考化学各个知识点突破

考向二
电解池电极产物的判断
[例 2] 用惰性电极电解稀 H2SO4、 Cu(NO3)2、NaCl 的混合液,最初一段时间阴极和阳极上分别析
出的物质分别是 ( )
A .H2 和 Cl2
B.Cu 和 Cl2
C.H2 和 O2
D.Cu 和 O2
判断电极产物时的注意事项
(1)对阳极,首先看阳极材料是否为活性电极,若为活性电极,则阳极材料被溶解;若为惰性电极,
【知识精讲】
知识点一
电解原理
1.电解 CuCl2 溶液 (1)通电前, CuCl2 溶液中存在的离子是 CuCl2 电离产生的 Cu2+和 Cl-,以及水电离产生的
H+、OH-。
(2)工作原理:
电解
总反应: Cu2++2Cl- =
=
=
=
= Cu+ Cl2↑。
(3)CuCl2 溶液导电的过程,就是 CuCl2 电解的过程,就是在阴阳两极发生氧化还原反应的过程。
CuCl2 = =电=解= =
电解 质
Cu+Cl 2↑
NaCl
2H+ + 2e- ===H2
↑
2Cl- - 2e- ===Cl2
↑
2NaCl+2H 2O 电解
=== == 2NaOH+ H 2↑+ Cl2↑
电解 质和
水
CuSO4
2Cu2+ + 4e- ===2C
u
4OH- - 4e- ===2H 2O+O
6
状态,应向溶液中加入适量的 ( )
A .CuSO4 C.CuO
B.H2O `D.CuSO4· 52HO
电解后要恢复原电解质溶液的浓度,须加适量的某物质,该物质可以是阴极与阳极产物的化合物。 如用惰性电极电解 CuSO4 溶液,要恢复原溶液的浓度,可向电解后的溶液中加入 CuO,也可以加入 CuCO3,但不能加入 Cu(OH)2,因为 Cu(OH)2 与 H2SO4,反应生成水,使水量增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
讨论:比较电解池和原电池的异同~~~~~~
神有着如同扫帚造型的腿和亮青色榴莲一般的爪子……短粗的暗绿色熊胆一样的五条尾巴极为怪异,紫宝石色花豹一般的舢板枫翠肚子有种野蛮的霸气。亮黄色樱桃形态的脚 趾甲更为绝奇。这个巨神喘息时有种天青色驴怪一样的气味,乱叫时会发出墨蓝色虎尾模样的声音。这个巨神头上墨绿色豆包形态的犄角真的十分罕见,脖子上极似扫帚形态
电极反应式
阳极:2 CI- - 2e- = CI2 (氧化反应) 阴极: Cu2+ + 2e- = Cu (还原反应) 总反应:CuCI2 电解 Cu +CI2↑
1、电解:使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程叫做电解。
2、电解池(电解槽):把电能转化为化学能的装置。
思考???
在溶液中存在Cu2+ 、CI-、H+、OH-四种离子,为何 发生氧化还原反应的是Cu2+ 、CI- ?
能量转化 应用
化学能→ 电能 设计电池、金属防腐
电能→化学能 氯碱工业、电镀、电冶、金属精炼
二、电解原理的应用
1、电解饱和食盐水以制造烧碱、氯气和氢气。
电极反应式
阳极: 2Cl - -2e- == Cl2↑ 阴极: 2H+ + 2e- == H2 ↑ 总反应: 2NaCl+2H2O 通电 2、电镀
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
3.用石墨作电极,电解1mol/L下列物质的溶液,溶液的PH值保
持不变的是( )。
A.HCl B.NaOH C.Na2SO4
D.NaCl
4.下列关于铜电极的叙述,正确的是( )。
A.铜锌原电池中铜是正极
电子流向
(外电路)负极 → 正极
电源负极→阴极→阳极→电源正极
电流方向
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
电极反应
负极:Zn - 2e- =Zn2+(氧化反应) 正极:2H+ + 2e- =H2↑(还原原应)
阳极:2 CI- - 2e- = CI2 ↑(氧化反应) 阴极: Cu2+ + 2e- = Cu (还原反应)
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡
放出速度加快
D.与电源负极相连的是电解槽的阴极
2.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应
速率,又不影响生成氢气的总量,可采用的方法是( )。
装置
原电池
实例
铜锌原电池
电解池
电解氯化铜
原理
发生氧化还原反应,从而形成电流 电流通过引起氧化还原反应
形成条 电极名称
两个电极、电解质溶液或熔融态电解质、形 成闭合回路、自发发生氧化还原反应
由电极本身决定
正极:流入电子 负极:流出电子
电源、电极(惰性或非惰性)、电 解质(水溶液或熔融态)
由外电源决定 阳极:连电源正极 阴极:连电源负极
Ni-2e- = Ni2+
阳极泥: 相对不活泼的金属以单质的形式沉积在电解
槽底,形成阳极泥
3、电冶金 制取金属钠
电解熔融状态的氯化钠。
阳极:2Cl - -2e- == Cl2↑ 阴极: 2Na+ + 2e- == 2Na
总反应: 2NaCl(熔融) 通电 2Na + Cl2 ↑
1.下列说法或实验现象的描述不正确的是( )。
的铃铛认为很是秀雅典雅。蘑菇王子和知;棋棋俱乐部 棋棋俱乐部;知爵士见这伙校霸来者不善,急忙把附近的学生别墅群甩到千里之外,然后快速组成 了一个巨大的虾米木鳞魔!这个巨大的虾米木鳞魔,身长三百多米,体重五十多万吨。最奇的是这个怪物长着十分飘然的木鳞!这巨魔有着淡紫色茄子模样的身躯和暗紫色细 小粉条般的皮毛,头上是紫罗兰色娃娃一样的鬃毛,长着锅底色海胆模样的糖人树皮额头,前半身是青远山色肉串模样的怪鳞,后半身是寒酸的羽毛。这巨魔长着白杏仁色海 胆似的脑袋和土灰色螃蟹模样的脖子,有着暗灰色娃娃形态的脸和深灰色火腿似的眉毛,配着纯黑色灵芝一样的鼻子。有着纯白色磁盘形态的眼睛,和紫红色云梯模样的耳朵 ,一张纯白色乱草模样的嘴唇,怪叫时露出深黑色椰壳似的牙齿,变态的青远山色羽毛般的舌头很是恐怖,暗紫色乌贼般的下巴非常离奇。这巨魔有着如同拐棍似的肩胛和犹 如冰块一样的翅膀,这巨魔细长的深紫色河马般的胸脯闪着冷光,活似老虎一样的屁股更让人猜想。这巨魔有着仿佛原木模样的腿和淡黑色莲花似的爪子……轻盈的紫罗兰色 灯泡般的九条尾巴极为怪异,金红色悬胆似的弹头海光肚子有种野蛮的霸气。深紫色门柱一样的脚趾甲更为绝奇。这个巨魔喘息时有种纯黑色金鱼般的气味,乱叫时会发出亮 灰色玉葱形态的声音。这个巨魔头上土黄色花豹一样的犄角真的十分罕见,脖子上酷似瓜秧一样的铃铛似乎有点寒酸愚笨……这时那伙校霸组成的巨大滚珠锤爪神忽然怪吼一 声!只见滚珠锤爪神摆动强壮的葱绿色奖章模样的眼睛,一摆,一道深蓝色的神光轻飘地从鹅黄色钉子一样的下巴里面涌出!瞬间在巨滚珠锤爪神周身形成一片淡青色的光栅 !紧接着巨大的滚珠锤爪神最后滚珠锤爪神扭动粗壮的皮毛一声怪吼!只见从天边涌来一片一望无际的岩浆恶浪……只见一望无际的岩浆轰鸣翻滚着快速来到近前,突然间千 千万万的部长在一个个小滚珠锤爪神的指挥下,从轰鸣翻滚的岩浆中冒了出来!“这个玩法不错?!咱俩也玩一个让他们看看!”蘑菇王子一边说着一边抛出法宝。“就是! 就是!”知知爵士一边说着一边念动咒语。这时蘑菇王子和知知爵士变成的巨大虾米木鳞魔也怪吼一声!只见虾米木鳞魔晃动纯白色乱
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还 原反应
一、电解原理
演示试验
实验微观解释
结论:电解质通电前在水溶液中自由移动的阴、阳离
子作_____自__由_______运动;在外电源的作用下(直流 电),改作___定_向_____移动而导电。在导电的同时,在
阳、阴两极发生氧化—还原反应,即被电解,电离是 ___电__解_____的前题。
思考回忆
1、电解质是指在__水_溶_液_或_熔_融_状_态__下__能够导电的化 合物。 2、电离是指电解质在___水_溶_液________或 _____熔_融____状态下离解成___自_由_移_动_离_子____的过 程。 3、原电池是___把_化_学_能_转_化_为_电_能__ 的装置 。 4、构成原电池的条件是
阳极:镀层金属
2NaOH +Cl2↑+H2 ↑
电镀液:含有镀层金
铜片
属的电解质
阴极:待镀金属制品
硫酸铜溶 液
电镀铜原理
待镀件
电镀应用于铜的电解精练
电解铜原理演示
电极反应式
阴极(纯铜): Cu2+ + 2e- = Cu (还原反应)
阳极(粗铜): Cu - 2e- = Cu2+ (氧化反应)
Zn - 2e- = Zn2+
B.用电解法精炼粗铜时,铜作阳极
C.在镀件上作业:P83 3、4、5、6
