浙江新高考29题化学计算题试题练习
2016年浙江省高考理综化学部分第28、29题练习

2016年浙江省高考理综化学部分第28、29题练习1.(15分)汽车尾气排放的一氧化碳、氮氧化物等气体已成为大气污染的主要来源。
德国大众汽车尾气检测造假事件引起全世界震惊。
根据下列示意图回答有关问题:(1)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) ∆H = +180 kJ·mol-1,其能量变化示意图如下:则NO中氮氧键的键能为▲ kJ·mol-1。
(2)空燃比过小易产生CO。
有人提出可以设计反应2CO(g)=2C(s)+O2(g)来消除CO的污染。
判断该设想是否可行,并说出理由▲ 。
(3)利用活性炭涂层排气管处理NO x的反应为:xC(s)+2NO x(g)N2(g)+xCO2(g) ∆H= -b kJ·mol-1。
若使NO x更加有效的转化为无毒尾气排放,以下措施理论上可行的是▲ 。
A.增加排气管长度B.增大尾气排放口C.升高排气管温度D.添加合适的催化剂(4)催化装置中涉及的反应之一为:2NO(g) + 2CO(g)N2(g) + 2CO2(g) 。
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到图28-1所示的曲线。
催化装置比较适合的温度和压强是▲ 。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO 和NO百分含量随时间变化曲线如图28-2所示。
则前10 s 内,CO和NO百分含量没明显变化的原因是▲ 。
③研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。
为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了以下三组实验:实验编号T(K)NO初始浓度(mol·L-1) CO初始浓度(mol·L-1)催化剂的比表面积(m2/g)Ⅰ400 1.00×10-3 3.60×10-382Ⅱ400 1.00×10-3 3.60×10-3124Ⅲ450 1.00×10-3 3.60×10-3124 根据坐标图28-3,计算400K时该反应的平衡常数为▲ ;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号)。
2020版(2020年4月)浙江选考高考化学:特训4第29题化学计算题专练 Word版含答案
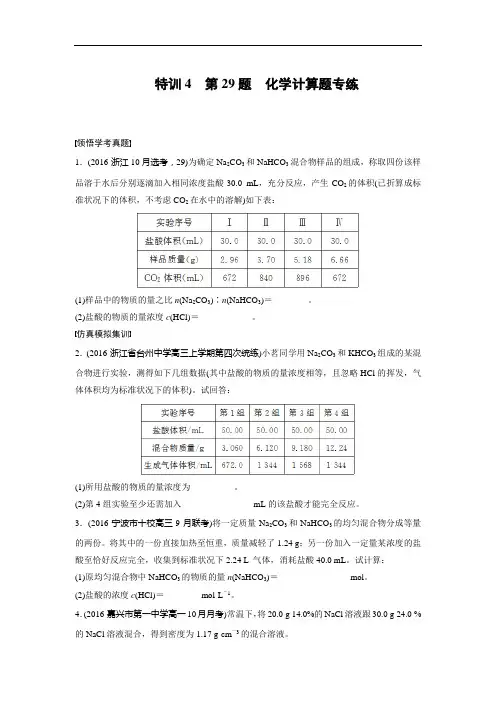
特训4第29题化学计算题专练领悟学考真题1.(2016·浙江10月选考,29)为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=____________。
仿真模拟集训2.(2016·浙江省台州中学高三上学期第四次统练)小茗同学用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(其中盐酸的物质的量浓度相等,且忽略HCl的挥发,气体体积均为标准状况下的体积)。
试回答:(1)所用盐酸的物质的量浓度为__________。
(2)第4组实验至少还需加入________________ mL的该盐酸才能完全反应。
3.(2016·宁波市十校高三9月联考)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。
将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0 mL。
试计算:(1)原均匀混合物中NaHCO3的物质的量n(NaHCO3)=________________ mol。
(2)盐酸的浓度c(HCl)=________ mol·L-1。
4.(2016·嘉兴市第一中学高一10月月考)常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0 %的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。
(1)该混合溶液的质量分数为__________。
(2)该混合溶液的物质的量浓度是_______mol·L -1。
(3)在1 000 g 水中溶解__________ mol NaCl 才能使其浓度与上述混合溶液的浓度相等。
2016年浙江省高考理综化学部分第29题练习(3)

2016年浙江省高考理综化学部分第29题练习(3)1.(15分)间硝基苯胺(Mr=138)是一种重要的染料中间体。
它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇。
间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:NO2NO2NH2NO2+ Na2S2 + H2O + Na2S2O3实验步骤:①在锥形瓶中配制足量的多硫化钠溶液,备用。
②三颈烧瓶中加入4.74g间二硝基苯(Mr=158)与40mL水,滴液漏斗中加入多硫化钠溶液。
③加热三颈烧瓶至微沸并搅拌。
慢慢滴加多硫化钠溶液,滴加完毕后继续搅拌回流30min。
移去热源,用冷水浴冷却至室温,减压过滤,滤饼洗涤三次。
④在150mL某容器中配制稀盐酸(30mL水加7mL浓盐酸),将上述粗产物转移进该容器,加热并搅拌使间硝基苯胺溶解,趁热过滤。
⑤在搅拌下向滤液中滴加过量浓氨水到pH=8,滤液中逐渐析出黄色的间硝基苯胺。
⑥过滤,洗涤滤饼至中性,抽干,产物重结晶、干燥、称重,得2.56g。
回答下列问题:(1)第④步中配制稀盐酸的容器名称为▲。
(2)第③步中滤饼洗涤三次,可选用的洗涤剂为▲;第⑥步产物要进行重结晶,可选用的试剂为▲。
A.冷水B.热水C.乙醚D.乙醇(3)第④步中趁热过滤的目的是▲。
(4)在铁和盐酸作用制得初生态氢也可以将硝基还原为氨基,却未被采用,其可能原因为▲。
(5)第④步用盐酸溶解粗产品,而不用水的原因▲。
(6)该反应的产率为▲。
2.(15分)醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。
实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒。
已知二价铬不稳定,极易被氧气氧化,不与锌反应。
制备过程中发生的相关反应如下:Zn(s)+ 2HCl(aq)= ZnCl2(aq)+ H2(g)2CrCl3(aq)+ Zn(s) = 2CrCl2(aq)+ ZnCl2(aq)2Cr2+(aq)+ 4CH3COO-(aq)+ 2H2O(l)=[Cr(CH3COO)2]2·2H2O(s)请回答下列问题:(1)仪器1的名称是,如何检查装置3的气密性。
2023年浙江高考化学真题及答案

2023年浙江高考化学真题及答案可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32 Cl-35.5K-39 Ca-40 Fe-56 Cu-64 Br-80 Ag-108 I-17 Ba-137一、选择题(本大题共16小题,每小题3分,共48分。
每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)1. 材料是人类赖以生存和发展的物质基础,下列材料主要成分属于有机物的是 A. 石墨烯B. 不锈钢C. 石英光导纤维D. 聚酯纤维2. 下列化学用语表示正确的是 A. 分子的球棍模型:2H SB. 的价层电子对互斥模型:3AlCl C. 的电子式:KI K I AAAA∶∶D. 的名称:3−甲基戊烷 ()3232CH CH CH CH 3. 氯化铁是一种重要的盐,下列说法不正确的是 A. 氯化铁属于弱电解质 B. 氯化铁溶液可腐蚀覆铜板 C. 氯化铁可由铁与氯气反应制得D. 氯化铁溶液可制备氢氧化铁胶体4. 物质的性质决定用途,下列两者对应关系不正确的是 A. 铝有强还原性,可用于制作门窗框架 B. 氧化钙易吸水,可用作干燥剂C. 维生素C 具有还原性,可用作食品抗氧化剂D. 过氧化钠能与二氧化碳反应生成氧气,可作潜水艇中的供氧剂 5. 下列说法正确的是A. 图①装置可用于制取并收集氨气B. 图②操作可排出盛有溶液滴定管尖嘴内的气泡 4KMnOC. 图③操作俯视刻度线定容会导致所配溶液浓度偏大D. 图④装置盐桥中阳离子向溶液中迁移4ZnSO 6. 化学烫发巧妙利用了头发中蛋白质发生化学反应实现对头发的“定型”,其变化过程示意图如下。
下列说法不正确的是A. 药剂A 具有还原性B. ①→②过程若有键断裂,则转移电子 2 mol S-S 4 molC. ②→③过程若药剂B 是,其还原产物为22H O 2O D. 化学烫发通过改变头发中某些蛋白质中键位置来实现头发的定型 S-S 7. N A 为阿伏加德罗常数的值,下列说法正确的是 A. 4.4gC 2H 4O 中含有σ键数目最多为0.7N A B. 1.7gH 2O 2中含有氧原子数为AC. 向1L0.1mol/LCH 3COOH 溶液通氨气至中性,铵根离子数为0.1N AD. 标准状况下,11.2LCl 2通入水中,溶液中氯离子数为0.5N A 8. 下列说法不正确的是A. 通过X 射线衍射可测定青蒿素晶体的结构B. 利用盐析的方法可将蛋白质从溶液中分离C. 苯酚与甲醛通过加聚反应得到酚醛树脂D. 可用新制氢氧化铜悬浊液鉴别苯、乙醛和醋酸溶液 9. 下列反应的离子方程式正确的是A. 碘化亚铁溶液与等物质的量的氯气: 2+-3+-222Fe +2I +2Cl 2Fe +I +4Cl =B. 向次氯酸钙溶液通入足量二氧化碳: --223ClO +CO +H O HClO+HCO =C. 铜与稀硝酸:+-2+322Cu+4H +2NO Cu +2NO +2H O =↑D. 向硫化钠溶液通入足量二氧化硫: 2--2223S +2SO +2H O H S+2HSO =10. 丙烯可发生如下转化,下列说法不正确的是A. 丙烯分子中最多7个原子共平面B. X 的结构简式为 3CH CH=CHBrC. Y 与足量KOH 醇溶液共热可生成丙炔D. 聚合物Z 的链节为11. X 、Y 、Z 、W 四种短周期主族元素,原子序数依次增大。
浙江省 2016届高考化学第29题-----化学实验

浙江省2016届高考化学第29题-----化学实验2016.3.181.2.(15分)某化学活动小组按下图所示流程由粗氧化铜样品(含少量氧化亚铁及不溶于酸的杂质)制取无水硫酸铜。
已知Fe3+、Cu2+、Fe2+三种离子在水溶液中形成氢氧化物沉淀的pH范围如下图所示:请回答下列问题:(1)在整个实验过程中,下列实验装置不可能用到的是▲(填序号)①②③④⑤(2)溶液A中所含溶质为▲;物质X应选用▲(填序号)①氯水②双氧水③铁粉④高锰酸钾(3)从溶液C中制取硫酸铜晶体的实验操作为▲。
(4)用“间接碘量法”可以测定溶液A中Cu2+(不含能与I-发生反应的杂质)的浓度。
过程如下:第一步:移取10.00mL溶液A于100mL容量瓶,加水定容至100mL。
第二步:取稀释后试液20.00mL于锥形瓶中,加入过量KI固体,充分反应生成白色沉淀与碘单质。
第三步:以淀粉溶液为指示剂,用0.05000mol·L-1的Na2S2O3标准溶液滴定,前后共测定三组。
达到滴定终点时,消耗Na2S2O3标准溶液的体积如下表:(已知:I2+2S2O32-===2I-+S4O62-)①CuSO4溶液与KI的反应的离子方程式为▲。
②滴定中,试液Na2S2O3应放在▲(填“酸式滴定管”或“碱式滴定管”),滴定终点的现象是▲。
③溶液A中c(Cu2+)= ▲mol/L3..(15分)某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。
提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在中(填写仪器编号)。
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关、打开开关就可观察到氢氧化亚铁的颜色。
试分析实验开始时排尽装置中空气的理由。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
2021年6月浙江新高考化学试卷真题及答案详解(精校版)
2021年6月浙江新高考化学试卷真题及答案详解(精校版)可能用到的相对原子质量:H 1C 12N 14O 16Na 23Mg 24Al 27P31S 32Cl 35.5Fe 56Cu 64Br 80Ag 108I 127Ba 137一、选择题(本大题共25小题,每小题2分,共50分。
每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)1.下列物质属于纯净物的是A .汽油B .食醋C .漂白粉D .小苏打2.下列物质属于弱电解质的是A .CO 2B .H 2OC .HNO 3D .NaOH3.下列物质的化学成分不正确...的是A .生石灰:()2Ca OH B .重晶石:4BaSO C .尿素:()22CO NH D .草酸:HOOC-COOH4.下列图示表示灼烧操作的是A .B .C .D .5.下列表示不正确...的是A .乙炔的实验式22C H B .乙醛的结构简式3CH CHOC .2,3-二甲基丁烷的键线式D .乙烷的球棍模型6.下列说法正确的是A .C 60和C 70互为同位素B .C 2H 6和C 6H 14互为同系物C .CO 和CO 2互为同素异形体D .CH 3COOH 和CH 3OOCH 是同一种物质7.关于有机反应类型,下列判断不正确...的是A .Δ2CH CH+HCl CH =CHCl ≡→催化剂(加成反应)B .−−−−→醇33232ΔCH CH(Br)CH +KOH CH =CHCH↑+KBr+H O (消去反应)C .催化剂Δ322322CH CH OH+O 2CH CHO+2H O −−−−−→(还原反应)D .3323232浓硫酸CH COOH+CH CH OH CH COOCH CH +H O Δ(取代反应)8.关于反应K 2H 3IO 6+9HI=2KI+4I 2+6H 2O ,下列说法正确的是A .K 2H 3IO 6发生氧化反应B .KI 是还原产物C .生成12.7g I 2时,转移0.1mol 电子D .还原剂与氧化剂的物质的量之比为7:19.下列说法不正确...的是A .硅酸钠是一种难溶于水的硅酸盐B .镁在空气中燃烧可生成氧化镁和氮化镁C .钠与水反应生成氢氧化钠和氢气D .常温下,铝遇浓硝酸或浓硫酸时会发生钝化10.下列说法不正确...的是A .应避免铵态氮肥与草木灰混合施用B .工业上可用离子交换法提高海带中碘的提取率C .电解饱和食盐水可以得到金属钠和氯气D .将生铁进一步炼制减少含碳量,能得到耐腐蚀的钢11.下列说法正确的是A .减压过滤适用于过滤胶状氢氧化物类沉淀B .实验室电器设备着火,可用二氧化碳灭火器灭火C .制备硫酸亚铁铵晶体时,须将含4FeSO 和()442NH SO 的溶液浓缩至干D .将热的3KNO 饱和溶液置于冰水中快速冷却即可制得颗粒较大的晶体12.下列“类比”结果不正确...的是A .22H O 的热稳定性比2H O 的弱,则24N H 的热稳定性比3NH 的弱B .2H O 的分子构型为V 形,则二甲醚的分子骨架(C-O-C )构型为V 形C .()32Ca HCO 的溶解度比3CaCO 的大,则3NaHCO 的溶解度比23Na CO 的大D .将丙三醇加入新制()2Cu OH 中溶液呈绛蓝色,则将葡萄糖溶液加入新制()2Cu OH 中溶液也呈绛蓝色13.不能正确....表示下列变化的离子方程式是A .碳酸镁与稀盐酸反应:2322CO 2H =CO H O-++↑+B .亚硫酸氢钠的水解:3223HSO H O H SO OH--++ C .锌溶于氢氧化钠溶液:[]2242Zn 2OH 2H O=Zn(OH)H --+++↑D .亚硝酸钠与氯化铵溶液受热反应:2422NO NH N 2H O-++↑+ 14.关于油脂,下列说法不正确...的是A .硬脂酸甘油酯可表示为B .花生油能使酸性高锰酸钾溶液褪色C .植物油通过催化加氢可转变为氢化油D .油脂是一种重要的工业原料,可用于制造肥皂、油漆等15.已知短周期元素X 、Y 、Z 、M 、Q 和R 在周期表中的相对位置如下所示,其中Y 的最高化合价为+3。
高考化学计算题
高考化学计算题
在解决高考化学计算题时,避免使用标题相同的文字是十分重要的。
这是因为,高考要求考生具备独立思考和解决问题的能力,而如果题目文字与其它部分相同,会导致评卷老师无法分辨答案所属的部分,可能会影响得分。
因此,在计算题中我们可以这样进行操作:
例如,计算题要求计算氧化镁的质量百分比。
1. 首先,我们可以列出所给条件:已知氧化镁的摩尔质量为40 g/mol,氧化镁的质量为 X g。
2. 接下来,根据化学式和已知条件,我们可以建立方程:40 g/mol = (X g / Y g)* 100,其中 Y g 表示化合物的总质量。
3. 然后,将方程转化为横式形式:X g = (40 g/mol)* (Y g / 100)
4. 最后,根据给定的化合物总质量(Y g),将数据代入方程进行计算。
这样,尽管没有标题,但通过清晰地阐述问题解决过程,能够保证我们的解答得到正确评分。
不仅如此,还可以提高评卷老师对我们计算方法的理解,并确保他们能够正确地查看我们的解答。
通过避免使用标题相同的文字,我们可以更好地解答高考化学计算题,提高得分。
高考化学二轮复习专题讲座一学考第29题-化学计算题解题方法(含解析)
1 专题讲座一学考第29题——化学计算题解题方法1.(2016·浙江4月选考,29)Cl 2与NaOH 溶液反应可生成NaCl 、NaClO和NaClO 3,c (Cl -)和c (ClO -)的比值与反应的温度有关,用24 g NaOH 配成的250 mL 溶液,与Cl 2恰好完全反应(忽略Cl 2与水的反应、盐类的水解及溶液体积变化)。
(1)NaOH 溶液的物质的量浓度mol·L -1。
(2)某温度下,反应后溶液中c (Cl -)=6c (ClO -),则溶液中c (ClO -) =mol·L -1。
答案 (1)2.4 (2)0.30解析 (1)24 g NaOH 的物质的量为0.6 mol ,溶液体积为250 mL ,故c (NaOH)=0.6 mol 0.25 L =2.4 mol·L -1。
(2)根据题意,设反应后溶液中c (Cl -)=a ,c (ClO -)=b ,c (ClO-3)=c ,根据电荷守恒得c (Na +)=c (Cl -)+c (ClO -)+c (ClO -3),则a +b +c =2.4 mol·L -1,根据转移电子守恒a =b +5c以及题给信息a =6b ,解题a =1.8 mol·L -1,b =0.3 mol·L -1,c =0.3 mol·L -1。
2.(2015·浙江10月选考,29)量取8.0 mL 5.0 mol·L -1H 2SO 4溶液,加蒸馏水稀释至100 mL ,取两份稀释后的H 2SO 4溶液各25 mL ,分别加入等质量的Zn 和Fe ,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。
请计算:(1)稀释后H 2SO 4溶液的物质的量浓度为mol·L -1。
(2)加入Fe 的质量至少有 g 。
【第29题专项练习】-【含答案】
【第29题】——学(选)考专项练习1、【2018年06月·浙江学考·T30】将2.80 g含氧化镁的镁条完全溶于50.0 mL硫酸溶液后,滴加2.00 mol/L氢氧化钠溶液,恰好完全沉淀时用去200.0 mL。
将所得的沉淀灼烧、冷却后称量得固体质量为4.40 g。
请计算:(1).上述硫酸的物质的量浓度c(H2SO4)= 4.00mol/L;(2).镁条中氧化镁和镁的物质的量之比为n(MgO)︰n(Mg)=1︰10。
2、【2018年04月·浙江学(选)考】称取4.00 g氧化铜和氧化铁固体混合物,加入50.0mL、2.00 mol/L的硫酸充分溶解,往所得溶液中加入5.60 g铁粉,充分反应后,得固体的质量为3.04 g。
请计算:(1).加入铁粉充分反应后,溶液中溶质的物质的量0.100 mol;(2).固体混合物中氧化铜的质量 2.40 g。
3、【2017年11月·浙江学(选)考】取7.90 g KMnO4 ,加热分解后剩余固体7.42 g。
该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素均以Mn+2存在。
请计算:(1).KMnO4的分解率为:60.0%;(2).气体A的物质的量为:0.0950 mol。
4、【2016年04月·浙江学(选)考】Cl2与NaOH溶液反应可以生成NaCl、NaClO、NaClO3 ,c(Cl-)和c(ClO-)的比值与反应温度有关。
用24 g NaOH配成的250 mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化)。
(1).NaOH溶液的物质的量浓度为 2.4mol/L;(2).某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-)=0.30mol/L。
5、【2017~2018学年(上)·金华十校期末调研】已知一定量的H2在Cl2中燃烧,所得混合物用500 mL、6.0 mol/L的KOH溶液恰好完全吸收,测得溶液中含有ClO-0.200.30 mol(忽略Cl2与水的反应,盐类水解及溶液体积变化)。
2016年浙江省高考理综化学部分第29题练习(3)
2016年浙江省高考理综化学部分第29题练习(3)1.(15分)间硝基苯胺(Mr=138)是一种重要的染料中间体。
它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇。
间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:NO2NO2NH2NO2+ Na2S2 + H2O + Na2S2O3实验步骤:①在锥形瓶中配制足量的多硫化钠溶液,备用。
②三颈烧瓶中加入4.74g间二硝基苯(Mr=158)与40mL水,滴液漏斗中加入多硫化钠溶液。
③加热三颈烧瓶至微沸并搅拌。
慢慢滴加多硫化钠溶液,滴加完毕后继续搅拌回流30min。
移去热源,用冷水浴冷却至室温,减压过滤,滤饼洗涤三次。
④在150mL某容器中配制稀盐酸(30mL水加7mL浓盐酸),将上述粗产物转移进该容器,加热并搅拌使间硝基苯胺溶解,趁热过滤。
⑤在搅拌下向滤液中滴加过量浓氨水到pH=8,滤液中逐渐析出黄色的间硝基苯胺。
⑥过滤,洗涤滤饼至中性,抽干,产物重结晶、干燥、称重,得2.56g。
回答下列问题:(1)第④步中配制稀盐酸的容器名称为▲。
(2)第③步中滤饼洗涤三次,可选用的洗涤剂为▲;第⑥步产物要进行重结晶,可选用的试剂为▲。
A.冷水B.热水C.乙醚D.乙醇(3)第④步中趁热过滤的目的是▲。
(4)在铁和盐酸作用制得初生态氢也可以将硝基还原为氨基,却未被采用,其可能原因为▲。
(5)第④步用盐酸溶解粗产品,而不用水的原因▲。
(6)该反应的产率为▲。
2.(15分)醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。
实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒。
已知二价铬不稳定,极易被氧气氧化,不与锌反应。
制备过程中发生的相关反应如下:Zn(s)+ 2HCl(aq)= ZnCl2(aq)+ H2(g)2CrCl3(aq)+ Zn(s) = 2CrCl2(aq)+ ZnCl2(aq)2Cr2+(aq)+ 4CH3COO-(aq)+ 2H2O(l)=[Cr(CH3COO)2]2·2H2O(s)请回答下列问题:(1)仪器1的名称是,如何检查装置3的气密性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浙江新高考29题——化学计算
1. 将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2体积(标准状况)与加入的盐酸体积有如图关系(不考虑CO 2在水中的溶解)。
试计算:(无需书写计算步骤)
(1)盐酸的物质的量浓度为mol/L。
(2)该样品中NaOH与Na2CO3物质的量之比为。
2. 取1.19gK2CO3和KHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLBa(OH)2溶液恰好使生成的
白色沉淀的量最多。
反应后溶液的c(OH-)=0.3mol/L(混合溶液体积为50mL)。
试计算:
(1)反应后溶液中n(OH-)= mol。
(2)原混合物中n(K2CO3):n(KHCO3)= 。
3. 取2.74gNa2CO3和NaHCO3的混合物溶于水配成25mL溶液,往溶液中加入25mLHCl溶液恰好完全反应生成标准状况下672mL气体。
反应后溶液的c(Cl-)=0.8mol/L(混合溶液体积为50mL)。
试计算:
(1)反应后溶液中n(Cl-)= mol。
(2)原混合物中n(Na2CO3):n(NaHCO3)= 。
5. 取14.3g Na2CO3·xH2O溶于水配成100mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸20.0mL,并收集到1.12LCO2(标准状况)。
试计算:
(1) 稀盐酸物质的量的浓度为mol/L。
(2) x值是。
6. 取NaHCO3和Na2CO3的混合物8.22g,加热到质量不再发生变化,冷却后测得其质量为6.36g。
(1)取等质量的原混合物溶于水,配成80mL溶液,则c(Na+)= mol/L
(2)向(1)所配的溶液中逐滴加入1mol/L的稀盐酸至过量,
生成CO2的体积(标准状况)与加入盐酸的体积有如右图所示
的关系(不考虑CO2的溶解),则a点消耗盐酸的体积为 mL。
7. 标准状况下,将7.84L HCl气体溶于水配得350mL 盐酸,然后与含17.9g Na2CO3和NaHCO3的溶液混合,充分反应后生成0.200mol CO2气体。
(1)盐酸的物质的量浓度 mol/L
(2)原溶液中m(NaHCO3)= g
8.为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号I II III IV
盐酸体积(mL) 30.0 30.0 30.0 30.0
样品质量(g) 2.96 3.70 5.18 6.66
CO2体积(mL) 672 840 896 672
(1) 样品中物质的量之比n(Na2CO3):n(NaHCO3)=_________。
(2) 盐酸的物质的量浓度c(HCl)=______________。
9.将铁粉和氧化亚铁粉末混合物9.2g加入150mL的稀硫酸中,恰好完全反应,在标准状况下生成2.24L 气体,试计算:
(1)混合物中铁粉的质量为 g。
(2)稀硫酸的物质的量的浓度为 mol/L。
10.将一定量的铜片加入到100mL稀硫酸和硫酸铁的混合液中,若铜片完全溶解时(不考虑盐的水解及溶液体积的变化),溶液中的Fe3+、Cu2+、H+三种离子的物质的量的浓度相等,且测得溶液的c(H+)=0.1nol/L。
(1)原混合液中硫酸铁的物质的量 mol
(2)反应后溶液中SO42-离子的物质的量的浓度 mol/L。
11.部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)5.76g,经如图所示的处理:
试计算:
(1)合金样品中铁元素的质量分数为。
(2)标准状况下气体V= mL。
12.将20g某铁矿石(设只含铁的氧化物和杂质SiO2)溶于过量的稀盐酸,过滤后得滤液和5.6g不容物;然后在滤液中加入足量的NaOH溶液,过滤、洗涤、灼烧得16g红棕色固体。
(1)该矿石中铁的氧化物的化学式是。
(2)若加入的稀盐酸为2.1mol/L 200mL,则滤液的PH = (忽略反应前后体积变化)。
13. 有一包铁粉与铜粉混合均匀的粉末样品,为确定其组成,某同学将不同质量的该样品分别与40ml
1mol/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液的体积的变化)。
试计算:
(1)实验④的滤液中c(Fe2+)= 。
(2)原粉末样品中m(Fe): m(Cu) = 。
14.某同学将一定量铜粉与10mL的浓硫酸充分反应,生成的气体为1.12L(已换算为标准状况,且不考虑其它副反应)。
(1)反应中理论上消耗铜的质量为 g
(2)若向反应后溶液中逐滴加入5mol/LNaOH溶液至铜离子恰好全部转变为C u(O H)2沉淀,消耗NaOH溶液52mL,则原浓硫酸的浓度为 mol/L。
15.实验室中,用一小片铜与5mL浓硫酸在试管中充分反应,将反应后的溶液稀释到200mL,测得PH=1。
将生成的SO2气体用50mL 1.2mol/L的NaOH溶液吸收,得到NaHSO3和Na2SO3的混合液中,两种溶质的物质的物质的量恰好相等。
(1)参加反应的铜的质量为 g。
(2)浓硫酸物质的量的浓度为 mol/L。
16.已知一定量的氢气在氯气中燃烧,所得混合物用500 mL 3.00 mol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.300 mol。
忽略氯气与水反应、盐类水解及溶液体积变化。
回答下列问题
(1)所得溶液中Cl-的物质的量为_________mol。
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= ________。
17.将一定质量未除去氧化膜的镁条投入100 mL某浓度的盐酸中,镁条恰好完全溶解,生成气体100.8 mL(标准状况),向反应后的溶液中逐滴加入0.2 mol·L-1的NaOH溶液,当Mg2+恰好完全沉淀时,消耗NaOH 溶液体积为50 mL。
(1)盐酸物质的量浓度为________mol·L-1。
(2)该镁条中未被氧化的镁与被氧化的镁的物质的量之比为________。
18.量取16.0 mL 10.0 mol·L-1HCl溶液,加蒸馏水稀释至100 mL,取两份稀释后的HCl溶液各25 mL,分别加入等质量的Mg和Al,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。
请计算:
(1)稀释后HCl溶液的物质的量浓度为__________mol·L-1。
(2)加入Mg的质量至少有__________。
19.取100 mL等物质的量浓度的盐酸和硫酸混合溶液,当加入100 mL 3.0 mol·L-1的Ba(OH)2溶液时,溶液显中性。
请计算:
(1)原混合液中H+的物质的量浓度为__________mol·L-1。
(2)当加入的Ba(OH)2体积为75 mL时,产生的沉淀质量为____________g。
20.Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24 g NaOH 配成的250 mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
(1)NaOH溶液的物质的量浓度________mol·L-1。
(2)某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-) =________mol·L-1。
21.实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。
为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①取25 mL甲溶液,向其中缓慢滴入乙溶液15 mL,共收集到112 mL(标准状况)气体。
②取15 mL乙溶液,向其中缓慢滴入甲溶液25 mL,共收集到56 mL(标准状况)气体。
(1)甲是____________(填化学式,下同)溶液,乙是_____________溶液。
(2)甲溶液的物质的量浓度为_______mol·L-1,乙溶液的物质的量浓度为________mol·L-1。
