炭,铁,磷,硫在氧气中燃烧的实验及现象12146教学提纲
硫燃烧实验报告

一、实验目的1. 观察硫在氧气和空气中燃烧的现象。
2. 探究氧气浓度对燃烧现象的影响。
3. 了解硫燃烧的化学性质。
二、实验原理硫是一种非金属元素,化学符号为S。
硫在氧气和空气中都可以燃烧,燃烧时产生明亮的火焰和刺激性气味的气体。
硫燃烧的化学方程式为:S + O2 → SO2。
三、实验器材1. 硫粉2. 氧气集气瓶3. 空气集气瓶4. 火柴5. 试管6. 碳酸钠溶液7. 氧化铜粉末四、实验步骤1. 准备实验器材,检查氧气集气瓶和空气集气瓶的密封性。
2. 取少量硫粉放入试管中。
3. 用火柴点燃硫粉,观察燃烧现象。
4. 将燃烧的硫粉放入氧气集气瓶中,观察燃烧现象。
5. 将燃烧的硫粉放入空气集气瓶中,观察燃烧现象。
6. 分别将瓶中的残留液加入碳酸钠溶液和氧化铜粉末,观察现象。
五、实验现象1. 硫粉在空气中燃烧,产生微弱的淡蓝色火焰,燃烧不剧烈。
2. 硫粉在氧气中燃烧,产生明亮的蓝紫色火焰,燃烧剧烈。
3. 将瓶中的残留液加入碳酸钠溶液,产生气泡。
4. 将瓶中的残留液加入氧化铜粉末,固体逐渐减少,溶液由无色变成蓝色。
六、实验分析1. 硫粉在氧气和空气中都可以燃烧,但氧气浓度越高,燃烧越剧烈。
这是因为氧气是硫燃烧的氧化剂,氧气浓度越高,氧化剂浓度越大,燃烧反应越容易进行。
2. 硫燃烧生成的气体具有刺激性气味,为二氧化硫(SO2)。
二氧化硫能和水反应生成亚硫酸,亚硫酸是一种酸,具有酸的通性,能和比较活泼的金属反应,能和某些盐反应。
3. 实验中,将瓶中的残留液加入碳酸钠溶液和氧化铜粉末,观察到气泡和溶液颜色变化,说明残留液呈酸性。
七、实验结论1. 硫在氧气和空气中都可以燃烧,但氧气浓度越高,燃烧越剧烈。
2. 硫燃烧生成的气体为二氧化硫,具有刺激性气味。
3. 二氧化硫能和水反应生成亚硫酸,亚硫酸具有酸的通性。
八、实验注意事项1. 实验过程中,要注意安全,避免火灾和爆炸。
2. 实验结束后,要及时清理实验器材,保持实验室卫生。
高中一年级化学磷在氧气中燃烧的实验-教学考试网

内容高中一年级化学磷在氧气中燃烧的实验05教育技术学 20052801131 林波教学对象:高中一年级教学科目:化学教学过程:磷在氧气中燃烧的实验原来编码:磷在氧气中燃烧,呈黄色火焰,生成大量的白烟,烟是固体。
教师就是要把这个实验以及相关磷的知识教授给学生,学生中从抽象中认识到磷在氧气中燃烧能生成什么,有什么特征。
学生根据老师纯粹口头上的讲授,虽然可以从概念上把这个实验的相关知识记住,但这种记忆是瞬时性和暂时性的,学生还没有从客观上对此产生深刻的认识,对于这些学生来说,口头的讲教是很容易遗忘的。
改变编码:通过以课件和实物演示的形式来表达抽象的意义。
具体办法就是教师利用多媒体在投影器上投影一次这个实验(这个实验事先已经被摄制下来,作为教学用),然后教师实物演示整个实验过程,在全部学生面前进行磷燃烧实验,把整个实验过程产生的现象都呈现在学生面前,然后学生再在老师的指导下进行自我的操作,做一遍这个实验,并取得如期效果。
教学效果:高中一年级的学生对这个实验以及磷有了进一步的了解,并且印象深刻,比原来的纯文字传授教学有了更好的记忆。
教学分析:这种教学方法是最典型的,但典型中透视的是学科的特殊性,比如物理化学这些理科就是注重动手操作的,在无数次的实验之后才有一个合适的结论。
教学不仅是视觉和听觉上的传授,更注重的是一种动手操作能力。
现代教育传播,不只是文字的传播,更多的是图形结合,视觉认识、听觉认识和触觉认识结合。
∙2011年浙江省奉化市中考思想品德专题总复习:科学发展观、可持续发展∙生物:第11章人体内的废物排入环境同步测试(苏教版七年级下)∙2011届高考历史第二轮专题检测试题59∙人教版七年级上册第三单元单元练习6套第三单元复习试卷6∙网络信息调查功能的设计与实现∙2010-2011学年度南昌市高三第一轮复习训练题数学(12)(圆锥曲线)1∙语文:第5课《苏州园林》同步练习(鄂教版九年级下)∙从《沁园春雪》看阅读教学“三要素”∙化学:3.1《认识氧气》同步练习(粤教版九年级上)∙浙江省2011年高考模拟试卷物理卷(4)∙历史:第12课《北伐战争》同步练习(鲁教版八年级上)∙2011届高考历史第二轮专题检测试题56∙第 3周第2次课教案总6 次备课教师:钱厉风∙福建省厦门外国语学校中美班2010年入学考试数学试题(无答案)∙广东省中山市镇区五校20102011学年高二上学期期中联考政治(文)∙2012《高考密码》高中生物总复习(新课标人教版):必修三课时训练(第六章生态环境的保护)∙苏教版必修1~5全部教案学案-第27课时——幂函数(1)教师版∙苏教版必修1~5全部教案学案-第18课时6.1.3 分层抽样∙安徽省泗县双语中学11-12学年高二上学期实验班竞赛试题(英语)∙2011年中考数学三轮复习综合训练(8)及答案∙数学:7.1轴对称现象教案1(北师大版七年级下)∙2011中考数学考前专题:样本与总体∙化学:8.2《合成材料》素材(旧人教版必修2)∙2010年山东青岛市高三第一次教学质量检测文科数学试卷∙【物理】2011年高三100套选择题小专题专项训练(23)∙苏教版必修1~5全部教案学案-第16课——指数函数(1)配套练习∙苏教版必修1~5全部教案学案-第9课——分段函数——配套练习∙翼教版七年级语文上册 19《四季交响曲》同步练习(无答案)∙(《论语》选读)之《诲人不倦》教学设计之二∙[名校联盟]山西省孝义三中2010-2011学年高一单元测试(一)生物试题∙苏教版必修1~5全部教案学案-第25课时6.4.1线性回归方程(1)∙语文:第20课《罗布泊,消失的仙湖》同步练习(鲁教版七年级上)∙物理:鲁科版必修2 3.1 运动的合成与分解(同步练习)∙2011高考语文第一轮总复习提分卡:语病∙[名校联盟]广西区桂林十八中2010-2011学年高一下学期期中考试英语试题∙普通高校招生统一考试数学试卷分章节汇编及详细答案-2.3指数函数与对数函数∙生物:1.2《内环境稳态的重要性》测试3(新人教版必修3)∙数学:1.9整式的除法(第2课时)教案(北师大版七年级下)∙2011年一模试题分类 (电化学)∙2011年湖北地理中考会考专题复习系列资料——中国的疆域与人口复习学案© 2011 教学考试网. All Rights Reserved. 冀ICP备10203516号-1。
炭,铁,磷,硫在氧气中燃烧的实验与现象

初中化学常见物质在氧气中燃烧的实验一.红磷在氧气中燃烧一.实验操作①用记号将集气瓶中的水面上方的容积分为5等分;②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;③冷却至室温后,松开弹簧夹。
二.实验现象①红磷燃烧,发出白光,产生大量白烟,放出热量;②冷却后松开弹簧夹,水流入集气瓶且流入水的体积约占集气瓶原空气体积的三.实验结论氧气约占空气体积的。
同时也得出氮气不燃烧,也不支持燃烧,难溶于水四.集气瓶中水的作用①防止生产物溅落而炸裂瓶底②为了吸收生成的白烟③吸收热量,有助于装置冷却五.实验误差分析因数影响测定结果小于装置漏气反应后外界空气进入红磷量不足氧气未被完全消耗未到装置冷却到室温就打开弹簧夹温度较高,气体膨胀,剩余气体占了较大的体积测定结果大于点燃红磷插入到瓶中后未立即塞上胶塞空气受热膨胀,部分逸出最初弹簧夹未夹紧空气受热膨胀,部分逸出六.注意实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以是氢氧化钠二.铁丝在氧气中燃烧一.实验现象①在空气中加热铁丝只能烧到发红,不燃烧②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体二.实验操作①为了达到铁丝燃烧的温度而采取的两个主要措施是:a.铁丝绕成螺旋状(目的:增大铁丝的受热面积)b.系一根火柴棍(目的:引燃火柴给铁丝预热)②等火柴快要燃尽时再将铁丝放入集气瓶的原因是:a.充分给铁丝预热b.减少未燃尽的火柴对瓶氧气的消耗③使铁丝与氧气充分反应,操作方法是:把铁丝由上而下缓慢插入集气瓶④底部放水或砂石的目的:a.防止铁丝燃烧后产生的高温熔融物溅落炸裂瓶底⑤注意:铁丝不能用生锈的,若用生锈的铁丝,使用前需要打磨三.硫在氧气中燃烧一.硫的性质硫(淡黄色固体)硫的熔点很低,所以燃烧时为液态在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色二.实验现象蓝紫色火焰,放出热量,生产有刺激性气味的气体三.注意事项硫的用量不能过多,防止造成空气污染四.集气瓶底部留有少量水的作用①吸收有毒气体二氧化硫四.木炭在氧气中燃烧.. 实验现象①木炭在空气中只能烧到发红;②木炭在氧气中燃烧能发出白光③放出热量④生产能使澄清石灰水边浑浊的气体(加入了第四个实验才能说明这个现象,不然不能说变浑浊的这个现象)古希腊哲学大师亚里士多德说:人有两种,一种即“吃饭是为了活着”,一种是“活着是为了吃饭”.一个人之所以伟大,首先是因为他有超于常人的心。
炭,铁,磷,硫在氧气中燃烧的实验及现象
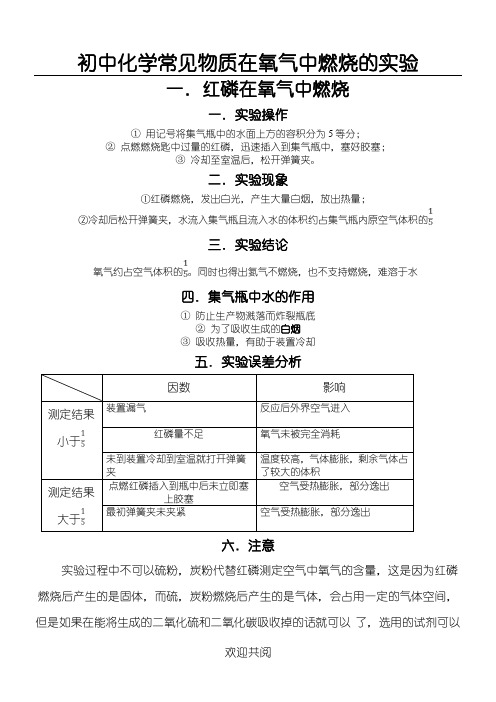
初中化学常见物质在氧气中燃烧的实验
一.红磷在氧气中燃烧
一.实验操作
①用记号将集气瓶中的水面上方的容积分为5等分;
②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;
③冷却至室温后,松开弹簧夹。
二.实验现象
四.集气瓶中水的作用
小于
大于
六.注意
实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以
是氢氧化钠
二.铁丝在氧气中燃烧
一.实验现象
①在空气中加热铁丝只能烧到发红,不燃烧
②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体
二.实验操作
①
a.
硫(淡黄色固体)
硫的熔点很低,所以燃烧时为液态
在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色
二.实验现象
蓝紫色火焰,放出热量,生产有刺激性气味的气体
三.注意事项
硫的用量不能过多,防止造成空气污染
四.集气瓶底部留有少量水的作用
①吸收有毒气体二氧化硫
四.木炭在氧气中燃烧
..
④。
_“铁丝在氧气中燃烧的探究” 实验教学设计

教师: 提示从燃烧条件角度进行分析。 (引导学生联系铁丝在氧气中顺利燃烧的现象进 行讨论、 分析, 得出实验失败的原因和氧气有关。 可能 原因是: 氧气浓度不足或和氧气接触不充分) 设计意图: 通过对实验现象的对比观察, 引发学生 质疑, 结合已有知识进行分析、 讨论, 得出铁丝燃烧失败 的原因, 并为后续学习中讨论铁丝燃烧产生火星四射现 象的原因做实验铺垫。 提问: 铁丝燃烧是不是一定需要纯氧? 学生: 讨论, 设计方案 (有难度, 教师提示)探究铁 丝燃烧和氧气浓度的关系 [1], 并进行如表 1 所示对比实 验, 观察实验现象。 探究活动 1:
图 3 纳米铁粉自燃视频截图
302 细钢丝 备注
学生: 讨论, 分析, 得出结论——随着铁粉粒径的 减小, 铁的活性也随之增强, 故纳米铁粉可以在空气中 自燃。 设计意图: 通过实验及视频的展示, 使学生得出铁 和氧气的接触程度也是影响铁在氧气中能否顺利燃烧的 因素。 对于其中还原铁粉在酒精灯火焰上抖落的实验, 可以邀请学生进行演示, 从而对学生产生强烈的实验刺
学生: 根据实验现象, 讨论、 分析, 得出结论—— 铁丝含碳量越高, 火星四射现象越明显。 设计意图: 通过前述环节教学, 学生已经建立铁丝燃 烧过程中火星四射现象的确和其中含碳元素相关, 但具 体关联程度如何, 却是未知, 为探究这一问题, 在教师提 供的必要实验用品范围内, 鼓励学生自主或合作, 设计出 合理的探究方案, 并进行探究实验, 最终得出正确的实 验结论。 教师: 引导学生回顾本课所学知识, 交流所得及仍 然存在的困惑, 对本课作必要的总结和反思, 并给出课 后所需完成的任务(如: 铁丝在氧气中燃烧产物组成的 探究) 。 学生: 交流本课学习的心得体会。 4 实验教学说明 (1) 本实验教学设计所需的实验用品如下: 镁条、 薄片状木炭 (小煤块) 、 石棉网细铁丝、 304L 细钢丝、 304 细钢丝、 302 细钢丝、 还原铁粉(AR) 、 坩埚钳、 石 棉网、 80%的氧气 1 瓶, 瓶底有水的氧气 6 瓶、 酒精灯、 火柴、 相关视频课件资料等。 (2)本教学设计中所选用的细铁(钢)丝均为河 北省唐山市光大银河金属材料有限公司提供的 304L、 304、 302 型材, 含碳量分别约为 0.03%、 0.08%、 0.15%, 直径均为 0.2 mm 及 0.3 mm。 如图 9(0.2 mm) 、 图 10 (0.3 mm) 。
铁丝在氧气中燃烧现象教学设计

"铁丝在氧气中燃烧为什么会火星四射"的教学设计一、教学设计思路根据《普通高中化学课程标准(实验)》第三部分内容标准,必修课程《化学1》主题2化学实验基础,内容标准1“体验科学探究的过程,学习运用以实验为基础的实证研究方法”、标准4“能够独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流”,以及主题3常见无机物及其应用,内容标准3“根据生产、生活中的应用实例或通过实验探究,了解铁、铝、镁等金属及其重要化合物的主要性质”等要求,关注初、高中化学知识的衔接,利用活动元教学原理,设计不同的活动,让学生主动积极地参与活动,并充分利用实验及多媒体课件等多种教学手段以达到教学目的。
“铁丝在氧气中燃烧”实验学生在初中已经做过,但是学生一般只知道实验表象并不知“产生火星四射”的原因。
本节课通过“产生火星四射现象原因”的过程探究,重点培养学生掌握实验科学探究的方法。
在为学生揭示铁丝和镁条分别在氧气中燃烧时现象不同的科学道理同时,增强学生实验技能,锻炼学生从实验中发现问题,从实验中解决问题的能力。
具体思路为:分组实验,提出问题,引起思考──讨论与交流,初步悟出与铁丝在氧气中燃烧火星四射现象有关的因素──学生设计提出实验探究的方法──分组实验,探究讨论得出“铁丝在氧气中燃烧火星四射现象与自身含碳量有关”的初步结论──结论运用──结合实例,理论探究和分析总结“因碳的存在而产生气体,气体受热体积急剧膨胀,使铁丝在氧气中燃烧过程中产生火星四射的现象”──动画演示“碳的存在使铁丝在氧气中燃烧过程中产生火星四射的现象”的过程——课堂小结。
二、教案三维目标:1.知识与技能(1)使学生了解常见金属燃烧的现象,运用比较、归纳、分析等方法初步揭示化学现象的本质,并能做出合理的解释;(2)引导学生通过实验探究活动来学习化学,学习实验研究的方法,能设计并完成一些化学实验,分析和解决与化学有关的实际问题;(3)重视化学与其他学科之间的联系,能综合运用物理等学科有关的知识、技能与方法分析和解决一些化学问题;(4)培养学生探究意识和提高探究能力。
硫的燃烧实验报告

1. 观察硫在氧气和空气中的燃烧现象;2. 掌握硫燃烧的化学方程式;3. 分析硫燃烧产生的气体对环境的影响。
二、实验原理硫在氧气中燃烧时,会发出明亮的蓝紫色火焰,并产生刺激性气味的二氧化硫气体。
在空气中燃烧时,硫燃烧的火焰颜色较淡,产生的是二氧化硫和三氧化硫的混合气体。
实验中,通过观察火焰颜色、气体气味和反应产物,可以了解硫的燃烧特性。
三、实验材料1. 硫粉;2. 氧气集气瓶;3. 空气集气瓶;4. 火柴;5. 试管;6. 碳酸钠溶液;7. 氧化铜粉末;8. 滴管;9. 玻璃片。
四、实验步骤1. 将硫粉平铺在火柴梗上,点燃火柴,用火柴点燃硫粉,观察硫在空气中的燃烧现象;2. 在氧气集气瓶中点燃硫粉,观察硫在氧气中的燃烧现象;3. 将燃烧后的硫粉放入试管中,加入少量碳酸钠溶液,观察溶液颜色变化;4. 将燃烧后的硫粉放入试管中,加入少量氧化铜粉末,观察溶液颜色变化。
1. 硫在空气中燃烧,发出微弱的淡蓝色火焰,火焰较小,燃烧时间较短;2. 硫在氧气中燃烧,发出明亮的蓝紫色火焰,火焰较大,燃烧时间较长;3. 碳酸钠溶液中加入燃烧后的硫粉,溶液变为淡黄色;4. 氧化铜粉末中加入燃烧后的硫粉,固体逐渐减少,溶液由无色变成蓝色。
六、实验结果与分析1. 硫在氧气中燃烧比在空气中燃烧更加剧烈,这是因为氧气浓度更高,燃烧反应更加充分;2. 碳酸钠溶液中加入燃烧后的硫粉,溶液变为淡黄色,说明硫燃烧产生了二氧化硫气体;3. 氧化铜粉末中加入燃烧后的硫粉,固体逐渐减少,溶液由无色变成蓝色,说明硫燃烧产生了三氧化硫气体。
七、实验结论1. 硫在氧气中燃烧比在空气中燃烧更加剧烈;2. 硫燃烧产生的气体对环境有污染,其中二氧化硫和三氧化硫是主要污染物;3. 硫燃烧的化学方程式为:S + O2 → SO2。
八、实验讨论1. 硫燃烧时,为何在氧气中燃烧比在空气中燃烧更加剧烈?答:因为氧气浓度更高,燃烧反应更加充分。
2. 硫燃烧产生的气体对环境有何影响?答:二氧化硫和三氧化硫是主要污染物,会污染空气,对人体健康和环境造成危害。
铁丝在氧气中燃烧的探究实验教学设计

《铁丝在氧气中燃烧的探究》实验教学设计
一、实验目的
1、观察氧气中铁丝的燃烧行为,让学生了解物质燃烧的基本规律;
2、分析燃烧过程中物质变化的原因,熟悉物质的组成和性质;
二、实验原理
氧气是燃烧必需的气体,铁丝中的铁可以与氧气反应,燃烧时释放出大量的热量,从
而产生火焰。
三、实验准备
1、实验用具:氧气瓶、火焰熔炉、铁丝、灯芯、火柴、玻璃杯等;
2、实验材料:氧气、铁丝、火柴等。
四、实验步骤
1、把铁丝放入玻璃杯中,然后把一个灯芯放入瓶中,在铁丝上加入少量的氧气,然
后用火柴点燃灯芯;
2、当氧气与铁丝反应时,会发生火焰,观察铁丝的燃烧行为,细细观察火焰的变化;
3、记录实验过程中的观察结果,根据实验结果和观察结果,分析铁丝在氧气中燃烧
的原因。
五、实验结果
1、实验中,当氧气与铁丝反应时,会发生火焰,火焰较旺盛,蓝色火焰较淡;
2、实验中,铁丝燃烧时,会发射出光和热,在火焰中可以看到少量的灰尘粒子;
3、实验中,燃烧过程中,铁丝会被氧气中的氧气氧化,产生铁氧化物,从而形成灰
尘粒子。
六、结论
铁丝在氧气中燃烧时,会发射出光和热,并产生少量灰尘粒子,这是由氧气和铁丝反应产生的氧化反应,铁丝在此反应中被氧化成铁氧化物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学常见物质在氧气中燃烧的实验
一.红磷在氧气中燃烧
一.实验操作
①用记号将集气瓶中的水面上方的容积分为5等分;
②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;
③冷却至室温后,松开弹簧夹。
二.实验现象
①红磷燃烧,发出白光,产生大量白烟,放出热量;
②冷却后松开弹簧夹,水流入集气瓶且流入水的体积约占集气瓶内原空气体积的三.实验结论
氧气约占空气体积的。
同时也得出氮气不燃烧,也不支持燃烧,难溶于水
四.集气瓶中水的作用
①防止生产物溅落而炸裂瓶底
②为了吸收生成的白烟
③吸收热量,有助于装置冷却
五.实验误差分析
因数影响
测定结果小于装置漏气反应后外界空气进入
红磷量不足氧气未被完全消耗
未到装置冷却到室温就打开弹簧
夹
温度较高,气体膨胀,剩余气体占
了较大的体积
测定结果大于点燃红磷插入到瓶中后未立即塞
上胶塞
空气受热膨胀,部分逸出最初弹簧夹未夹紧空气受热膨胀,部分逸出
六.注意
实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以是氢氧化钠
二.铁丝在氧气中燃烧
一.实验现象
①在空气中加热铁丝只能烧到发红,不燃烧
②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体
二.实验操作
①为了达到铁丝燃烧的温度而采取的两个主要措施是:
a.铁丝绕成螺旋状(目的:增大铁丝的受热面积)
b.系一根火柴棍(目的:引燃火柴给铁丝预热)
②等火柴快要燃尽时再将铁丝放入集气瓶的原因是:
a.充分给铁丝预热
b.减少未燃尽的火柴对瓶内氧气的消耗
③使铁丝与氧气充分反应,操作方法是:把铁丝由上而下缓慢插入集气瓶
④底部放水或砂石的目的:
a.防止铁丝燃烧后产生的高温熔融物溅落炸裂瓶底
⑤注意:铁丝不能用生锈的,若用生锈的铁丝,使用前需要打磨
三.硫在氧气中燃烧
一.硫的性质
硫(淡黄色固体)
硫的熔点很低,所以燃烧时为液态
在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色二.实验现象
蓝紫色火焰,放出热量,生产有刺激性气味的气体三.注意事项
硫的用量不能过多,防止造成空气污染
四.集气瓶底部留有少量水的作用
①吸收有毒气体二氧化硫
四.木炭在氧气中燃烧
..
实验现象
①木炭在空气中只能烧到发红;
②木炭在氧气中燃烧能发出白光
③放出热量
④生产能使澄清石灰水边浑浊的气体(加入了第四个实验才能说明这个现象,不然不
能说变浑浊的这个现象)。
