炭,铁,磷,硫在氧气中燃烧的实验及现象
初中化学实验现象总结大全

初中化学实验现象总结大全北斗升学助手 2017-07-1110:421、镁条在空气中燃烧:发出耀眼强光,放出大量热,生成白烟同时生成一种白色物质2、木条在氧气中燃烧:放出白光,放出热量3、硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体4、铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质5、加热试管中碳酸氢铵:有刺激性气味气体生成,试管口有液滴生成6、氢气在氯气中燃烧:发出苍白色火焰,产生大量的热,有雾生成7、在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成8、用木炭粉还原氧化铜粉末:黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊9、一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量10、向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成11、加热试管中硫酸铜晶体:蓝色晶体逐渐变为白色粉末,试管口有液滴生成12、钠在氯气中燃烧:剧烈燃烧,生成白色固体13、点燃纯净的氢气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成14、向含有Cl-的溶液中滴加硝酸酸化的硝银溶液:有白色沉淀生成15、向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液:有白色沉淀生成16、一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成17、在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成18、在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成19、在生石灰上加少量水:反应剧烈,发出大量热20、将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅21、将铜片插入硝酸汞溶液中:铜片表面有银白色物质附22、向盛有石灰的的试管里,注入浓的碳酸钠溶液:有白色沉淀生成23、细铜丝在氯气中燃烧后入水:有棕色的烟生成,加水后生成绿色的溶液24、强光照射氢气、氯气的混和氯和气体:迅速反就肆生爆炸,有雾生成25、红磷在氯气中燃烧:有白色烟雾生成26、氯气遇到湿的有色条:有色布条的颜色褪去27、加热浓盐酸与二氧化锰的混和物:有黄绿色刺激性气味气体生成28、给氯化钠定(固)与硫酸(浓)的和混合物加强热:有雾生成有刺少许性的气味29、在溴化钠溶液中滴加硝酸银溶液后再加硝酸:有浅黄色沉淀生成30、在碘化钾溶液中滴加硝酸银溶液后再加稀硝酸:有黄色沉淀生成31、.细铜丝在硫蒸气中燃烧:细铜丝发红后生成黑色物质32、铁粉与硫粉混和后加热到红热:反应继续进行,放出大量的热,生成黑色物质33、硫化氢气体不完全燃烧(在火焰上罩上蒸发皿):火焰呈淡蓝色(蒸发四底部有黄色的粉末)34、硫化氢气体完全燃烧(在火焰上罩上干冷烧杯):火焰呈淡蓝色,生成有刺激性气味的气体(烧杯内壁有液滴生成)35、在集气瓶中混和硫化氢和二氧化硫:瓶内壁有黄色粉末生成36、二氧化硫气体通入品红溶液后再加热:红色褪去,加热后又恢复原来颜色37、过量的铜投入盛有浓硫酸的试管,并加热,反应毕,待浓液冷却后加水:有刺激性气味的气体生成,加水后溶液呈蓝色38、加热盛有浓硫酸和木炭的试管:有气体生成,且气体有刺激性的气味39、钠在空气中燃烧:火焰呈黄色40、钠投入水中:反应激烈,钠浮于水面,放出大量的热使钠溶成小球在水面上游动,有嗤嗤声41、把水滴入盛有过氧化钠固体的试管,将带火星木条伸入试管口:木条复燃42、加热碳酸氢钠固体,使生成气体通入澄清石灰水:澄清的石灰水变浑浊43、氨气与氯化氢相遇:有大量的白烟产生44、加热氯化铵与氢氧化钙的混和物:有刺激性气味的气体产生45、铜与浓硝酸反应:反应激烈,有红棕色气体产生48、铜与稀硝酸反应(反应在试管中进行):试管下端产生无生气体,气体上升,逐渐变为红棕色49、在硅酸钠溶液中加入稀盐酸:有白色胶状沉淀产生50、在氢氧化铁胶体中加硫酸镁溶液:胶体变浑浊51、加热氢氧化铁胶体:胶体变浑浊52、将点燃的镁条伸入盛有二氧化碳的集气瓶中:剧烈燃烧,有黑色物质附着于集气瓶内壁53、向硫酸铝溶液中滴加氨水:生成蓬松的白色絮物质54、向硫酸亚铁溶液中滴加氢氧化钠溶液:有白色絮状沉淀产生,立即转变为灰绿色,一会儿又转为红褐色沉淀55、向含Fe3+的溶液中滴入KSCN溶液:溶液呈血红色56、向硫化钠水溶液中滴加氯水:溶液变浑浊S2-+Cl2=S+2Cl-57、向天然水中加入少量皂液:泡沫逐渐减少,且有沉淀产生58、在空气中点燃甲烷,并在火焰上罩上干冷烧杯:火焰呈淡蓝色,烧杯内壁有液滴产生59、光照甲烷与氯气的混和气体:黄绿色逐渐变浅(时间较长,容器内壁有液滴生成)60、加热(170℃)乙醇与浓硫酸的混和物,并使产生的气全通入溴水,通入酸性高锰酸钾溶液:有气体产生,溴水褪色,紫色逐渐变浅61、在空气中点燃乙烯:火焰明亮,有黑烟产生,放出热量62、在空气中点燃乙炔:火焰明亮,有浓烟产生,放出热量63、笨在空气中燃烧:火焰明亮,并带有黑烟64、将乙炔通入溴水:溴水颜色褪去65、将乙炔通入酸性高锰酸钾溶液:紫色逐渐变浅,直至褪去:66、苯与液溴、铁粉反应:有白雾产生,生成物油状且带有褐色67、将少量甲苯倒入少量酸性高锰酸钾溶液中,并振荡:紫色褪去68、将金属钠投入盛有乙醇的试管中:有气体放出69、在盛有少量苯酚的试管中滴入过量的浓溴水:有白色沉淀生成70、在盛有苯酚的试管中滴入几滴FeCl3溶液,并振荡:溶液显紫色71、乙醛与银氨溶液在试管中反应:洁净的试管内壁附着一层光亮如银的物质72、在加热至沸的情况下乙醛与新制氢氧化铜反应:有红色沉淀产生73、在适宜条件下乙醇和乙酸反应:有透明的带香味的油状液体生成科学收藏举报世上没有一件工作不辛苦,没有一处人事不复杂。
铁丝在氧气中燃烧为什么会火星四射

铁丝在氧气中燃烧为什么会火星四射铁丝在氧气中燃烧为什么会火星四射呢?这是因为我们实验用的铁丝不是纯铁,铁丝中含有一定数量的碳(其实还包括微量的硫、磷),碳与氧气或熔融状态的铁的氧化物反应生成二氧化碳气体,二氧化碳气体使体积迅速臌胀,推动周围的呈熔融状态的铁及其氧化物向四周飞溅,于是我们便看到火星四射的实验现象。
通过大量实验得到如下结果:1、木炭与铁在氧气中燃烧有相似的实验现象上面这幅图中的实验现象相信大家都比较熟悉,其中有一瓶是木炭在氧气中燃烧,另两瓶是含碳量不同的铁丝在氧气中燃烧你知道哪瓶是木炭在燃烧吗?对了,就是中间这瓶:乙瓶。
从图中我们可以清楚地看到乙瓶木炭燃烧现象与丙瓶中铁丝燃烧现象近似。
它们为什么会有相似的火星四射的现象呢?因为它们燃烧时生成的气体使固体或液体向四周飞溅形成爆裂物。
具体一点,在点燃的铁丝上,在氧气能够到达的浅表面发生碳与氧气直接生成二氧化碳的反应,稍深一点的由于熔融状态物质的流动性,碳与新生成铁的氧化物反应生成二氧化碳,二氧化碳推动周围的熔化物向四周飞溅。
2、铁中含碳量不同,则实验现象不同上面图中甲瓶与丙瓶显示的都是铁丝在氧气中燃烧的现象,为什么甲瓶中的火星明显没有丙瓶中的多呢?其实就是它们含碳量不同。
较纯的铁丝(工业级)在氧气中燃烧火星较少,弯成螺旋状有时不能燃烧,或燃烧不能持久,采用较多量铁丝疏松缠绕在一起燃烧现象与上图中甲瓶类似;低碳钢铁丝,弯成螺旋状产生火星的数量与甲瓶类似,反应有时不能持久;中高碳钢弯成螺旋状很容易剧烈燃烧,火星四射,本人常采用圆珠笔内的弹簧做该实验,效果很好,从来没有失败过,现象如上图中丙瓶所示。
很多老师用窗纱上的细钢丝做铁在氧气中燃烧实验失败了,其主要原因应该是窗纱上的纺织钢丝是低碳钢,以前资料一般解释的有氧化膜、氧气不纯、没有达到着火点等原因虽然存在,主要原因还是含碳量太低。
3、其它不含碳金属的燃烧镁、铝的冶炼方法决定了镁、铝通常都比较纯,特别是镁、铝中不含碳(最多含有痕量的碳)。
(完整版)物质在氧气中燃烧现象归纳
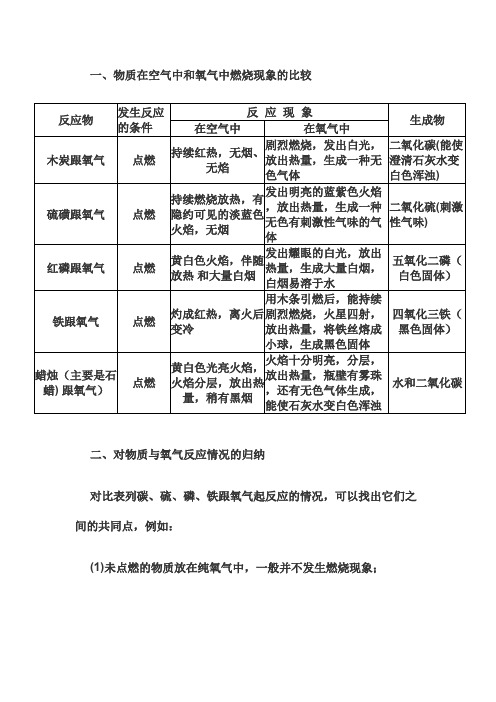
一、物质在空气中和氧气中燃烧现象的比较
二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
反 应 现 象
反应物发生反应的条件在空气中在氧气中
生成物木炭跟氧气
点燃
持续红热,无烟、
无焰
剧烈燃烧,发出白光,
放出热量,生成一种无
色气体
二氧化碳(能使澄清石灰水变白色浑浊)硫磺跟氧气点燃
持续燃烧放热,有
隐约可见的淡蓝色
火焰,无烟
发出明亮的蓝紫色火焰
,放出热量,生成一种
无色有刺激性气味的气
体
二氧化硫(刺激性气味)红磷跟氧气点燃
黄白色火焰,伴随
放热 和大量白烟
发出耀眼的白光,放出
热量,生成大量白烟,
白烟易溶于水
五氧化二磷(白色固体)铁跟氧气点燃
灼成红热,离火后变冷用木条引燃后,能持续
剧烈燃烧,火星四射,放出热量,将铁丝熔成
小球,生成黑色固体四氧化三铁(黑色固体)
蜡烛(主要是石蜡) 跟氧气)
点燃黄白色光亮火焰,
火焰分层,放出热
量,稍有黑烟
火焰十分明亮,分层,
放出热量,瓶壁有雾珠
,还有无色气体生成,
能使石灰水变白色浑浊
水和二氧化碳
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
2020年中考化学分析专题-- 空气 氧气1

2020年中考化学分析专题-- 空气氧气考纲解读空气和氧气在初中化学中占有极其重要的地位,是历年中考的热点,也是每年中考的必考内容。
有关空气和氧气这一考点内容包括空气的组成成分、空气中氧气含量的测定、空气的污染、氧气的化学性质、氧气的实验室制法等常见考点外,还常与金属性质的测定、水的电解、分子的构成、燃烧等知识点相融合,渗透在各种题型中。
空气和氧气是初中化学的基础考点,是中考必备知识。
在中考命题中形式多样,主要考查学生环保意识,对化学基本概念的理解和实验探究能力,考查学生运用知识解决生活、生产中的实际问题的能力。
中考题揭秘1.(2013湖南长沙)人类生存离不开空气,下列说法正确的是())的多少不影响人体健康A.空气中可吸入颗粒物(PM2.5B.空气是混合物C.空气中不含二氧化碳D.氮气可以供给呼吸2.(2013 天津)下列气体与空气混合后遇明火,可能发生爆炸的是()A.甲烷B.氮气C.氧气D.二氧化碳3.(2013 云南昆明)下列关于氧气用途的叙述不正确的是()A.医疗急救B.潜水C.灯泡中充氧气以延长使用寿命D.动植物呼吸要点归纳1、空气(一)空气的成分(二)空气中氧气含量的测定能否用碳、硫代替红磷?不能。
原因:产物是气体,不能产生压强差。
(三)空气的污染及防治对空气造成污染的主要是有害气体(CO 、SO 2、氮的氧化物)和烟尘等。
目前计入空气污染指数的项目为 CO 、SO 2、NO 2、O 3 和可吸入颗粒物等。
空气污染的危害:严重损害人体健康,影响作物生长,破坏生态平衡.全球气候变暖,臭氧层破坏和酸雨等。
防治措施:加强大气质量监测,改善环境状况,使用清洁能源,工厂的废气经处理过后才能排放,积极植树、造林、种草等。
(四)常见气体的用途①氧气:供呼吸 (如潜水、医疗急救);支持燃烧 (如燃料燃烧、炼钢、气焊)。
②氮气:惰性保护气(化性不活泼)、重要原料(硝酸、化肥)、液氮冷冻③稀有气体(He 、Ne 、Ar 、Kr 、Xe 等的总称):保护气、电光源(通电发不同颜色的光)、激光技术。
初中化学人教版九年级上册重点实验总结(共12个)

九年级化学上册重点实验
物理性质无色、无味的气体,不易溶于水,化学性质不能燃烧,也不支持燃烧。
以上实验得到的分子具有的基本性质是:分子是在不断运动的。
(1)适用范围:用于难溶性固体与液体的分离。
(1)蒸馏是根据液态混合物中各成分的沸点不同进行分离的一种方法。
石棉网的作用是使烧瓶受热均匀,防止炸裂。
烧杯中的冷水的作用是使水蒸气迅速液化,如
(1)在电解水的实验中,负极放出氢气,正极放出氧气,体积比为2:1,质量比为1:8,此
(每两种材料间均用纱布隔开)
(1)图中所用材料的摆放顺序,有一处错误是石英砂与小卵石顺序放反了。
(1)实验1的现象白磷燃烧,产生白烟,气球先膨胀后收缩。
气球的作用是缓冲作用,防止
(1)实验一:试管内实验现象是固体由黑色变成红色,化学方程式是C+2CuO高温2Cu+CO↑。
倒在纸上观察?防止灼热的铜重新被空气中的氧气氧化。
(2)实验二:硬质玻璃管内的现象是黑色的固体变红色,化学方程式CO+CuO Cu+CO
2。
(3)实验三:倒了适量水后,旋紧盖子,观察到的现象是矿泉水瓶变扁了,得到此现象的原
【实验结论】二氧化碳与水能发生反应生成H CO。
(2)实验
(Ⅳ)结束后,烘干第四朵花所发生的现象,说明碳酸不稳定,受热易分解,发生反应的化
学方程式是H
2CO
3
CO
2
↑+H
2
O。
(1)实验1:铜片上的白磷是否燃烧是,左图水中的白磷是否燃烧否,说明燃烧需要氧气;。
化学元素周期表记忆口诀

化学元素周期表记忆口诀化学元素周期表记忆口诀初高中化学都要求大家掌握元素周期表的规律与排列,以下是店铺整理的化学元素周期表记忆口诀,仅供参考,大家一起来看看吧。
化学元素周期表口诀口诀A、按周期分:第一周期:氢氦——侵害第二周期:锂铍硼碳氮氧氟氖——鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩——那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰铁钴镍铜锌镓锗——铁姑捏痛新嫁者砷硒溴氪——生气休克第五周期:铷锶钇锆铌——如此一告你钼锝钌——不得了铑钯银镉铟锡锑——老把银哥印西堤碲碘氙——地点仙第六周期:铯钡镧铪——(彩)色贝(壳)蓝(色)河钽钨铼锇——但(见)乌(鸦)(引)来鹅铱铂金汞砣铅——一白巾供它牵铋钋砹氡——必不爱冬(天)第七周期:钫镭锕——防雷啊!B、按族分:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动规律一、元素周期表中元素及其化合物的递变性规律1、原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族—4递增到—1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同。
3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
4、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
碳硫磷铁在氧气中燃烧的化学方程式
碳硫磷铁在氧气中燃烧的化学方程式1. 引言在化学反应中,物质的燃烧一直是备受关注的话题。
其中,碳、硫、磷、铁等金属元素在氧气中的燃烧过程更是引人注目。
本文将从化学方程式的角度出发,深入探讨碳、硫、磷、铁在氧气中燃烧的过程和特点,从而帮助读者更深入地理解这一化学现象。
2. 碳在氧气中的燃烧碳是一种常见的元素,其在氧气中的燃烧反应是我们日常生活中经常能够观察到的现象。
碳在氧气中燃烧,会产生二氧化碳和大量的热能。
其化学方程式如下所示:C + O2 → CO2这个简单的化学方程式揭示了碳燃烧的基本过程,同时也说明了碳和氧气之间的化学反应。
此反应释放出的热能也是我们在实际应用中利用的重要能源之一。
3. 硫在氧气中的燃烧与碳类似,硫在氧气中的燃烧也是一种常见的化学反应。
硫在氧气中燃烧的化学方程式如下所示:S + O2 → SO2通过这个化学方程式,我们可以看到硫在氧气中燃烧时会生成二氧化硫。
这一反应也释放出大量的热能,产生明亮的火焰。
4. 磷在氧气中的燃烧磷在氧气中燃烧的化学方程式如下所示:P + O2 → P4O10磷和氧气的化学反应产生了氧化物——氧化四磷,其燃烧过程同样伴随着强烈的光和热能的释放。
这一现象也是我们在实验室或者其他场合中常常观察到的化学反应之一。
5. 铁在氧气中的燃烧铁在氧气中燃烧的化学方程式如下所示:4Fe + 3O2 → 2Fe2O3这一化学方程式揭示了铁和氧气之间的化学反应,产生了氧化铁。
铁在氧气中燃烧的特点是会产生大量的热能,并且会生成明亮的火花。
6. 总结与回顾通过以上对碳、硫、磷、铁在氧气中燃烧的化学方程式的深入探讨,我们可以了解到不同物质在氧气中燃烧的过程和产物。
碳、硫、磷、铁在氧气中燃烧的化学方程式反映了它们在氧气环境中的活性和化学特性,也给我们提供了更多了解这些元素特性的方式。
个人观点与理解在实际生活和工作中,了解碳、硫、磷、铁等元素在氧气中的燃烧特性对我们的日常生活和工作具有一定的指导意义。
炭铁磷硫在氧气中燃烧的实验及现象
初中化学常见物质在氧气中燃烧的实验一.红磷在氧气中燃烧一.实验操作①用记号将集气瓶中的水面上方的容积分为5等分;②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;③冷却至室温后,松开弹簧夹;二.实验现象①红磷燃烧,发出白光,产生大量白烟,放出热量;②冷却后松开弹簧夹,水流入集气瓶且流入水的体积约占集气瓶内原空气体积的15三.实验结论;同时也得出氮气不燃烧,也不支持燃烧,难溶于水氧气约占空气体积的15四.集气瓶中水的作用①防止生产物溅落而炸裂瓶底②为了吸收生成的白烟③吸收热量,有助于装置冷却五.实验误差分析六.注意实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以是氢氧化钠二.铁丝在氧气中燃烧一.实验现象①在空气中加热铁丝只能烧到发红,不燃烧②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体二.实验操作①为了达到铁丝燃烧的温度而采取的两个主要措施是:a.铁丝绕成螺旋状目的:增大铁丝的受热面积b.系一根火柴棍目的:引燃火柴给铁丝预热②等火柴快要燃尽时再将铁丝放入集气瓶的原因是:a.充分给铁丝预热b.减少未燃尽的火柴对瓶内氧气的消耗③使铁丝与氧气充分反应,操作方法是:把铁丝由上而下缓慢插入集气瓶④底部放水或砂石的目的:a.防止铁丝燃烧后产生的高温熔融物溅落炸裂瓶底⑤注意:铁丝不能用生锈的,若用生锈的铁丝,使用前需要打磨三.硫在氧气中燃烧一.硫的性质硫淡黄色固体硫的熔点很低,所以燃烧时为液态在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色二.实验现象蓝紫色火焰,放出热量,生产有刺激性气味的气体三.注意事项硫的用量不能过多,防止造成空气污染四.集气瓶底部留有少量水的作用①吸收有毒气体二氧化硫四.木炭在氧气中燃烧..实验现象①木炭在空气中只能烧到发红;②木炭在氧气中燃烧能发出白光③放出热量④生产能使澄清石灰水边浑浊的气体加入了第四个实验才能说明这个现象,不然不能说变浑浊的这个现象。
木炭,磷,硫,铁丝燃烧的现象
铁丝燃烧
不能燃烧
注意:在集气瓶底部放少量的水或 剧烈燃烧,火星四射,放出大 一层细沙。 量的热,生成黑色固体。 原因:防止高温的熔化物溅落下来 使集气瓶炸裂。 1、烧的更旺、发白光 2、放出大量的热 3、火焰分三层 、、、、、、
点燃 铁 + 氧气——→ 四氧化三铁 (Fe)(O2) (Fe3O4)
1、发出黄色火焰 2、放热 石蜡燃烧 3、火焰分三层 、、、、、、 1、发出耀眼的白光 镁带燃烧 2、放出大量的热 3、有白色粉末状固体生成 铝燃烧 不能燃烧
点燃 石蜡 + 氧气——→二氧化碳 + 水 (O2) (CO2) (H2O) 点燃 镁 + 氧气——→ 氧化镁 (Mg) (O2) (MgO)
1、剧烈燃烧、发出耀眼的白光 2、放出大量的热 3、生成白色粉末固体
同铁丝燃烧
点燃 铝 + 氧气——→ 氧化铝 (Al)(O2) (Al2O3)
化学反应文字表达式 点燃 磷 + 氧气——→ 五氧化二磷 (P) (O2) (P2O5) 点燃 硫 + 氧气——→ 二氧化硫 (S) (O2) (SO2) 点燃 碳 + 氧气——→ 二氧化碳 (S)(O2) (CO2)
1、发出微弱的淡蓝色火焰 1、发出蓝紫色火焰 硫燃烧 2、有刺激性气味的气体生成 2、有刺激性气味的气体生成 3、放出大量的热 3、放出大量的热 1、发红 2、放热 木炭燃烧 3、有能够使澄清石灰水变 浑浊的气体生成 1、剧烈燃烧、发白光 2、放出大量的热 3、有能够使澄清石灰水变 浑浊的气体生成
现 在空气中 1、发出黄色火焰 磷燃烧 2、有大量白烟生成 3、放出大量的 3、放出大量的热
注意事项及原因 注意:在集气瓶底部放少量的水。 原因:①防止集气瓶炸裂 ②吸收白烟五氧化二磷 注意:在集气瓶底部放少量的水。 原因:吸收生成的有毒气体二氧化 硫 注意:木炭由瓶口向下缓慢插入。 原因:防止生成的热的二氧化碳把 氧气排出瓶外。
有关铁在氧气中燃烧实验的五种现象解析
可燃性 气体 , 然后 可 燃性气 体进 行燃 烧 , 此时
度 很高 , 因此就 有 了火星 四射的现象 产生 。含碳量
越 高 的铁 ( 或钢) 丝, 火 星 四射越 明显 。纯 净 的铁 燃 烧时没有气 体生成 , 是 没有火星 四射现 象 的。许
F e O 。为 1 5 6 0 ℃并分解, F e O 为 1 5 9 4  ̄ 并 分 解) , 故 不 能 产 生 大 量 的 固体 小 颗粒 聚集 悬 浮 在
火焰 是 可燃 性 的 气 体 或 者 蒸 气 燃 烧 时 产 生
空中, 所 以就没有 产 生烟子 的现象 了 。
3 铁 丝在 氧气 中燃 烧为什 么 火星 四射 … 木炭 燃烧之所 以产生火星 四射的现象 , 是 因为
的 。对 于 可燃 性 固体 而言 , 其 燃 烧 产 生火 焰 的情
况 通 常有 四种 : 一 是 蒸 发 燃 烧 。 固体 的熔 点 和 着 火点都 比较 低 , 在 受 热时就 会首 先熔 化 为液体 , 然 后 蒸发 变 为蒸气 与空 气进行 混 合燃烧 。初 中化 学
疏 松多孔 的木 炭在 内部燃 烧 时产 生一 氧化 碳 与二 氧化碳气体 。这些气体在 受热时体 积膨胀 , 使燃着 的 固体或液 体爆 裂 向 四周 飞 溅 。实 验 用 的铁 丝通 常并不是纯净 的铁 , 而是含 有一定量 的碳及 微量 的
燃烧 。结 构复 杂 的 固体 可 燃 物 , 在 受 热 时 发生 热 分解 , 生成 可 燃性 气 体 与空 气 进行 混 合燃 烧 。例
如, 点 燃 一 根 木材 , 是 木 材 先 发生 热 分 解 , 挥发 出
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学常见物质在氧气中燃烧的实验
一.红磷在氧气中燃烧
一.实验操作
①用记号将集气瓶中的水面上方的容积分为5等分;
②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;
③冷却至室温后,松开弹簧夹。
二.实验现象
①红磷燃烧,发出白光,产生大量白烟,放出热量;
②冷却后松开弹簧夹,水流入集气瓶且流入水的体积约占集气瓶内原空气体积的三.实验结论
氧气约占空气体积的。
同时也得出氮气不燃烧,也不支持燃烧,难溶于水
四.集气瓶中水的作用
①防止生产物溅落而炸裂瓶底
②为了吸收生成的白烟
③吸收热量,有助于装置冷却
五.实验误差分析
因数影响
测定结果小于装置漏气反应后外界空气进入
红磷量不足氧气未被完全消耗
未到装置冷却到室温就打开弹簧
夹
温度较高,气体膨胀,剩余气体占
了较大的体积
测定结果大于点燃红磷插入到瓶中后未立即塞
上胶塞
空气受热膨胀,部分逸出最初弹簧夹未夹紧空气受热膨胀,部分逸出
六.注意
实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以是氢氧化钠
二.铁丝在氧气中燃烧
一.实验现象
①在空气中加热铁丝只能烧到发红,不燃烧
②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体
二.实验操作
①为了达到铁丝燃烧的温度而采取的两个主要措施是:
a.铁丝绕成螺旋状(目的:增大铁丝的受热面积)
b.系一根火柴棍(目的:引燃火柴给铁丝预热)
②等火柴快要燃尽时再将铁丝放入集气瓶的原因是:
a.充分给铁丝预热
b.减少未燃尽的火柴对瓶内氧气的消耗
③使铁丝与氧气充分反应,操作方法是:把铁丝由上而下缓慢插入集气瓶
④底部放水或砂石的目的:
a.防止铁丝燃烧后产生的高温熔融物溅落炸裂瓶底
⑤注意:铁丝不能用生锈的,若用生锈的铁丝,使用前需要打磨
三.硫在氧气中燃烧
一.硫的性质
硫(淡黄色固体)
硫的熔点很低,所以燃烧时为液态
在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色
二.实验现象
蓝紫色火焰,放出热量,生产有刺激性气味的气体
三.注意事项
硫的用量不能过多,防止造成空气污染
四.集气瓶底部留有少量水的作用
①吸收有毒气体二氧化硫
四.木炭在氧气中燃烧
..
实验现象
①木炭在空气中只能烧到发红;
②木炭在氧气中燃烧能发出白光
③放出热量
④生产能使澄清石灰水边浑浊的气体(加入了第四个实验才能说明这个现象,不然不
能说变浑浊的这个现象)。
