总大肠菌群数测定原始记录表
大肠菌群检验原始记录-平板计数法-2016版-5样

将以上VRBA平板倒置于36.0±1.°C,培养18h~24h(//时〜/_/时)并
分别计数可疑和典型菌落。
4.平板菌落数选择
选取菌落数在15~150CFU之间的平板,分别计数平板上出现的典型和可疑大肠菌群菌落。典型菌落为紫红色,菌落周围有红色的胆盐沉淀环。
5.证实试验(接种BG1.B)
从VRBA平板上挑取10个不同类型的典型和可疑菌落,少于10个菌落的挑取全部典型和可疑菌落,分别移种于BG1.B肉汤管内,36°C±1°C培养24h~48h,(//时〜/_/时)观察产气
大肠菌群检验原始记录(平板计数法)
检验单位
检验员
检验日期
至
环境条件
温度℃,相对湿度%
检验依据
GB4789.3-2016《食品安全国家标准食品微生物学检验大肠菌群计数》第二法
样品名称
产品批号
仪器设备及耗材:
电子天平、洁净工作台、电热恒温培养箱、立式压力蒸汽灭菌器、水浴锅、PH计、移液器
培养基及试剂:
结晶紫中性红胆盐琼脂培养基(VRBA):m1.配制日期:
第三稀释度
结果
CF∪∕m1.□CFU∕g□
VRBA疑似大肠菌群菌落数
接种BG1.B管数
BG1.B阳性管数
样品4
稀释度
第一稀释度
第二稀释度
第三稀释度
结果
CF∪∕m1.□CFU∕g□
VRBA疑似大肠菌群菌落数
接种BG1.B管数
BG1.B阳性管数
样品
5
稀释度
第一稀释度
第二稀释度
第三稀释度
结果
CFU∕m1.□CFU∕g□
2.接种VRBA
选择适宜的2~3个连续稀释度的样品匀液(液体样品可包括原液),吸取Im1.于无菌平皿内,每个稀释度接种两个平皿。同时分别吸取1m1.生理盐水加入两个无菌平皿内作为空白对照。及时将15~20m1.融化并恒温至46℃的VRBA倾注平皿,并转动平皿使其混合均匀,待琼脂凝固后,再加3~4m1.VRBA覆盖平板表层。同时再以只加VRBA的平皿,作为VRBA的空白对照。将平板翻转,培养。
总大肠菌群原始记录表

总大肠菌群检验数据原始记录
委托书编号:委托单位:
检测项目:总大肠菌群检测依据:GB/T 5750.12-2006 2.1多管发酵法
样品名称:样品数量:
样品编号:样品状态:
收样日期:检测日期:
环境温度:环境湿度:
操作方法:
一、乳糖发酵实验
1、取10ml水样接种到10ml二倍乳糖蛋白胨培养液中,取1ml水样接种到10ml单料乳糖蛋白胨培养液中,另取1ml水样注入到9ml灭菌生理盐水中,混匀后吸取1ml (即0.1ml水样)注入到10ml单料乳糖蛋白胨培养液中,每一稀释度接种5管。对已处理过的出厂自来水,需经常检验或每天检验一次的,可直接种5份10ml水样双料培养基,每份接种10ml水样。
培养温度
培养时间
二倍浓缩乳糖蛋白胨培养液
36±1°C
24h±2h
乳糖蛋白胨培养液
36±1°C
24h±2h
EMB
36±1°C
24h±2h
观察结果
序号
样品编号
乳糖发酵
复发酵
结果报告(MPN/100mL)
10ml
1ml
0.1ml
10ml
1ml
0.1ml
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
操作人:复核人:二、分来自培养:经培养24h后,将产酸产气的发酵管,分别接种于伊红美蓝平板上,36±1°C恒温培养8h-24h,观察形态,挑取数个可疑菌落进行涂片、革兰氏染色、镜检。
总大肠菌群原始记录表

3、将接种管置36±l°C培养箱内,培养24h±2h,如所有乳糖蛋白胨培养管都不产气产酸,则可报告为总大肠菌群阴性,如有产酸产气者,则按下列步骤进行。
二、分离培养:
经培养24h后,将产酸产气的发酵管,分别接种于伊红美蓝平板上,36±1°C恒温培养8h-24h,观察形态,挑取数个可疑菌落进行涂片、革兰氏染色、镜检。
三、证实试验:
挑取可疑管接种乳糖蛋白胨培养液中,置于36±1°C愠温箱中培养24h ±2h,有产酸产气者,即证实有总大肠菌群存在。
培养基
19
20
操作人:复核人:
培养温度
培养时间
二倍浓缩乳糖蛋白胨培养液
36±1°C
24h±2h
乳糖蛋白胨培养液
36±1°C
24h±2h
EMB
36±1°C
24h±2h
观察结果
序号
样品编号
乳糖发酵
复发酵
结果报告(MPN/100mL)
10ml
1ml
0.1ml
10ml
1ml
0.1ml
1
2
3
4
5
6
7
8
9பைடு நூலகம்
10
11
12
13
14
15
16
17
18
总大肠菌群检验数据原始记录
委托书编号:委托单位:
检测项目:总大肠菌群检测依据:GB/T 5750.12-2006 2.1多管发酵法
大肠菌群检测原始记录

发酵试验
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
阳性管数
报出值 MPN/ml
审核:
年月
日
编号: 样品名称:
检验依据:GB/T4789.3-2016 培养开始时间: 年 月 培养结束时间: 年 月
稀பைடு நூலகம்度
1
稀释度
项目 管号
1 2 3 1 2 3 1 2 3
项目 管号
2
稀释度
3
稀释度
4
稀释度
1 2 3 1 2 3 1 2 3
项目 管号
1 2 3 1 2 3 1 2 3
项目 管号
1 2 3 1 2 3 1 2 3
项目 管号
1
2
3
5
1
2
3
1
2
3
检验员:
大肠菌群检测原始记录
批次:
日时
日时
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
恒温时间: h 恒温温度:36℃±1℃
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
发酵试验
阳性管数
报出值 MPN/ml
LST肉汤管初 BGLG肉汤管复
发酵试验
大肠菌群、沙门氏菌GBT23780检测原始记录
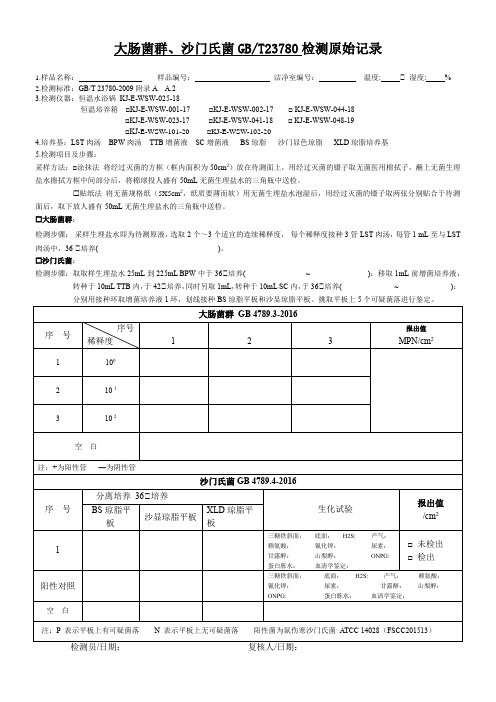
大肠菌群、沙门氏菌GB/T23780检测原始记录1.样品名称:样品编号:洁净室编号:温度: ℃ 湿度: %2.检测标准:GB/T 23780-2009附录A A.23.检测仪器:恒温水浴锅KJ-E-WSW-025-18恒温培养箱□KJ-E-WSW-001-17 □KJ-E-WSW-002-17 □ KJ-E-WSW-044-18□KJ-E-WSW-023-17 □KJ-E-WSW-041-18 □ KJ-E-WSW-048-19□KJ-E-WSW-101-20□KJ-E-WSW-102-204.培养基:LST肉汤BPW肉汤TTB增菌液SC增菌液BS琼脂沙门显色琼脂XLD琼脂培养基5.检测项目及步骤:采样方法:□涂抹法将经过灭菌的方框(框内面积为50cm2)放在待测面上,用经过灭菌的镊子取无菌医用棉拭子,蘸上无菌生理盐水擦拭方框中间部分后,将棉球投人盛有50mL无菌生理盐水的三角瓶中送检。
贴纸法将无菌规格纸(5X5cm2,纸质要薄而软)用无菌生理盐水泡湿后,用经过灭菌的镊子取两张分别贴合于待测面后,取下放人盛有50mL无菌生理盐水的三角瓶中送检。
大肠菌群:检测步骤:采样生理盐水即为待测原液,选取2个~3个适宜的连续稀释度,每个稀释度接种3管LST肉汤,每管1 mL至与LST 肉汤中,36 ℃培养( )。
沙门氏菌:检测步骤:取取样生理盐水25mL到225mL BPW中于36℃培养( ~ );移取1mL前增菌培养液,转种于10mL TTB内,于42℃培养,同时另取1mL,转种于10mL SC内,于36℃培养( ~ );分别用接种环取增菌培养液1环,划线接种BS琼脂平板和沙显琼脂平板。
挑取平板上5个可疑菌落进行鉴定。
检测员/日期:复核人/日期:。
大肠菌群检验原始记录平板计数法2016版5样

检验单位
检验员
检验日期
至
环境条件
温度℃,相对湿度%
检验依据
GB4789.3-2016《食品安全国家标准食品微生物学检验大肠菌群计数》第二法
样品名称
产品批号
仪器设备及耗材:
电ห้องสมุดไป่ตู้天平、洁净工作台、电热恒温培养箱、立式压力蒸汽灭菌器、水浴锅、PH计、移液器
培养基及试剂:
结晶紫中性红胆盐琼脂培养基(VRBA):m1配制日期:
接种BG1B管数
BG1B阳性管数
糊也
VRBA空白(仅VRBA)
生理盐水+VRBA
BG1B空白(仅BG1B)
报告人
报告日期
复核人
复核日期
2.接种VRBA
选择适宜的2〜3个连续稀释度的样品匀液(液体样品可包括原液),吸取Im1于无菌平皿内,每个稀释度接种两个平皿。同时分别吸取1m1生理盐水加入两个无菌平皿内作为空白对照。及时将15~20m1融化并恒温至46℃的VRBA倾注平皿,并转动平皿使其混合均匀,待琼脂凝固后,再加3~4m1VRBA覆盖平板表层。同时再以只加VRBA的平皿,作为VRBA的空白对照。将平板翻转,培养。
3.培养
将以上VRBA平板倒置于36.0±1°C,培养18h~24h(//时〜/_/时)并
分别计数可疑和典型菌落。
4.平板菌落数选择
选取菌落数在15~150CFU之间的平板,分别计数平板上出现的典型和可疑大肠菌群菌落。典型菌落为紫红色,菌落周围有红色的胆盐沉淀环。
5.证实试验(接种BG1B)
从VRBA平板上挑取10个不同类型的典型和可疑菌落,少于10个菌落的挑取全部典型和可疑菌落,分别移种于BG1B肉汤管内,36°C±1°C培养24h〜48h,(//时〜/_/时)观察产气
大肠菌群检验原始记录-平板计数法

-
阴性
报告人
报告日期
复核人
复核日期
将以上 VRBA 平板倒置于 36.0±1℃,培养 18h~24h(2022/xx/xx xx 时~2022/xx/xx xx 时) 并分别计数 可疑和典型菌落。 4.证实试验(接种 BGLB)
选取菌落数在 15~150CFU 之间的平板,从 VRBA 平板上挑取 10 个不同类型的典型和可疑菌落,少于 10 个 菌落的挑取全部典型和可疑菌落,分别移种于 BGLB 肉汤管内,36℃±1℃培养 24h~48h,观察产气情况。 5.结果与报告 5.1 按“四舍五入”原则修约,保留 2 位有效数字,无菌落生长以<1 乘以最低稀释倍数报告。 5.2 称重取样以 CFU/g 为单位报告,体积取样以 CFU/mL 为单位报告。
实验过程: 1.样品处理和稀释: 1.1 如需要,使用 0.1mol/L 氢氧化钠或 0.1mol/L 盐酸将样品调整 pH 在 6.5~7.5 之间。 1.2 制备样品稀释液
根据样品状态,无菌操作,称取/吸管吸取 25g(mL)样品,加入到 225mL 无菌磷酸盐缓冲液中均质(混 匀),制成 1:10 样品匀液。根据对样品污染情况的估计,按上述操作将样品稀释至所需浓度。 2.接种 VRBA
稀释度
10-1 稀释度
大肠菌检验原始记录
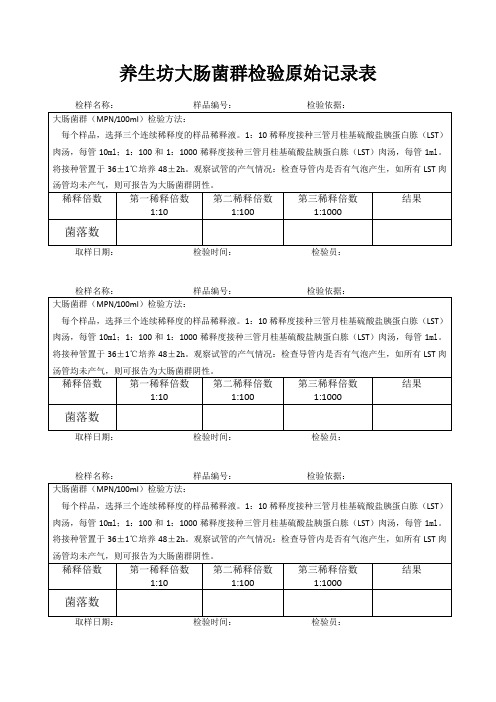
养生坊大肠菌群检验原始记录表检样名称:样品编号:检验依据:大肠菌群(MPN/100ml)检验方法:每个样品,选择三个连续稀释度的样品稀释液。
1:10稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管10ml;1:100和1:1000稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管1ml。
将接种管置于36±1℃培养48±2h。
观察试管的产气情况:检查导管内是否有气泡产生,如所有LST肉汤管均未产气,则可报告为大肠菌群阴性。
稀释倍数第一稀释倍数1:10 第二稀释倍数1:100第三稀释倍数1:1000结果菌落数取样日期:检验时间:检验员:检样名称:样品编号:检验依据:大肠菌群(MPN/100ml)检验方法:每个样品,选择三个连续稀释度的样品稀释液。
1:10稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管10ml;1:100和1:1000稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管1ml。
将接种管置于36±1℃培养48±2h。
观察试管的产气情况:检查导管内是否有气泡产生,如所有LST肉汤管均未产气,则可报告为大肠菌群阴性。
稀释倍数第一稀释倍数1:10 第二稀释倍数1:100第三稀释倍数1:1000结果菌落数取样日期:检验时间:检验员:检样名称:样品编号:检验依据:大肠菌群(MPN/100ml)检验方法:每个样品,选择三个连续稀释度的样品稀释液。
1:10稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管10ml;1:100和1:1000稀释度接种三管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管1ml。
将接种管置于36±1℃培养48±2h。
观察试管的产气情况:检查导管内是否有气泡产生,如所有LST肉汤管均未产气,则可报告为大肠菌群阴性。
稀释倍数第一稀释倍数1:10 第二稀释倍数1:100第三稀释倍数1:1000结果菌落数取样日期:检验时间:检验员:。
