2020届高三化学一轮复习《化学反应原理》专题练习卷
2022届高三化学大一轮复习化学反应原理专题练_38沉淀溶解平衡的图像分析

2022届高三化学大一轮复习化学反应原理专题练_38沉淀溶解平衡的图像分析一、单选题(本大题共15小题,共45分)1.某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/L AgNO3溶液,滴加过程中−lg c(M)(M为Cl−或CrO42−)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。
下列说法不正确的是()A. 曲线L1表示−lgc(Cl−)与V(AgNO3)的变化关系B. M点溶液中:c(NO3−)>c(K+)>c(Ag+)>c(H+)>c(OH−)C. 该温度下,K sp(Ag2CrO4)=4.0×10−12D. 相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点2.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是()A. K sp[Fe(OH)3]<K sp[Cu(OH)2]B. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和C. 加适量NH4Cl固体可使溶液由a点变到b点D. c、d两点代表的溶液中c(H+)与c(OH−)乘积相等3.已知t℃时AgCl的K sp=4×10−10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
下列说法错误的是()A. 在t℃时,Ag2CrO4的K sp为1×10−11B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点C. 在t℃,Ag2CrO4(s)+2Cl−(aq)⇌2AgCl(s)+CrO42−(aq)平衡常数K=6.25×107D. 在t℃时,以0.01mol⋅L−1AgNO3溶液滴定未知浓度K2CrO4溶液,可选用0.01mol⋅L−1KCl溶液作为指示剂4.绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。
2020届暑假人教版高三一轮复习化学反应原理综合大题专题练习 含答案

2020届暑假人教版高三一轮复习化学反应原理综合大题专题练习1.(2019深圳一研)CO还原脱硝技术可有效降低烟气中的NOx的排放量。
回答下列问题:I.CO还原NO的脱硝反应:2CO(g)+2NO(g)⇌2CO2(g)+N2(g)△H(1)已知:CO(g)+NO2(g)⇌CO2(g)+NO(g)△H1=-226 kJ·mol-1N2(g)+2O2(g)⇌2NO2(g)△H2=+68 kJ·mol-1N2(g)+O2(g)⇌2NO(g)△H3=+183 kJ·mol-1脱硝反应△H=____________ ,该反应向正反应方向自发进行的倾向很大,其原因是_______ _______________________________________________,有利于提高NO平衡转化率的条件是_________________________________________________________(写出两条)。
(2)以Mn3O4为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:____________________________;第二步:3MnO2+2CO=Mn3O4+2CO2(3)在恒温恒容的密闭容器中,充入等物质的量的CO和NO混合气体,加入Mn3O4发生脱硝反应,t0 时达到平衡,测得反应过程中CO2的体积分数与时间的关系如右图所示。
①比较大小:a处v 正________b处v 逆(填“>”、“<”或“=”)②NO的平衡转化率为_____________。
II.T℃时,在刚性反应器中发生如下反应:CO(g)+NO2(g)⇌CO2(g)+NO(g),化学反应速率v =k Pm(CO)Pn( NO2),k 为化学反应速率常数。
研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:(4)若反应初始时P(CO)=P(NO2)=a kPa,反应t min时达到平衡,测得体系中P(NO)=b kPa,则此时v =___________ kPa·s-1(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=_____(Kp是以分压表示的平衡常数)。
2020届高三高考化学一轮复习专题专练:铁、铜及其化合物

铁、铜及其化合物1.玻璃制造行业需要消耗大量硼酸(H 3BO 3)。
工业上以铁硼矿(主要成分为2MgO·B 2O 3·H 2O 和Fe 3O 4,还含有少量Fe 2O 3、FeO 、CaCO 3、Al 2O 3和SiO 2等)为原料生产硼酸的工艺流程如下:资料:(1)H 3BO 3的溶解度在20 ℃、40 ℃、60 ℃、100 ℃时分别为5.0 g 、8.7 g 、14.8 g 、40.2 g ; (2)Fe 3O 4是一种铁氧体磁性物质,不溶于水和酸;(3)Fe 3+、Al 3+、Fe 2+和Mg 2+以氢氧化物形式完全沉淀时,溶液的pH 分别为3.2、5.2、9.7和12.4;(4)母液呈酸性。
则下列推断不正确的是( ) A .浸出渣中只含SiO 2B .热过滤的目的是防止温度降低时H 3BO 3从溶液中析出C .除杂时需向浸出液中依次加入H 2O 2和MgO ,以除去Fe 2+、Fe 3+、Al 3+等杂质离子D .回收母液可以制得硫酸镁晶体2.化学反应中,反应物用量、浓度或反应条件不同可能对生成物产生影响。
下列反应的生成物不受上述因素影响的是( )A .铜与硝酸反应B .钠与氧气反应C .氢气与氯气反应D .氯化铝与氢氧化钠溶液反应3.已知下列转化关系中,M 、N 均为单质,则M 可能是( ) M +N ――→点燃 Q ――→溶于水 Q 溶液――――――→惰性电极电解 M +N A .Na B .Al C .FeD .Cu4.下列常见金属的冶炼原理中不合理的是( )532A .Cu ――――→浓HNO 3Cu(NO 3)2 B .Cu ――――→稀HNO 3Cu(NO 3)2C .Cu ――→O 2空气△CuO ――→稀HNO 3△Cu(NO 3)2D .Cu ――→Cl 2△CuCl 2―――――→硝酸银溶液 Cu(NO 3)26.下列关于Fe 3+、Fe 2+性质实验的说法错误的是( )A .用如图装置可以制备Fe(OH)2B .配制FeCl 3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度C .向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe 2+D .向FeCl 2溶液中加入少量铁粉是为了防止Fe 2+被氧化7.粗制的CuSO 4·5H 2O 晶体中含有Fe 2+。
2022届高三化学大一轮复习化学反应原理专题练_41难溶物的沉淀溶解平衡综合练习

2022届高三化学大一轮复习化学反应原理专题练_41难溶物的沉淀溶解平衡综合练习一、单选题(本大题共17小题,共51分)1.已知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随PH的升高,Fe(OH)3首先析出,为除去MgCl2酸性溶液中的Fe3+可以在加热搅拌的条件下.加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是()A. NH3⋅H2OB. MgOC. Mg(OH)2D. MgCO32.已知在Ca3(PO4)2的饱和溶液中,[Ca2+]=2.0×10−6mol.L−1,[PO43−]=1.58×10−6mol.L−1,则Ca3(PO4)2的K sp为()A. 2.0×10−29mol.L−5B. 3.2×10−12mol5.L−5C. 6.3×10−18mol5.L−5D. 5.1×10−27mol5.L−53.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:(1)CuSO4+Na2CO3主要:Cu2++CO32─+H2O=Cu(OH)2↓+CO2↑次要:Cu2++CO32─ =CuCO3↓(2)CuSO4+Na2S主要:Cu2++S2─ =CuS↓次要:Cu2++S2─+2H2O=Cu(OH)2↓+H2S↑则下列几种物质的溶解度大小的比较中,正确的是()A. Cu(OH)2>CuCO3>CuSB. CuS>Cu(OH)2>CuCO3C. Cu(OH)2<CuCO3<CuSD. CuS<Cu(OH)2<CuCO34.往含Cl−和I−的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法正确的是()A. K sp(AgCl)<K sp(AgI)B. c( Cl-):c( I-)=3:2C. m( AgCl ):m( AgI )=2:3D. a~b段产生黄色沉淀5.下列实验操作,现象和结论均正确的是()实验现象结论A.某溶液中滴加K3[Fe(CN)6]溶液产生蓝色沉淀原溶液中有Fe2+,无Fe3+B.常温下分别测量等浓度的K2SO3和KCl溶液的pHpH:K2SO3>KCl非金属性Cl>SC.室温下测0.1mol·L−1醋酸pH pH≈3.3醋酸是弱酸D.向5mL0.1mol·L−1NaOH溶液中ⅰ.滴加几滴同浓度的MgSO4溶液ⅰ.再滴加几滴同浓度FeCl3溶液ⅰ.产生白色沉淀ⅰ.产生红褐色沉淀K sp[Fe(OH)3]<K sp[Mg(OH)2]A. AB. BC. CD. D6.下列说法正确的是()A. 装置①可用于探究硫酸浓度对反应速率的影响B. 装置②可用于测定中和热C. 装置③可用于探究Mg(OH)2能否转化为Fe(OH)3D. 装置④不能防止铁闸门被腐蚀7.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示.纵坐标p(M n+)表示−lgc(M n+),横坐标p(S2−)表示−lgc(S2−),下列说法不正确的是()A. 该温度下,Ag2S的K sp=1.6×10−49B. 该温度下,溶解度的大小顺序为NiS>SnS=104C. SnS和NiS的饱和溶液中c(Sn2+)c(Ni2+)D. 向含有等物质的量浓度的Ag+、Ni2+、Sn2+溶液中加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S>SnS>NiS8.工业上可通过如下流程回收铅蓄电池中的铅,下列有关说法不正确的是A. PbSO4在水中存在溶解平衡:PbSO4(s)⇌Pb2+(aq)+SO42−(aq)B. 生成PbCO3的离子方程式为PbSO4+CO32−⇌PbCO3+SO42−C. 滤液中不存在Pb2+D. pH:滤液<饱和Na2CO3溶液9.不同温度(T1℃和T2℃)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。
2020届高三化学一轮复习 盖斯定律 反应热的计算(跟踪训练)

2020届高三化学一轮复习 盖斯定律 反应热的计算一、选择题1、已知在298K 时下述反应的有关数据: C(s)+12O 2(g)===CO(g) ΔH 1=-110.5kJ·mol -1C(s)+O 2(g)===CO 2(g) ΔH 2=-393.5kJ·mol -1,则C(s)+CO 2(g)===2CO(g)的ΔH 为( ) A .+283.5kJ·mol -1 B .+172.5kJ·mol -1 C .-172.5kJ·mol -1 D .-504kJ·mol -1答案 B2、化学反应过程可视为旧化学键断裂和新化学键形成的过程,H —H 键的键能为436kJ·mol -1,Cl —Cl 键的键能为243kJ·mol -1,H —Cl 键的键能为431kJ·mol -1。
已知H 2(g)+Cl 2(g)===2HCl(g) ΔH =-Q kJ·mol -1,则Q 等于( )A .-183B .183C .-862D .862 答案 B3、已知:①C(s)+H 2O(g)===CO(g)+H 2(g) ΔH 1=a kJ·mol -1②2C(s)+O 2(g)===2CO(g) ΔH 2=-220kJ·mol -1通常人们把拆开1mol 某化学键所消耗的能量看成该化学键的键能。
已知H —H 、O==O 和O —H 键的键能分别为436kJ·mol -1、496kJ·mol-1和462kJ·mol -1,则a 为( )A .-332B .-118C .+350D .+130 答案 D4.已知丙烷的燃烧热ΔH =-2 215 kJ·mol -1。
若一定量的丙烷完全燃烧后生成1.8 g 水,则放出的热量约为( )A .55 kJB .220 kJC .550 kJD .1 108 kJ 答案 A5、氯原子对O 3分解有催化作用: O 3+Cl===ClO +O 2 ΔH 1 ClO +O===Cl +O 2 ΔH 2大气臭氧层的分解反应是O 3+O===2O 2 ΔH ,该反应的能量变化如图:下列叙述中,正确的是( ) A .反应O 3+O===2O 2的ΔH =E 1-E 3 B .O 3+O===2O 2是吸热反应 C .ΔH =ΔH 1+ΔH 2 D .ΔH =E 3-E 2>0 答案 C 6、已知反应:H 2(g)+12O 2(g)===H 2O(g) ΔH 112N 2(g)+O 2(g)===NO 2(g) ΔH 2 12N 2(g)+32H 2(g)===NH 3(g) ΔH 3 则反应2NH 3(g)+72O 2(g)===2NO 2(g)+3H 2O(g)的ΔH 为( )A .2ΔH 1+2ΔH 2-2ΔH 3B .ΔH 1+ΔH 2-ΔH 3C .3ΔH 1+2ΔH 2+2ΔH 3D .3ΔH 1+2ΔH 2-2ΔH 3答案 D7、已知298K 、101kPa 时: 2H 2O(g)===O 2(g)+2H 2(g) ΔH 1 Cl 2(g)+H 2(g)===2HCl(g) ΔH 22Cl 2(g)+2H 2O(g)===4HCl(g)+O 2(g) ΔH 3 则ΔH 3与ΔH 1和ΔH 2间的关系正确的是( ) A .ΔH 3=ΔH 1+2ΔH 2 B .ΔH 3=ΔH 1+ΔH 2 C .ΔH 3=ΔH 1-2ΔH 2 D .ΔH 3=ΔH 1-ΔH 2 答案 A8、肼(N 2H 4)是火箭发动机的一种燃料,反应时N 2O 4为氧化剂,反应生成N 2和水蒸气。
2020届福建高三化学大题练——化学反应原理题(2)
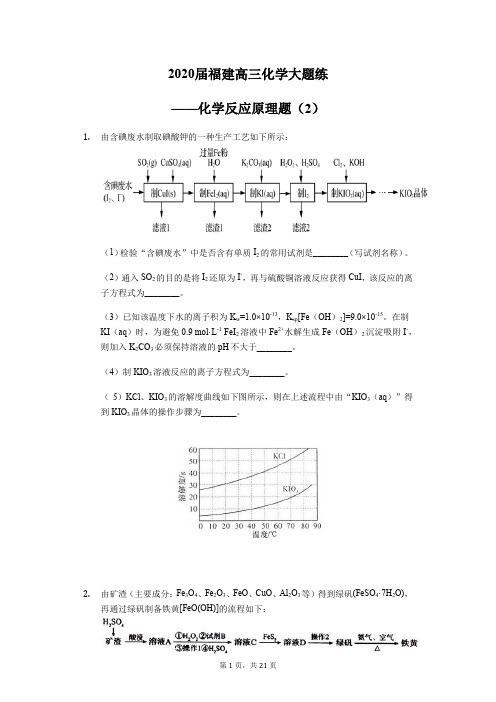
2020届福建高三化学大题练——化学反应原理题(2)1.由含碘废水制取碘酸钾的一种生产工艺如下所示:(1)检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
(2)通入SO2的目的是将I2还原为I-,再与硫酸铜溶液反应获得CuI,该反应的离子方程式为________。
(3)已知该温度下水的离子积为K w=1.0×10-13,K sp[Fe(OH)2]=9.0×10-15。
在制KI(aq)时,为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成Fe(OH)2沉淀吸附I-,则加入K2CO3必须保持溶液的pH不大于________。
(4)制KIO3溶液反应的离子方程式为________。
(5)KCl、KIO3的溶解度曲线如下图所示,则在上述流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为________。
2.由矿渣(主要成分:Fe3O4、Fe2O3、FeO、CuO、Al2O3等)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:已知:①FeS2和铁黄均难溶于水②生成氢氧化物沉淀的pH回答下列问题(1)写出酸浸过程中,Fe3O4所发生的离子反应方程式________________________________。
(2)加入试剂B,控制溶液pH的范围__________。
(3)请写出溶液C→溶液D的离子方程式__________________________________________。
(4)操作2为__________、__________、过滤、洗涤;绿矾制铁黄的化学反应方程式为_______________________。
(5)为测定制备的铁黄的纯度,取样品10.00 g,用稀硫酸溶解并配成250 mL溶液,每次取25 mL,并加入5.000 mol/L的KI溶液5 mL,用0.5000 mol/L Na2S2O3溶液滴定(),三次测定消耗Na2S2O3溶液的体积如下:则制得铁黄的纯度为__________。
2023届高三化学高考备考一轮复习专题训练:化学反应原理综合题(word版含答案)

2023届高三化学高考备考一轮复习专题训练:化学反应原理综合题1.(2022·山东·泰安一中高三期末)如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。
将直流电源接通后,F极附近呈红色。
请回答:(1)B极是电源的_______极。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为_______。
(3)现用丙装置给铜件镀银,则H应该是_______(填“镀层金属”或“镀件”),电镀液是_______溶液;当乙中溶液的c(OH-)=0.1 mol·L-1时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为_______,甲中溶液的pH_______(填“变大”“变小”或“不变”)。
(4)若将E电极换为铁,其它装置都不变,则乙中发生总反应的离子方程式是_______。
(5)通电一段时间后,需向甲中加入49 g Cu(OH)2固体才能使电解质溶液复原,则这段时间内,整个电路中转移的电子数为_______。
2.(2022·四川达州·高三期末)煤燃烧产生的SO2是形成酸雨的重要原因之一,工业上可采用多种方法减少SO2的排放。
回答下列问题:(1)H2还原法:已知:2H2S(g)+SO2(g)=3S(s)+2H2O(1) △H=akJ·mol-1H2S(g)=H2(g)+S(s) △H=bkJ·mol-1H2O(l)=H2O(g) △H=ckJ·mol-1SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式_______。
(2)碘循环法:其循环过程如图所示A为_______(填化学式),在整个循环系统中做催化剂的物质是_______。
(3)钠碱循环法:1mol/L的Na2SO3溶液作为吸收液来吸收尾气SO2。
2022届高三化学一轮化学反应原理题型必练—1化学反应原理综合题

Fe(OH)2++H2O +H+K2
+H2O Fe(OH)3+H+K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是___________。
(3)配制FeCl3溶液时,常将FeCl3晶体溶于浓盐酸中,使用时加蒸馏水稀释至指定浓度。
某同学误将FeCl3直接放入自来水(含有Mg2+、Ca2+、 、Cl-等杂质离子)中,看到红褐色沉淀和大量气泡,试解释出现该现象的原因___________(用离子方程式表示)。
(5)在373K,p 条件下,将含有H2O(g)的CO2(g)通过NaHCO3(s),计算:为避免NaHCO3(s)分解,气流中水的摩尔分数________。
(6)CO2(g)是温室气体,焙烧CaCO3(s)时产生过程有两种:
①CaCO3(s)热分解制生石灰,不同温度下的分解压力即CO2的平衡压力示于下表。由CaCO3(s)烧制生石灰时,若窑中气体不与外界对流,则窑温至少应维持多少度________?
③为了除去CuCl2溶液中含有的少量FeCl2,可以用___________(填化学式,写出一种即可)将FeCl2氧化为FeCl3,然后通过加入___________(填化学式,出一种即可)调控溶液pH值,使___________<pH<___________,将FeCl3转化为Fe(OH)3除去。
5.研究氮的循环和转化对生产、生活有重要的价值。
Ⅰ.氨是重要的化工原料。某工厂用氨制硝酸和铵盐ቤተ መጻሕፍቲ ባይዱ流程如图所示。
(1)设备1中发生反应的化学方程式是__,设备2中通入的物质A是__。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020届高三化学一轮复习《化学反应原理》专题练习卷1.[2018海南卷]过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成.医疗消毒等领域。
回答下列问题:(1)已知:H2(g)+12错误!未找到引用源。
O2(g)=H2O(l) △H1=-286 kJ·mol¯1H2(g)+O2(g)=H2O2(l) △H2=-188 kJ·mol¯1过氧化氢分解反应2H2O2(l)=2H2O(l)+O2(g)的△H=______kJ·mol¯1。
不同温度下过氧化氢分解反应的平衡常数K(313K)_____K(298K) (填大于、小于或等于)。
(2)100℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:离子加入量(mg·L¯1) 分解率% 离子加入量(mg·L¯1)分解率%无0 2 Fe3+ 1.0 15Al3+10 2 Cu2+0.1 86Zn2+10 10 Cr3+0.1 96 由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是_______。
贮运过氧化氢时,可选用的容器材质为_________(填标号)。
A.不锈钢 B.纯铝 C.黄铜 D.铸铁(3)过氧化氢的Ka1=2.24×10¯12,H2O2的酸性________H2O (填大于、小于或等于)。
研究表明,过氧化氢溶液中HO2-的浓度越大,过氧化氢的分解速率越快。
常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。
一定浓度的过氧化氢,pH增大分解率增大的原因是___________________:相同pH下,过氧化氢浓度越大分解率越低的原因是__________________________________________。
【答案】(1)-196 小于(2)Cr3+ B(3)大于 pH升高,c()增大,分解速率加快 H2O2浓度越大,其电离度越小,分解率越小2.[2018北京卷]近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。
过程如下:(1)反应Ⅰ:2H2SO4(l)2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1反应Ⅲ:S(s)+O2(g)SO2(g) ΔH3=-297 kJ·mol-1反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。
将ii补充完整。
i.SO2+4I-+4H +S↓+2I2+2H2Oii.I2+2H2O+__________________+_______+2 I-(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。
(已知:I2易溶解在KI溶液中)序号 A B C D试剂组成0.4 mol·L-1 KI a mol·L-1 KI0.2 mol·L-1 H2SO40.2 mol·L-1 H2SO40.2 mol·L-1 KI0.0002 mol I2实验现象溶液变黄,一段时间后出现浑浊溶液变黄,出现浑浊较A快无明显现象溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
【答案】(1)3SO 2(g)+2H2O (g)2H2SO4(l)+S(s) ΔH2=−254kJ·mol−1(2)> 反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,H2SO4的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大(3)SO2 SO42− 4H+(4)0.4 I−是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率反应ii比i快;D中由反应ii产生的H+使反应i加快3.[2018天津卷]CO2是一种廉价的碳资源,其综合利用具有重要意义。
回答下列问题:(1)CO2可以被NaOH溶液捕获。
若所得溶液pH=13,CO2主要转化为______(写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液pH=______。
(室温下,H2CO3的K1=4×10−7;K2=5×10−11)(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)①已知上述反应中相关的化学键键能数据如下:化学键C—H C=O H—H C O(CO)键能/kJ·mol−1413 745 436 1075 则该反应的ΔH=_________。
分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。
两容器中反应达平衡后放出或吸收的热量较多的是_______(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。
此反应优选温度为900℃的原因是________。
(3)O2辅助的Al~CO2电池工作原理如图4所示。
该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O 2+6e−6O2−6CO 2+6O2−3C2O42−反应过程中O2的作用是________。
该电池的总反应式:________。
【答案】(1)CO32- 10(2)+120 kJ·mol-1 B 900 ℃时,合成气产率已经较高,再升高温度产率增幅不大,但能耗升高,经济效益降低(3)Al–3e–=Al3+(或2Al–6e–=2Al3+)催化剂 2Al+6CO2=Al2(C2O4)34.[2019江苏] CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。
CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
①写出400~600 ℃范围内分解反应的化学方程式:▲ 。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是▲ 。
(2)电解法转化CO2可实现CO2资源化利用。
电解CO2制HCOOH的原理示意图如下。
①写出阴极CO 2还原为HCOO −的电极反应式: ▲ 。
②电解一段时间后,阳极区的KHCO 3溶液浓度降低,其原因是 ▲ 。
(3)CO 2催化加氢合成二甲醚是一种CO 2转化方法,其过程中主要发生下列反应:反应Ⅰ:CO 2(g)+H 2(g)CO(g)+H 2O(g) ΔH =41.2 kJ·mol −1反应Ⅱ:2CO 2(g)+6H 2(g)CH 3OCH 3(g)+3H 2O(g) ΔH =﹣122.5 kJ·mol −1在恒压、CO 2和H 2的起始量一定的条件下,CO 2平衡转化率和平衡时CH 3OCH 3的选择性随温度的变化如图。
其中:CH 3OCH 3的选择性=332CH OCH C 2O 的物质的量反应的的物质的量×100%①温度高于300 ℃,CO 2平衡转化率随温度升高而上升的原因是 ▲ 。
②220 ℃时,在催化剂作用下CO 2与H 2反应一段时间后,测得CH 3OCH 3的选择性为48%(图中A 点)。
不改变反应时间和温度,一定能提高CH 3OCH 3选择性的措施有 ▲ 。
【答案】(1)①CaC 2O 4400~600℃CaCO 3+CO ↑②CaC 2O 4·H 2O 热分解放出更多的气体,制得的CaO 更加疏松多孔 (2)①CO 2+H ++2e−HCOO −或CO 2+3HCO -+2e−HCOO −+23CO -②阳极产生O 2,pH 减小,3HCO -浓度降低;K +部分迁移至阴极区(3)①反应Ⅰ的ΔH >0,反应Ⅱ的ΔH <0,温度升高使CO 2转化为CO 的平衡转化率上升,使CO 2转化为CH 3OCH 3的平衡转化率下降,且上升幅度超过下降幅度 ②增大压强,使用对反应Ⅱ催化活性更高的催化剂5.[2019北京]氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为H 2和CO 2,其物质的量之比为4∶1,甲烷和水蒸气反应的方程式是______________。
②已知反应器中还存在如下反应: i.CH 4(g)+H 2O(g)CO(g)+3H 2(g) ΔH 1 ii.CO(g)+H 2O(g)CO 2(g)+H 2(g) ΔH 2iii.CH 4(g)C(s)+2H 2(g) ΔH 3……iii 为积炭反应,利用ΔH 1和ΔH 2计算ΔH 3时,还需要利用__________反应的ΔH 。
③反应物投料比采用n (H 2O )∶n (CH 4)=4∶1,大于初始反应的化学计量数之比,目的是________________(选填字母序号)。
a.促进CH 4转化b.促进CO 转化为CO 2c.减少积炭生成④用CaO 可以去除CO 2。
H 2体积分数和CaO 消耗率随时间变化关系如下图所示。
从t 1时开始,H 2体积分数显著降低,单位时间CaO 消耗率_______(填“升高”“降低”或“不变”)。
此时CaO 消耗率约为35%,但已失效,结合化学方程式解释原因:____________________________。
(2)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。
通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接_______________。
产生H2的电极反应式是_______________。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:________________________。
【答案】(1)①CH4+2H2O4H2+CO2②C(s)+2H2O(g)CO2(g)+2H2(g)或C(s)+ CO2(g)2CO(g)③a b c④降低 CaO+ CO2CaCO3,CaCO3覆盖在CaO表面,减少了CO2与CaO的接触面积(2)①K1 2H2O+2e-H2↑+2OH-③制H2时,电极3发生反应:Ni(OH)2+ OH--e-NiOOH+H2O。
