第八章 表面现象与分散系统 - 上课资料
合集下载
《物理化学简明教程》(第四版)印永嘉 第八章 表面现象与分散系统
下一内容
回主目录
返回
2016/2/26
第八章 表面现象与分散系统
上一内容
下一内容
回主目录
返回
2016/2/26
第八章 表面现象与分散系统
上一内容
下一内容
回主目录
返回
2016/2/26
第八章 表面现象与分散系统
上一内容
下一内容
回主目录
返回
2016/2/26
(一) 表面现象
• 吸附热为负值。吸附过程是一个放热过程。
上一内容
下一内容
回主目录
返回
2016/2/26
8.3 气体在固体表面上的吸附
• ③ 吸附等温线
• 图8.8 几种类型的吸附等温线
上一内容 下一内容 回主目录
返回
2016/2/26
2 朗格缪尔单分子层吸附等温式
• 1916年,朗格缪尔(Langmuir)提出个气固吸 附理论。其基本假定是: • l.吸附是单分子层的。 • 2.吸附分子之间无相互作用力。
8.1 表面吉布斯函数与表面张力 界面是指两相接触的约几个分子厚度的过渡区, 若其中一相为气体,这种界面通常称为表面。 严格讲表面应是液体和固体与其饱和蒸气之间
的界面,但习惯上把液体或固体与空气的界面称为
液体或固体的表面。
上一内容
下一内容
回主目录
返回
2016/2/26
8.1 表面吉布斯函数与表面张力
上一内容 下一内容 回主目录
返回
2016/2/26
3 BET多分子层吸附等温式
• 在朗格缪尔吸附理论的基础上,1938年勃劳纳 尔(Brunauer)、爱密特(Emmett)和泰勒 (Te11er)三人提出了多分子层的气固吸附理 论,导出了BET公式:
物理化学课件:第八章 表面现象

第一节 表面积与表面Gibbs能
比表面(specific surface area)
比表面:指单位质量(或单位体积)的物质所具有的表面积 有两种常用的表示方法:
as
A; m
aV
A V
式中,m 和 V 分别为物质的质量和体积,As为其表面 积。本章的研究对象即是具有巨大比表面积的系统。
液例滴8-1为:球分形割,半试径计为算r的分液割滴后,的使液成滴为总半表径面积r1 A11和r0 原的液小滴液表滴面,积若 A之比。
Tricor (非诺贝特 )
Triglide (非诺贝特 )
降血脂,纳米晶2004.12 NanoCrystal
FDA批准
technology
(Elan/Abbot)
降血脂,纳米晶
NanoCrystal technology
达到nm级的超细微粒,具有巨大的比表面积,因而具有许 多独特的表面效应。
界面现象的本质
克服附加压力Δp所作 的功等于可逆增加表面积 的Gibbs能
ΔG = ΔpdV = dAຫໍສະໝຸດ ΔppgR'
ΔpdV = dA
R ' r dr
V 4 r3,
3
A 4r 2 ,
所以 dV 4r 2dr 所以 dA 8rdr
代入得: p 2
r
球形曲面
Δp
pg
R'
dr
附加压力的大小与曲率半径和液体的表面张力有关
(3)凹液面的曲率半径为负值,因此附加压力也是负值, 凹液面下的液体受到的压力比平液面下的液体受到的压力小。
什么时候考虑Δp? – 依据粒子尺度
室温下小水滴:r=1mm, Δp=200 Pa
r=10nm, Δp=145 atm 当颗粒半径可以用mm描述时,可忽略Δp; 当颗粒半径小至纳米级时,由于Δp巨大,颗粒许多性 质发生改变,与普通液体和固体不同,需考虑Δp 。
08 表面现象与分散系统

该理论假设如下: 固体表面是均匀的; 吸附靠分子间力,吸附可以是多分子层的 被吸附的气体分子间无相互作用力; 吸附与脱附建立起动态平衡。
Physical Chemistry
p 1 C 1 p * * V p p VmC VmC p
V—T、p下质量为m的吸附剂吸附达平衡时吸附气体的体积; Vm—T、p下质量为m的吸附剂盖满一层时吸附气体的体积;
Physical Chemistry
8.表面现象与分散系统
Physical Chemistry
目录
(一)表面现象
§8.1 表面自由能与表面张力
§8.2 纯液体的表面现象 §8.3 气体在固体表面上的吸附 §8.4 溶液的表面吸附 §8.5 表面活性剂及其作用 §8.8 溶胶的电性质 §8.9 溶胶的聚沉和絮凝
RT ln( p p )
0 ' 0
r RT ln( p p )
0 ' r 0
r RT ln( pr' p ' )
8 rdr 2 p 2 4 r dr r
G r Vm ( pr p) Vm p
pr' 2 M ln ' p RTr
Physical Chemistry
§8.2 纯液体的表面现象
(1)附加压力 由于表面能的作用,任何液面都 有尽量紧缩而减小表面积的趋势。 如果液面是弯曲的,则这种紧缩 的趋势会对液面产生附加的压力。
p ' p p
当活塞的位置向下作一无限小的移动时,则有
p ' dV pdV pdV
a kbp
2.当气体压力很大时,bp>>1,得
ak
Physical Chemistry
p 1 C 1 p * * V p p VmC VmC p
V—T、p下质量为m的吸附剂吸附达平衡时吸附气体的体积; Vm—T、p下质量为m的吸附剂盖满一层时吸附气体的体积;
Physical Chemistry
8.表面现象与分散系统
Physical Chemistry
目录
(一)表面现象
§8.1 表面自由能与表面张力
§8.2 纯液体的表面现象 §8.3 气体在固体表面上的吸附 §8.4 溶液的表面吸附 §8.5 表面活性剂及其作用 §8.8 溶胶的电性质 §8.9 溶胶的聚沉和絮凝
RT ln( p p )
0 ' 0
r RT ln( p p )
0 ' r 0
r RT ln( pr' p ' )
8 rdr 2 p 2 4 r dr r
G r Vm ( pr p) Vm p
pr' 2 M ln ' p RTr
Physical Chemistry
§8.2 纯液体的表面现象
(1)附加压力 由于表面能的作用,任何液面都 有尽量紧缩而减小表面积的趋势。 如果液面是弯曲的,则这种紧缩 的趋势会对液面产生附加的压力。
p ' p p
当活塞的位置向下作一无限小的移动时,则有
p ' dV pdV pdV
a kbp
2.当气体压力很大时,bp>>1,得
ak
材料表界面课件 表面分散系统

1 103 109 1015 1021
比表面Av/(m2/m3) 6 ×102 6 ×103 6 ×105 6 ×107 6 ×109
第八章 表面现象及分散体系
从表上可以看出,当将边长为10-2m的立方体分割 成10-9m的小立方体时,比表面增长了一千万倍。
边长 l/cm
1 10-1 10-2 10-3 10-4(=1μm) 10-5 10-6
第八章 表面现象及分散体系
• 概述
✓界面(interface):是指两相紧密接触的约几 个分子层厚度的过渡区;
✓表面(surface):若两相接触的其中一相为气体, 这种界面通常称为表面。
严格讲,表面应是液体或固体与其饱和蒸气之 间的界面,但习惯上把液体或固体与空气的界面称 为其表面。
第八章 表面现象及分散体系
例如,Cu、Ag、Pt纳米团簇具有负的热容效 应。意味着系统能量增加时,其温度反而降低。
第八章 表面现象及分散体系
纳米晶体Fe的热容与粗粒Fe热容之比较
第八章 表面现象及分散体系
纳米材料的表面效应 纳米材料的表面效应是指纳米粒子的表面原子数与总
原子数之比随粒径的变小而急剧增大后所引起的性质上的 变化。
如果刺破线圈中央的液膜,线 圈内侧张力消失,外侧表面张力立 (b) 即将线圈绷成一个圆形,见(b)图, 清楚地显示出表面张力的存在。演 示
§8.1 表面自由能与表面张力
(a)
(b)
§8.1 表面自由能与表面张力
关于的几点说明: (1)的物理意义
比表面自由能:增加单位表面积引起系统 Gibbs 自由能的增量;或者单位表面积上的分子比 相同数量的内部分子“超额的”Gibbs自由能。
第八章 表面现象及分散体系
比表面Av/(m2/m3) 6 ×102 6 ×103 6 ×105 6 ×107 6 ×109
第八章 表面现象及分散体系
从表上可以看出,当将边长为10-2m的立方体分割 成10-9m的小立方体时,比表面增长了一千万倍。
边长 l/cm
1 10-1 10-2 10-3 10-4(=1μm) 10-5 10-6
第八章 表面现象及分散体系
• 概述
✓界面(interface):是指两相紧密接触的约几 个分子层厚度的过渡区;
✓表面(surface):若两相接触的其中一相为气体, 这种界面通常称为表面。
严格讲,表面应是液体或固体与其饱和蒸气之 间的界面,但习惯上把液体或固体与空气的界面称 为其表面。
第八章 表面现象及分散体系
例如,Cu、Ag、Pt纳米团簇具有负的热容效 应。意味着系统能量增加时,其温度反而降低。
第八章 表面现象及分散体系
纳米晶体Fe的热容与粗粒Fe热容之比较
第八章 表面现象及分散体系
纳米材料的表面效应 纳米材料的表面效应是指纳米粒子的表面原子数与总
原子数之比随粒径的变小而急剧增大后所引起的性质上的 变化。
如果刺破线圈中央的液膜,线 圈内侧张力消失,外侧表面张力立 (b) 即将线圈绷成一个圆形,见(b)图, 清楚地显示出表面张力的存在。演 示
§8.1 表面自由能与表面张力
(a)
(b)
§8.1 表面自由能与表面张力
关于的几点说明: (1)的物理意义
比表面自由能:增加单位表面积引起系统 Gibbs 自由能的增量;或者单位表面积上的分子比 相同数量的内部分子“超额的”Gibbs自由能。
第八章 表面现象及分散体系
第8章 A2 表面现象与分散系统

用超显微镜可以观察到溶 胶粒子不断地作不规则“之” 字形的运动,从而能够测出在 一定时间内粒子的平均位移。
通过大量观察,得出结论: 粒子越小,布朗运动越激烈。 其运动激烈的程度不随时间 而改变,但随温度的升高而 增加。
b.1905年和1906年 爱因斯坦 (Einstein)和斯莫 鲁霍夫斯基(Smoluchowski)
认为Brown运动是分散介质 分子热运动的必然结果,分子 以不同大小和不同方向的力对 胶体粒子不断撞击而产生的,由于受到的力不平衡,所 以连续以不同方向、不同速度作不规则运动。
随着粒子增大,撞击的次数增多,而作用力抵消的可 能性亦大。当半径大于~5um,Brown运动消失。
3. 扩散
在有浓度梯度存在时,物质粒子因热运动(布朗运动) 而发生宏观上的定向迁移现象(即由高浓度处向低浓度处 移动),称为扩散。
先将体系抽真空,然后适当 加热管2和管4,使钠和苯的蒸气 同时在管5 外壁凝聚。
除去管5中的液氮,凝聚在外
壁的混合蒸气融化,在管3中获 得钠的苯溶胶。
2.溶胶的净化
(1).渗析法 (2).超过滤法
在制备溶胶的过程中,常生成一些多余的电解质, 如制备Fe(OH)3溶胶时生成的HCl。
少量电解质可以作为溶胶的稳定剂,但是过多的电 解质存在会使溶胶不稳定,容易聚沉,所以的大分子溶解在合适的溶剂,
一旦将溶剂蒸发,大分子化合物凝聚,再加入溶剂, 又可形成溶胶,亲液溶胶是热力学上稳定、可逆的体系, 是均相真溶液。
3.缔合胶体(也称为胶体电解质)
分散相 是由表面活性剂缔合形成的胶束,通常以水作为 分散介质。
胶束中表面活性剂亲油基团向里,亲水基团朝外, 分散相和分散介质间有较好的亲和性。是一种多相但热 力学上是稳定的体系。
通过大量观察,得出结论: 粒子越小,布朗运动越激烈。 其运动激烈的程度不随时间 而改变,但随温度的升高而 增加。
b.1905年和1906年 爱因斯坦 (Einstein)和斯莫 鲁霍夫斯基(Smoluchowski)
认为Brown运动是分散介质 分子热运动的必然结果,分子 以不同大小和不同方向的力对 胶体粒子不断撞击而产生的,由于受到的力不平衡,所 以连续以不同方向、不同速度作不规则运动。
随着粒子增大,撞击的次数增多,而作用力抵消的可 能性亦大。当半径大于~5um,Brown运动消失。
3. 扩散
在有浓度梯度存在时,物质粒子因热运动(布朗运动) 而发生宏观上的定向迁移现象(即由高浓度处向低浓度处 移动),称为扩散。
先将体系抽真空,然后适当 加热管2和管4,使钠和苯的蒸气 同时在管5 外壁凝聚。
除去管5中的液氮,凝聚在外
壁的混合蒸气融化,在管3中获 得钠的苯溶胶。
2.溶胶的净化
(1).渗析法 (2).超过滤法
在制备溶胶的过程中,常生成一些多余的电解质, 如制备Fe(OH)3溶胶时生成的HCl。
少量电解质可以作为溶胶的稳定剂,但是过多的电 解质存在会使溶胶不稳定,容易聚沉,所以的大分子溶解在合适的溶剂,
一旦将溶剂蒸发,大分子化合物凝聚,再加入溶剂, 又可形成溶胶,亲液溶胶是热力学上稳定、可逆的体系, 是均相真溶液。
3.缔合胶体(也称为胶体电解质)
分散相 是由表面活性剂缔合形成的胶束,通常以水作为 分散介质。
胶束中表面活性剂亲油基团向里,亲水基团朝外, 分散相和分散介质间有较好的亲和性。是一种多相但热 力学上是稳定的体系。
第八章 表面现象与分散系统(物理化学-印永嘉)资料

d (70 50) 103
p' p p即p p' p
p 8 rdr 2 4 r 2dr r
(拉普拉斯公式)
p 2
r
图 8.2 附加压力与曲率 半径的关系
空气中的液滴(凸液面): p' p p 液体中的气泡(凹液面): p' p p
液泡(有内外两个表面):p 4
一定温度下,吸附分子在固体表面上所占面积占表面总 面积的分数称为覆盖度,用θ表示。
吸附速率 rads k1(1 ) p
脱附速率 rd k2
吸附平衡时, k1(1 ) p k2
k1 p bp , 其中b 源自k1k2 k1 p 1 bp
k2
a k kbp (朗格缪尔单分子层吸附 等温式)
溶质在表面层浓度小于本 体浓度,称为负吸附;溶质在 表面层浓度大于本体浓度,称 为正吸附。
图8.8 溶液浓度对表面张力的影响
2. 吉布斯吸附公式
c d
RT dc
式中称为 表面吸附量。定义:单位面积的表面层所含溶质物
质的量比同量溶剂在本体溶液中所含溶质的物质的量的超出值。
当 d 0;则 0,发生负吸附
r
2. 曲率对蒸气压的影响
小液滴内液体的压力 pr p p
图8.3 平面液体与小液滴
G r Vm ( pr p)
Vmp
r
RT
ln(
p' r
)
p
RT ln( p' )
p
r
RT
ln(
pr' p'
)
物理化学(第五版) 演示文稿8-7 分散系统的分类

均相分散系统 大分子溶液(亲液胶体)
分散 系统
缔合胶束溶液(缔合胶体) 胶体分
微乳状液
散系统
非均相分散系统
溶胶(憎液胶体)
粗分散系统
(乳状液、泡沫、悬浮液及悬浮体)
小分子溶液、电解质溶液的分散质质点大小为1 nm以下,且透 明,不发生散射现象,溶质扩散速度快,是热力学稳定系统。
3
胶体分散系统及粗分散系统的分类
气
固
固体泡沫 沸石、泡沫玻璃、泡沫金属
液
固
凝胶
珍珠
固
固
固溶胶
加颜料的塑料
液
气
气溶胶
雾
固
气
悬浮体
烟、尘、沙尘暴、霾
5
3.胶体分散系统及粗分散系统研究的对象
分散质可以是一种物质也可以是多种物质,可以是 由许许多多的原子或分子(通常是103~109个) 组成的 粒子,也可以是一个大分子,只要它们至少有一维 空间的尺寸(即线尺寸)在1~1000 nm、并分散于分散 介质之中,即构成胶体分散系统。
➢按分散质的质点大小分类 胶体分散系统 分散质的质点大小在 1~1000 nm (10-9~10-6 m)
粗分散系统 分散相的质点大小超过 1 µm (10-6 m)
4
➢按分散相及分散介质的聚集态分类
非均相分散系统的分类
分散相 分散介质
通称
举例
气
液
泡沫
肥皂及灭火泡沫
液
液
乳状液
牛奶及含水原油
固
液 溶胶或悬浮液 银溶胶、油墨、泥浆、钻井液
7
胶体分散系统包括:溶胶、缔合胶束溶液(胶体电解 质溶液)、大分子溶液及微乳状液。
6
大学物理化学课件 第八章 表面现象

W ' dA Fdx
Fdx (2l' dx)
F = •2l '
F 2l '
式中 为比例常数,是作用于液面上单位长度线段上的力,
即表面张力,单位是N·m-1。
表面吉布斯能和表面张力是完全等价的,具有等价的量 纲和相同的数值。
三、影响表面张力的因素
1. 组成表面的物质 物质内部的分子间引力引起表面吉布斯能,分子间作用力越大, 表面吉布斯能越大。
也就是单位表面积上的分子比 相同数量的内部分子“超额”吉布斯自由能,
因此σ称为“表面吉布斯自由能” 或简称为“表面能”
二、表面吉布斯能和表面张力 2. 表面张力 用肥皂液在一个系有线 圈的金属环上形成一个液膜, 由于线圈周围都是相同的液 体,受力均衡,线圈可以在 液膜上自由移动位置。
若将线圈内液膜刺破, 线圈两边受力不再平衡, 立即绷紧成圆形。
二、表面吉布斯能和表面张力
这些现象表明,在液体表面存在一种使液面 收缩的力,称表面张力(surface tension)或界面 张力(interfacial tension)。
表面张力的方向和表面相切, 是垂直作用在表面上单位长度线段上的表面收缩力。
二、表面吉布斯能和表面张力
在温度、压力恒定的条件下,在AB边施加向右的力F,使 AB在可逆的情况下向右移动dx。F和液膜表面边缘的长度l成 正比,因为液膜有正反两个表面,设AB = l′,则
表面功的大小和dA成正比
Байду номын сангаас
W = dA
为比例系数
根据热力学第二定律
d G T , p,nB δW 'r
所以:dGT ,P,nB dA 定义表面吉布斯能
G
A T , p,nB
Fdx (2l' dx)
F = •2l '
F 2l '
式中 为比例常数,是作用于液面上单位长度线段上的力,
即表面张力,单位是N·m-1。
表面吉布斯能和表面张力是完全等价的,具有等价的量 纲和相同的数值。
三、影响表面张力的因素
1. 组成表面的物质 物质内部的分子间引力引起表面吉布斯能,分子间作用力越大, 表面吉布斯能越大。
也就是单位表面积上的分子比 相同数量的内部分子“超额”吉布斯自由能,
因此σ称为“表面吉布斯自由能” 或简称为“表面能”
二、表面吉布斯能和表面张力 2. 表面张力 用肥皂液在一个系有线 圈的金属环上形成一个液膜, 由于线圈周围都是相同的液 体,受力均衡,线圈可以在 液膜上自由移动位置。
若将线圈内液膜刺破, 线圈两边受力不再平衡, 立即绷紧成圆形。
二、表面吉布斯能和表面张力
这些现象表明,在液体表面存在一种使液面 收缩的力,称表面张力(surface tension)或界面 张力(interfacial tension)。
表面张力的方向和表面相切, 是垂直作用在表面上单位长度线段上的表面收缩力。
二、表面吉布斯能和表面张力
在温度、压力恒定的条件下,在AB边施加向右的力F,使 AB在可逆的情况下向右移动dx。F和液膜表面边缘的长度l成 正比,因为液膜有正反两个表面,设AB = l′,则
表面功的大小和dA成正比
Байду номын сангаас
W = dA
为比例系数
根据热力学第二定律
d G T , p,nB δW 'r
所以:dGT ,P,nB dA 定义表面吉布斯能
G
A T , p,nB
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子倾向于钻入液体内部 ➢ 能量:
将一个内部分子移动到表面上,环境要克服不对称力
场而作功。 (表面分子) > (内部分子)
第八章
表面现象与分散系统
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
2. 表面功 ➢将内部分子移至表面,环境作功。
结果:(1)分子能量增加;(2)系统A↑,因此称“表面功” ➢ 定义:在等温等压定组成的条件下,可逆地增大系
气-液
HC2uO铁SO管4
溶液
Hg
气-固界面界面
液-液 固-固界面界面
玻璃板
第八章
表面现象与分散系统
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
一、表面功 (Surface work)
1. 表面分子的特殊性
蒸气
F≠0
➢受力:
内部分子:热运动不需要做功 液体
f=0
表面分子:不对称力场
表面分子与内部分子能量不同
20℃ /Nm-1
H2O(l) C6H6(l) CCl4(l) 0.0728 0.0289 0.0269
(H2O- C6H6) (H2O-CCl4)
0.0326 0.045
(G A)T,p,n
对一指定的液体, =f(T,p)
(2) T :T↑,l-g差异↓, ↓ (3) p:p↑, ↓
第八章
=F上dx (可逆)
= (2l)dx = dA
即 dA= dA
=
与: 意义和单位不同、数值和量纲相同的物理量
其他界面张力: s-g, l-l , s-l , s-s
第八章
表Байду номын сангаас现象与分散系统
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
影响表面张力的因素
(1)物质的种类及共存相的种类(性质)
A T , p,nB ,nC ,
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
表面张力 N m1
物理意义:在相界面的切面上, 垂直作用于表面上任意长度单位 切线的表面紧缩力。
第八章
表面现象与分散系统
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
表面张力与比表面能的关系
l 膜
dx
F
W´ = Fdx (环境作功)
U
A S ,V ,nB ,nC ,
dH TdS Vdp
BdnB dA
H
A S , p,nB ,nC ,
dA SdT pdV
BdnB dA
( A)
A T ,V ,nB ,nC ,
dG SdT Vdp BdnB dA
第八章
表面现象与分散系统
G
第八章
表面现象与分散系统
宁夏大学新华学院
8.2 纯液体的表面现象
二、曲率对蒸气压的影响-----Kelvin eq.
( )T: 1mol液体
p
p
p’
pr
p' p
pr p p
统的表面积时所作的非体积功 W´
➢ 计算:等T、p、组成时,可逆增大面积dA,则
第八章
W ' dA
比例系数
表面现象与分散系统
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
二、表面能 (Surface energy or Specific surface energy)
W ' dA dGT,P 比表面能 (G A)T,p,n J.m-2
表面现象与分散系统
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
例1: 20℃,p下,将1kg水分散成10-9m半径的小水滴需
做功多少?已知 =0.0728 Nm-1, =1000 kgm-3
解: Wr’ = A = (A2 – A1) A2 = n 4 r 2
而 1kg = n × ( 4/3r3 ) n = 2.4 1023个
第八章
表面现象与分散系统
宁夏大学新华学院
8.2 纯液体的表面现象
自由液滴或气泡通常为何都呈球形 ? 1、假若液滴具有不规则的形状,则在表面上的不同 部位曲面弯曲方向及其曲率不同,所具的附加压力的方 向和大小也不同,这种不平衡的力,必将迫使液滴呈现 球形
2、相同体积的物质,球形的表面积最小,则表面总的 Gibbs自由能最低,所以变成球状就最稳定
R越大,p越小;平面时R,p=0
注意:
1.不管是凸液面,还是凹液面,附加压力的方向总是指向球心,
即球内的压力一定大于球外的压力;
2. 液膜(肥皂泡)p=4/r
第八章
表面现象与分散系统
宁夏大学新华学院
8.2 纯液体的表面现象
p p
AB
p
P 0
AB
p
p p
p凸 p p
p p
AB
p p p凹 p p
➢ 的物理意义:定温定压组成不变的条件下,系统
增大1m2表面积时环境所作的表面功,即1m2表面上 的分子比同数量的内部分子多出的吉布斯自由能
第八章
表面现象与分散系统
宁夏大学新华学院
8.1 表面吉布斯函数与表面张力
在表面热力学中,W´为表面功
比表面Gibbs函数
dU TdS pdV
BdnB dA
Wr’ =310-3/r =218 kJ
第八章
表面现象与分散系统
宁夏大学新华学院
8.2 纯液体的表面现象
一、弯曲液面的附加压力
对活塞稍加压力,将毛细管内液体压出少许
p’ p p
使液滴体积增加dV
表面积增加dA
克服附加压力∆p所作的功等于 可逆增加表面积的Gibbs自由能
pdV dA
p
p
r
V 4r3
3
A 4 r 2
dV 4 r 2dr
2
dA 8rdr
p 拉普拉斯公式 r
第八章
表面现象与分散系统
宁夏大学新华学院
8.2 纯液体的表面现象
任意弯曲表面下的附加压力
杨-拉普拉斯(Young-Laplace)方程式
p ( 1 1 )
R1 R2
对于球面,R = R1 = R2
p 2
R
式中R:曲率半径
表面(界面)现象
第八章
表面现象与分散系统
宁夏大学新华学院
第八章 表面现象与分散系统
界面化学
Interface chemistry
研究相界面的物理化 学规律及体相与表相 的相互影响关系的一 门学科。
胶体化学
Colloid chemistry
研究具有巨大相界面 胶体分散体系物理化 学性质的一门科学。
➢ 实用性强 应用广泛
➢ 科研活跃
第八章
表面现象与分散系统
宁夏大学新华学院
表面和界面(Surface and interface)
界面是指两相接触的约几个分子厚度的过渡区。若其中
一相为气体,这种界面通常称为表面。
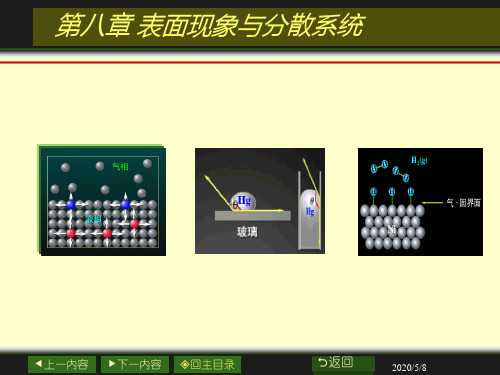
1.气-液界面 2.气-固界面 3.液-液界面 4.液-固界面 5.固-固界面
空气
Hg Cr镀层液-固界面
H2O
