高中有机化学方程式总结及高锰酸钾褪色超全
高中有机化学方程式总结

高中有机化学方程式总结高中有机化学方程式综述一、碳氢化合物甲烷烷烃通式:CnH2n-2 (1)氧化反应燃烧甲烷燃烧:CH4+2O2 CO2+2H2O甲烷不能使酸性高锰酸钾溶液和溴水变色。
(2)取代反应光线氯甲烷:CH4+Cl2 CH3Cl+HCl2.乙烯乙烯的制备:烯烃通式:(1)乙烯的氧化反应燃烧:乙烯会使酸性高锰酸钾溶液褪色并引起氧化反应。
(2)加成反应丙烯和溴水加成:丙烯和氢加成:丙烯和氯化氢加成:丙烯和水加成:(3)聚合反应丙烯加成聚合,3.1,3丁二烯向溴中加入1,3丁二烯:1:1加入1,3丁二烯:4。
乙炔乙炔的制备:(1)乙炔在氧化反应中的燃烧;乙炔会使酸性高锰酸钾溶液变色并引起氧化反应。
(2)加成反应和溴水添加:加入氢气;加入氯化氢;图2乙炔(3)聚合反应的制备丙烯加聚:5。
苯苯的同系物具有以下通式:(1)氧化反应苯的燃烧:(苯不能淡化溴水和酸性高锰酸钾溶液。
(2)取代反应①苯和溴反应(2)硝化反应高中化学方程式概述(第二部分),第2-1页,共6页(3)加成反应甲苯(1)氧化甲苯的燃烧:甲苯不能使溴水褪色,但能使酸性高锰酸钾溶液褪色。
(2)取代反应:与溴的反应甲苯硝化反应产生2,4,6-三硝基甲苯,简称三硝基甲苯,也称为三硝基甲苯,是一种淡黄色晶体,不溶于水。
它是一种烈性炸药,广泛用于国防、采矿等。
二。
碳氢化合物衍生物烃类衍生物的重要类别及主要化学性质:卤代烃类醇酚醛羧酸酯代表物质通式为R-X R-羟基溴乙烷C2H5Br乙醇C2H5OH苯酚-羟基乙醛O | | CH3-C-H分子结构特征C-X键具有极性,易断裂的C-O键和O-H 键具有极性;-羟基直接与链烃基相连-羟基直接与苯环相连。
碳氧双键具有极性,并具有不饱和的主要化学性质。
1.取代反应:用氢氧化钠溶液进行取代反应生成乙醇;2.消除反应:与强碱醇溶液共同加热生成烯烃。
1.与钠反应生成醇钠并释放氢气;2.氧化反应:O2:产生CO2和H2O;;氧化剂:产生乙醛;3.脱水反应:140℃;乙醚;170℃:乙烯;4.酯化反应。
(完整版)高中有机化学方程式总结
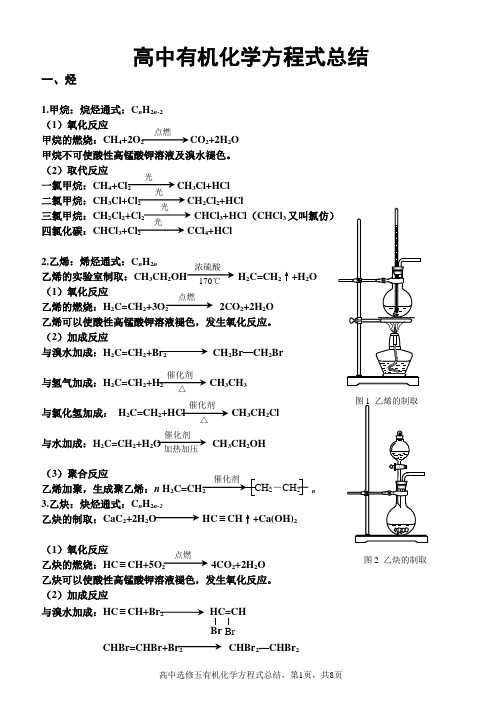
高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高锰酸钾褪色化学方程式

高锰酸钾褪色化学方程式
高锰酸钾(Potassium permanganate)褪色的化学方程式如下:
1. KMnO4 + 4HCl = KCl + MnCl2 + 2H2O + Cl2
2. KMnO4 + H2SO4 = K2SO4 + MnSO4 + Cl2 + H2O
3. KMnO4 + H3PO4 = K3PO4 + Mn3(PO4)2 + Cl2 + H2O
4. KMnO4 + HNO3 = KNO3 + Mn(NO3)2 + Cl2 + H2O
用高锰酸钾进行褪色实验是一种经常使用的技术。
高锰酸钾具有以下特点:
一、高效率:
高锰酸钾是一种物理氧化褪色剂,它对多种染料的褪色效果很理想。
如果高锰酸钾的浓度是一定的、水温控制在一定的范围内,则褪色的效率会比较高。
二、安全性:
高锰酸钾不使用任何危险的化学物质,它的氧化能力比氯酸小,可以
保证安全性。
三、稳定性:
高锰酸钾的稳定性非常好,它在空气中是稳定的,不易分解,而且易
于储存、操作、移动,可以长期保存,使用方便。
四、兼容性:
与混色型染料相比,高锰酸钾可以有效褪色配合染料中的蓝色成分。
此外,它还可以褪色经典、无机染料,并且与多种助剂和污染物兼容,不能褪色染料的残留物。
高锰酸钾的副作用也比较大。
它含有MnO4-离子,如果使用过量,会
对蛋白质、青贮蔬菜等食物形成氧化反应,产生不利影响,同时可能
会导致皮肤的刺激性和过敏性。
因此,在褪色实验中一定要注意使用量,以及希望获得最佳褪色效果的正确操作。
只有这样,才能有效地
保护环境和我们自身的健康。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 点燃光光 光光 浓硫酸 170℃ 高温催化剂△图1 乙烯的制取乙烯加聚,生成聚乙烯:n H 2 2 n3.乙炔乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2HC=CH B rCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl nCHn4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完整版)高中有机化学方程式总结

高中有机化学方程式总结一、烃1.甲烷:烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯:烯烃通式:C n H 2n乙烯的实验室制取:CH 3CH 2OH H 2C=CH 2↑+H 2O (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2 n3.乙炔:炔烃通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃ 点燃催化剂△催化剂加热加压 2-CH 2点燃图2 乙炔的制取Br 催化剂△与氢气加成:HC ≡CH+H 2 H 2C=CH2与氯化氢加成:HC ≡CH+HCl CH2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯:苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式总结
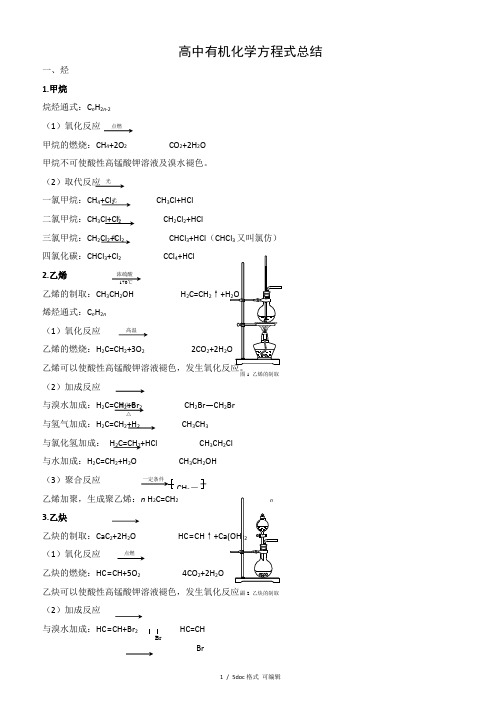
高中有机化学方程式总结一、烃1.甲烷烷烃通式:C n H 2n -2(1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑烯烃通式:C n H 2n(1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2(2)加成反应 与溴水加成:H 2C=CH 2+Br2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH 23.乙炔 乙炔的制取:CaC 2+2H 2O HC ≡CH ↑(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CHBr点燃光光光光浓硫酸170℃高温催化剂 △CH 2-图1 乙烯的制取点燃图2 乙炔的制取BrCHBr=CHBr+Br 2 CHBr2—CHBr 2 与氢气加成:HC ≡CH+H 2H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl nn4.苯苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(完整版)高中有机化学方程式总结(20200922155444)
高中有机化学方程式总结一、烃1. 烷烃—通式: C n H 2n-2( 1)氧化反应点燃①甲烷的燃烧: CH 4+2O 2CO 2+2H 2O ②甲烷不履行酸性高锰酸钾溶液及溴水褪色。
( 2)取代反应光一氯甲烷: CH 4+Cl 2CH 3Cl+HCl光二氯甲烷: CH 3Cl+Cl 2CH 2 Cl 2 +HCl光三氯甲烷: CH 2Cl 2+ClCHCl 3+HCl ( CHCl 3 又叫氯仿)2光四氯化碳: CHCl 3+Cl 2CCl 4+HCl( 3)分解反应高温CH 4 C+2H 2制得的 C 2H 4 中经常混有 2. 烯烃 —通式: C n H 2n 浓硫酸CO 、CO 、 SO 等气体22乙烯的制取: CH 3CH 2OH 170℃H 2C=CH 2↑ +H 2O( 1)氧化反应点燃①乙烯的燃烧: H 2C=CH 2 +3O 22CO 2+2H 2O②乙烯能够使酸性高锰酸钾溶液褪色,发生氧化反应。
( 2)加成反应与溴水加成: H 2 C=CH 2+Br 2 CH 2Br — CH 2 Br与氢气加成: H 2 C=CH 2+H 2催化剂△CH 3CH 3与氯化氢加成:H 2C=CH 2 +HCl催化剂CH 3CH 2Cl△催化剂溴的 CCl 4 可用于 鉴别烯烃和烷烃, 也可用于除掉烷烃中混有的烯烃。
图 1 乙烯的制取与水加成: H 2C=CH 2+H 2O 加热加压 CH 3CH 2OH( 3)聚合反应催化剂乙烯加聚,生成聚乙烯: n H 2C=CH 2CH 2- CH 2 n3. 炔烃 —通式: C n H 2n-2电石中含有的 CaS 与水 乙炔的制取: CaC 2+2H 2OHC CH ↑ +Ca(OH)2反应会生成 H 2S ,可用 ( 1)氧化反应点燃CuSO 4 或 NaOH 溶液将①乙炔的燃烧: HCCH+5O 2222 除掉4CO H S+2H O②乙炔能够使酸性高锰酸钾溶液褪色,发生氧化反应。
(完美版)高中有机化学方程式总结
(完美版)高中有机化学方程式总结高中有机化学方程式总结一、烃1.甲烷烷烃通式:C n H2n-2(1)氧化反应甲烷的燃烧:CH4+2O2 CO2+2H2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH4+Cl2 CH3Cl+HCl二氯甲烷:CH3Cl+Cl2 CH2Cl2+HCl三氯甲烷:CH2Cl2+Cl2 CHCl3+HCl(CHCl3又叫氯仿)四氯化碳:CHCl3+Cl2 CCl4+HCl2.乙烯乙烯的制取:CH3CH2OH H2C=CH2↑+H2O烯烃通式:C n H2n(1)氧化反应乙烯的燃烧:H2C=CH2+3O2 2CO2+2H2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H2C=CH2+Br2 CH2Br—CH2Br与氢气加成:H2C=CH2+H2 CH3CH3与氯化氢加成: H2C=CH2+HCl CH3CH2Cl与水加成:H2C=CH2+H2O CH3CH2OHCH2-CH2(3)聚合反应乙烯加聚,生成聚乙烯:n H2C=CH2 n3.乙炔乙炔的制取:CaC 2+2H 2O HC CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC CH+Br 2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC CH+H 2 H 2C=CH 2 Cl与氯化氢加成:HC CH+HCl CH 2=CHClCH 2—CH(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH2=CHCl nCH=CH乙炔加聚,得到聚乙炔:n HC CH n4.苯苯的同系物通式:C n H 2n-6(1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
(2)取代反应 ①苯与溴反应(溴苯)②硝化反应+HO —NO 2 +H 2O (硝基苯)(3)加成反应 (环己烷)。
有机化学方程式和高中有机化学方程式总结
让我发疯的有机化学方程式和高中有机化学方程式总结一、各类化合物的辨别方式1.烯烃、二烯、炔烃:(1)溴的四氯化碳溶液,红色腿去(2)高锰酸钾溶液,紫色腿去。
2.含有炔氢的炔烃:(1)硝酸银,生成炔化银白色沉淀(2)氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
3.小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色4.卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
5.醇:(1)与金属钠反应放出氢气(鉴别6个碳原子以下的醇);(2)用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
6.酚或烯醇类化合物:(1)用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
(2)苯酚与溴水生成三溴苯酚白色沉淀。
7.羰基化合物:(1)鉴别所有的醛酮:2,4-二硝基苯肼,产生黄色或橙红色沉淀;(2)区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;(3)区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;(4)鉴别甲基酮和具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
8.甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能。
9.胺:区别伯、仲、叔胺有两种方法(1)用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。
(2)用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应。
芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体。
10.糖:(1)单糖都能与托伦试剂和斐林试剂作用,产生银镜或砖红色沉淀;(2)葡萄糖与果糖:用溴水可区别葡萄糖与果糖,葡萄糖能使溴水褪色,而果糖不能。
(3)麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能。
二、例题解析例1.用化学方式辨别丁烷、1-丁炔、2-丁炔。
(完整版)高中有机化学方程式总结
高中有机化学方程式总结一、烃1. 烷烃 -通式:C n H 2n —2(1)氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O ②甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl(CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl (3)分解反应 CH 4 C+2H 2 2。
烯烃 —通式:C n H 2n乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O(1)氧化反应①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应乙烯加聚,生成聚乙烯:n H 2n3. 炔烃 —通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡(1)氧化反应 ①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2(2)加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2-CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl 点燃光光光光浓硫酸 170℃点燃催化剂 △催化剂加热加压 2-CH 2点燃图2 乙炔的制取催化剂 △催化剂Br 催化剂 △高温(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2=CHCl n乙炔加聚,得到聚乙炔:n HC CH n4. 苯 C 6H 6(1)氧化反应①苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O ②苯不能使溴水和酸性高锰酸钾溶液褪色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溴水与高锰酸钾溶液在有机化学中常用来作为检验一些有机物的试剂,反应以溶液中颜色变化来鉴定或鉴别某些有机物。
(1)能使溴水褪色或变色的物质及有关化学反应原理分别为:①烯烃、炔烃、二烯烃等不饱与烃类及其不饱与烃的衍生物反应,使溴水褪色CH2=CH2+Br2——→CH2Br-CH2BrCH≡CH+Br2——→CHBr=CHBr(或CH≡CH+2Br2——→CHBr2-CHBr2CH2=CH-CH=CH2+Br2——→CH2Br-CH=CH-CH2Br(或CH2=CH-CH=CH2+Br2——→CH2Br-CHBr-CH=CH2)②与苯酚反应生成白色沉淀图1③与醛类等有醛基的物质反应,使溴水褪色CH3CHO+Br2+H2O=CH3COOH+2HBr④因萃取作用使溴水褪色,有机溶剂溶解溴呈橙色(或棕红色)。
(1)密度大于1的溶剂(四氯化碳、氯仿、溴苯、二硫化碳等);(2)密度小于1的溶剂(液态的饱与烃、直馏汽油、苯及其同系物、液态环烷烃、液态饱与酯)。
⑤与碱性溶液(如NaOH溶液、Na2CO3溶液等)反应,使溴水褪色。
Br2+2NaOH=NaBr+NaBrO+H2O(或3Br2+6NaOH=5NaBr+NaBrO3+3H2O)Br2+Na2CO3=NaBr+NaBrO+CO2⑥与较强的无机还原剂(如H2S、SO2、KI与FeSO4等)发生反应,使溴水褪色。
Br2+H2S=2HBr+S↓(浅黄色沉淀)Br2+SO2+2H2O=2HBr+H2SO43Br2+6FeSO4=2Fe2(SO4)3+2FeBr3Br2+2KI=2KBr+I2(溶液变为棕色)⑦其它:石油产品(裂化气、裂解气、裂化石油等);天然橡胶等。
(2)能使高锰酸钾溶液褪色的物质及有关化学反应原理分别为:①与烯烃、炔烃、二烯烃等不饱与烃类及不饱与烃的衍生物反应,使高锰酸钾溶液褪色;与苯的同系物(甲苯、乙苯、二甲苯等)反应,使酸性高锰酸钾溶液褪色。
②与部分醇羟基、酚羟基(如苯酚)发生氧化还原反应,使高锰酸钾溶液褪色③与醛类等有醛基的有机物(如醛、甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等)发生氧化还原反应,使高锰酸钾溶液褪色④与具有还原性的无机还原剂(如H2S、SO2、FeSO4、KI、HCl等)反应,使高锰酸钾溶液褪色。
光照 光照 光照 光照 高温 CaO △催化剂 加热、加压催化剂 △ 催化剂⑤石油产品(裂化气、裂解气、裂化石油等);天然橡胶等。
(3)归纳“既使高锰酸钾溶液褪色,又使溴水褪色的物质”包括:既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的物质包括分子结构中有C=C 双键、C≡叁键、醛基(—CHO)的有机物;苯酚与无机还原剂。
苯的同系物只能使其中的酸性高锰酸钾溶液褪色;有机萃取剂只能使其中的溴水褪色。
有此可见:烃类有机物的鉴别最常用的试剂就是酸性高锰酸钾溶液与溴水,烃的衍生物的鉴别往往避免使用酸性高锰酸钾溶液与溴水,一般就是利用各官能团的特征反应。
1、 CH 4 + Cl 2 CH 3Cl + HCl2、 CH 3Cl + Cl 2 CH 2Cl 2 + HCl3、 CH 2Cl + Cl 2 CHCl 3 + HCl4、 CHCl 3 + Cl 2 CCl 4+ HCl5、 CH 4 C +2H 26、 C 16H 34 C 8H 18 + C 8H 167、 CH 3COONa + NaOH CH 4↑+ Na 2CO 38、 CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9、 CH 2 = CH 3CH 2OH10、 CH 2 3—CH 2Br 11、 CH 2 —CH 3 12、 nCH 2 CH 2 ] n 13、 nCH 2 [CH 2-CH=CH-CH 2] n14、 2CH 23CHO15、 CH ≡CH + Br 2 CHBr = CHBr16、 CHBr = CHBr+ Br 2 CHBr 2-CHBr 217、 CH ≡CH + HCl H 2C = CHCl 18、 nCH 2 = CH [ CH 2-CH ] nCl Cl19、 CH ≡CH + H 2O CH 3CHO醇△催化剂△浓硫酸170℃浓硫酸140℃△催化剂△20、CaC2 + 2H2O CH≡CH↑+ Ca(OH)22122NO2 +H2O23SO3H+H2O24.+ 3H225-NO2O26、3CH≡27、CH3CH228、CH3CH229、CH3CH2Br+ NaOH CH2 = CH2 + NaBr +H2O30、2CH3CH2OH+2Na 2CH3CH2ONa + H2↑31、2CH3CH2OH+O2 2CH3CHO + 2H2O32、CH3CH2OH CH2 = CH2↑+ H2O33、C2H5OH+C2H5OH C2H5OC2H5+H2O34ONa+H2O35OH+H2O O-+H3O+36ONa+H2OH+ NaHCO337. 238、CH339、2CH340、CH33COONH4+2Ag↓+3NH3+H2O催化剂催化剂 催化剂 催化剂 催化剂 △ 催化剂加热、加压41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O42、 2CH 3COOH+2Na 2CH 3COONa+H 2↑43、2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44、 CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45、 CH 3COOH + NaOH CH 3COONa + H 2O46、 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O47、CH 3COOH+CH 3CH 23COOCH 2CH 3 +H 2O 48、 CH 3COOCH 2CH 3COONa+CH 3CH 2OH49、 nOHCH 2CH 2COO H → [ OCH 2CH 2C ] n +H 2O50、 C 6H 12O 6 (s) + 6O 2 (g) 6CO 2 (g) + 6H 2O (l)51、 C 6H 12O 6 2CH 3CH 2OH + 2CO 252、 C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6蔗糖 葡萄糖 果糖53、 C 12H 22O 11 + H 2O 2C 6H 12O 6麦芽唐 葡萄糖54、 (C 6H 10O 5)n + nH 2O n C 6H 12O 6淀粉 葡萄糖55、 (C 6H 10O 5)n + nH 2O n C 6H 12O 6 纤维素 葡萄糖 56、C 17H 33COO-CH 2 C 17H 35COO-CH 2C 17H 33COO-CH +3H 2 C 17H 35COO-CHC 17H 33COO-CH 2 C 17H 35COO-CH 257、 C 17H 35COO-CH 2 CH 2-OH(1)、实验室制乙烯(170℃) (2)、蒸馏(3)、固体溶解度的测定(4)、乙酸乙酯的水解(70-80℃) (5)、中与热的测定(6)制硝基苯(50-60℃)〔说明〕:(1)凡需要准确控制温度者均需用温度计。
(2)注意温度计水银球的位置。
3.能与Na反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有:醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
5.能使高锰酸钾酸性溶液褪色的物质有:(1)含有碳碳双键、碳碳叁键的烃与烃的衍生物、苯的同系物(2)含有羟基的化合物如醇与酚类物质(3)含有醛基的化合物(4)具有还原性的无机物(如SO2、FeSO4、KI、HCl、H2O2等)6.能使溴水褪色的物质有:(1)含有碳碳双键与碳碳叁键的烃与烃的衍生物(加成)(2)苯酚等酚类物质(取代)(3)含醛基物质(氧化)(4)碱性物质(如NaOH、Na2CO3)(氧化还原――歧化反应)(5)较强的无机还原剂(如SO2、KI、FeSO4等)(氧化)(6)有机溶剂(如苯与苯的同系物、四氯甲烷、汽油、已烷等,属于萃取,使水层褪色而有机层呈橙红色。
)7.密度比水大的液体有机物有:溴乙烷、溴苯、硝基苯、四氯化碳等。
8、密度比水小的液体有机物有:烃、大多数酯、一氯烷烃。
9.能发生水解反应的物质有卤代烃、酯(油脂)、二糖、多糖、蛋白质(肽)、盐。
10.不溶于水的有机物有:烃、卤代烃、酯、淀粉、纤维素11.常温下为气体的有机物有:分子中含有碳原子数小于或等于4的烃(新戊烷例外)、一氯甲烷、甲醛。
12.浓硫酸、加热条件下发生的反应有:苯及苯的同系物的硝化、磺化、醇的脱水反应、酯化反应、纤维素的水解13.能被氧化的物质有:含有碳碳双键或碳碳叁键的不饱与化合物(KMnO4)、苯的同系物、醇、醛、酚。
大多数有机物都可以燃烧,燃烧都就是被氧气氧化。
14.显酸性的有机物有:含有酚羟基与羧基的化合物。
15.能使蛋白质变性的物质有:强酸、强碱、重金属盐、甲醛、苯酚、强氧化剂、浓的酒精、双氧水、碘酒、三氯乙酸等。
16.既能与酸又能与碱反应的有机物:具有酸、碱双官能团的有机物(氨基酸、蛋白质等)17.能与NaOH溶液发生反应的有机物:(1)酚:(2)羧酸:(3)卤代烃(水溶液:水解;醇溶液:消去)(4)酯:(水解,不加热反应慢,加热反应快)(5)蛋白质(水解)18、有明显颜色变化的有机反应:1.苯酚与三氯化铁溶液反应呈紫色;2.KMnO4酸性溶液的褪色;3.溴水的褪色;4.淀粉遇碘单质变蓝色。
5.蛋白质遇浓硝酸呈黄色颜色反应《有机化学基础》方程式归纳请大家注意方程式的反应条件、一些结构简式的书写形式、与气体、沉淀等符号!取代反应1.CH4 + Cl2CH3Cl + HCl2.3.4.5.6.7.8.9.10.11.12.13.14.15.16.17.18.19.加成反应20.+Br221.+ H222.23.24.25.26.27.28.29.30.31.消去反应32.33.34.35.氧化反应36.37.38.39.40.41.42.还原反应43.44.45.46.加聚反应47.48.49.50.缩聚反应51.52.53.54.。
