一些溶剂与水形成的二元共沸物
实验室常用溶剂共沸体系

实验室常用溶剂共沸体系18、00、960浓盐酸1、1912、10、372浓硝酸1、4215、90、704磷酸1、7014、80、855冰醋酸1、0517、450、998浓氨水0、9014、530、566浓氢氧化钠1、5419、40、505注:表中数据录自JohnA、 Dean、Lange’s Handbook of Chemistry、13th ed、1985常见的共沸混合物1)与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/%溶剂沸点/℃共沸点/℃含水量/%氯仿61、256、12、5甲苯185、020四氯化碳77、066、04、0正丙醇97、287、728、8苯80、469、28、8异丁醇108、4 89、988、2丙稀腈78、070、013、0二甲苯137- 40、592、037、5二氯乙烷83、772、019、5正丁醇117、737、5乙睛82、076、016、0吡啶1 15、594、042乙醇78、378、14、4异戊醇1 31、095、149、6乙酸乙酯77、170、48、0正戊醇1 38、395、444、7异丙醇82、480、412、1氯乙醇197、859、0乙醚35341、0二硫化碳46442、0甲酸101107262)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/%共沸物的沸点/℃乙醇-乙酸乙酯78、3,78、030:7072、0乙醇-苯78、3,80、632:6868、2乙醇-氯仿78、3,61、27:9359、4乙醇-四氯化碳78、3,77、016:8464、9乙酸乙酯-四氯化碳78、0,77、043:5775、0甲醇-四氯化碳77、021:7955、7甲醇-苯64、7,80、439:6148、3氯仿-丙酮61、2,56、480:2064、7甲苯-乙酸101、5,1 18、572:28105、4乙醇-苯-水78、3,80、6,10019:74:764、9。
常见共沸混合物

8月28日常见共沸混合物近期想低温下蒸出DMF,于是想共沸的方式,但没找到很好的共沸体系.下面是一些常见共沸体系.(a)与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃ 共沸点/℃ 含水量/% 溶剂沸点/℃ 共沸点/℃ 含水量/%氯仿 61.2 56.1 2.5 甲苯 110.5 85.0 20四氯化碳 77.0 66.0 4.0 正丙醇 97.2 87.7 28.8苯 80.4 69.2 8.8 异丁醇 108.4 89.9 88.2丙稀腈 78.0 70.0 13.0 二甲苯 137-40.5 92.0 37.5二氯乙烷 83.7 72.0 19.5 正丁醇 117.7 92.2 37.5乙睛 82.0 76.0 16.0 吡啶 115.5 94.0 42乙醇 78.3 78.1 4.4 异戊醇 131.0 95.1 49.6乙酸乙酯 77.1 70.4 8.0 正戊醇 138.3 95.4 44.7异丙醇 82.4 80.4 12.1 氯乙醇 129.0 97.8 59.0乙醚 35 34 1.0 二硫化碳 46 44 2.0甲酸 101 107 26(b)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃ 共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯 78.3,78.0 30:70 72.0乙醇-苯 78.3,80.6 32:68 68.2乙醇-氯仿 78.3,61.2 7:93 59.4乙醇-四氯化碳 78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳 78.0,77.0 43:57 75.0甲醇-四氯化碳 64.7,77.0 21:79 55.7甲醇-苯 64.7,80.4 39:61 48.3氯仿-丙酮 61.2,56.4 80:20 64.7甲苯-乙酸 101.5,118.5 72:28 105.4乙醇-苯-水 78.3,80.6,100 19:74:7 64.9共沸的二个溶剂间沸点不要相差太大,这可能是经验之说.。
常见的共沸混合物的组成及共沸点
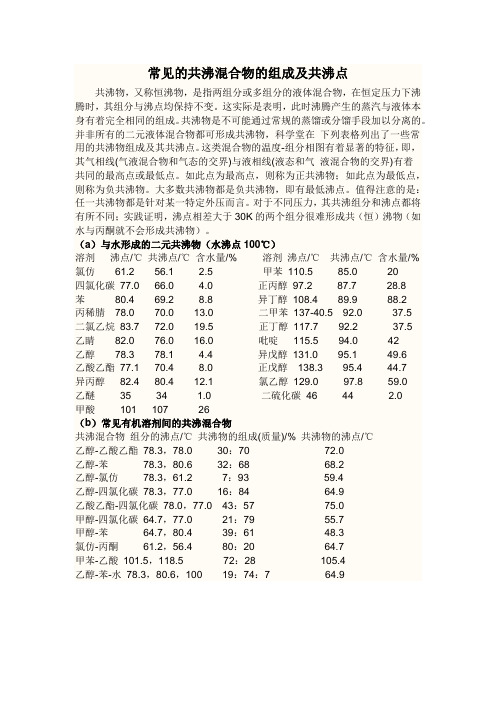
常见的共沸混合物的组成及共沸点共沸物,又称恒沸物,是指两组分或多组分的液体混合物,在恒定压力下沸腾时,其组分与沸点均保持不变。
这实际是表明,此时沸腾产生的蒸汽与液体本身有着完全相同的组成。
共沸物是不可能通过常规的蒸馏或分馏手段加以分离的。
并非所有的二元液体混合物都可形成共沸物,科学堂在下列表格列出了一些常用的共沸物组成及其共沸点。
这类混合物的温度-组分相图有着显著的特征,即,其气相线(气液混合物和气态的交界)与液相线(液态和气液混合物的交界)有着共同的最高点或最低点。
如此点为最高点,则称为正共沸物;如此点为最低点,则称为负共沸物。
大多数共沸物都是负共沸物,即有最低沸点。
值得注意的是:任一共沸物都是针对某一特定外压而言。
对于不同压力,其共沸组分和沸点都将有所不同;实践证明,沸点相差大于30K的两个组分很难形成共(恒)沸物(如水与丙酮就不会形成共沸物)。
(a)与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/% 溶剂沸点/℃共沸点/℃含水量/% 氯仿61.2 56.1 2.5 甲苯110.5 85.0 20四氯化碳77.0 66.0 4.0 正丙醇97.2 87.7 28.8苯80.4 69.2 8.8 异丁醇108.4 89.9 88.2丙稀腈78.0 70.0 13.0 二甲苯137-40.5 92.0 37.5二氯乙烷83.7 72.0 19.5 正丁醇117.7 92.2 37.5乙睛82.0 76.0 16.0 吡啶115.5 94.0 42乙醇78.3 78.1 4.4 异戊醇131.0 95.1 49.6乙酸乙酯77.1 70.4 8.0 正戊醇138.3 95.4 44.7异丙醇82.4 80.4 12.1 氯乙醇129.0 97.8 59.0乙醚35 34 1.0 二硫化碳46 44 2.0甲酸101 107 26(b)常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4乙醇-四氯化碳78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0甲醇-四氯化碳64.7,77.0 21:79 55.7甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9。
实验室常见有机溶剂间的共沸混合物

昂常见有机溶剂间的共沸混合物来源:有机化学网作者:chemfei共沸物的沸点/℃共沸混合物组分的沸点/℃共沸物的组成(质量)/%乙醇-乙酸乙酯78.3,78.030:7072.0乙醇-苯78.3,80.632:6868.2乙醇-氯仿78.3,61.27:9359.4乙醇-四氯化碳78.3,77.016:8464.9乙酸乙酯-四氯化碳78.0,77.043:5775.0甲醇-四氯化碳64.7,77.021:7955.7甲醇-苯64.7,80.439:6148.3氯仿-丙酮61.2,56.480:2064.7甲苯-乙酸101.5,118.572:28105.4乙醇-苯-水78.3,80.6,10019:74:764.9实验室常用酸、碱的浓度来源:有机化学网作者:chemfei试剂名称密度(20℃)g/ml浓度mol/L质量分数浓硫酸 1.8418.00.960浓盐酸 1.1912.10.372浓硝酸 1.4215.90.704磷酸 1.7014.80.855冰醋酸 1.0517.450.998浓氨水0.9014.530.566浓氢氧化钠 1.5419.40.505一些溶剂与水形成的二元共沸物来源:有机化学网作者:chemfei各种显色剂及其配制方法来源:有机化学网作者:admin碘:不饱和或者芳香族化合物配制方法在100ml广口瓶中,放入一张滤纸,少许碘粒。
或者在瓶中,加入10g碘粒,30g硅胶紫外灯含共厄基团的化合物,芳香化合物硫酸铈:生物碱配制方法10%硫酸铈(IV)+15%硫酸的水溶液氯化铁苯酚类化合物配制方法1% FeCl3 + 50% 乙醇水溶液.桑色素(羟基黄酮)广谱, 有荧光活性配制方法0.1% 桑色素+甲醇茚三酮氨基酸配制方法1.5g 茚三酮+ 100mL of 正丁醇+ 3.0mL 醋酸二硝基苯肼(DNP)醛和酮配制方法12g二硝基苯肼+ 60mL 浓硫酸+ 80mL 水+ 200mL 乙醇香草醛(香兰素)广谱配制方法15g 香草醛+ 250mL 乙醇+2.5mL 浓硫酸高锰酸钾含还原性基团化合物,比如羟基,氨基,醛配制方法1.5g KMnO4 + 10g K2CO3 + 1.25mL 10% NaOH + 200mL 水. 使用期3个月溴甲酚绿羧酸,pKa<=5.0配制方法在100ml乙醇中,加入0.04g溴甲酚绿,缓慢滴加0.1M的NaOH水溶液,刚好出现蓝色即至。
常见有机溶剂间的共沸混合物

沸点 /℃ 110.5 97.2 108.4 137-40.5 117.7 115.5 131.0 138.3 129.0 46
共沸点 /℃ 85.0 87.7 89.9 92.0 92.2 94.0 95.1 95.4 97.8 44
含水量 /% 20 28.8 88.2 37.5 37.5 42 49.6 44.7 59.0 2.0
甲醇-苯 氯仿-丙酮 甲苯-乙酸 乙醇-苯-水
组分的沸点/℃ 78.3,78.0 78.3,80.6 78.3,61.2 78.3,77.0 78.0,77.0 64.7,77.0 64.7,80.4 61.2,56.4 101.5,118.5
78.3,80.6,100
共沸物的组成(质量)/% 30:70 32:68 7:93 16:84 43:57 21:79 39:61 80:20 72:28
共沸点 /℃ 56.1 66.0 69.2 70.0 72.0 76.0 78.1 70.4 80.4 34 107
含水量 /% 2.5 4.0 8.8 13.0 19.5 16.0 4.4 8.0 12.1 1.0 26
溶剂
甲苯 正丙醇 异丁醇 二甲苯 正丁醇 吡啶 异戊醇 正戊醇 氯乙醇 二硫化碳
/articles/open.asp?id=2202006-2-6 20:45:33
有机化学网-技术文章-常见有机溶剂间的共沸混合物
常见有机溶剂间的共沸混合物 来源:有机化学网 作者:chemfei
共沸混合物 乙醇-乙酸乙酯
乙醇-苯 乙醇-氯仿 乙醇-四氯化碳 乙酸乙酯-四氯化碳 甲醇-四氯化碳
有机化学网-技术文章-一些溶剂与水形成的二元共沸物
一些溶剂与水形成的二元共沸物 来源:有机化学网 作者:chemLeabharlann ei溶剂氯仿 四氯化碳
有机化学实验考试(四个制备实验)

实验原理:蒸馏:利用混合液体或液-固体系中各组分沸点不同,使低沸点组分蒸发,再冷凝以分离整个组分。
分馏:利用分馏柱的理论塔板将混合液蒸汽进行一系列的热交换,使高沸点组分冷凝回流,低沸点组分蒸出,从而达到分离。
萃取分液:利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
重结晶:利用混合物中各组分在某种溶剂中的溶解度不同,或在同一溶剂时不同温度的溶解度不同,从而使它们相互分离。
环己烯的制备(消去反应)实验原理:物理原理:分馏、萃取、蒸馏化学原理:正反应:副反应:生成二环己基醚,烯烃聚合物,分子间的失水碳化。
实验仪器及用品:用品:名称用量作用环己醇0.1mol(10g10.4mL)反应物实验仪器:加热:升降台、电热套制备:50mL圆底烧瓶、分馏柱、温度计套管、温度计、蒸馏头、直形冷凝管、接引管、50ml锥形瓶(冷水浴)分液:小分液漏斗蒸馏:50mL圆底烧瓶、温度计套管、温度计、蒸馏头、直形冷凝管、接引管、接收器实验步骤:1.制备:在干燥的50ml圆底烧瓶放入0.1mol环己醇及少量多次加入4mL浓磷酸,充分摇荡使两种液体混合均匀。
投入几粒沸石,装好装置,接收器冷水浴。
加热至沸腾,保持温度计度数不超过90℃,慢慢蒸出环己烯和水,约1h。
当无液体蒸出时,可大火加热;当烧瓶内只剩下很少的残渣并出现白雾时,停止加热。
2.分液:将馏出液用约1g氯化钠饱和,然后加入3~4mL5%的碳酸钠溶液中和微量的酸。
然后将液体倒入小分液漏斗,振摇静置,分层后放出下方水层,将上层粗产品用1~2g无水氯化钙干燥(清亮透明),然后滤入50mL蒸馏烧瓶中,加入沸石进行蒸馏,收集80~85℃的馏分,产物为无色有刺激性气味液体,称量体积。
注意事项重难点:1.所有仪器需干燥,粗产物需干燥才能进行蒸馏。
2.正确进行操作,温度计玻璃球位置应在支口处。
(下端液面上,上端在支管口下沿),记得加沸石。
共沸表 jlac

与水形成的二元共沸物(水沸点100℃)溶剂沸点/℃共沸点/℃含水量/%氯仿61.2 56.1 2.5甲苯110.5 85.0 20四氯化碳77.0 66.0 4.0正丙醇97.2 87.7 28.8苯80.4 69.2 8.8异丁醇108.4 89.9 88.2丙稀腈78.0 70.0 13.0二甲苯137-40.5 92.0 37.5二氯乙烷83.7 72.0 19.5正丁醇117.7 92.2 37.5乙睛82.0 76.0 16.0吡啶115.5 94.0 42乙醇78.3 78.1 4.4异戊醇131.0 95.1 49.6乙酸乙酯77.1 70.4 8.0正戊醇138.3 95.4 44.7异丙醇82.4 80.4 12.1乙醇129.0 97.8 59.0乙醚35 34 1.0二硫化碳46 44 2.0甲酸101 107 26常见有机溶剂间的共沸混合物共沸混合物组分的沸点/℃共沸物的组成(质量)/% 共沸物的沸点/℃乙醇-乙酸乙酯78.3,78.0 30:70 72.0乙醇-苯78.3,80.6 32:68 68.2乙醇-氯仿78.3,61.2 7:93 59.4乙醇-四氯化碳78.3,77.0 16:84 64.9乙酸乙酯-四氯化碳78.0,77.0 43:57 75.0甲醇-四氯化碳64.7,77.0 21:79 55.7甲醇-苯64.7,80.4 39:61 48.3氯仿-丙酮61.2,56.4 80:20 64.7甲苯-乙酸101.5,118.5 72:28 105.4乙醇-苯-水78.3,80.6,100 19:74:7 64.9表1乙醇-水-苯三元共沸物性质共沸物(简记)共沸点℃共沸物组成,wt% 乙醇水苯乙醇-水-苯(T) 64.85 18.5 7.4 74.1 乙醇-苯(AB Z) 68.24 32.7 0.0 67.63 苯-水(BW Z) 69.25 0.0 8.83 91.17 乙醇-水(AW Z) 78.15 95.57 4.43 0.0表2乙醇、水、苯的常压沸点物质名称(简记) 乙醇(A) 水(B) 苯(B)沸点温度,℃78.3 100.0 80.2。
异丙醇和水的混合物常用的分离方法
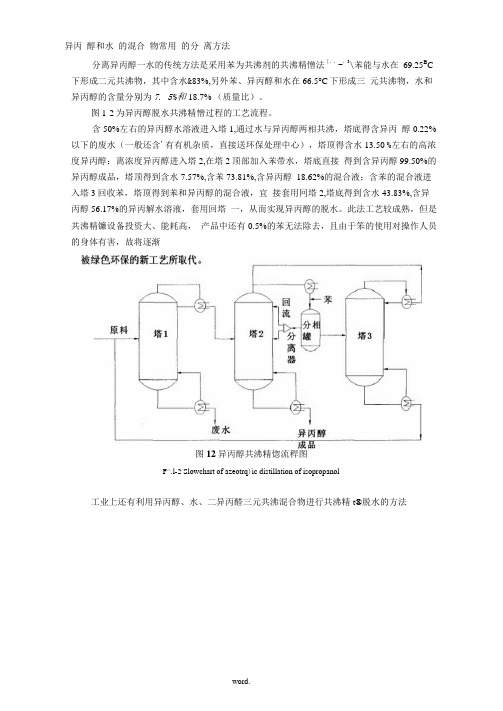
异丙醇和水的混合物常用的分离方法分离异丙醇一水的传统方法是采用苯为共沸剂的共沸精憎法[,,-,3\苯能与水在69.25B C 下形成二元共沸物,其中含水&83%,另外苯、异丙醇和水在66.5°C下形成三元共沸物,水和异丙醇的含量分别为7. 5%和18.7% (质量比)。
图1-2为异丙醇脱水共沸精憎过程的工艺流程。
含50%左右的异丙醇水溶液进入塔1,通过水与异丙醇两相共沸,塔底得含异丙醇0.22%以下的废水(一般还含'有有机杂质,直接送环保处理中心),塔顶得含水13.50 %左右的高浓度异丙醇;离浓度异丙醇进入塔2,在塔2顶部加入苯带水,塔底直接得到含异丙醇99.50%的异丙醇成品,塔顶得到含水7.57%,含苯73.81%,含异丙醇18.62%的混合液;含苯的混合液进入塔3回收苯,塔顶得到苯和异丙醇的混合液,宜接套用冋塔2,塔底得到含水43.83%,含异丙醇56.17%的异丙解水溶液,套用回塔一,从而实现异丙醇的脱水。
此法工艺较成熟,但是共沸精镰设备投资大、能耗高,产品中还有0.5%的苯无法除去,且由于笨的使用对操作人员的身体有害,故将逐渐图12异丙醇共沸精惚流稈图F^.l-2 Slowchart of azeotrq)ic distillation of isopropanol工业上还有利用异丙醇、水、二异丙醛三元共沸混合物进行共沸精t®脱水的方法,10\二异丙醛虽然無性较苯低,但易与空气形成过氧化物,有爆炸的危险,且带水壘比苯少,总体效果也不理想。
1.3.2吸附蒸tg工艺吸附分离技术^是20世纪60年代以后得到迅速发展的新分离技术,对于相对挥发度接近1・0的难分离物系,吸附技术在许多方面明显优于常规蒸蚀技术。
吸附蒸馅是将吸附和蒸懈相复合的分离过程,具有吸附过程分离因数高、蒸馆过程连续的优点, 适用于有共沸点物系的分离。
文献:⑷采用吸附蒸馆技术分离异丙醇-水混合物,该工艺流程如图卜3所示。
