物理化学知识点总结(热力学第一定律)
物理化学知识点(全)
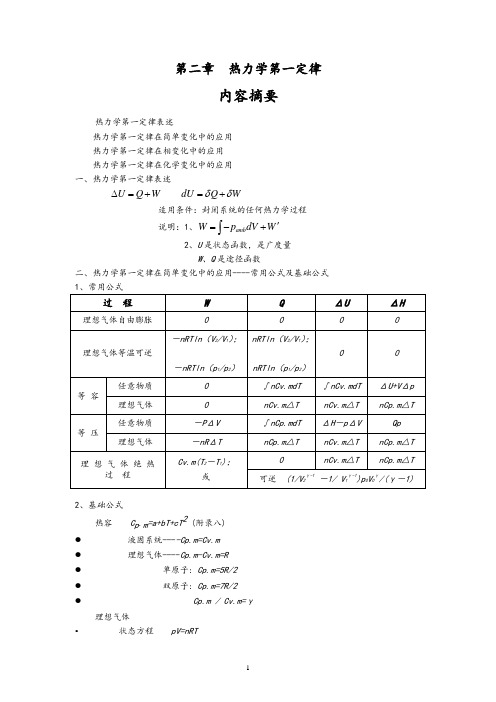
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学傅献彩版知识归纳

物理化学傅献彩版知识归纳一、热力学第一定律1、内容:能量守恒定律在化学反应中的应用,内容为:封闭系统中发生的能量转化等于该系统内所有物体能量的总和。
2、公式:ΔU = Q + W,其中ΔU为系统内能的变化,Q为系统吸收的热量,W为系统对外做的功。
3、应用:判断反应是否自发进行;计算反应过程中的焓变等。
二、热力学第二定律1、内容:熵增加原理,即在一个封闭系统中,自发进行的反应总是向着熵增加的方向进行。
2、公式:ΔS = Σ(δQ/T),其中ΔS为系统熵的变化,δQ为系统热量的变化,T为热力学温度。
3、应用:判断反应是否自发进行;计算反应过程中的熵变等。
三、化学平衡1、定义:在一定条件下,可逆反应达到平衡状态时,反应物和生成物的浓度不再发生变化,各组分的浓度之比等于系数之比。
2、公式:K = [C]^n/[D]^m,其中K为平衡常数,C和D分别为反应物和生成物的浓度,n和m分别为反应物和生成物的系数。
3、应用:判断反应是否达到平衡状态;计算平衡常数;计算反应物的转化率等。
四、电化学基础1、原电池:将化学能转化为电能的装置。
主要由正极、负极、电解质和隔膜组成。
2、电解池:将电能转化为化学能的装置。
主要由电源、电解液、电极和导线组成。
3、电池的电动势:E = E(标准) - (RT/nF)ln(a(正)/a(负)),其中E为电池的电动势,E(标准)为标准状况下的电动势,R为气体常数,T为热力学温度,n为电子转移数,F为法拉第常数,a(正)和a(负)分别为正极和负极的活度。
4、电解的电压:V = (RT/nF)ln[(a(正)·a(阴))/(a(阴)·a(阳))],其中V为电解电压,R为气体常数,T为热力学温度,n为电子转移数,F为法拉第常数,a(正)、a(阴)和a(阳)分别为正极、阴极和阳极的活度。
《物理化学》第五版是南京大学傅献彩等编著的教材,该教材是化学、化工类专业本科生的基础课教材,也可作为从事化学、化工领域科研和工程技术人员的参考书。
物理化学知识点总结(热力学第一定律)

热力学第一定律一、基本概念1.系统与环境敞开系统:与环境既有能量交换又有物质交换的系统。
封闭系统:与环境只有能量交换而无物质交换的系统。
(经典热力学主要研究的系统)孤立系统:不能以任何方式与环境发生相互作用的系统。
2.状态函数:用于宏观描述热力学系统的宏观参量,例如物质的量n、温度T、压强p、体积V等。
根据状态函数的特点,我们把状态函数分成:广度性质和强度性质两大类。
广度性质:广度性质的值与系统中所含物质的量成正比,如体积、质量、熵、热容等,这种性质的函数具有加和性,是数学函数中的一次函数,即物质的量扩大a倍,则相应的广度函数便扩大a倍。
强度性质:强度性质的值只与系统自身的特点有关,与物质的量无关,如温度,压力,密度,摩尔体积等。
注:状态函数仅取决于系统所处的平衡状态,而与此状态的历史过程无关,一旦系统的状态确定,其所有的状态函数便都有唯一确定的值。
二、热力学第一定律热力学第一定律的数学表达式:对于一个微小的变化状态为:dU=公式说明:dU表示微小过程的内能变化,而δQ和δW则分别为微小过程的热和功。
它们之所以采用不同的符号,是为了区别dU是全微分,而δQ和δW不是微分。
或者说dU与过程无关而δQ和δW却与过程有关。
这里的W既包括体积功也包括非体积功。
以上两个式子便是热力学第一定律的数学表达式。
它们只能适用在非敞开系统,因为敞开系统与环境可以交换物质,物质的进出和外出必然会伴随着能量的增减,我们说热和功是能量的两种传递形式,显然这种说法对于敞开系统没有意义。
三、体积功的计算1.如果系统与环境之间有界面,系统的体积变化时,便克服外力做功。
将一定量的气体装入一个带有理想活塞的容器中,活塞上部施加外压。
当气体膨胀微小体积为dV时,活塞便向上移动微小距离dl,此微小过程中气体克服外力所做的功等于作用在活塞上推力F与活塞上移距离dl的乘积因为我们假设活塞没有质量和摩擦,所以此活塞实际上只代表系统与环境之间可以自由移动的界面。
物理化学知识点归纳

物理化学知识点归纳物理化学是化学学科的一个重要分支,它综合运用物理学的原理和方法来研究化学现象和过程。
以下是对物理化学一些重要知识点的归纳:一、热力学第一定律热力学第一定律,也就是能量守恒定律,表明能量可以在不同形式之间转换,但总量保持不变。
在热力学中,通常用公式△U = Q + W来表示,其中△U 是系统内能的变化,Q 是系统吸收或放出的热量,W 是系统对外做功或外界对系统做功。
例如,在一个绝热容器中进行的化学反应,如果体系对外做功,那么内能就会减少;反之,如果外界对体系做功,内能就会增加。
二、热力学第二定律热力学第二定律有多种表述方式,其中克劳修斯表述为:热量不能自发地从低温物体传到高温物体。
开尔文表述为:不可能从单一热源取热使之完全变为有用功而不产生其他影响。
熵(S)的概念在热力学第二定律中至关重要。
对于一个孤立系统,熵总是增加的,这意味着系统总是朝着更加混乱和无序的方向发展。
比如,混合气体自发扩散后,不会自动分离回到初始状态,因为这个过程熵增加了。
三、热力学第三定律热力学第三定律指出,绝对零度(0K)时,纯物质完美晶体的熵值为零。
这一定律为计算物质在不同温度下的熵值提供了基准。
四、化学平衡化学平衡是指在一定条件下,可逆反应中正逆反应速率相等,反应物和生成物的浓度不再随时间改变的状态。
平衡常数(K)是衡量化学平衡的重要参数。
对于一个一般的化学反应 aA + bB ⇌ cC + dD,平衡常数 K 的表达式为:K = C^cD^d / A^aB^b (其中方括号表示物质的浓度)。
影响化学平衡的因素包括温度、浓度、压强等。
例如,对于吸热反应,升高温度会使平衡向正反应方向移动;增加反应物浓度,平衡也会向正反应方向移动。
五、相平衡相平衡研究的是多相体系中各相的组成、性质以及它们之间的相互转化规律。
相律是描述相平衡体系中自由度、组分数和相数之间关系的定律,其表达式为 F = C P + 2,其中 F 是自由度,C 是组分数,P 是相数。
物理化学热力学第一定律总结

物理化学热力学第一定律总结热力学第一定律是热力学中最基本的定律之一,并且与能量守恒原理密切相关。
它陈述了一个闭合系统内部的能量转换过程。
根据热力学第一定律,能量是不能从真空中产生的,也不能消失,它只能在系统内部进行转化。
该定律可以用以下公式表达:ΔU=Q-W其中,ΔU表示系统内部能量的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
这个公式说明了能量的守恒,即系统吸收的热量和对外界做的功之和等于系统内部能量的变化。
当系统从外界吸收热量时,其内部能量会增加,而当系统对外界做功时,其内部能量会减少。
这种能量的转化是一个相互依存的过程,可以通过热力学第一定律进行描述。
热力学第一定律的应用十分广泛,并且在实际问题中具有重要的意义。
以下是热力学第一定律在不同领域的应用:1.在化学反应中,热力学第一定律可以用来计算反应的焓变。
通过测量反应前后系统吸收或释放的热量,可以计算出反应的焓变,从而了解反应的能量转化和方向。
2.在工程领域,热力学第一定律常用于能量转换设备的设计和优化中。
例如,蒸汽轮机、内燃机和制冷机等能量转换系统的效率可以通过热力学第一定律进行评估和计算。
3.在生物学领域,热力学第一定律可以用于研究生物体内的能量转化过程。
例如,通过测量生物体吸收的热量和对外界做的功,可以计算出生物代谢的能量转换效率。
热力学第一定律的重要性在于揭示了能量守恒的基本原理,为能量转化和能量利用提供了基础理论支持。
它对于研究和解决实际问题具有重要指导意义。
热力学第一定律的应用可以帮助我们评估能量转换过程的效率,优化能量利用方式,并促进可持续发展。
总之,物理化学热力学第一定律表述了能量守恒的原则,描述了能量转化和能量守恒的过程。
它在化学、工程、生物等领域具有广泛的应用,并对能量转换和利用提供了理论支持。
热力学第一定律的理解和应用可以帮助我们更好地理解能量转换过程,优化能量利用方式,并实现可持续发展的目标。
物理化学知识点总结

第一章 热力学第一定律一、基本概念系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。
二、基本定律热力学第一定律:ΔU =Q +W 。
焦耳实验:ΔU =f (T ) ; ΔH =f (T ) 三、基本关系式1、体积功的计算 δW = -p e d V恒外压过程:W = -p e ΔV可逆过程:1221ln ln p p nRT V V nRT W ==2、热效应、焓等容热:Q V =ΔU (封闭系统不作其他功) 等压热:Q p =ΔH (封闭系统不作其他功) 焓的定义:H =U +pV ; d H =d U +d(pV )焓与温度的关系:ΔH =⎰21d p T T T C3、等压热容与等容热容热容定义:V V )(T U C ∂∂=;p p )(T H C ∂∂=定压热容与定容热容的关系:nR C C =-V p 热容与温度的关系:C p =a +bT +c’T 2 四、第一定律的应用1、理想气体状态变化等温过程:ΔU =0 ; ΔH =0 ; W =-Q =⎰-p e d V 等容过程:W =0 ; Q =ΔU =⎰T C d V ; ΔH =⎰T C d p 等压过程:W =-p e ΔV ; Q =ΔH =⎰T C d p ; ΔU =⎰T C d V 可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p不可逆绝热过程:Q =0 ; 利用C V (T 2-T 1)=-p e (V 2-V 1)求出T 2,W =ΔU =⎰T C d V ;ΔH =⎰T C d p2、相变化可逆相变化:ΔH =Q =n Δ_H ;W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W3、热化学物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。
摩尔反应热的求算:)298,()298(B H H m f B m r θθν∆=∆∑反应热与温度的关系—基尔霍夫定律:)(])([,p B C T H m p BB m r ∑=∂∆∂ν。
第一课物理化学热力学第一定律小结

热力学第一定律 U Q W
W 400 J
2019/12/10
14
(2)同样的始态与终态,状态函数值相同
ΔH 2092J U 1247J
273K 101.325KPa
V0
373K 69.220KPa
2V0
(I)等温 第一步为等温过程,对理气:
273K
P3 V3
(II)等容
ΔU1 0, Q1 -W1
2、焓的定义
H U pV
3、焓变 ①
H U ( pV )
式中△(pV)为pV乘积的增量,不是体积功。
②
2019/12/10
2
H 1 nCp,m dT
理想气体单纯pVT变化的一切过程, 真实气体的恒压变温过程, 纯的液体、固体物质压力变化不大的变温过程。
7
4、热力学能(又称内能)变
p dV
nRT
ln( V2
/V1 )
nRT
ln(
p2
/
p1 )
⑤、理想气体绝热过程
W U nCV ,m (T2 T1) 适用于Cv,m为常数的过程。
2019/12/10
10
8、理想气体可逆绝热过程方程
TV r1 T1V1r1 T2V2r1 C
pV r p1V1r p2V2r C
一 种 广 度 性 质= 另一种广度性质
强
度
性
质
,
如Vm
V n
,
ρ
m V
等
2019/12/10
2
3、相的定义 系统中物理性质及化学性质均匀的部分。 均相系统;非均相系统
物理化学知识点归纳

第二章热力学第一定律一、热力学基本概念1.状态函数状态函数,是指状态所持有的、描述系统状态的宏观物理量,也称为状态性质或状态变量.系统有确定的状态,状态函数就有定值;系统始、终态确定后,状态函数的改变为定值;系统恢复原来状态,状态函数亦恢复到原值。
2.热力学平衡态在指定外界条件下,无论系统与环境是否完全隔离,系统各个相的宏观性质均不随时间发生变化,则称系统处于热力学平衡态。
热力学平衡须同时满足平衡(△T=0)、力平衡(△p=0)、相平衡(△μ=0)和化学平衡(△G=0)4个条件.二、热力学第一定律的数学表达式1.△U=Q+W或dU=ΔQ+δW=δQ—p amb dV+δW`规定系统吸热为正,放热为负.系统得功为正,对环境做功为负。
式中p amb为环境的压力,W`为非体积功。
上式适用于封闭系统的一切过程.2.体积功的定义和计算系统体积的变化而引起的系统和环境交换的功称为体积功.其定义式为:δW=-p amb dV(1) 气体向真空膨胀时体积功所的计算 W=0(2) 恒外压过程体积功 W=p amb (V 1—V 2)=-p amb △V 对于理想气体恒压变温过程 W=—p △V=—nR △T (3) 可逆过程体积功 W r =⎰21p V V dV(4)理想气体恒温可逆过程体积功W r =⎰21p V V dV =—nRTln(V 1/V 2)=—nRTln (p 1/p 2)(5)可逆相变体积功 W=-pdV三、恒热容、恒压热,焓 1.焓的定义式H def U + p V 2.焓变(1)△H=△U+△(pV)式中△(pV)为p V 乘积的增量,只有在恒压下△(pV)=p(V 2—V 1)在数值上等于体积功。
(2)△H=⎰21,T T m p dT nC此式适用于理想气体单纯p VT 变化的一切过程,或真实气体的恒压变温过程,或纯的液、固态物质压力变化不大的变温过程。
3. 内能变 (1)△U=Qv式中Qv 为恒热容.此式适用于封闭系统,W`=0、dV=0的过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学知识点总结
(热力学第一定律) -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
热力学第一定律
一、基本概念
1.系统与环境
敞开系统:与环境既有能量交换又有物质交换的系统。
封闭系统:与环境只有能量交换而无物质交换的系统。
(经典热力学主要研究的系统)
孤立系统:不能以任何方式与环境发生相互作用的系统。
2.状态函数:用于宏观描述热力学系统的宏观参量,例如物质的量n、温度
T、压强p、体积V等。
根据状态函数的特点,我们
把状态函数分成:广度性质和强度性质两大类。
广度性质:广度性质的值与系统中所含物质的量成
正比,如体积、质量、熵、热容等,这种性质的函数具
有加和性,是数学函数中的一次函数,即物质的量扩大
a倍,则相应的广度函数便扩大a倍。
强度性质:强度性质的值只与系统自身的特点有关,与物质的量无关,如温度,压力,密度,摩尔体积等。
注:状态函数仅取决于系统所处的平衡状态,而与此状态的历史过程无关,一旦系统的状态确定,其所有的状态函数便都有唯一确定的值。
二、热力学第一定律
热力学第一定律的数学表达式:
对于一个微小的变化状态为:
dU=
公式说明:dU表示微小过程的内能变化,而δQ和δW则分别为微小过程的热和功。
它们之所以采用不同的符号,是为了区别dU是全微分,而δQ和δW不是微分。
或者说dU与过程无关而δQ和δW却与过程有关。
这里的W既包括体积功也包括非体积功。
以上两个式子便是热力学第一定律的数学表达式。
它们只能适用在非敞开系统,因为敞开系统与环境可以交换物质,物质的进出和外出必然会伴随着能量的增减,我们说热和功是能量的两种传递形式,显然这种说法对于敞开系统没有意义。
三、体积功的计算
1.如果系统与环境之间有界面,系统的体积变化时,便克服外力做功。
将一
定量的气体装入一个带有理想活塞的容器中,活塞上部施加外压。
当气体膨胀微小体积为dV时,活塞便向上移动微小距离dl,此微小过程中气
体克服外力所做的功等于作用在活塞上推力F与活塞上移距离dl的乘积
因为我们假设活塞没有质量和摩擦,所以此活塞实际上只代表系统与环境之间可以自由移动的界面。
因此推力F实际上是作用于环境,而由产生的外力则作用于系统,两者属于作用力与反作用力,若A代表活塞的体积,则
,积分得到
2
1
外
d
V
V
W p V =-⎰
2.如果系统体积膨胀对环境做功,则W<0。
环境对系统做功体积压缩,则
W>0。
3.若膨胀过程分为无穷多步完成,其中每一步都可以看成是一个平衡态,则可逆膨胀做功计算公式为:
由上可知,功与变化的途径有关。
可逆膨胀,系统对环境做功最多;可逆压缩,环境对系统做的功最小。
热力学的一个过程,其中每一个步骤都可以在相反方向进行而不在环境中引起其他变化,我们称这样的过程叫可逆过程。
思考:有人说可逆过程可以理解成可以逆向进行的过程?
为什么热力学中计算体积功时不用内压用外压
四、热的计算
1.等容热效应,由热力学第一定律可知,若系统不做非体积功,且等容条件下(体积功为0),则:
,
此结果表明,等容且不做非体积功过程的内能变化热效应等于系统等压热效应。
2.等压热效应,由热力学第一定律可知,系统在等压条件下,则:
由于等压过程中p是常数,即dp=0我们定义H=U+pV,即。
对整个过程积分则得到:
此结果表明,等压且不做非体积功过程的热效应等于系统焓值的变化。
3.热容及简单的变温过程热的计算
在物理学中,热容的定义是
其意义是在没有非体积功的情况下,将系统的温度升高1K时所吸收的热量,由于热量与过程有关,所以在不同的过程中有不同的热容,我们需要掌握的是等容热容和等压热容。
等容热容代表在等容条件下,系统升高1K时所吸收的热量,记作
在没有非体积功的条件下,于是
由此可知,对于微小的等容简单变温过程有
若系统的温度由T1变成T2,则此式两端积分,得到
类似地,等压热容,在没有非体积功的条件下,于是
由此可知,对于微小的等压简单变温过程有
若系统的温度由T1变成T2,则此式两端积分,得到
我们知道热容是具有广度性质的函数,除以物质的量n之后,相应的热容就成为了摩尔等容热容和摩尔等压热容,这两个物理量则具有强度性质。
5.等容热容与等压热容的关系
6.理想气体的热容
由于理想气体的U和H只与温度有关,故
故对于理想气体,有
7.理想气体的绝热过程,我们需要掌握理想气体的绝热、可逆、且不做非体积功的三个过程方程,这部分大家去翻一翻教材吧。
五、实际气体的内能和焓
对于一定量的任意气体
所以
则实际气体任意过程的焓变要通过下式计算
Similarly, 对于一定量的任意气体
所以
则实际气体任意过程的内能变化要通过下式计算
以上内容就是热力学第一定律的主要部分剌,希望能给大家一些帮助。
