四大滴定总结
分析化学四大滴定总结

分析化学四大滴定总结
定性分析化学中的四大滴定,也就是碱度滴定、水的氢离子滴定、质
量滴定(定量滴定)和酸度滴定,是实验室中最基本的定性分析化学方法,用于化学分析当中不同物质的含量测定和种类鉴定。
一、碱度滴定
碱度滴定是指测定溶液的碱离子的含量,即溶液中氢离子浓度的定量
测定,是通过酸度滴定时,将酸离子与碱离子结合,反应形成盐类,消耗酸,使pH值变化,从而测定溶液中碱离子的含量的一种化学滴定方法。
碱度滴定根据反应物是否有色不同,可分为标准的无色滴定和常用的有色
滴定两种类型。
碱度滴定通常用于分析碱性物质的含量,例如碱的溶液,
如NaOH溶液、KOH溶液等。
二、水的氢离子滴定
水的氢离子滴定(也称氢离子滴定)是在水样中测定溶液中氢离子的
含量的一种滴定,是一种实验室中常用的化学分析滴定方法。
水的氢离子
滴定是通过测定溶液中氢离子的浓度来评价溶液的碱度的,它是以硫酸铜
为滴定剂,采用titration程序,以滴定曲线的路径从而测定水质当中氢
离子含量的一种滴定方法。
三、质量滴定
质量滴定,也称定量滴定,是指以一定的量的容量或重量的质量,测
定溶液中其中一种物质的含量的一种化学分析滴定方法。
分析化学:19章四大滴定(重点整理)

一、终点误差
一、终点误差
终点误差:指示剂确定的滴定终点 (EP)与化学计量点 (SP) 之间存在着差异(pHep≠pHsp) ,使滴定结果产生的误差,用 TE表示。
终点时过量(或不足量)滴定剂的物质的量
化学计量点时应加入滴定剂的物质的量
TE=
×100%
TE=
终点时剩余被滴定物的物质的量 开始时被滴定物的物质的量
(1)一元弱酸(碱)溶液 一元弱酸(HA) 质子条件式: [H+]=[A-]+[OH-]
[H+]= 精确表达式: [H+]=
Ka[HA] [H+]
+
Kw
[H+]
Ka[HA] + Kw c[H+]
[HA]= cδHA=
[H+] + Ka
展开则得一元三次方程, 数学处理麻烦!
对精确式简化:
[ H ] K a [ HA] KW (精确式)
19.1.3 标准溶液的配制、基准物、基准溶液
标准溶液:
1.
直接法:准确称取一定量的物质,溶解后定量转移到容量瓶中并稀 释到刻度,计算其准确浓度(四位有效数字)。 这种溶液也称为基准溶液,能用来配制这种溶液的物质称为基准物 质。对基准物的要求是:
(1) 纯度高。易制备和提纯。
(2) 组成与化学式完全相符。有结晶水的物质,如H2C2O42H2O等, 结晶水的含量也应与化学式相符。
H+-C1
H2O
SO42AcOH[H+]=C1+[SO42-]+[Ac-]+[OH-]
例8. C1 mol/L NaH2PO4 + C2 mol/L HCl + C3 mol/L NH4HCO3
分析化学四大滴定总结讲解学习

分析化学四大滴定总结一、酸碱滴定原理酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
基本反应H++ OH- = H2O滴定曲线与直接滴定的条件强碱滴定强酸强碱滴定弱酸强酸滴定弱碱cK a≥10-8cK b≥10-8多元酸的滴定混合酸的滴定多元碱的滴定c o K a1≥10-9c o K b1≥10-9K b1/K b2>104液基准物质无水碳酸钠、硼酸邻苯二甲酸氢钾、苯甲酸应用硼酸的测定、铵盐的测定、克氏定发、酸酐和醇类的测定等酸碱溶液pH计算一元弱酸两性物质二元弱酸缓冲物质理定分析方法。
基本反应M+Y=MY配合物的稳定常数酸效应αY(H)干扰离子效应αY(N)溶液酸度越大,αY(H)越大,表示酸效应引起的副反应越严重。
αY(H)=1+β1[H+] +β2[H+] ²+β3[H+] ³+β4[H+]⁴+βⁿ [H+] ⁿ[Y]越小,αY(N)越大,表示干扰离子效应引起的副反应越严重。
金属离子的配位效应αM(OH)、αM(L)及总副反应αMY的总副反应αY条件稳定常数K’MYαM越小,αY越小,K’MY越小,配合物稳定性越大滴定条件准确直接滴定的条件K’MY≥10-6分别滴定的条件K’MY≥10-6,△lgK≥5配位剂1.无机配位剂 2.有机配位剂:EDTA、CyDTA、EGTA、EDTP等指示剂铬黑T、二甲酚橙、钙指示剂、PAN等指示剂原理指示剂游离态与配合态颜色不同影响滴定突跃范围因素1.金属离子浓度的影响:K’MY一定时,CM越大,ΔpM’越大2.条件稳定常数的影响:CM一定时,K’MY越大,ΔpM’越大3.酸度的影响:pH越小,αY(H)越大,K’MY越小,ΔpM’越小4.其他辅助配位剂的影响:CL越大,αM(L)越大,K’MY越小,ΔpM’越小用掩蔽和解蔽的方法进行滴定常用掩蔽方法配位掩蔽法沉淀掩蔽法氧化还原隐蔽法解蔽法应用测定石灰石中CaO、测定Ga2+、Mg2+Bi3+、Zr4+、Th4+的滴定测定Cu2+、Zn2+、条件电极电位条件对电极电位的影响离子强度副反应酸度一般忽略离子强度的影响,一般用浓度代替活度酸度变化直接影响电对的电极电位条件平衡常数滴定反应条件影响反应速率的因素1.反应物浓度2.温度3.催化剂4.诱导作用滴定化学计量点前化学计量点时化学计量点后曲线与终点的测定指示剂氧化还原指示剂、自身指示剂、专属指示剂预处理预氧化、预还原,除去有机物:干法灰化。
分析化学四大滴定总结

分析化学四大滴定总结分析化学是化学学科中的一个重要分支,它主要研究物质的成分、结构和性质的分析方法。
而滴定法是分析化学中常用的一种定量分析方法,它通过溶液的滴定来确定物质的含量,被广泛应用于实验室和工业生产中。
在分析化学中,有四种常用的滴定方法,分别是酸碱滴定、络合滴定、氧化还原滴定和沉淀滴定。
本文将对这四种滴定方法进行总结和分析,希望能够为化学爱好者和专业人士提供一些参考和帮助。
首先,酸碱滴定是一种通过酸碱中和反应来确定物质含量的方法。
在实验中,通常会使用酸碱指示剂来标志滴定终点,常见的指示剂有酚酞、甲基橙、溴甲酚等。
酸碱滴定广泛应用于酸度、碱度和中和值的测定,是化学分析中最基本的滴定方法之一。
其次,络合滴定是一种通过金属离子与络合剂形成络合物的反应来确定物质含量的方法。
络合滴定常用于测定金属离子的含量,如测定水样中的钙、镁等金属离子含量。
络合滴定的滴定剂通常是EDTA(乙二胺四乙酸)等络合剂,滴定过程中需要控制pH值以确保络合反应的进行。
第三,氧化还原滴定是一种通过氧化还原反应来确定物质含量的方法。
在氧化还原滴定中,常用的指示剂有淀粉溶液、二酮类化合物等。
氧化还原滴定广泛应用于测定含氧量、还原剂含量等,是化学分析中常用的一种滴定方法。
最后,沉淀滴定是一种通过沉淀生成反应来确定物质含量的方法。
在沉淀滴定中,常用的滴定剂有氯化银、氯化铅等。
沉淀滴定广泛应用于测定阴离子含量,如测定水样中的氯离子含量、硫酸根离子含量等。
总的来说,四种滴定方法各有其适用范围和特点,可以根据具体的实验需求选择合适的滴定方法。
在进行滴定实验时,需要注意滴定条件的控制、指示剂的选择以及滴定终点的准确判定,以确保实验结果的准确性和可靠性。
希望本文能够对化学爱好者和专业人士有所帮助,谢谢阅读!。
四大滴定比较与总结

四大滴定比较与总结滴定是化学分析常用的一种分析方法,主要用于测定溶液中其中一种物质的含量。
四大滴定是指电位滴定、自动滴定、嗅觉滴定和颜色滴定。
这四种滴定方法各有特点,下面将对它们进行比较与总结。
1.电位滴定电位滴定是通过测定电位的变化来判断滴定终点的方法。
它的优点是滴定速度快、灵敏度高,可以实现自动控制。
电位滴定需要使用较贵的电位计仪器,因此成本较高。
2.自动滴定自动滴定是指通过电动滴定器进行滴定操作,滴定剂的滴定过程由机器自动完成。
自动滴定优点是操作简便、准确度高,可以提高实验效率。
然而,需要注意的是机器操作所需的技术支持较高,且设备价格相对较高。
3.嗅觉滴定嗅觉滴定是通过嗅觉来判断滴定终点的方法。
这种方法不需要任何仪器设备,简便易行。
嗅觉滴定的缺点是主观性较强,准确度较低,且对于不同人来说灵敏度差异较大。
4.颜色滴定颜色滴定是通过颜色的变化来判断滴定终点的方法。
它的优点是操作简便,可观察到直观的颜色变化,使滴定过程更为直观。
而且,现有的颜色滴定剂相对较多,可根据不同的滴定物质选择合适的颜色指示剂。
然而,颜色滴定对于滴定终点的判断常常不够准确,需要较丰富的经验和实践。
综上所述,四大滴定方法各有优缺点。
电位滴定能够实现自动化、快速高灵敏度的滴定分析,但所需设备价格较高。
自动滴定操作简单准确,但设备价格相对较高且需要技术支持。
嗅觉滴定方法简单易行,但主观性较高,准确度较低。
颜色滴定直观易懂,但滴定终点判断较为主观,需要经验和实践。
在实际应用中,选择滴定方法要根据具体的实验需求和条件来确定。
对于要求快速高灵敏度的滴定分析,电位滴定是更合适的选择。
对于操作简便准确度要求较高的滴定,可以考虑自动滴定方法。
对于便捷性要求较高且不需要太高准确度的滴定分析,可以使用嗅觉滴定法。
而颜色滴定方法则适用于对经验要求较高、对实验结果准确度不要求过高的分析。
四大滴定总结

四大滴定总结分析化学中的四大滴定即:酸碱滴定,氧化还原滴定,配位滴定,沉淀滴定。
一酸碱滴定1原理酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
基本反应为H+ + OH- = H2O也称中和法,是一种利用酸碱反应进行容量分析的方法用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
[2]2滴定曲线强碱滴定弱酸滴定反应为:以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L)用NaOH滴定HOAc的滴定曲线为例,滴定曲线如下图:滴定开始前 pH=2.88滴入NaOH 液19.98ml时 pH=7.75化学计量点时 pH=8.73滴入NaOH液20.02ml时 pH=9.70指示剂的选择(1)只能选择碱性指示剂(酚酞或百里酚酞等),不能选用酸性范围内变色的指示剂(如甲基橙、甲基红等)。
因为突跃范围较小,pH值在7.75~9.70之间;计量点在碱性区。
(2)弱酸被准确滴定的判决是C·Ka>10-8。
因为Ka愈大,突跃范围愈大。
而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃范围也愈大。
3酸碱指示剂用于酸碱滴定的指示剂,称为酸碱指示剂。
是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用类型指示剂名称范围酸色中性色碱色甲基橙 3.1-4.4 红橙黄甲基红4.4-6.2 红橙黄溴百里酚蓝 6.0-7.6 黄绿蓝酚酞 8.2-10.0 无色浅红红紫色石蕊 5.0-8.0 红紫蓝4影响滴定结果的因素⑴读数:滴定前俯视或滴定后仰视(偏大)滴定前仰视或滴定后俯视(偏小)⑵未用标准液润洗滴定管(偏大);未用待测溶液润洗滴定管(偏小)⑶用待测液润洗锥形瓶(偏大)⑷滴定前标准液滴定管尖嘴有气泡,滴定后尖嘴气泡消失(偏大)⑸不小心将标准液滴在锥形瓶的外面(偏大)⑹指示剂(可当作弱酸)用量过多(偏小)⑺滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出(偏小)⑻开始时标准液在滴定管刻度线以上,未予调整(偏小)⑼碱式滴定管(量待测液用)或移液管内用蒸馏水洗净后直接注入待测液(偏小)⑽移液管吸取待测液后,悬空放入锥形瓶,少量待测液洒在外面(偏小)⑾滴定到指示剂颜色刚变化,就是到了滴定终点(偏小)⑿锥形瓶用蒸馏水冲洗后,不经干燥便直接盛待测溶液(无影响)⒀滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁(无影响)(14)滴定时待测液滴定管尖嘴有气泡,滴定后尖嘴气泡消失(偏小)二配位滴定2滴定曲线。
四大滴定总结
指示剂变色原理
利用酸碱指示剂颜色的突然变化来指示终点。当溶液pH改变时,酸碱指示剂由于结构改变而发生颜色变化
用金属指示剂判断滴定终点。金属指示剂是指一些有机配位剂,可与金属离子形成有色配合物,其颜色与游离指示剂不同,因而能指示滴定过程中金属离子浓度的变化情况
以氧化还原指示剂来指示终点。氧化还原指示剂的氧化态和还原态具有不同的颜色,因氧化还原作用而发生颜色变化
2.Ka(Kb):
酸(碱)越强,滴定突跃越大,酸(碱)越弱,滴定突跃越小,甚至不会出现滴定突跃
1.cM:
cM越大,滴定突跃越大。cM决定滴定突跃下限
2.KMY:
KMY越大,滴定突跃越大。KMY决定滴定突跃上限
3.pH:
pH越大,滴定突跃越大。pH决定滴定突跃上限
与两个电对的条件(标准)电极电位的差值有关,差值越大,滴定突跃越大。与浓度无关
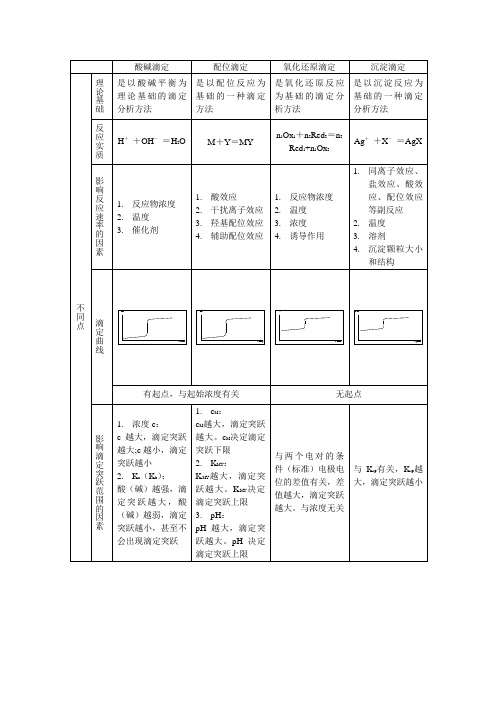
酸碱滴定
配位滴定
氧化还原滴定
沉淀滴定
不同点
理论基础
是以酸碱平衡为理论基础的滴定分析方法
是以配位反应为基础的一种滴定方法
是氧化还原反应为基础的滴定分析方法
是以沉淀反应为基础的一种滴定分析方法
反应实质
H+OH=H2O
M+Y=MY
n1Ox1+n2Red2=n2Red1+n1Ox2
Ag+X=AgX
影响反应速率的因素
指示剂的选择方法
pKHln-1≤pH≤pKHln+1
通过实验确定
根据应用确定:
1.高锰酸钾法:自身指示剂
2.重铬酸钾法:氧化还原指示剂
3.碘量法:专属指示剂
根据应用确定:
1.摩尔法:铬酸钾
2.佛尔哈德法:铁铵矾
四大滴定的比较与总结

四⼤滴定的⽐较与总结四⼤滴定的⽐较与总结⼀:反应原理及滴定曲线酸碱滴定:滴定曲线:溶液pH 随滴定分数(a)变化的曲线指⽰剂选择: pHep 与pHsp 尽可能接近,以减⼩滴定误差⼀、强碱强酸滴定(⼀)强碱滴定强酸NaOH (0.1000mol/L )→HCL (0.1000mol/L, 20.00mL ) 1.滴定过程中pH 值的变化(1)Vb = 0:(2)Vb < V a :加⼊NaOH 18.00mL(3)Vb = 19.80mL(4)Vb < V a : SP 前0.1% 时,加⼊NaOH 19.98mL(5)Vb = V a (SP ):(6)Vb > V a :SP 后0.1%,加⼊NaOH 20.02mLLmol C Ha /1000.0][==+0.1=pH 320.0018.000.1 5.26310/20.0018.00a b a a bV V H C m ol L V V +---??=?=?=++2.28pH = 3.27pH =[]Lmol C V V V VH a ba ba/100.51.098.1900.2098.1900.205-+=+-=+-=3.4=pH [][]H OH K mol Lw +--===107/0.7=pH 520.0220.000.1 5.010/20.0020.02b a b a b V V OH C mol L V V ----??=?=?=++3.4=pOH 7.9=?pH(7)Vb = 40.00mLNaOH 加⼊量ml PH 范围△ PH 0.00→19.80 1--3.3 2.3 19.80 →19.98 3.3 --4.3 1 19.98 →20.02 4.3--9.7 5.4 ↓0.04 ml△ PH=5.42.滴定曲线的形状40.0020.000.140.0020.02b a b a b V V O H C V V ---??=?=??++1.48pOH =12.52pH ?=pH 0 12滴定分数a9.7 sp+0.1%4.3 sp-0.1%sp 7.0突跃络合滴定基本原理络合滴定:滴定反应为配位反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四大滴定总结
分析化学中的四大滴定即:酸碱滴定,氧化还原滴定,配位滴定,沉淀滴定。
一酸碱滴定
1原理
酸碱滴定法是以酸、碱之间质子传递反应为基础的一种滴定分析法。
基本反应为
H+ + OH- = H2O
也称中和法,是一种利用酸碱反应进行容量分析的方法
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
[2]
2滴定曲线
强碱滴定弱酸
滴定反应为:
以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L)
用NaOH滴定HOAc的滴定曲线
为例,滴定曲线如下图:
滴定开始前 pH=2.88
滴入NaOH 液19.98ml时 pH=7.75
化学计量点时 pH=8.73
滴入NaOH液20.02ml时 pH=9.70
指示剂的选择
(1)只能选择碱性指示剂(酚酞或百里酚酞等),不能选用酸性范围内变色的指示剂(如甲基橙、甲基红等)。
因为突跃范围较小,pH值在7.75~9.70之间;计量点在碱性区。
(2)弱酸被准确滴定的判决是C·Ka>10-8。
因为Ka愈大,突跃范围愈大。
而Ka<10-8时,已没有明显突跃,无法用指示剂来确定终点;另外,酸的浓度愈大,突跃范围也愈大。
3酸碱指示剂
用于酸碱滴定的指示剂,称为酸碱指示剂。
是一类结构较复杂的有机弱酸或有机弱碱,它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。
常用类型
指示剂名称范围酸色中性色碱色
甲基橙 3.1-4.4 红橙黄
甲基红4.4-6.2 红橙黄
溴百里酚蓝 6.0-7.6 黄绿蓝
酚酞 8.2-10.0 无色浅红红
紫色石蕊 5.0-8.0 红紫蓝
4影响滴定结果的因素
⑴读数:滴定前俯视或滴定后仰视(偏大)滴定前仰视或滴定后俯视(偏小)
⑵未用标准液润洗滴定管(偏大);未用待测溶液润洗滴定管(偏小)
⑶用待测液润洗锥形瓶(偏大)
⑷滴定前标准液滴定管尖嘴有气泡,滴定后尖嘴气泡消失(偏大)
⑸不小心将标准液滴在锥形瓶的外面(偏大)
⑹指示剂(可当作弱酸)用量过多(偏小)
⑺滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出(偏小)
⑻开始时标准液在滴定管刻度线以上,未予调整(偏小)
⑼碱式滴定管(量待测液用)或移液管内用蒸馏水洗净后直接注入待测液(偏小)
⑽移液管吸取待测液后,悬空放入锥形瓶,少量待测液洒在外面(偏小)
⑾滴定到指示剂颜色刚变化,就是到了滴定终点(偏小)
⑿锥形瓶用蒸馏水冲洗后,不经干燥便直接盛待测溶液(无影响)
⒀滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁(无影响)
(14)滴定时待测液滴定管尖嘴有气泡,滴定后尖嘴气泡消失(偏小)
二配位滴定
2滴定曲线。
