盐类的水解图像题
盐类的水解图像题含有解析
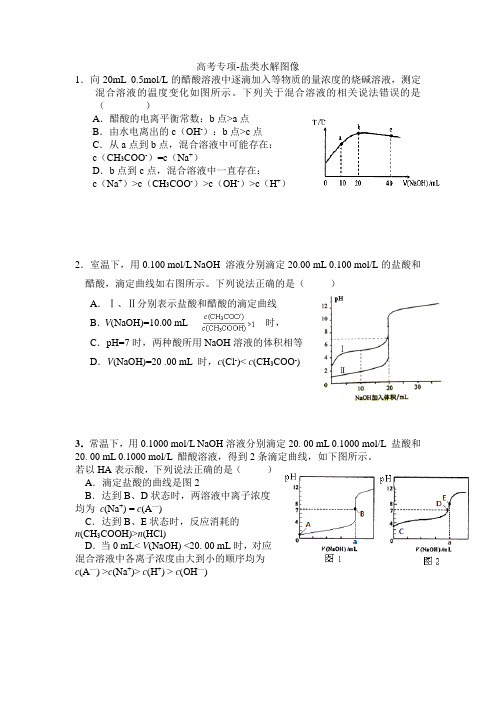
高考专项-盐类水解图像1.向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。
下列关于混合溶液的相关说法错误的是()A.醋酸的电离平衡常数:b点>a点B.由水电离出的c(OH-):b点>c点C.从a点到b点,混合溶液中可能存在:c(CH3COO-)=c(Na+)D.b点到c点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)2.室温下,用0.100 mol/L NaOH 溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如右图所示。
下列说法正确的是()A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线B.V(NaOH)=10.00 mL 时,C.pH=7时,两种酸所用NaOH溶液的体积相等D.V(NaOH)=20 .00 mL 时,c(Cl-)< c(CH3COO-)3.常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
若以HA表示酸,下列说法正确的是()A.滴定盐酸的曲线是图2B.达到B、D状态时,两溶液中离子浓度均为c(Na+) = c(A—)C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A—) >c(Na+)> c(H+) > c(OH—)1A选项,电离常数作为化学常数的一种,只受温度影响,而且电离过程是吸热的,故温度升高,电离常数增大,A正确。
由题意可知点时,恰好生成溶液,则点时溶液过量,能促进水的电离,过量的会抑制水的电离,即点水的电离程度大于点,故B正确。
第三节盐类的水解PPT23张

该体系为: 等n的 CH3COOH --- CH3COONa的混合体系
该溶液中存在的平衡:
CCHH33CCOOOO-H+ H2O
CH3COO- + H CH3COOH
+
+OH
-
电离 >水解 抓主要方面
以上二平衡间有何影响? 相互抑制
四、盐类水解的利用
1、某些盐溶液的配制
如:配制一定浓度的FeCl3、Al2(SO4) 3溶液
二、盐溶液呈现不同酸碱性的原因
(一)强碱弱酸所生成盐的水解
思考: CH3COONa溶液中, ① 溶液中有几种电离?
② 有哪些离子、分子?
③ CH3COONa对水的电离有何影响?
CH3COONa == CH3COO- + Na+
H2O
+ H+
+ OH -
由于CH3COO结合了H+,溶 液中的
c(OH-) > c(H+)
思考3:等浓度混合的CH3COOH 与 CH3COONa溶液的酸碱性。
CH3COOH
CH3COO- + H +
主要
CH3COO- + H2O
CH3COOH +OH-
因电离 >水解,故混合溶液呈酸性
结论3:存在多种平衡的混合溶液,抓主要方面,溶液的酸碱性 也由主要方面决定。
练习:将40mL1mol/L CH3COOH溶液跟40mL 0.5mol/LNaOH 溶液相混合,所得溶液中离子浓度由大到小的顺序是( C )。
H2O
O+H- + H+
NH3·H2O
NH4Cl + H2O
盐类的水解的图像问题练习题(2)

1.25℃ 时,向23Na CO 溶液中滴入盐酸,混合溶液的pH 与离子浓度变化的关系如图所示。
已知:2-3-3(CO )lgX=lg (HCO )c c 或-323(HCO )lg (H CO )c c ,下列叙述错误的是( )A.曲线n 表示pH 与-323(HCO )lg (H CO )c c 的变化关系B.当溶液呈中性时,()+-2-33c Na (HCO )2(CO )c c += C. () 6.4a123K H CO 1.010-⨯=D.25℃ 时,2323CO H O HCO OH ---++的平衡常数为 3.71.010-⨯2.室温下,将两种浓度均为10.1mol L -⋅的溶液等体积混合,假设混合后溶液的体积等于混合前两溶液的体积之和,下列各混合溶液中微粒的物质的量浓度关系正确的是( )A.323NaHCO Na CO -混合溶液(pH=10.30):()()()()233233Na 2CO 2HCO 2H CO c c c c +--=++B.324NH H O NH Cl ⋅-混合溶液(pH=9.25):()()()()432NH H NH H O OH c c c c ++-+=⋅+C.33CH COOH CH COONa -混合溶液(pH=4.76):()()()()33Na CH COOH CH COO H c c c c +-+>>> D.22424H C O NaHC O -混合溶液(pH=1.68):()()()()()222424H H C O Na C O OH c c c c c ++--+=++3.室温下某二元酸2H M 溶液中22H M HM M --、、的浓度对数lg c 随溶液pH 的变化关系如图所示。
下列分析错误的是( )A.该二元酸溶液的浓度为0.01mol/LB.HM -的水解常数的数量级为10C.pH=7时,()()2lg M lg HM 0.77c c ---=D.在NaHM 溶液中,水的电离受到抑制4.设A N 为阿伏加德罗常数值。
《盐类的水解》练习题及答案解析

《盐类的水解》练习题解析1.下列各组离子能够在指定的环境下大量共存的是()A.在pH=0的溶液中:Na+、K+、MnO4-、Cl-B.和Al反应能产生氢气的溶液:K+、NH4+、Cl-、S2O32-C.中性溶液:Al3+、K+、SO42-、AlO2-D.c(H+)<c(OH-)的溶液:Na+、K+、SO32-、S2-分析与解答考虑离子能否大量共存应从下面几个方面考虑:(1)离子间能否发生复分解反应不能大量共存,复分解反应发生的条件为有:有难溶物、挥发性物质、难电离物质生成(2)离子间能发生互促水解,不能大量共存(3)离子间发生氧化还原反应不能大量共存相应氧化性离子可以把下面对应还原性离子氧化说明:I. NO3-、SO32-只有在酸性环境下才表现氧化性II.酸性环境可加大MnO4-、ClO-的氧化性III.络合反应:Fe3+和SCN-不共存注意:①判断离子是否大量共存还有许多隐含的条件,如:“无色透明”、“强酸性”、“强碱性”、“pH=x”等。
有色离子通常有:Cu2+、Fe3+、Fe2+、MnO4-、[Fe(SCN)x]3-(x=1~6)②既可以是强酸性也可以是强碱性的条件是:能溶解Al(OH)3、和Al反应能生成H2的溶液(除H+、NO3-和Al产生NO而不产生H2)、水电离产生c(H+)和c(OH-)浓度都小于10-7mol/L 的溶液、水电离出c(H+)和c(OH-)的乘积小于10-14mol/L的溶液。
③离子间能发生复分解反应的例如:AlO2-、HCO3-不共存,PO43-、H2PO4-不共存。
HCO3-+AlO2-+H2O=Al(OH)3+CO32-PO43-+ H2PO4-=2HPO42-答案:D2.下列离子反应方程式中,不属于水解反应的是A.NH4+ + H2O=NH3·H2O + H+B.NH3·H2O=NH4+ + OH-C.HCO3-+H2O=H3O+ +CO32-D.AlO2-+2H2O=Al(OH)3+ OH-分析与解答B、C选项是电离方程式,水解反应后一定有弱酸或弱碱。
新教材高中化学课时检测13盐类的水解含解析新人教版选择性必修1

盐类的水解1.下图所示是某离子X的水解过程示意图,则离子X可能是( )A.CO2-3B.HCO-3C.Na+D.NH+4解析:选D 由题给水解过程示意图中右侧的结构模型可判断X为NH+4。
2.常温下,某溶液中由水电离产生的H+的浓度为1×10-5mol·L-1,则该溶液中的溶质可能是下列物质中的( )A.HCl B.NaHSO4C.NH4Cl D.NaCl解析:选C 常温下,某溶液中由水电离产生的H+的浓度为1×10-5mol·L-1>1×10-7 mol·L-1,说明溶质是促进水电离的物质,NH4Cl为强酸弱碱盐,促进水的电离,C正确。
3.物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )A.Ba(OH)2、Na2SO3、FeCl3、KClB.Na2SiO3、Na2SO3、KNO3、NH4ClC.NH3·H2O、H3PO4、Na2SO4、H2SO4D.NaHCO3、HClO、C2H5OH、HCl解析:选 B A项pH由大到小顺序为Ba(OH)2>Na2SO3>KCl>FeCl3;B正确;C应为NH3·H2O>Na2SO4>H3PO4>H2SO4;D应为NaHCO3>C2H5OH>HClO>HCl。
4.下列离子方程式表示的是盐类的水解且正确的是( )A.HS-+H2O H3O++S2-B.HS-+H+===H2S↑C.CO2-3+2H2O H2CO3+2OH-D.Fe3++3H2O Fe(OH)3+3H+解析:选D HS-水解的离子方程式为HS-+H2O OH-+H2S,HS-+H2O H3O++S2-表示其电离方程式,A错误;HS-+H+===H2S↑表示HS-与氢离子反应生成硫化氢,B错误;碳酸根离子的水解分步进行,且以第一步水解为主:CO2-3+H2O HCO-3+OH-,C错误;Fe3+水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+,D正确。
【高二特训】盐类水解和离子浓度大小图像专题(提高练习)(解析版)

【高二特训】盐类水解和离子浓度大小图像专题(提高练习)一、多选题1.25℃时,在10mL浓度均为0.1mol·L-1的NaOH和CH3COONa混溶液中滴加0.1mol·L-1盐酸,所得滴定曲线如右图所示。
下列有关溶液中粒子浓度关系正确的是A.a点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B.b点溶液中:c(H+)=c(OH-)-c(CH3COOH)C.c点溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)D.d点溶液中:c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)【答案】BD【解析】【分析】【详解】A.由图知a点溶液为等浓度的NaOH和CH3COONa混合溶液,故c(Na+)>c(OH-)>c(CH3COO-)>c(H+),A项错误;B.b点溶液中的溶质为等物质的量的CH3COONa和NaCl,根据物料守恒知c(Na+)==2c(Cl-)=c(Cl-)+c(CH3COOH)+c(CH3COO-),根据电荷守恒知c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-),联立两式得c(H+)=c(OH-)-c(CH3COOH)(质子守恒),B项正确;C.c点溶液中根据电荷守恒知知c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CH3COO-),因此时c(H+)=c(OH-),则c(Na+)=c(Cl-)+c(CH3COO-),而c(Cl-)>c(CH3COOH),故c(Na+)>c(CH3COOH)+c(CH3COO-),C项错误;D.d点溶液中溶质为NaCl和CH3COOH,且两者的物质的量之比为2:1,根据物料守恒有c(Na+)=c(Cl-)=2c(CH 3COOH)+2c(CH3COO-),且有H2O H++OH-,故有c(Na+)=c(Cl-)>c(H+)>c(CH3COO-),D项正确;答案为BD。
2023届高考化学一轮复习 第28讲 盐类的水解 课件(51张PPT)

―→KKaa22> <KKhh, ,溶 溶液 液显 显____酸碱__性性__________
HA-+H2O
H2A+OH- Kh=cH2cAH·Ac-OH-=KKaw1
水解使溶液显碱性
例:(1) 已知25℃时,草酸(H2C2O4)的电离平衡常数Ka1=5.6×10-2、Ka2=1.5× 10-5,则NaHC2O4的盐类水解平衡常数Kh=____1._8_×_1_0_-_13_________,Kh__<____Ka2, pH__<____7。(填“>”“<”或“=”)
(3) 已知25℃时,HCN电离平衡常数Ka=6.2×10-10,等浓度HCN与NaCN混合溶 液Kh___>___Ka(填“>”“<”或“=”),可见以___N__aC_N_水__解_______为主,溶液pH
___>___7。 【解析】
用精密pH试纸测得浓度均为0.1 mol/L的
C(2021·江苏百校
联考)
NH4HCO3溶液、HCOONa溶液的pH分别为
7.8、10.0
HNO2电离出H+的能 力比CH3COOH的强
H2CO3电离出H+的能 力比HCOOH的强
选项
实验操作和现象
结论
D(2020·苏锡常镇 常温下,分别测定同浓度Na2CO3溶液与
【解析】 pH<7。
(1) Kh=Ka1HK2wC2O4=51.×6×101-01-42=1.8×10-13,Ka2>Kh溶液显酸性,
(2) 已知25℃时,碳酸的电离平衡常数Ka1=4.5×10-7、Ka2=4.7×10-11,则 NaHCO3的盐类水解平衡常数Kh=_____2_.2_×__10_-_8________,Kh___>___Ka2,pH___>___7。 (填“>”“<”或“=”)
盐类的水解规律习题PPT资料优选版

Na2CO3 > NaHCO3
⑤能使H2O + H2O
H3O+ + OH– 的
电离平衡向电离方向移动,且所得溶液
呈酸性的是( B )
32
2SO4 D.将水加热到100℃
NaClO> NaHCO3
Fe3+ + 3H2O Fe(OH)3 + 3H+
(二)外因:符合勒夏特列原理。
①温度: 升温促进水解,降温抑制水解。
CH3COONa的酚酞溶液加热后颜色: 加深
②浓度:
Al3+ + 3H2O
Al(OH)3 + 3 H+ △H>0
加水稀释,促进水解, c(H+)减小 加AlCl3固体,促进水解, c(H+)增大
升温促进水解,降温抑制水解。
)
C、FeCl3 D、Ba(NO3)2
Fe3+与AlO2-、HCO3-、CO32-
A、CO32- + 2H2O
CO2 ↑+ 2OH-
④ 为了使Na CO 溶液中c (Na )/c(CO ) 一般来说,水解趋势大于电离趋势。
2 3 Al3+ + 3H2O
Al(OH)3 + 3 H+ △H>0
Na2CO3 ___ CH33 ___MgCl2
故用“=”连接,且要写上 “ ”、“ ”符号 ⑤能使H2O + H2O
H3O+ + OH– 的电离平衡向电离方向移动,且所得溶液呈酸性的是(
)
一般来说,水解趋势大于电离趋势。
②下列水解的离子方程式正确的( )
结合能力越强
Al3+ + 3H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
--
1.向20mL 0.5mol/L的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。
下列关于混合溶液的相关说法错误的是()
A.醋酸的电离平衡常数:b点>a点
B.由水电离出的c(OH-):b点>c点
ﻩC.从a点到b点,混合溶液中可能存在:
c(CH3COO-)=c(Na+)
ﻩD.b点到c点,混合溶液中一直存在:ﻩﻩﻩﻩﻩﻩ
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
2.室温下,用0.100 mol/L NaOH溶液分别滴定20.00 mL0.100 mol/L 的盐酸和醋酸,滴定曲线如右图所示。
下列说法正确的是()
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00 mL时,
C.pH=7时,两种酸所用NaOH溶液的体积相等
D.V(NaOH)=20 .00mL时,c(Cl-)< c(CH3COO
-)
3.常温下,用0.1000 mol/LNaOH溶液分别滴定20.00 mL 0.1000 mol /L盐酸和20. 00 mL 0.1000mol/L醋酸溶液,得到2条滴定曲线,如下图所示。
若以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度
均为c(Na+)= c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)
>n(HCl)
D.当0mL<V(NaOH) <20. 00 mL时,
对应混合溶液中各离子浓度由大到小的顺序
均为c(A—) >c(Na+)> c(H+)>c(OH—)。
