电解质溶液图像专题
电解质溶液-离子平衡图像

C.c、d两点代表的溶液中c(H+)与c(OH-) 水的离子积常数 乘积相等 D.Fe(OH)3、Cu(OH)2分别在b、c两点代 表的溶液中达到饱和 溶解平衡曲线的认识
考点拓展训练: (1)结合该图,化工流程中除去1mol/LCu2+中的Fe3+,
最适宜的PH范围
(2)该温度下,d点是否处于饱和状态? 溶解平衡图像突破口:
横纵坐标 点
粒子分布图像突破口:
①抓“点”:交点等特殊点 ②抓“线”:搞清各条曲线的所属 ③联“想”:运用三大守恒
线 面
解 题 策 略
溶解平衡图像突破口:
①抓“点、线、面” ②联“想”:溶解平衡移动原理
联想 三大平衡、三大守恒
滴定图像突破口:
①抓“五点”:起点(N)、中性点(M)、中和点(Q)、一半点(P)、过量点(R) ②抓“溶质”:据反应分析各点溶质组成是基础 ③联“想”:运用三大守恒
2016年
2015年 2014年
1卷12题(滴定图像)
1卷13题(稀释图像) 1卷11题(溶解平衡图像)
2018考试说明
接受、吸收、整合化学信息的能力
1.通过对自然界、生产和生活中的化学现象的
观察,以及实验现象、实物、模型的观察,对
图形、图表的阅读,获取有关的感性知识和印
象,并进行初步加工、吸收、有序存储的能力
考点拓展训练: (1)水的电离程度:a点
<
b点(填>,<或者=)
-5 (2)该温度下ROH电离平衡常数约为 1.11×10 。
稀释图像突破口:
①抓“点”:起点等特殊点
②抓“线”:PH图像的斜率判断强弱 (斜率越大酸碱性越 强 ) ③联“想”:电离、水解、稀释规律
电解质溶液图像专题

一、弱电解质的电离平衡
1.(山东理综)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,
平衡时pH值随溶液体积变化的曲线如下图所示。据图判断正确的是
()
D
A.Ⅱ为盐酸稀释时的pH值变化曲线 B.b点溶液的导电性比c点溶液的导电性强 C.a点KW的数值比c点KW的数值大 D.b点酸的总浓度大于a点酸的总浓度
2.常温时,0.10 mol/LH2A 溶液用 0.10 mol/L NaOH 溶液滴定,滴定曲线如下图所示:已知:
①pKa=-lgKa;②二元弱酸 H2A 的酸式盐 NaHA 溶液中的 c(H+) = Ka1 Ka2
下列说法正确的是 A. 可用甲基橙作滴定指示剂 C. 反应 H2A +A2-=2HA-的 PK=9.7 D. Y 点溶液中 c(Na+)=c(OH-) +3c(HA-)-c(H+)
c(M )
c(R增) 大
3.浓度均为0.01mol·L-1、体积均为V1L的两种一元酸HX和HY的
水溶液,加水稀释至体积为VL,测得两溶液pH随lgv/v1变化的
情况如图所示,下列说法错误的是
A. HY为一元弱酸 B. 将两种溶液无限稀释,由水电离产生的c(H+)相等
C. lgvv1=3时,升高温度,c(Y-)c(X-)增大
三、二元酸碱混合滴定
1.已知:pKa=-lgKa,25℃时,H2A 的 pKal=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL 0.1 mol·L-1H2A 溶液的滴定曲线如图所示。下列说法正确的是 A. a 点所得溶液中:V0=10 mL B. b 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) C. A2-水解平衡常数 Kh(A2-)=10-7.19 D. c 点所得溶液中:c(A2-)=c(HA-)
考点16 电解质溶液中两类图像分析-2023-2024学年高二化学核心考点归纳与分层测试(人教版20
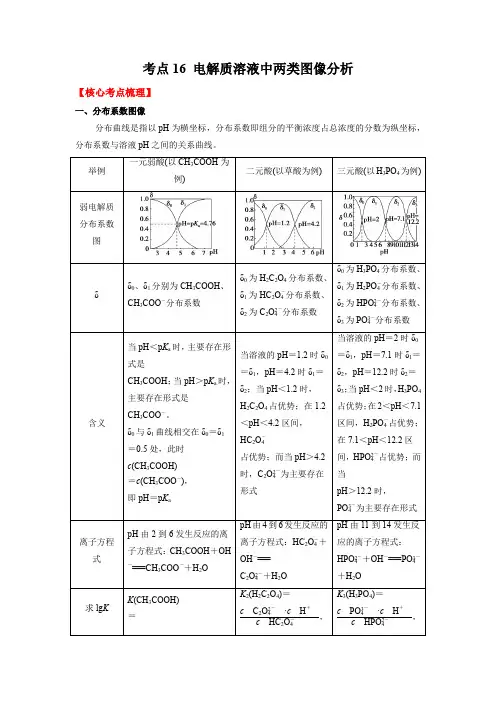
考点16 电解质溶液中两类图像分析【核心考点梳理】一、分布系数图像分布曲线是指以pH为横坐标,分布系数即组分的平衡浓度占总浓度的分数为纵坐标,分布系数与溶液pH之间的关系曲线。
举例一元弱酸(以CH3COOH为例)二元酸(以草酸为例)三元酸(以H3PO4为例)弱电解质分布系数图δδ0、δ1分别为CH3COOH、CH3COO-分布系数δ0为H2C2O4分布系数、δ1为HC2O-4分布系数、δ2为C2O2-4分布系数δ0为H3PO4分布系数、δ1为H2PO-4分布系数、δ2为HPO2-4分布系数、δ3为PO3-4分布系数含义当pH<p K a时,主要存在形式是CH3COOH;当pH>p K a时,主要存在形式是CH3COO-。
δ0与δ1曲线相交在δ0=δ1=0.5处,此时c(CH3COOH)=c(CH3COO-),即pH=p K a当溶液的pH=1.2时δ0=δ1,pH=4.2时δ1=δ2;当pH<1.2时,H2C2O4占优势;在1.2<pH<4.2区间,HC2O-4占优势;而当pH>4.2时,C2O2-4为主要存在形式当溶液的pH=2时δ0=δ1,pH=7.1时δ1=δ2,pH=12.2时δ2=δ3;当pH<2时,H3PO4占优势;在2<pH<7.1区间,H2PO-4占优势;在7.1<pH<12.2区间,HPO2-4占优势;而当pH>12.2时,PO3-4为主要存在形式离子方程式pH由2到6发生反应的离子方程式:CH3COOH+OH-===CH3COO-+H2OpH由4到6发生反应的离子方程式:HC2O-4+OH-===C2O2-4+H2OpH由11到14发生反应的离子方程式:HPO2-4+OH-===PO3-4+H2O求lg K K(CH3COOH)=K2(H2C2O4)=c C2O2-4·c H+c HC2O-4,K3(H3PO4)=c PO3-4·c H+c HPO2-4,c CH 3COO -·c H+c CH 3COOH ,从图可知, c (CH 3COO -) =c (CH 3COOH) 时pH =p K =4.76。
高考化学一轮复习电解质溶液图像分析课件(21张)

2.T ℃时,分别向10 mL浓度均为0.1 mol·L-1的CuCl2溶液和ZnCl2 溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)和-lg c(Zn2 + ) 与 Na2S 溶 液 体 积 的 变 化 关 系 如 图 所 示 [ 已 知 : Ksp(ZnS)>Ksp(CuS),lg 3≈0.5]。下列有关说法错误的是( )
注意:水的电离过程吸热,温度越高,Kw越大。Kw只与温度有关, 与溶液的酸碱性变化无关。水电离出的c水(H+)与c水(OH-)始终相等。
2.中和滴定过程中pH-V图像 25 ℃时,以向20 mL 0.1 mol·L-1一元弱酸HA溶液中加入0.1 mol·L- 1NaOH溶液过程中的pH-V图像为例进行分析:
A.随着盐酸的加入,溶液中水的电离程度先减小后增大 B.Kh1(Na2A)的数量级约为10-3 C.c点对应溶液的pH为8.3
D.b点对应溶液中:c(OH-)=c(H+)+c(HA-)+ c(H2A)
答案:D
1.8 mol·L-1
90 1.02
注意:(1)大部分难溶电解质的电离过程是吸热的,升高温稀释,平衡向溶解方向移动, 但仍为饱和溶液,离子浓度不变,Ksp不变。(3)向平衡体系中加入可 与体系中某些离子反应生成更难溶物质或更难电离物质或气体时,平
衡向溶解方向移动,但Ksp不变。
【专题精练】 1.常温下用0.2 mol·L-1 NaOH溶液分别滴定浓度均为0.2 mol·L-1一 元酸HA和HB溶液,溶液pH与离子浓度的变化关系如图所示。下列有 关叙述错误的是( ) A.Ka(HA)的数量级为10-5 B.酸碱恰好反应时,HB溶液的pH为9.15 C.反应HA+B-⇌HB+A-的平衡常数为10-1.5 D.相同条件下对水电离的影响程度:NaA>NaB
高2017级化学小专题 电解质溶液图像专题 (1)

向移动
2.常温下,CH3COOH 和 NH3·H2O 的电离常数均为 1.8×10-5。向 20 mL 浓度均为 0.1 mol/L NaOH 和 NH3·H2O 的混合液中滴加等物质的量浓度的 CH3COOH 溶液,所得 混合液的导电率与加入 CH3COOH 溶液的体积(V)的关系如图所示。下列说法不正 确的是( )
(在 t℃时,饱和反应 Ag2CrO4 溶液中[Ag+]2·[CrO42-]=Ksp 的图像) A.在 t℃时,Ag2CrO4 的 Ksp 为 1×10-11 B.在饱和溶液中加入 K2CrO4(s)可使溶液由 Y 点到 Z 点 C.在 t℃时,Ag2CrO4(s)+2Cl-(aq)⇌2AgCl(s)+ CrO42- (aq)的平衡常数 K=6.25×107
3.关注横纵坐标变幻的数学意义和化学涵义 【例 7】常温下,二元弱酸 H2A 溶液中滴加 NaOH 溶液,所得混合溶液 pH 与离子浓度变化如图所示,下列
说法正确的是( )
A.直线 M 表示 pH 与 lg 的变化关系
B.Ka2( H2A) =10-4.3 C.交点 e 的溶液中: c(H2A)=c(A2- )>c( HA-)>c(H+)>c(OH-) D.f 点溶液中:c(H+)-c(OH-)=c(HA-)+c(A2-)-c(Na+)
◆题型四 溶解平衡曲线
【例 15】在一定温度下,AgCl 与 AgI 的饱和溶液中存在如下关系,下列说法正确的是( )
A.AgCl(s) +I-(aq) AgI(s) +Cl-(aq),在该温度 溶液中加入 AgNO3 溶液,当 I-刚好完全沉淀时, c(Ag+ )=2×10-12mol/L
专题7-电解质溶液图像题

专题7-电解质溶液图像题真题演练1. 【2021广东选择考适应性测试9】. 叠氮酸(HN 3)与NaOH 溶液反应生成NaN 3。
已知NaN 3溶液呈碱性,下列叙述正确的是A. 0.01 mol·L -1HN 3溶液的pH=2 B. HN 3溶液的pH 随温度升高而减小 C. NaN 3 的电离方程式: NaN 3= Na ++3N 3-D. 0.01 mol·L -1 NaN 3溶液中: c (H +)+ c (Na + )= c (N 3-)+ c (HN 3) 【答案】B【解析】A .由题意,NaN 3溶液呈碱性,叠氮酸根(N 3-)会发生水解,说明HN 3为弱酸,在水溶液中不能完全电离,故0.01 mol·L -1 HN 3溶液的pH>2,A 错误;B .HN 3为弱酸,电离方程式为HN 3=H + +N 3-,电离是吸热过程,升高温度促进HN 3的电离,c (H +)增大, pH 减小,B 正确;C .NaN 3是强电解质,完全电离出Na +和N 3-,电离方程式为 NaN 3= Na ++ N 3-,C 选项错误;D .0.01 mol·L -1 NaN 3溶液中:由物料守恒 c (Na +)= c (N 3-)+ c (HN 3),故D 错误。
2.2.【2021重庆市学业水平选择性考试13】 草酸H 2C 2O 4是二元弱酸。
向100 mL 0.40 mol/L H 2C 2O 4溶液中加入1.0 mol/L NaOH 溶液调节pH ,加水控制溶液体积为200 mL 。
测得溶液中微粒的δ(x)随 pH 变化曲线如图所示,δ(x)=-2-2242424c(x)c(H C O )+c(HC O )+c(C O ),x 代表微粒H 2C 2O 4、HC 2O -4或C 2O 2-4。
下列叙述正确的是A. 曲线Ⅰ是HC 2O -4的变化曲线 B. 草酸H 2C 2O 4的电离常数K= 1.0×10-1.22C. 在 b 点,c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +) D. 在c 点,c(HC 2O -4)=0.06 mol/L 【答案】B【解析】A .当酸性越强时,曲线Ⅰ表示的微粒的含量越高,可推知曲线Ⅰ是H 2C 2O 4的变化曲线,曲线Ⅱ是HC 2O -4的变化曲线,曲线Ⅲ是C 2O 2-4的变化曲线,A 错误;B .在a 点H 2C 2O 4的浓度和HC 2O -4的浓度相等,pH=1.22,则草酸H 2C 2O 4的电离常K =()()()-24224c HC O ?c H c H C O+=()c H +=10-1.22,则B 正确;C .在 b 点,c(C 2O 2-4)= c(HC 2O -4),且溶液呈酸性,若c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +),则2c(OH -)= c(H +),显然不成立,C 错误;D .在c 点,HC 2O -4的含量为0.15,而H 2C 2O 4的物质的量为0.1L× 0.40 mol/L=0.04 mol,则HC 2O -4的物质的量为0.15×0.04 mol=0.006 mol,溶液体积为0.2L ,c(HC 2O -4)=0.006 mol÷0.2L=0.03 mol/L,D 错误。
高中化学专题7 电解质溶液(72张ppt)
沉淀溶解平衡逆向移动,溶液中 仍等于
,温度不变Ksp不变,故
不变,D
项正确。
返
1.(2018年山东济南模拟)25 ℃时,下列有关电解质溶液的说法正确的是( D )。
A.加水稀释0.1 mol·L-1氨水,溶液中c(H+)·c(OH-)和
均不变
B.向饱和AgCl溶液中加入少量AgNO3固体,AgCl的Ksp和溶解度均不变 C.向盐酸中滴加氨水,由水电离出的c(H+)=10-7 mol·L-1时,溶液一定显中性
答 案
解析
返
解析▶根据表格数据分析可知,酸性H2SO3 >HCOOH>CH3COOH>HS 。因为乙 酸的酸性大于HS 而小于H2SO3,所以Na2SO3和乙酸反应生成NaHSO3和乙酸钠, 故A项错误;因为HCOO-水解使甲酸钠呈碱性,且存在质子守恒,c(OH-)=c(H+)+ c(HCOOH),因为溶液的pH=8,所以c(OH-)=10-6 mol·L-1,c(H+)=10-8 mol·L-1,所以 c(HCOOH)=9.9×10-7 mol·L-1,故B项正确;等浓度的乙酸和甲酸溶液中存在电离 平衡,假设甲酸溶液的pH=b, =10-4.74, =10-3.74,计算得b=a-0.5,故C项错 误;因为甲酸的酸性比HS 的酸性强,所以同温度下,等浓度的溶液中HCOO-的 水解程度小于S 的水解程度,即等浓度的甲酸钠的pH小于亚硫酸钠,故D项错 误。
3.酸碱中和滴定实验操作
(1)滴定前的准备工作。a.滴定管的检漏:关闭活塞,加水观察活塞周围有无水渗出;旋
转活塞180°再检验有无水渗出。b.洗涤:滴定管用水洗后一定要用待装液进行润洗;
锥形瓶水洗后不能进行润洗。c.装液调零:将溶液装入滴定管中,赶出气泡,并将液面
电解质溶液图像专题探究
电解质溶液图像专题探究(二课时)电解质溶液图像专题探究的意义:电解质溶液的图像题,从知识载体的角度看:一可用于考查溶液中离子浓度的大小比较;二可考查溶液中离子浓度的守恒问题;三可考查有关电解质溶液的各种计算;四可结合生产和生活实际考查分离和提纯等具体的化学应用问题。
从图像的主要类型看:第一类,是有关电离平衡的图像(包括今天要讲的分布分数图);第二类,是有关滴定曲线的图像;第三类,是有关沉淀溶解平衡的图像。
探究1 分布分数图例1.(2012江苏∙15)25℃,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。
下列有关离子浓度关系叙述正确的是()A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(Na+)+c(H+)=c(CH3COOH)+c(OH-) +c(Cl-)【反思】本题同其它的直接考查离子浓度大小比较和离子浓度守恒问题的题有什么不同?【图像含义】上述这种图可叫分布分数图,可以表示溶液中各种组分随pH的变化而变化的曲线,以下为二元弱酸H2C2O4的分布分数图。
请同学们先观察图像,再回答下列问题①大约在什么pH范围内H2C2O4浓度较其它组分浓度高?②大约在什么pH 时HC 2O 4-浓度最高?③大约在什么pH 范围内C 2O 42-浓度较其它组分浓度高? ④大约在什么pH 时HC 2O 4-和C 2O 42-浓度相等?【拓展】不仅是弱酸的各种组分可随pH 变化,实际上弱碱以及配合物的组分也可随pH 发生变化,生产生活中常利用这种图像指导物质的分离和提纯。
高中化学精品课件:电解质溶液图像
本节总结,认清起点、终点、交点和特殊点
根据图像点线面的含义,特别是溶液的pH和微粒浓度的
联系,结合反应,做出判断
思原理
电荷守恒、物料守恒及其推导式
用公式
各种平衡常数表达式、 pH的计算公式、对数计算公式
Ka1(H2X)
模拟演练
模拟训练
常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列
说法错误的是( D )
-
cHY
A.曲线M表示pH与 lg
的变化关系
cH2Y
-4.3
B.Ka2 (H2Y)=10
C.a点溶液中:c(H +)-c(OH -)=2c(Y2-)+c(HY -)-c(K +)
反应一半的点(酸和盐1:1)
真题演练
2016·天津高考
用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,
滴定曲线如图所示,下列判断错误的是( C )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:
c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
如右图是用0.05 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1
HA溶液时,NaOH溶液体积与溶液pH的关系曲线图。
1、分析图像指出原点和① ② ③ ④四点
溶液中的溶质组成
2、各点热点考查
电离常数的计算
浓度计算
微粒浓度大小关系
物料守恒 电荷守恒
高三化学二轮复习:电解质溶液图像类题目分析课件
浓度小
CuS MnS
浓度大
浓度小
山东卷真题演练
1.(2022·山东,14)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研 究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol· L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg [c(Sr2+)/mol· L-1]随pH的变化关系如图所示。下列说法错误的是 A.反应 SrSO4(s)+CO23-(aq) SrCO3(s)+
(2)写出pH由1到14依次发生反应的离子方程式:__H_3_P_O_4_+__O_H__-_=_=_=_H_2_P_O__- 4 _ +__H__2_O__、_H_2_P_O__-4 _+__O_H_-__=_=_=_H_P_O__24-_+__H__2_O_、_H_P__O_24-_+__O__H_-_=_=_=_P_O__34-_+__H_2_O__。 (3)Ka1=_1_0_-__2 _,Ka2=_1_0_-_7_.1_,Ka3=_1_0_-__12_.2_。
B
•
C. b点对应溶液中Q>KBsp
•
D. a、c点对应的Ksp相等
AgCl(s)
Ag+(aq)+Cl-(aq)
• 真题演练
(2022·广州期末)已知298 K时,Ksp(CuS)=6.3×10-36,Ksp(MnS)=2.5×10-13,随着温度的升高两者的Ksp 都增大。298 K时,饱和溶液中p(S2-)和p(M2+)的关系如图所示,其中p(S2-)=-lgc(S2-),p(M2+)=-lgc(Cu2+)
线下方为不饱和溶液 AgCl的沉淀溶解平衡图像
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
qq:2742438702
本节课的目标
电解质溶液图像题以弱电解质的电离平衡,或盐类的水解平衡以及沉淀溶解 平衡为背景,以图像为载体,考察电解质溶液相关知识为近年命题热点,具体 主要体现在一下几个方面: 1、巩固溶液中离子浓度大小比较、离子浓度守恒式及有关电解质溶液的 各种计算。 2、进一步提高读图、识图、数型分析的基本技能。 3、通过对图表的剖析,掌握对图表题进行定性、定量分析的方法。
3
2、浓度均为0.10 molL、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,
4
3、
5
4、常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度
6
解题方法总结: 1、先看图像的面与线,面要看横坐标和纵坐标的含义,在看线的 变化规律; 2、 再看图像的点,点要看起点,终点和交点以及最高点、最低点 、转折点等。 3、联系电离平衡和水解平衡以及沉淀溶解平衡的规律进行判断; 4、还要特别注意在图表中没有提供的信息或潜在信息。
与君共勉:只有坚持,才有希望成功!
2
1、用0.100 mol· L-1 AgNO3滴定50.0 mL 0.0500 mol· L-1 Cl-溶液 的滴定曲线如图所示。下列有关描述错误的是
A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B. 曲线上各点的溶液满足关系式c(Ag+)· c(Cl-)=Ksp(AgCl) C. 相同实验到a D. 相同实验条件下,若改为0.0500 mol· L-1 Br-,反应终点c向b方 向移动
