电解质溶液图像专题
专题21电解质溶液图像分析(学生版)高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)

专题21 电解质溶液图像分析目录一、热点题型归纳.....................................................................................................................1 【题型一】溶液稀释图像............................................................................................................1 【题型二】水电离度图像............................................................................................................3 【题型三】物质滴定曲线............................................................................................................5 【题型四】浓度比型图像............................................................................................................7 【题型五】分布系数图像............................................................................................................9 二、最新模考题组练 (11)【题型一】溶液稀释图像【典例分析】【典例1】(河南省名校联盟2021~2022学年高三3月联考)常温时,浓度均为1mol ·L -1的CH 3NH 2和NH 2OH 两种碱溶液,起始时的体积都为10mL 。
化学易错题专题训练一电解质溶液图像含解析
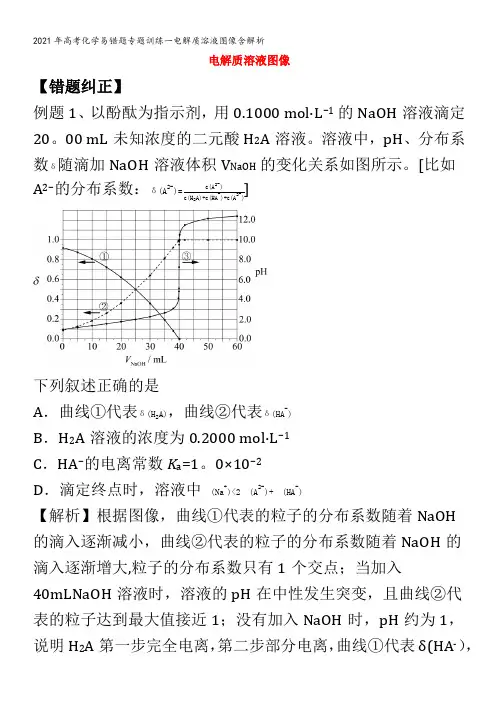
电解质溶液图像【错题纠正】例题1、以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20。
00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。
[比如A2−的分布系数:δ(A2-)=c(A2-)]c(H2A)+c(HA-)+c(A2-)下列叙述正确的是A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.2000 mol·L−1C.HA−的电离常数K a=1。
0×10−2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)【解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A 2—),根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0。
1000mol/L,据此分析作答。
A .根据分析,曲线①代表δ(HA —),曲线②代表δ(A 2-),A 错误;B .当加入40。
00mLNaOH 溶液时,溶液的pH 发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H 2A=Na 2A+2H 2O,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0.1000mol/L ,B 错误;C .根据曲线当δ(HA -)=δ(A 2—)时溶液的pH=2,则HA —的电离平衡常数K a =c(A 2-)⋅c (H +)c (HA -)=c (H +)=1×10—2,C 正确;D .用酚酞作指示剂,酚酞变色的pH 范围为8.2~10,终点时溶液呈碱性,c (OH —)>c (H +),溶液中的电荷守恒为c (Na +)+c (H +)=2c (A 2-)+c (HA —)+c (OH -),则c (Na +)>2c (A 2—)+c (HA -),D 错误;答案选C 。
高2017级化学小专题 电解质溶液图像专题 (1)

向移动
2.常温下,CH3COOH 和 NH3·H2O 的电离常数均为 1.8×10-5。向 20 mL 浓度均为 0.1 mol/L NaOH 和 NH3·H2O 的混合液中滴加等物质的量浓度的 CH3COOH 溶液,所得 混合液的导电率与加入 CH3COOH 溶液的体积(V)的关系如图所示。下列说法不正 确的是( )
(在 t℃时,饱和反应 Ag2CrO4 溶液中[Ag+]2·[CrO42-]=Ksp 的图像) A.在 t℃时,Ag2CrO4 的 Ksp 为 1×10-11 B.在饱和溶液中加入 K2CrO4(s)可使溶液由 Y 点到 Z 点 C.在 t℃时,Ag2CrO4(s)+2Cl-(aq)⇌2AgCl(s)+ CrO42- (aq)的平衡常数 K=6.25×107
3.关注横纵坐标变幻的数学意义和化学涵义 【例 7】常温下,二元弱酸 H2A 溶液中滴加 NaOH 溶液,所得混合溶液 pH 与离子浓度变化如图所示,下列
说法正确的是( )
A.直线 M 表示 pH 与 lg 的变化关系
B.Ka2( H2A) =10-4.3 C.交点 e 的溶液中: c(H2A)=c(A2- )>c( HA-)>c(H+)>c(OH-) D.f 点溶液中:c(H+)-c(OH-)=c(HA-)+c(A2-)-c(Na+)
◆题型四 溶解平衡曲线
【例 15】在一定温度下,AgCl 与 AgI 的饱和溶液中存在如下关系,下列说法正确的是( )
A.AgCl(s) +I-(aq) AgI(s) +Cl-(aq),在该温度 溶液中加入 AgNO3 溶液,当 I-刚好完全沉淀时, c(Ag+ )=2×10-12mol/L
专题7-电解质溶液图像题

专题7-电解质溶液图像题真题演练1. 【2021广东选择考适应性测试9】. 叠氮酸(HN 3)与NaOH 溶液反应生成NaN 3。
已知NaN 3溶液呈碱性,下列叙述正确的是A. 0.01 mol·L -1HN 3溶液的pH=2 B. HN 3溶液的pH 随温度升高而减小 C. NaN 3 的电离方程式: NaN 3= Na ++3N 3-D. 0.01 mol·L -1 NaN 3溶液中: c (H +)+ c (Na + )= c (N 3-)+ c (HN 3) 【答案】B【解析】A .由题意,NaN 3溶液呈碱性,叠氮酸根(N 3-)会发生水解,说明HN 3为弱酸,在水溶液中不能完全电离,故0.01 mol·L -1 HN 3溶液的pH>2,A 错误;B .HN 3为弱酸,电离方程式为HN 3=H + +N 3-,电离是吸热过程,升高温度促进HN 3的电离,c (H +)增大, pH 减小,B 正确;C .NaN 3是强电解质,完全电离出Na +和N 3-,电离方程式为 NaN 3= Na ++ N 3-,C 选项错误;D .0.01 mol·L -1 NaN 3溶液中:由物料守恒 c (Na +)= c (N 3-)+ c (HN 3),故D 错误。
2.2.【2021重庆市学业水平选择性考试13】 草酸H 2C 2O 4是二元弱酸。
向100 mL 0.40 mol/L H 2C 2O 4溶液中加入1.0 mol/L NaOH 溶液调节pH ,加水控制溶液体积为200 mL 。
测得溶液中微粒的δ(x)随 pH 变化曲线如图所示,δ(x)=-2-2242424c(x)c(H C O )+c(HC O )+c(C O ),x 代表微粒H 2C 2O 4、HC 2O -4或C 2O 2-4。
下列叙述正确的是A. 曲线Ⅰ是HC 2O -4的变化曲线 B. 草酸H 2C 2O 4的电离常数K= 1.0×10-1.22C. 在 b 点,c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +) D. 在c 点,c(HC 2O -4)=0.06 mol/L 【答案】B【解析】A .当酸性越强时,曲线Ⅰ表示的微粒的含量越高,可推知曲线Ⅰ是H 2C 2O 4的变化曲线,曲线Ⅱ是HC 2O -4的变化曲线,曲线Ⅲ是C 2O 2-4的变化曲线,A 错误;B .在a 点H 2C 2O 4的浓度和HC 2O -4的浓度相等,pH=1.22,则草酸H 2C 2O 4的电离常K =()()()-24224c HC O ?c H c H C O+=()c H +=10-1.22,则B 正确;C .在 b 点,c(C 2O 2-4)= c(HC 2O -4),且溶液呈酸性,若c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +),则2c(OH -)= c(H +),显然不成立,C 错误;D .在c 点,HC 2O -4的含量为0.15,而H 2C 2O 4的物质的量为0.1L× 0.40 mol/L=0.04 mol,则HC 2O -4的物质的量为0.15×0.04 mol=0.006 mol,溶液体积为0.2L ,c(HC 2O -4)=0.006 mol÷0.2L=0.03 mol/L,D 错误。
高中化学专题7 电解质溶液(72张ppt)

沉淀溶解平衡逆向移动,溶液中 仍等于
,温度不变Ksp不变,故
不变,D
项正确。
返
1.(2018年山东济南模拟)25 ℃时,下列有关电解质溶液的说法正确的是( D )。
A.加水稀释0.1 mol·L-1氨水,溶液中c(H+)·c(OH-)和
均不变
B.向饱和AgCl溶液中加入少量AgNO3固体,AgCl的Ksp和溶解度均不变 C.向盐酸中滴加氨水,由水电离出的c(H+)=10-7 mol·L-1时,溶液一定显中性
答 案
解析
返
解析▶根据表格数据分析可知,酸性H2SO3 >HCOOH>CH3COOH>HS 。因为乙 酸的酸性大于HS 而小于H2SO3,所以Na2SO3和乙酸反应生成NaHSO3和乙酸钠, 故A项错误;因为HCOO-水解使甲酸钠呈碱性,且存在质子守恒,c(OH-)=c(H+)+ c(HCOOH),因为溶液的pH=8,所以c(OH-)=10-6 mol·L-1,c(H+)=10-8 mol·L-1,所以 c(HCOOH)=9.9×10-7 mol·L-1,故B项正确;等浓度的乙酸和甲酸溶液中存在电离 平衡,假设甲酸溶液的pH=b, =10-4.74, =10-3.74,计算得b=a-0.5,故C项错 误;因为甲酸的酸性比HS 的酸性强,所以同温度下,等浓度的溶液中HCOO-的 水解程度小于S 的水解程度,即等浓度的甲酸钠的pH小于亚硫酸钠,故D项错 误。
3.酸碱中和滴定实验操作
(1)滴定前的准备工作。a.滴定管的检漏:关闭活塞,加水观察活塞周围有无水渗出;旋
转活塞180°再检验有无水渗出。b.洗涤:滴定管用水洗后一定要用待装液进行润洗;
锥形瓶水洗后不能进行润洗。c.装液调零:将溶液装入滴定管中,赶出气泡,并将液面
高中化学精品课件:电解质溶液图像

本节总结,认清起点、终点、交点和特殊点
根据图像点线面的含义,特别是溶液的pH和微粒浓度的
联系,结合反应,做出判断
思原理
电荷守恒、物料守恒及其推导式
用公式
各种平衡常数表达式、 pH的计算公式、对数计算公式
Ka1(H2X)
模拟演练
模拟训练
常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示,下列
说法错误的是( D )
-
cHY
A.曲线M表示pH与 lg
的变化关系
cH2Y
-4.3
B.Ka2 (H2Y)=10
C.a点溶液中:c(H +)-c(OH -)=2c(Y2-)+c(HY -)-c(K +)
反应一半的点(酸和盐1:1)
真题演练
2016·天津高考
用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,
滴定曲线如图所示,下列判断错误的是( C )
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:
c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
如右图是用0.05 mol·L-1 NaOH溶液滴定10 mL 0.1 mol·L-1
HA溶液时,NaOH溶液体积与溶液pH的关系曲线图。
1、分析图像指出原点和① ② ③ ④四点
溶液中的溶质组成
2、各点热点考查
电离常数的计算
浓度计算
微粒浓度大小关系
物料守恒 电荷守恒
高考化学 电解质溶液中的平衡图像
[图解过程]
电解质溶液中的平衡图像
电解质溶液中的平衡图像
解题过程: ①先弄清图中的横坐标、纵坐标分别表示什么。 ②利用特殊点,如:pH=7、lgx=0、交点等。 ③根据特殊点判断离子浓度大小,如:lgccHHX2X-=0,则 c(HX-)=c(H2X)。 ④根据 lgccHHX2X-、lgccHXX2--和 pH 可分别求出 Ka1(H2X)和 Ka2(H2X)。 ⑤KHX 溶液的酸碱性判断,比较 Ka2 和 Kh 相对大小可以判断溶液的酸、碱性。 ⑥数量级确定:10-5.4 数量级为 10-6;105.4 数量级为 105。
HPO24-占优势;而当 pH>12.2 时, PO34-为主要存在形式
电解质溶液中的平衡图像
离子方程式 求 lg K
pH 由 2 到 6 发生反应的离
pH 由 4 到 6 发生反应的离 pH 由 11 到 14 发生反应的
子方程式:
CH3COOH+OH- ===CH3COO-+ H2O
子方程式:HC2O-4 +OH- 离子方程式:HPO24-+
分布系数
布系数、δ3 为 PO34-分布系数
δn
当 pH<pKa 时,主要存在形式是 CH3COOH;当 pH>pKa 时,主要 存在形式是 CH3COO-。δ0 与 δ1 曲线相交在 δ0=δ1=0.5 处,此时
当溶液的 pH=1.2 时 δ0=δ1, pH=4.2 时 δ1=δ2;当 pH<1.2 时,H2C2O4 占优势;在 1.2<pH<4.2 区间, HC2O- 4 占
c(R+)
电解质溶液中的平衡图像
2. “pH-lgc1”离子浓度大小比较 c2
例题 (2018·江西模拟)常温下将 KOH 溶 液滴加到己二酸(H2X)溶液中,混合溶液的 pH 与离子浓度变化的关系如右图所示。下列叙述 正确的是( )
高三化学二轮复习:电解质溶液图像类题目分析课件
浓度小
CuS MnS
浓度大
浓度小
山东卷真题演练
1.(2022·山东,14)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研 究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol· L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg [c(Sr2+)/mol· L-1]随pH的变化关系如图所示。下列说法错误的是 A.反应 SrSO4(s)+CO23-(aq) SrCO3(s)+
(2)写出pH由1到14依次发生反应的离子方程式:__H_3_P_O_4_+__O_H__-_=_=_=_H_2_P_O__- 4 _ +__H__2_O__、_H_2_P_O__-4 _+__O_H_-__=_=_=_H_P_O__24-_+__H__2_O_、_H_P__O_24-_+__O__H_-_=_=_=_P_O__34-_+__H_2_O__。 (3)Ka1=_1_0_-__2 _,Ka2=_1_0_-_7_.1_,Ka3=_1_0_-__12_.2_。
B
•
C. b点对应溶液中Q>KBsp
•
D. a、c点对应的Ksp相等
AgCl(s)
Ag+(aq)+Cl-(aq)
• 真题演练
(2022·广州期末)已知298 K时,Ksp(CuS)=6.3×10-36,Ksp(MnS)=2.5×10-13,随着温度的升高两者的Ksp 都增大。298 K时,饱和溶液中p(S2-)和p(M2+)的关系如图所示,其中p(S2-)=-lgc(S2-),p(M2+)=-lgc(Cu2+)
线下方为不饱和溶液 AgCl的沉淀溶解平衡图像
电解质溶液图像专题-例题+练习
电解质溶液图像专题电解质溶液的图像题,从知识载体的角度看:一可用于考查溶液中离子浓度的大小比较;二可考查溶液中离子浓度的守恒问题;三可考查有关电解质溶液的各种计算;四可结合生产和生活实际考查分离和提纯等具体的化学应用问题。
常见的图像题类型:1.pH(或pOH)—体积的变化曲线2.微粒分布分数(或系数)—pH(或pOH)的变化曲线3.浓度—浓度的变化曲线4.对数的变化曲线5.导电能力(或电导率) —体积(或浓度)变化曲线【练1】分布分数图:可以表示溶液中各种组分随pH的变化而变化的曲线。
1.25℃,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。
下列有关离子浓度关系叙述正确的是()A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(Na+)+c(H+)=c(CH3COOH)+c(OH-) +c(Cl-)2.草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:(1)图中曲线1表示的分布系数变化;曲线3表示的分布系数变化.现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4 ③H2C2O4 ④(NH4)2C2O4 ⑤NH4HC2O4 已知NaHC2O4溶液显酸性.(2)Na2C2O4溶液中,c(Na+)/c(C2O42-) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示).(3)常温下,向10mL 0.1mol/L H 2C 2O 4溶液中滴加0.1mol/L NaOH 溶液,随着NaOH 溶液体积的增加,当溶液中c (Na +)=2c (C 2O 42-)+c (HC 2O 4-)时,溶液显 性(填“酸”、“碱”或“中”),且V (NaOH ) 10mL (填“>”、“=”或“<”).(4)下列关于五种溶液的说法中,正确的是A .溶液②中,c (C 2O 42-)<c (H 2C 2O 4)B .溶液②中,c (H 2C 2O 4)+c (OH -)=c (C 2O 42-)+c (H +)C .溶液④⑤中都符合c (NH 4+)+c (H +)=c (HC 2O 4-)+2c (C 2O 42-)+c (OH -)D .五种溶液都符合c (H 2C 2O 4)+c (HC 2O 4-)+c (C 2O 42-)=0.1mol ·L -1.(5)五种溶液中c (H 2C 2O 4)由大到小排列的顺序是具体解法:“四看三联系一注意”:四看:(1)先看图像的面与线,面要看横坐标和纵坐标的含义,线要看各组分浓度随pH 的变化趋势(2)再看图像的点,点要看起点,终点和交点对应的pH(3)点还要看最高点和最低点对应的pH 和各组分存在的pH 范围(4)最后看各条曲线相互重叠程度的大小三联系: 找出某个pH 对应的成分后再联系电离平衡和水解平衡的规律进行判断;一注意: 答题时还要特别注意在图表中没有提供的信息或潜在信息。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、弱电解质的电离平衡
1.(山东理综)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,
平衡时pH值随溶液体积变化的曲线如下图所示。据图判断正确的是
()
D
A.Ⅱ为盐酸稀释时的pH值变化曲线 B.b点溶液的导电性比c点溶液的导电性强 C.a点KW的数值比c点KW的数值大 D.b点酸的总浓度大于a点酸的总浓度
2.常温时,0.10 mol/LH2A 溶液用 0.10 mol/L NaOH 溶液滴定,滴定曲线如下图所示:已知:
①pKa=-lgKa;②二元弱酸 H2A 的酸式盐 NaHA 溶液中的 c(H+) = Ka1 Ka2
下列说法正确的是 A. 可用甲基橙作滴定指示剂 C. 反应 H2A +A2-=2HA-的 PK=9.7 D. Y 点溶液中 c(Na+)=c(OH-) +3c(HA-)-c(H+)
c(M )
c(R增) 大
3.浓度均为0.01mol·L-1、体积均为V1L的两种一元酸HX和HY的
水溶液,加水稀释至体积为VL,测得两溶液pH随lgv/v1变化的
情况如图所示,下列说法错误的是
A. HY为一元弱酸 B. 将两种溶液无限稀释,由水电离产生的c(H+)相等
C. lgvv1=3时,升高温度,c(Y-)c(X-)增大
三、二元酸碱混合滴定
1.已知:pKa=-lgKa,25℃时,H2A 的 pKal=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL 0.1 mol·L-1H2A 溶液的滴定曲线如图所示。下列说法正确的是 A. a 点所得溶液中:V0=10 mL B. b 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-) C. A2-水解平衡常数 Kh(A2-)=10-7.19 D. c 点所得溶液中:c(A2-)=c(HA-)
5.常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸 HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入 NaOH的物质的量的变化如图所示。 下列叙述正确的是( ) A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY) C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
二、一元酸碱混合滴定
1.25 ℃时,用 pH 计测量 VmL0.1 mol·L-1 NaOH 溶液中逐滴滴加等浓度的一元酸 HA 后 pH 的变化情况,绘制 pH 变化曲线如图所示,下列说法不正确的是 A. A 点溶液的 pH=13 B. B 和 C 两点H=7 时,溶液中存在:c(Na+)=c(H+)+(HA) D. C 点所示溶液中离子浓度大小顺序:c(A-)>c(Na+)>c(H+)>c(OH-)
B. X 点溶液 pH=6.4
2.浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,
pH随
lg
V
的变化如图所示,下列叙述错误的是(
)
V0
D
A.MOH的碱性强于ROH的碱性 B.ROH的电离程度:b点大于a点 C.若两溶液无限稀释,则它们的c(OH-)相等
V D.当 lg V0
=2时,若两溶液同时升高温度,则
D. HX 的电离程度:b>a
4.(2015年广东) 一定温度下,水溶液中H+和OH-的浓度变化曲线如图2,下列说
法正确的是
A.升高温度,可能引起有c向b的变化
C B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化 D.该温度下,稀释溶液可能引起由c向d的变化
4、(2015山东高考)室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确 的是
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)= c(A—)+ c(HA) D.b点所示溶液中c(A—)> c(HA)
3.常温下用 0.1000mol/L 的盐酸分别逐滴加入到 20.00mL0.1000 mo1/L 的三种一元碱 MOH、 XOH、YOH 溶液中,溶液的 pH 随加入盐酸体积的变化如图所示。 下列说法不正确的是 A. XOH 为强碱,MOH、YOH 均 为弱碱 B. V(HCl)=15.00mL 时,三份溶液中离子总浓度大小顺序:XOH>MOH>YOH C. 当盐酸滴加至 20.00 mL 时,三条曲线刚好相交 D. 在逐滴加入盐酸至 40.00mL 的过程中,三份溶液中水的电离程度均先增大后减小
2.常温下,用某浓度的 NaOH 溶液滴定 20.00 mL 等浓度的 CH3COOH 溶液,所得滴定曲线如下图。下列说法正确的是 A. a 点醋酸的浓度为 1.0×10-3mol·L-1 B. a、b 两点对应的醋酸电离平衡常数:a<b C. c 点 c(Na+):c(CH3COO-)=1:1 D. d 点溶液升高温度,溶液 pH 不变
4.25℃时,Ka(CH3COOH)=1.7×10-5。该温度下,用 0.1mol/L 的醋 酸滴定 10.00 mL0.1mol/L 的碱 MOH,滴定过程中加入醋酸的体积 (V) 与溶液中 lg[C(H+)/c(OH-)]的关系如图所示。下列说法正确的是 A. MOH 的电离方程式为 MOH M++OHB. a 点:V(CH3COOH)= 10.00mL C. b 点:c(CH3COO-)>c(H+ )>c(M+)>c(OH-) D. 25℃,时,CH3COO-的水解平衡常数为(10/17)×10-9
