高中化学必修二第三章有机化合物化学方程式总结
最新高中化学人教版必修二有机化合物化学方程式总结

高中化学人教版必修二有机化合物单元知识点总结甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+Na OH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
CaCO3 === CaO + CO2 2CaO+5C===2CaC2+CO2CaC2+2H2O→C2H2+Ca(OH)2C+H2O===CO+H2-----高温C2H2+H2→C2H4 ----乙炔加成生成乙烯C2H4可聚合苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)苯和液溴的取代C6H6+Br2→C6H5Br+HBr苯和浓硫酸浓硝酸C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸)苯和氢气C6H6+3H2→C6H12 (条件为催化剂)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这是总方程式)乙醇发生消去反应的方程式CH3CH2OH→CH2=CH2+H2O (条件为浓硫酸170摄氏度)两分子乙醇发生分子间脱水2CH3CH2OH→CH3CH2OCH2C H3+H2O (条件为催化剂浓硫酸140摄氏度)乙醇和乙酸发生酯化反应的方程式CH3COOH+C2H5OH→CH3COOC2H5+H2O乙酸和镁Mg+2CH3COOH→(CH3COO)2Mg+H2乙酸和氧化钙2CH3COOH+CaO→(CH3CH2)2Ca+H2O乙酸和氢氧化钠CH3COOCH2CH3+NaOH→CH3COONa+CH3CH2OH乙酸和碳酸钠Na2CO3+2CH3COOH→2CH3COONa+H2O+CO2↑甲醛和新制的氢氧化铜H CHO+4Cu(OH)2→2Cu2O+CO2↑+5H2O乙醛和新制的氢氧化铜CH3CHO+2CU(OH)2=CH3COOH+CU2O+2H2O乙醛氧化为乙酸2CH3CHO+O2→2CH3COOH(条件为催化剂或加温)乙炔的实验室制法:CaC2+2H2O→Ca(OH)2+C2H2↑实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4 (条件是CaO 加热)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑工业制取乙醇:C2H4+H20→CH3CH2OH (条件为催化剂)乙醛的制取乙炔水化法:C2H2+H2O→C2H4O(条件为催化剂,加热加压)乙烯氧化法:2 CH2=CH2+O2→2CH3CHO(条件为催化剂,加热)乙醇氧化法:2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂,加热)乙酸的制取乙醛氧化为乙酸:2CH3CHO+O2→2CH3COOH(条件为催化剂和加温)加聚反应:乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)氧化反应:甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)苯燃烧2C6H6+15O2→12CO2+6H2O (条件为点燃)乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃)乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)乙醛的催化氧化:CH3CHO+O2→2CH3COOH (条件为催化剂加热)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl(条件都为光照。
(完美版)高中有机化学方程式总结

高中有机化学方程式总结一、烃1.烷烃(烷烃性质较稳定,主要是燃烧和取代反应) 烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl(3)石油气的裂化烷烃的燃烧通式2.烯烃(乙烯产量标志着一个国家石油工业的发展水平)乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯的催化氧化:乙烯可以使酸性烯烃的燃烧通式 (2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)加聚反应乙烯加聚,生成聚乙烯:n H 2C=CH n3.炔烃(可加成、加聚,可使酸性高锰酸钾褪色)乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2 (1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2点燃光光光光浓硫酸170℃高温Ni△催化 催化剂2-CH 2图1 乙烯的制取点燃图2 乙炔的制取Br与氯化氢加成:HC ≡CH+HClCH 2=CHCl与水加成:(3)加聚反应氯乙烯加聚,得到聚氯乙烯:n CH 2n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯(苯密度比水小,沸点为80.1℃,不能使酸性高锰酸钾褪色,能萃取溴使溴水褪色。
化学必修二《第三章 有机化合物》总结

铭叔精华之必修二有机物方程式总结★反应条件自己翻书填上★反应现象和有实验操作的要熟悉★一、物理性质甲烷:无色无味难溶乙烯:无色稍有气味难溶苯:无色有特殊气味液体难溶有毒乙醇:无色有特殊香味混溶易挥发乙酸:无色刺激性气味易溶能挥发三、燃烧现象烷:火焰呈淡蓝色不明亮烯:火焰明亮有黑烟炔:火焰明亮有浓烈黑烟苯:火焰明亮大量黑烟(同炔)醇:火焰呈淡蓝色放大量热四、酸性KMnO4&溴水烷:都不褪色烯炔:都褪色(被高锰酸钾氧化和溴水加成)苯:遇KMnO4 不褪色,萃取使溴水褪色甲烷(正四面体,角度109°28')烷烃:取代CH4 +Cl2 →(光照)→ CH3Cl(g) + HClCH3Cl +Cl2 →(光照)→ CH2Cl2(l) + HClCH2Cl +Cl2 →(光照)→ CHCl3(l) + HClCHCl3 +Cl2 →(光照)→ CCl4(l) + HCl现象:颜色变浅装置壁上有油状液体注:4 种生成物里只有一氯甲烷是气体三氯甲烷= 氯仿四氯化碳作灭火剂乙烯(平面型,120°)——1、加成CH2=CH2 +Br2 → CH2BrCH2BrCH2=CH2 +HCl →(催化剂) → CH3CH2ClCH2=CH2 +H2 →(催化剂,加热) → CH3CH3 乙烷CH2=CH2 +H2O →(催化剂,加热加压) → CH3CH2OH 乙醇2、聚合(加聚)nCH2=CH2 →(一定条件) → [-CH2-CH2-]n (单体→高聚物) 注:断双键→两个“半键” 高聚物(高分子化合物)都是【混合物】苯(平面正六边形,120°)——1.取代反应: + Br 2 Br现象:导管口有白雾、浅黄色沉淀(AgBr )、下层CCl4层有褐色不溶于水的液体(溴苯)+ HONO 2 ——NO 2注:先加浓硝酸再加浓硫酸冷却至室温再加苯50℃-60℃【水浴】 温度计插入烧杯硝基苯:无色油状液体,难溶于水,苦杏仁味,有毒3.加成反应: + 3H 2 乙醇—— 1.氧化反应:2CH 3CH 2OH + O 2 →(Cu,加热)→ 2CH 3CHO(乙醛) + 2H 2O 现象:铜丝表面变黑浸入乙醇后变红液体有特殊刺激性气味 乙醇可以被酸性KMnO 4或酸性K 2Cr 2O 4直接氧化成乙酸。
高中化学有机物方程式总结

高中化学有机物方程式总结
高中化学中,有机物方程式是一种描述有机化合物化学反应的表达式。
有机化合物是由碳和氢组成的化合物,它们通常具有复杂的分子结构和多种化学反应。
有机物方程式总结了有机物的主要化学反应类型和反应条件,帮助我们理解有机化学的基本原理和机理。
以下是一些常见的有机物方程式及其反应类型:
1. 燃烧反应:有机物与氧气反应产生二氧化碳和水。
该反应是有机物在空气中燃烧时产生的基本反应。
例如,乙烷的燃烧反应方程式为:CH + 3O → 2CO + 3HO。
2. 反应性取代:有机物中的一个原子或官能团被另一个原子或官能团取代。
例如,卤代烃的溴取代反应方程式为:CHCHBr + NaOH →CHCHOH + NaBr。
3. 加成反应:两个或多个反应物结合形成一个新的化合物。
例如,烯烃的加成反应方程式为:CH + H → CH。
4. 消除反应:有机物中的两个官能团被移除,形成一个新的化合物和一个小分子。
例如,醇的脱水反应方程式为:CHCHOH → CH=CH + HO。
5. 酯化反应:酸和醇反应生成酯。
例如,乙酸和乙醇的酯化反应方程式为:CHCOOH + CHOH → CHCOOCH + HO。
6. 氧化还原反应:有机化合物中的氧化还原反应涉及电子的转移。
例如,醇的氧化反应方程式为:CHCHOH + [O] → CHCHO + HO。
有机物方程式总结了高中化学中我们需要了解的一些基本有机反应类型,这些反应对于我们理解有机化合物的性质和应用非常重要。
了解这些方程式有助于我们预测和解释有机化学中的一系列反应。
高中化学必修二第三章有机化合物化学方程式总结

高中化学 必修二第三章 有机化合物 化学方程式总结第一节 甲烷1、↑+−−→−+∆432CaO3CH CO Na NaOH COONa CH2、O H 2CO O 2CH 2224+−−→−+点燃3、HCl Cl CH Cl CH 324+−→−+光4、HCl Cl CH Cl Cl CH 2223+−→−+光5、HCl CHCl Cl Cl CH 3222+−→−+光6、HCl CCl Cl CHCl 423+−→−+光7、24H 2C CH +−−→−高温第二节 乙烯 8、O H CH CH OH CH CH 222C17023+↑=−−→−--。
浓硫酸 9、Br CH Br CH Br CH CH 22222-→+= 10、33222CH CH H CH CH -−−→−+=∆催化剂11、Cl CH CH HCl CH CH 2322-→+= 12、O H 2CO 2O 3CH CH 22222+−−→−+=点燃12、OH CH CH O H CH CH 23222--−−→−+=一定条件催化剂13、一定条件催化剂−−→−=22CH nCH n 22]CH CH [- 第三节 烯烃14、−−−→−=一定条件22CH nCH n 2]CH CH [- 15、2222CH CH CH CH Br Br CH CH CH CH --=→-+=-=16、2222CH CH CH CH Br Br CH CH CH CH -=-→-+=-=17、−−−→−=-=一定条件22CH CH CH nCH n 22]CH CH CH CH [-=- 18、−−−→−=-=一定条件22CH C CH nCH n 22]CH C CH CH [-=-第四节 苯 芳香烃19、Br −→−+Fe2Br H B r+20、2NO C60SO H 242NO HO 。
浓−−−→−-+OH 2+21、HSO 3−−−→−-+C80~C 703..H SO HO OH 2+ 22、∆−−→−+催化剂2H 3第五节 石油和石油产品概述3CH Br BrBrBr 3CH 3CH23、1681883416H C H C H C +−→−∆ 24、84104188H C H C H C +−→−∆25、634104H C CH H C +−→−∆26、6242104H C H C H C +−→−∆补充课程 卤代烃27、HBr OH CH CH O H Br CH CH 23NaOH223+−−→−+∆28、NaBr OH CH CH NaOH Br CH CH O H +−−→−+∆2323229、O H NaBr CH CH NaOHBr CH CH 22223++↑=−→−+∆醇30、Cl CH CH H CHCl CH 2322−−−→−+=一定条件31、−−−→−=一定条件CHCl nCH 2[]n 2CHCl CH - 第六节 乙醇32、↑+→+25252H ONa H C 2OH H C 2Na 2 33、CuO 2O Cu 22−→−+∆34、CHO CH Cu OH H C CuO 352+→+ 35、O H 2CHO CH 2O OH H C 223Cu252+−→−+∆(33、34结合) 36、O H Br CH CH HBr OH CH CH 22323+→+37、O H CH CH OH CH CH 222C170SO H 2342+↑=−−−→−。
必修二 有机化学 方程式总结

必修二有机化学方程式总结甲烷和Cl2: CH4+Cl2 CH3Cl+HClCH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HClCHCl3+Cl2CCl4+HCl甲烷燃烧: CH4+2O2 点CO2+2H2O甲烷分解: CH4 1000℃C+2H2乙烯燃烧: C2H4 +3O2 点2CO2+2H2O乙烯与Br2: C2H4+ Br2 C2H4Br2乙烯与H2: C2H4+H2 催C2H6乙烯与HX: C2H4+HX 催CH3CH2X乙烯与H2O: C2H4+H2O 催CH3CH2OH乙烯的加聚: nC2H4 催[ CH2-CH2 ] n苯的燃烧: +15O2 点12CO2+6H2O苯的溴代: +Br2 Br苯的硝化: +HNO3 浓硫酸50-60℃NO2 +H2O 苯的磺化: +H2SO4(浓) 70-80℃SO3H +H2O 苯与H2 : +3H2 Ni △乙醇和钠: 2C2H5OH+2Na 2CH3COONa+H2乙醇燃烧: C2H5OH+O2 点2CO2+3H2O乙醇催化氧化: 2C2H5OH+O2 Cu △2CH3CHO+2H2O乙醇分子内脱水: C2H5OH 浓H2SO4 170℃CH2=CH2 +H2O乙醇分子间脱水: 2C2H5OH浓H2SO4 140℃CH3CH2OC2H5+H2O乙醇与HX: C2H5OH+HX C2H5OX+H2O乙酸与钠: 2CH3COOH+Na 2 CH3COONa+H2O乙酸与NaOH: CH3COOH+NaOH CH3COONa+H2O乙酸Na2CO3: CH3COOH+Na2CO3 CH3COONa+H2O+CO2乙醇与乙酸: CH3COOH+ C2H5OH 浓硫酸△CH3COOC2H5+H2O乙酸乙酯水解: CH3COOC2H5+H2O △CH3COOH+ C2H5OH 乙酸乙酯皂化: CH3COOC2H5+NaOH △CH3COONa+ C2H5OH 蔗糖水解: C12H22O11蔗+H2O 稀硫酸C6H10O6葡+ C6H10O6果麦芽糖水解: C12H22O11麦+H2O 催 2 C6H10O6葡纤维素水解: (C6H10O5)n纤+H2O 催n C6H10O6葡淀粉水解: (C6H10O5)n淀+H2O 催 nC6H10O6葡硬脂酸甘油酯: C17H35COOCH2C17H35COOCH2C17H35COOCH2软质酸甘油酯: C15H35COOCH2C15H35COOCH2C15H35COOCH2油酸甘油酯: C17H33COOCH2C17H33COOCH2C17H33COOCH2。
(完整版)高一化学必修二第三章--有机化合物知识点总结
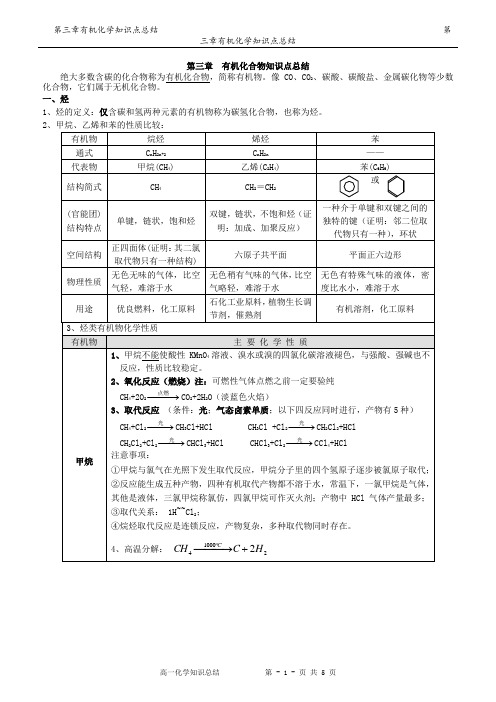
第三章有机化合物知识点总结绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2乙烯1.氧化反应 I .燃烧C 2H 4+3O 2−−→−点燃2CO 2+2H 2O (火焰明亮,伴有黑烟) II .能被酸性KMnO 4溶液氧化为CO 2,使酸性KMnO 4溶液褪色。
2.加成反应CH 2=CH 2+Br 2−→−CH 2Br -CH 2Br (能使溴水或溴的四氯化碳溶液褪色) 在一定条件下,乙烯还可以与H 2、Cl 2、HCl 、H 2O 等发生加成反应CH 2=CH 2+H 2催化剂 △CH 3CH 3CH 2=CH 2+HCl催化剂 △CH 3CH 2Cl (氯乙烷:一氯乙烷的简称) CH 2=CH 2+H 2O高温高压催化剂CH 3CH 2OH (工业制乙醇)3.加聚反应 nCH 2=CH 2催化剂△(聚乙烯)注意:①乙烯能使酸性KMnO 4溶液、溴水或溴的四氯化碳溶液褪色。
常利用该反应鉴别烷烃和烯烃,如鉴别甲烷和乙烯。
②常用溴水或溴的四氯化碳溶液来除去烷烃中的烯烃,但是不能用酸性KMnO 4溶液,因为会有二氧化碳生成引入新的杂质。
苯难氧化 易取代 难加成1.不能使酸性高锰酸钾褪色,也不能是溴水发生化学反应褪色,说明苯的化学性质比较稳定。
但可以通过萃取作用使溴水颜色变浅,液体分层,上层呈橙红色。
2.氧化反应(燃烧)2C 6H 6+15O 2−−→−点燃12CO 2+6H 2O (现象:火焰明亮,伴有浓烟,说明含碳量高) 3.取代反应(1)苯的溴代:(溴苯)+ Br 2FeBr 3+HBr(只发生单取代反应,取代一个H )①反应条件:液溴(纯溴);FeBr 3、FeCl 3或铁单质做催化剂 ②反应物必须是液溴,不能是溴水。
(溴水则萃取,不发生化学反应) ③溴苯是一种 无 色 油 状液体,密度比水 大 , 难 溶于水 ④溴苯中溶解了溴时显褐色,用氢氧化钠溶液除去溴,操作方法为分液。
最新高中化学必修二第三章有机化合物化学方程式总结

高中化学 必修二第三章 有机化合物 化学方程式总结第一节 甲烷1、↑+−−→−+∆432CaO3CH CO Na NaOH COONa CH2、O H 2CO O 2CH 2224+−−→−+点燃3、HCl Cl CH Cl CH 324+−→−+光4、HCl Cl CH Cl Cl CH 2223+−→−+光5、HCl CHCl Cl Cl CH 3222+−→−+光6、HCl CCl Cl CHCl 423+−→−+光7、24H 2C CH +−−→−高温第二节 乙烯 8、O H CH CH OH CH CH 222C17023+↑=−−→−--。
浓硫酸 9、Br CH Br CH Br CH CH 22222-→+= 10、33222CH CH H CH CH -−−→−+=∆催化剂11、Cl CH CH HCl CH CH 2322-→+= 12、O H 2CO 2O 3CH CH 22222+−−→−+=点燃12、OH CH CH O H CH CH 23222--−−→−+=一定条件催化剂13、一定条件催化剂−−→−=22CH nCH n 22]CH CH [- 第三节 烯烃14、−−−→−=一定条件22CH nCH n 2]CH CH [- 15、2222CH CH CH CH Br Br CH CH CH CH --=→-+=-=16、2222CH CH CH CH Br Br CH CH CH CH -=-→-+=-=17、−−−→−=-=一定条件22CH CH CH nCH n 22]CH CH CH CH [-=- 18、−−−→−=-=一定条件22CH C CH nCH n 22]CH C CH CH [-=-第四节 苯 芳香烃19−→−+Fe 2Br H B r+202C60SO H 242NO HO 。
浓−−−→−-+OH 2+21H3−−−→−-+C80~C 703..H SO HO OH 2+22∆−−→−+催化剂2H 3第五节 石油和石油产品概述3CH Br BrBrBr 3CH 3CH23、1681883416H C H C H C +−→−∆ 24、84104188H C H C H C +−→−∆25、634104H C CH H C +−→−∆26、6242104H C H C H C +−→−∆补充课程 卤代烃27、HBr OH CH CH O H Br CH CH 23NaOH223+−−→−+∆28、NaBr OH CH CH NaOH Br CH CH O H +−−→−+∆2323229、O H NaBr CH CH NaOHBr CH CH 22223++↑=−→−+∆醇30、Cl CH CH H CHCl CH 2322−−−→−+=一定条件31、−−−→−=一定条件CHCl nCH 2[]n 2CHCl CH - 第六节 乙醇32、↑+→+25252H ONa H C 2OH H C 2Na 2 33、CuO 2O Cu 22−→−+∆34、CHO CH Cu OH H C CuO 352+→+ 35、O H 2CHO CH 2O OH H C 223Cu252+−→−+∆(33、34结合) 36、O H Br CH CH HBr OH CH CH 22323+→+37、O H CH CH OH CH CH 222C170SO H 2342+↑=−−−→−。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学 必修二第三章 有机化合物 化学方程式总结
第一节 甲烷
1、↑+−−→−+∆
43
2CaO
3CH CO Na NaOH COONa CH
2、O H 2CO O 2CH 2224+−−
→−+点燃
3、HCl Cl CH Cl CH 324+−→−+光
4、HCl Cl CH Cl Cl CH 2223+−→−+光
5、HCl CHCl Cl Cl CH 3222+−→−+光
6、HCl CCl Cl CHCl 423
+−→−+光
7、24H 2C CH +−−→−高温
第二节 乙烯 8、O H CH CH OH CH CH 222C
17023
+↑=−−→−--。
浓硫酸 9、Br CH Br CH Br CH CH 22222-→+= 10、33222
CH CH H CH CH -−−→−+=∆催化剂
11、Cl CH CH HCl CH CH 2322-→+= 12、O H 2CO 2O 3CH CH 22222+−−
→−+=点燃
12、OH CH CH O H CH CH 23222--−−
→−+=一定条件
催化剂
13、一定条件
催化剂
−−
→−=22CH nCH n 22]CH CH [- 第三节 烯烃
14、−−
−→−=一定条件
22CH nCH n 2]CH CH [- 15、2222CH CH CH CH Br Br CH CH CH CH --=→-+=-=
16、2222CH CH CH CH Br Br CH CH CH CH -=-→-+=-=
17、−−
−→−=-=一定条件
22CH CH CH nCH n 22]CH CH CH CH [-=- 18、−−
−→−=-=一定条件
22CH C CH nCH n 22]CH C CH CH [-=-
第四节 苯 芳香烃
19、
Br −→
−+Fe
2Br H B r
+
20、
2
NO C
60SO H 24
2NO HO 。
浓−−−→−-+O
H 2+
21、
H
SO 3−−−→
−-+C
80~C 703..H SO HO O
H 2+ 22、
∆
−−→
−+催化剂2H 3
第五节 石油和石油产品概述
3
CH Br Br
Br
Br 3CH 3
CH
23、1681883416H C H C H C +−→−
∆ 24、84104188H C H C H C +−→−∆
25、634104H C CH H C +−→−
∆
26、6242104H C H C H C +−→−∆
补充课程 卤代烃
27、HBr OH CH CH O H Br CH CH 23NaOH
223+−−→−+∆
28、NaBr OH CH CH NaOH Br CH CH O H +−−→−+∆
23232
29、O H NaBr CH CH NaOH
Br CH CH 22223++↑=−→−+∆
醇
30、Cl CH CH H CHCl CH 2322−−
−→−+=一定条件
31、−−
−
→−=一定条件
CHCl nCH 2[]n 2CHCl CH - 第六节 乙醇
32、↑+→+25252H ONa H C 2OH H C 2Na 2 33、CuO 2O Cu 22−→−
+∆
34、CHO CH Cu OH H C CuO 352+→+ 35、O H 2CHO CH 2O OH H C 223Cu
2
52+−→−+∆
(33、34结合) 36、O H Br CH CH HBr OH CH CH 22323+→+
37、O H CH CH OH CH CH 222C
170SO H 234
2+↑=−−−→−。
浓
38、O H CH CH O CH CH OH CH CH 223223C
140SO H 2342+----−−−→−。
浓
39、O H 3CO 2O 3O H C 22262+−−
→−+点燃
40、乙烯水化制乙醇:OH CH CH O H CH CH 23P
T 222
、一定催化剂−−→−+=
41、卤代烃水解制乙醇:NaBr OH CH CH NaOH Br CH CH 23O
H 232+−−→−+∆
第七节 醛
42、OH CH CH H CHO CH 23Ni
2
3∆
−→−+ 43、34233NO NH AgOH O H NH AgNO +↓→⋅+
44、O H 2OH )NH (Ag O H NH 2AgOH 22323+→⋅+↓ 45、O H NH 3Ag 2COONH
CH OH )NH (Ag 2CHO CH 234
3233++↓+−−→−+热水浴
银氨溶液制备
46、424NaSO )OH (Cu NaOH 2CuSO +↓→+
47、COOH CH O H 2O Cu )OH (Cu CHO CH 232223++↓−→−
+∆
48、OH CH H HCHO
3Ni
2∆
−→−+
49、O H 2NH 7Ag 4HCO NH OH )NH (Ag 4HCHO 233423++↓+−−
→−+热水浴
50、乙烯氧化法制乙醛:CHO CH 2O CH CH 23P
T 222
、一定催化剂−−→−+=
52、2—丙醇氧化制丙酮: O
H 2CH C CH 2O CH CH CH 2233233+--−−→−+--∆
催化剂OH
O
第八节 乙酸
53、O H H COOC CH H C HO COOH CH 2523SO
H 5234
2+−−
−→←-+∆
浓
54、O H COOCH CH CH HO COOH CH 233SO
H 3342+−−
−→←-+∆
浓
55、∆
−−−→←+4
2SO H 3COOH CH 2浓 OH CH OH
CH 22-- 2
323
CH COO CH CH COO CH --O H 22+
56、COOH CH 2O CHO CH 2323−−
→−+催化剂
57、丁烷氧化法制乙酸:O H 2COOH CH 4O 5CH CH CH CH 223P
T 23223+−−→−+、一定催化剂
第九节 油脂
58、
P
T 2H 3、一定催化剂
−−→−+ 2
3317331723317CH COO H C CH COO H C CH COO H C --- 2
351735172
3517CH COO H C CH COO H C CH COO H C ---
59、
+−−−→←+∆
COOH H C 3O H 33517SO H 24
2浓 OH CH OH
CH OH
CH 22--- 2
351735172
3517CH COO H C CH COO H C CH COO H C ---
60、 +→+COONa H C 3NaOH 33517 OH CH OH
CH OH
CH 22---2
351735172
3517CH COO H C CH COO H C CH COO H C ---。
