苏州大学821化学综合14-15年真题
2015年高考试题化学(江苏卷)解析版(2021年整理)

(完整word)2015年高考试题化学(江苏卷)解析版(word版可编辑修改) 编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整word)2015年高考试题化学(江苏卷)解析版(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整word)2015年高考试题化学(江苏卷)解析版(word版可编辑修改)的全部内容。
2015年普通高等学校招生全国统一考试(江苏卷)化学单项选择题:本题包括10小题,每小题2分,共计20分.每小题只有一个选项符合题意。
1.“保护环境"是我国的基本国策。
下列做法不应该提倡的是( )A .采取低碳、节俭的生活方式B .按照规定对生活废弃物进行分类放置C .深入农村和社区宣传环保知识D .经常使用一次性筷子、纸杯、塑料袋等 【答案】D考点:考查环保问题.2.下列有关氯元素及其化合物的表示正确的是( )A .质子数为17、中子数为20的氯原子:B .氯离子(Cl -)的结构示意图:C .氯分子的电子式:D .氯乙烯分子的结构简式:H 3C -CH 2Cl 【答案】C 【解析】试题分析:A 、左上角应是质量数,质量数=中子数+质子数=37,应是37 17Cl ,故A 说法错误;B 、氯离子质子数大于电子数,其结构示意图:B 错误;C 、氯原子最外层7个电子,每个氯原2 8 7+17子都达到8电子稳定结构,故C 正确;D 、氯乙烯结构简式:CH 2=CHCl ,而题目中是氯乙烷,故D 说法错误.考点:考查化学用语。
3.下列说法正确的是( )A .分子式为C 2H 6O 的有机化合物性质相同B .相同条件下,等质量的碳按a 、b 两种途径完全转化,途径a 比途径b 放出更多热能途径a :CCO+H 2CO 2+H 2O途径b :C CO 2C .在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数D .通过化学变化可以直接将水转变为汽油 【答案】C考点:考查同分异构体、反应热、氧化还原反应等知识。
苏州大学2014年621生物化学真题答案

苏州大学2014年攻读硕士学位研究生入学考试试题答案解析一、名词解释1.氨基酸残基组成多肽链的氨基酸单位已不是完整的氨基酸分子,其中每一个-NH-CH-CO-│单位称为氨基酸残基。
R2.PKU症:苯丙酮尿症(PKU)是一种常见的氨基酸代谢病,是由于苯丙氨酸(PA)代谢途径中的酶缺陷,使得苯丙氨酸不能转变成为酪氨酸,导致苯丙氨酸及其酮酸蓄积,并从尿中大量排出。
3.脱氧核苷酸:脱氧核苷与磷酸通过酯键结合即构成脱氧核苷酸,它们是构成DNA的基本结构单位,包括dAMP、dGMP、dTMP、dCMP四种。
4.多聚核蛋白体:不论真核还是原核细胞中1条mRNA模板链可能附着10-100个核蛋白体,同时进行肽链合成,这种mRNA和多个核蛋白体聚合物称为多聚核蛋白体。
5。
RNA聚合酶的核心酶:RNA聚合酶的核心酶由α2ββ构成,如果是全酶再加上σ因子。
核心酶是起转录作用,σ因子是起到识别吸附DNA上的启动子,不参与转录。
只有原核生物有σ因子,真核生物没有,真核生物的RNA聚合酶更复杂。
5.重组修复:复制含有嘧啶二聚体或其它结构损伤的DNA,但当复制到损伤的部位时,子代DNA链中与损伤部位相对应的部位出现缺口,新合成的子链比未损伤的DNA链要短一些。
完整的母链与有缺口的子链重组,缺口由母链来的核苷酸片段弥补。
合成重组后,母链中的缺口通过DNA多聚酶的作用,合成核苷酸片段,然后由连接酶使新片段与旧链联结,重组修复完成。
6.FAD黄素腺嘌呤二核苷酸,又称活性型维生素B2、核黄素-5'-腺苷二磷酸,是糖代谢三羧酸循环中的一种重要黄素辅基,一些脱氢酶以它为辅基,维生素B2是它的活性基团。
FAD是一种比NAD和NADP更强的氧化剂,能参与两个连续的电子传递或同时发生的两个电子的传递。
F指黄素,A指腺嘌呤,D是指二核苷酸7.多酶复合物:多种酶通过非共价键相互嵌合催化连续反应的体系,称为多酶复合物(multienzyme complex)。
苏州大学有机试卷
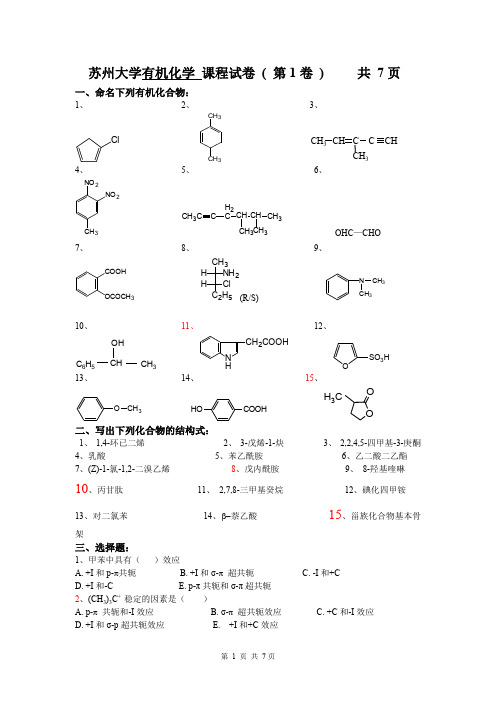
苏州大学有机化学 课程试卷 ( 第1卷 ) 共 7页一、命名下列有机化合物:1、2、3、ClCH 3CH 3CH 3CH 3CC CH4、5、6、NO 23NO 2CH 3CCH 2C CH CH CH 33CH 3 OHC —CHO7、8、9、COOH OCOCH 3CH 3NH 2H ClH 2H 5(R/S) N CH 3CH 310、11、 12、C 6H 5CHOHCH 3N HCH 2COOHOSO 3H13、14、15、O CH 3COOHHOOO H 3C二、写出下列化合物的结构式:1、 1,4-环已二烯2、 3-戊烯-1-炔3、 2,2,4,5-四甲基-3-庚酮4、乳酸5、苯乙酰胺6、乙二酸二乙酯7、(Z)-1-氯-1,2-二溴乙烯8、戊内酰胺9、 8-羟基喹啉10、丙甘肽 11、 2,7,8-三甲基癸烷 12、碘化四甲铵13、对二氯苯 14、β-萘乙酸 15、甾族化合物基本骨架三、选择题:1、甲苯中具有( )效应A. +I 和p-π共轭B. +I 和σ-π 超共轭C. -I 和+CD. +I 和-CE. p-π共轭和σ-π超共轭 2、(CH 3)3C + 稳定的因素是( )A. p-π 共轭和-I 效应B. σ-π 超共轭效应C. +C 和-I 效应D. +I 和σ-p 超共轭效应E. +I 和+C 效应3、能在硫酸汞催化下与水发生加成,并发生重排的物质是()A.3H3CHC B. CH3CH2C CH C. CH3CH2CH2CH3D. CH3CH2CH2CH2ClE. C6H5CH CH24、不能使KMnO4/H+溶液褪色的化合物是()A.CH2CH2CH2 B.CH3CH2C.H OD. 2OHE. CH CH5、下列化合物中无芳香性的是()C. D.E.6、下列各对化合物的酸性强弱的比较中,哪一对是正确的()>>C.OH H2CO3>3H>E.COOH> HCOOH7、下列化合物中羰基活性最大的是()A. HCHOB. CH3CHOC. CH3COCH3D.C CH3OE.CHO8、下列化合物最容易发生水解反应的是()A. CH3CH2CH2COOHB. (CH3CO)2OC. CH3COOCH2CH3D. CH3CH2CH2COClE.CH3CH2CH2CONH29、不发生银镜反应的是()A. 甲酸酯B. 甲酰胺C. 甲酸D. 甲基酮E.甲醛10、下列酸性最强的化合物是()A.COOHNO2B.O2C.CHD.E.COOHH3CO11、2,4-二碘戊烷的旋光异构体数目为()A. 2个B. 3个C. 4个D. 5个E.8个12、下列化合物,不属于季铵盐类的化合物是()A. CH3NH3Cl-B. (CH3CH2)4NCl-C. (C2H5)3NCH3I-D. (CH3CH2CH2)4NBr-E. (C2H5)3NCH3Cl-13、下列化合物酸性由强到弱排列正确的是()1. 正丙胺2. CH3CH2CH2SH3. CH3CH2CH2OHA. 1>2>3B. 2>1>3C. 3>2>1D. 2>3>1E.都不对14、NNHCH3NHNCH3的变化属于()A. 变旋光现象B. 构型异构现象C. 互变异构现象D. 碳链异构E.差向异构15、下面有关糖原结构的叙述是,错误的是()A. 含有α-1,4糖苷键B. 含有α-1,6糖苷键C. 组成糖原的结构单位是D-葡萄糖D. 糖原是无分支的分子E. 糖原是具有分支状分支结构的分子16、OCH2OHHOHO OH的名称是()A. β-D-吡喃甘露糖B. α-D-吡喃葡萄糖C. α-D-呋喃半乳糖D. β-D-吡喃半乳糖E. α-D-吡喃甘露糖17、下列试剂中可用于检查糖尿病患者尿中葡萄糖的是()A. 米伦试剂B. FeCl3溶液C. 茚三酮溶液D. 班氏试剂E.缩二脲试剂18、下列脂肪酸中为必需脂肪酸是()A. 软脂酸B. 硬脂酸C. 油酸D. 亚油酸E. 花生酸19、用重金属盐沉淀蛋白质时,蛋白质溶液的pH值最好调节为()A. 大于7B. 小于7C. 7D. 稍大于等电点E. 稍小于等电点20、酪蛋白的PI=4.60,它在蒸馏水中溶解后溶液的()A. pH>7B. pH=7C. pH=4.6D. pH<7E. pH不定四、完成下列反应式:1、NaOH-H2O2Cl2、+无水AlCl3 H3C C l3、C2H5OHΔH3C H2C H2C C l+KC N4、H3CH2C CH CH3OHI2+NaOH5、CH2CH CH2SHOH SHHg2+6、C6H5NaBH47、CH2CH COOHNH28、CH3(CH2)2COCOOH稀H249、2C lC H3N H2+10、N2+Cl-Cu2(CN)211、OCHO12、CHOCH2OHHNO3五、鉴别题:1、丙醛、丙酮、异丙醇2、苯丙氨酸、色氨酸、甘氨酸3、乙醚、乙烷、乙醇4、环丙烷、丙烷、丙烯、丙炔六、推证结构式:1、某二糖水解后,只产生D-葡萄糖,不与托伦试剂和斐林试剂反应,不生成糖脎,无变旋光现象,不生成糖苷,它只为麦芽糖酶水解,但不被苦杏仁酶水解,写出该二糖的哈瓦斯结构式。
2014年硕士研究生入学考试 物理化学(苏州大学

苏州大学2014年硕士研究生入学考试初试试题(B 卷)科目代码:《853》 满分:《150》分 科目名称:《物理化学》注意:①认真阅读答题纸上的注意事项;②所有答案必须写在答题纸上 ,写在本试题纸或草稿纸上均无效;③本试题纸须随答题纸一起装入试题袋中交回!一、选择题(共15题,30分)1、2分下列的过程可应用公式△H=Q 进行计算的是( )(A) 不做非体积功,终态压力相同但中间压力有变化的过程(B) 不做非体积功,一直保持体积不变的过程(C) 273.15 K ,p 下液态水结成冰的过程(D) 恒容下加热实际气体【考点解析】热力学第一定律基本知识点考察,知道这个公式适用条件即可解答。
【参考答案】C。
公式适用条件为等压不做非膨胀功的时候。
2、2分25℃时,1 mol 理想气体等温膨胀,压力从 10p 变到p ,体系吉布斯自由能变化多少?( )(A) 0.04 kJ (B) -12.4 kJ (C) 1.24 kJ (D) -5.70 kJ【考点解析】热力学第一定律知识点吉布斯自由能的考察,懂得吉布斯自由能计算公式,以及理想气体等温膨胀过程。
【参考答案】D。
通过题目所给数据,知道是等温膨胀过程,带入公式得出答案。
3、2分理想气体经绝热可逆膨胀至一定的终态,该过程中体系的熵变ΔS 体 及环境的熵变ΔS 环应为: ( )(A) ΔS 体>0,ΔS 环<0 (B ) ΔS 体<0,ΔS 环>0(C) ΔS 体>0,ΔS 环=0 (D ) ΔS 体=0,ΔS 环=0【考点解析】热力学第二定律关于熵的考察,重点理解绝热可逆过程。
【参考答案】D。
因为为绝热可逆过程。
4、2分若一气体的方程为pV m =RT +αp (α>0 常数),则: ( ) (A) ()T U V ∂∂=0 (B) ()V U p∂∂=0 (C) ()V U T ∂∂=0 (D) ()p U T∂∂=0 【考点解析】热力学第一定律知识点关于内能的考察。
《苏州大学834分析化学2007-2015年考研真题及答案解析》

苏州大学 2007 年招收攻读硕士学位研究生入学考试试卷答案解析................................ 52 苏州大学 2008 年招收攻读硕士学位研究生入学考试试卷答案解析................................ 69 苏州大学 2009 年招收攻读硕士学位研究生入学考试试卷答案解析................................ 86 苏州大学 2010 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 103 苏州大学 2011 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 118 苏州大学 2012 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 131 苏州大学 2013 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 150 苏州大学 2014 年招收攻读硕士学位研究生入学考试试卷答案解析.............................. 162
C.PhCOCH2Br
D.
《苏州大学分析化学历年考研真题及答案解析》
2/179
4.下列关于有机化合物的红外光谱的描述中,不正确的是: ( )
A.C-H 键中碳原子杂化态的 s 成分越大,C-H 键越强,振动频率也越高
江苏省扬州市2014-2015学年高二下学期期末考试 化学 Word版含答案.pdf

准状况下,该氢化物气体的相对分子质量为43.0,其中氮原子的质量分数为0.977。该氢化物受撞击后可完全分解为两
种单质气体。该氢化物分解的化学方程式为▲ 。
氨氧化法制硝酸工业尾气中的NO、NO2气体可用氨水吸收,反应方程式为6NO+4NH3===5N2十
6H2O6NO2+8NH3===7N2+12H2O。若尾气中NO和NO2共18 mol被氨水完全吸收后,产生了15.6 mol N2,则此尾气中NO与
选择该催化剂的理由是: ▲
。
某科研小组用选择的催化剂,在380℃时,研究了n(CO) : n(SO2)分别为1:1、3:1时,SO2转化率的变化情况(图
2)。则图2中表示n(CO) : n(SO2)=3:1的变化曲线为 ▲ 。
()研究铁屑地下水的反应原理。
①pH=2.5时,用铁粉还原KNO3溶液,相关离子浓度、pH随时间的变化关系如图部分副反应产物曲线略去。请根据
沉淀生成,再向其中滴加0.1 mol·L-1 NaI溶液sp(AgCl )> Ksp (AgI)13.将E和F加入密闭容器中,在一定条件下发
生反应:E(g)+F(s)2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
体积分数/% 压强/MPa温度/℃1.02.03.081054.0ab915c75.0d1 000ef83.0A.B. f
量分数▲ (填“偏高”、“偏低”或“无影响”)。
19.(12分)(1)联氨(N2H4)是一种高能燃料。工业上可以利用氮气和氢气制备联氨。
已知:N2(g)+H2(g)=N2H4(l) △H=+ 50.6kJ·mol-1 ; 2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
2014年2015年-高考理综试题及答案-全国卷1和2集合

2014年2015年-高考理综试题及答案-全国卷1和2集合D7.下列过程没有发生化学反应的是A.用活性炭去除冰箱中的异味B.用热碱水清除炊具上残留的污垢C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果D.用含硅胶、铁粉的透气小袋与食品一起密封包装8.四联苯的一氯代物有A. 3种B. 4种C. 5种D. 6种9.下列反应中,反应后固体物质增重的是A.氢气通过灼热的CuO粉末B. 二氧化碳通过Na2O2粉末C. 铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液10.下列图示试验正确的是11.一定温度下,下列溶液的离子浓度关系式正确的是A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5m ol·L-1 B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC24O)D. pH相同的①CH3COONa②NaHCO3③NaCIO三种溶液的c(Na+):①>②>③12. 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。
下列叙述错误的是A.a为电池的正极B.电池充电反应为LiMn2O4=Li1-xMn2O4+xLiC.放电时,a极锂的化合价发生变化D.放电时,溶液中的Li+从b向a迁移13.室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2:C u S O4·5H2O受热分解的化学方程式为:,热效应为ΔH3。
则下列判断正确的是A.ΔH2>ΔH3B.ΔH1<ΔH3C. ΔH1+ΔH3=ΔH2D.ΔH1+ΔH2=ΔH3二、选择题:本题共8题,每小题6分。
在每小题给出的四个选项中,第14—18题只有一项符合题目要求,第19—21题有多项符合题目要求。
2015年江苏省高考化学试卷答案和考点解析

2015年江苏省高考化学试卷一、单项选择题:本题包括10小题,每小题2分,共计20分.每小题只有一个选项符合题意.1.(2分)(2015•江苏)“保护环境”是我国的基本国策.下列做法不应该提倡的是()2.(2分)(2015•江苏)下列有关氯元素及其化合物的表示正确的是()Cl3.(2分)(2015•江苏)下列说法正确的是()24.(2分)(2015•江苏)在CO 2中,Mg 燃烧生成MgO 和C .下列说法正确的是( )25.(2分)(2015•江苏)短周期主族元素X 、Y 、Z 、W原子序数依次增大,X 原子最外层有6个电子,Y 是至今发现的非金属性最强的元素,Z 在周期表中处于周期序数等于族序数的位置,W 的单质广泛用作半导体材料.下列叙述正确的是( )6.(2分)(2015•江苏)常温下,下列各组离子一定能在指定溶液中大量共存的是()=1×10﹣13mol•L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣7.(2分)(2015•江苏)下列实验操作正确的是()8.(2分)(2015•江苏)给定条件下,下列选项中所示的物质间转化均能一步实现的是()MgCl Mg3[Ag9.(2分)(2015•江苏)下列指定反应的离子方程式正确的是()10.(2分)(2015•江苏)一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是()3H二、不定项选择题:本题包括5小题,每小题4分,共计20分.每小题只有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分.11.(4分)(2015•江苏)下列说法正确的是()12.(4分)(2015•江苏)己烷雌酚的一种合成路线如图:下列叙述正确的是( )13.(4分)(2015•江苏)下列设计的实验方案能达到实验目的是()14.(4分)(2015•江苏)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是()15.(4分)(2015•江苏)在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)⇌2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是()二、非选择题16.(12分)(2015•江苏)以磷石膏(只要成分CaSO 4,杂质SiO 2、Al 2O 3等)为原料可制备轻质CaCO 3.(1)匀速向浆料中通入CO 2,浆料清液的pH 和c (SO 42﹣)随时间变化见图.清液pH >11时CaSO 4转化的离子方程式为 CaSO 4+2NH 3•H 2O+CO 2=CaCO 3+2NH 4++SO 42﹣+H 2O 或CaSO 4+CO 32﹣=CaCO 3+SO 42﹣ ;能提高其转化速率的措施有 AC (填序号)A .搅拌浆料B .加热浆料至100℃C .增大氨水浓度D .减小CO 2通入速率 (2)当清液pH 接近6.5时,过滤并洗涤固体.滤液中物质的量浓度最大的两种阴离子为 SO 42﹣ 和 HCO 3﹣ (填化学式);检验洗涤是否完全的方法是 取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全.Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,(3)在敞口容器中,用NH4溶液中c(Ca2+)增大的原因是浸取液温度上升,溶液中氢离子浓度增大,促进固体中钙离子浸出.17.(15分)(2015•江苏)化合物F 是一种抗心肌缺血药物的中间体,可以通过以下方法合成:(1)化合物A 中的含氧官能团为 醚键 和 醛基 (填官能团的名称). (2)化合物B 的结构简式为 ;由C →D 的反应类型是: 取代反应 .(3)写出同时满足下列条件的E 的一种同分异构体的结构简式.Ⅰ.分子含有2个苯环Ⅱ.分子中含有3种不同化学环境的氢(4)已知:RCH 2CN RCH 2CH 2NH 2,请写出以为原料制备化合物X (结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH 3CHOCH 3COOHCH 3COOCH 2CH 3.,经水解、还原,最终生成;制备,经水解、还原,最终生成,,制备,然后与发生加成反应生成,18.(12分)(2015•江苏)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4(1)质量为17.40g纯净MnO2最多能氧化 4.48 L(标准状况)SO2.(2)已知:Ksp [Al(OH)3]=1×10﹣33,Ksp[Fe(OH)3]=3×10﹣39,pH=7.1时Mn(OH)2开始沉淀.室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10﹣6mol•L﹣1),需调节溶液pH范围为 5.0<pH<7.1 .(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4•H2O晶体,需控制结晶温度范围为高于60℃.(4)准确称取0.1710gMnSO4•H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol•L﹣1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL.计算MnSO4•H2O样品的纯度(请给出计算过程)=0.2mol19.(15分)(2015•江苏)实验室用图所示装置制备KClO 溶液,并通过KClO 溶液与Fe (NO 3)3溶液的反应制备高效水处理剂K 2FeO 4.已知K 2FeO 4具有下列性质①可溶于水、微溶于浓KOH 溶液,②在0℃﹣5℃、强碱性溶液中比较稳定,③在Fe 3+和Fe (OH )3催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成Fe (OH )3和O 2.(1)装置A 中KMnO 4与盐酸反应生成MnCl 2和Cl 2,其离子方程式为 2MnO 4﹣+16H ++10Cl ﹣=2Mn 2++5Cl 2↑+8H 2O ,将制备的Cl 2通过装置B 可除去 HCl (填化学式).(2)Cl 2和KOH 在较高温度下反应生成KClO 3,在不改变KOH 溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是 缓慢滴加盐酸、装置C 用冰水浴中 .(3)制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中.(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L﹣1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2﹣3次后,在真空干燥箱中干燥(实验中须使用的试剂有:饱和KOH溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱).20.(14分)(2015•江苏)烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量;O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:NO(g)+O3(g)═NO2(g)+O2(g)△H=﹣200.9kJ.mol﹣1NO(g)+O2(g)═NO2(g)△H=﹣58.2kJ.mol﹣1SO2(g)+O3(g)═SO3(g)+O2(g)△H=﹣241.6kJ.mol﹣1(1)反应3NO(g)+O3(g)=3NO2(g)的△H= ﹣317.3 mol•L﹣1.(2)室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见图.①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是O3将NO2氧化为更高价态氮氧化物.②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是可能是其反应较慢.(3)当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO32﹣将NO2转化为NO2﹣,其离子方程式为:SO32﹣+2NO2+2OH﹣=SO42﹣+2NO2﹣+H2O .(4)CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32﹣)=[用c(SO42﹣)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因CaSO3转化为CaSO4使溶液中SO32﹣的浓度增大,加快SO32﹣与NO2的反应速率.OO;根据故答案为:四.(12分)【选做题】本题包括21、22两小题,请选定一中一小题,并在相应的答题区域内作答.若多做,则按A小题评分.21.(12分)(2015•江苏)下列反应曾用于检测司机是否酒后驾驶:2Cr2O 72﹣+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH(1)Cr3+基态核外电子排布式为1s22s22p63s23p63d3;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是O (填元素符号).(2)CH3COOH中C原子轨道杂化类型为sp3和sp2.1mol CH3COOH分子中含有σ键的数目为7mol或7×6.02×1023.(3)与H2O互为等电子体的一种阳离子为H2F+(填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为H2O与CH3CH3OH之间可以形成氢键.22.(2015•江苏)实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2﹣二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经H2SO4干燥过的液溴,保温反应一段时间,冷却.步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机相用10%NaHCO3溶液洗涤.步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤.步骤4:减压蒸馏有机相,收集相应馏分.(1)实验装置中冷凝管的主要作用是冷凝回流,锥形瓶中的溶液应为NaOH .(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3.(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的Br2、HCl (填化学式).(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水.(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.附表相关物质的沸点(101kPa)2015年江苏省高考化学试卷答案和考点解析31 / 31。
