物理有机化学习题
有机化学课后习题答案12第十二章醛和酮核磁共振谱(第5轮)答案

1. 2-丁烯醛
CH3CH=CHCHO
2,4-戊二酮
4-氯-4-甲基-2-戊烯醛
14. CH3COCH2CH2OH 15. (CH3)2 CHCH2CHO
4-羟基-2-丁醇
4-甲基丁醛
2. 二苯甲酮
C O
3. 2,2-二甲基环戊酮
O
C
CH3
CH3
4. 3-(间羟基苯基)丙醛
5. 甲醛苯腙
6. 丙酮缩氨脲
)。
A.糠醛
B.甲醛
C.乙醛
D.苯甲醛
9. 醛.酮与锌汞齐(Zn-Hg)和浓盐酸一起加热,羰基即被( C )。
A.氧化为羧基 B.转变成卤代醇 C.还原为亚甲基 D.还原为醇羟基
10. C6H5COCH2CH2C6H5 的系统命名法名称应该是:(B )
A.1,3-二苯基-3-丙酮
B.1,3-二苯基-1-丙酮
8.
CHCHO
CH3
2-环己基丙醛
9.
O CH3
CH3 C CHCH2CHO
3-甲基-4-氧代戊醛
10. CH3CHCH2COCH2CH3
CH2CH3
11. CH3COCH2COCH3
Cl
12.
(CH3)2CCH CHCHO
5-甲基-3-庚酮
13.
CH3 CH3C N OH
丙酮肟
二.写出下列化合物结构式
R CH R' OH
R CH2 R'
NH2NH2 , NaOH (HOCH2CH2)2O
R
CH2
R'
还原能力较强,还能还原碳碳不饱和键。 还原能力较弱,仅能将羰基还原成羟基。 还原能力比四氢硼钠稍强,能还原羧基。 Clemmensen 还原法 黄鸣龙还原法
有机化学课后习题及答案(第六章)

有机化学课后习题及答案(第六章)6章思考题6.1 试解释实验中所遇到的下列问题:(1)(1)⾦属钠可⽤于除去苯中所含的痕量H2O,但不宜⽤于除去⼄醇中所含的⽔。
(2)(2)为什么制备Grignard试剂时⽤作溶剂的⼄醚不但需要除去⽔分,并且也必须除净⼄醇(⼄醇是制取⼄醚的原料,常参杂于产物⼄醚中)。
(3)(3)在使⽤LiAlH4的反应中,为什么不能⽤⼄醇或甲醇作溶剂?6.2 叔丁基醚[(CH3)3C]2O既不能⽤Williamson法也不能⽤H2SO4脱⽔法制得,为什么?6.3 苯酚与甲苯相⽐有以下两点不同的物理性质:(a)苯酚沸点⽐甲苯⾼;(b)苯酚在⽔中的溶解度较甲苯⼤。
你能解释其原因吗?6.4 解释下列现象(1)(1)从2-戊醇所制得的2-溴戊烷中总含有3-溴戊烷。
(2)(2)⽤HBr处理新戊醇(CH3)2C-CH2OH时只得到(CH3)2CBrCH2CH3。
解答6.1 答(1)⼄醇的活泼氢能与Na发⽣反应,苯与Na⽆反应。
(2)RMgX不仅是⼀种强的亲核试剂,同时⼜是⼀种强碱,可与醇羟基中的H结合,即RMgX可被具活性氢的物质所分解,如(3)LiAlH4既是⼀种强还原剂,⼜是⼀种强碱,它所提供H-与醇发⽣反应,如6.2叔丁基醚⽤H2SO4脱⽔法合成时,主要产⽣烯烃。
6.3 答甲苯和苯酚的相对分⼦质量相近,但是甲苯的沸点110.6℃,⽽苯酚的沸点181.8℃,这是由于苯酚可以形成分⼦间氢键;甲苯不溶于⽔,⽽苯酚易溶于⽔,是由于苯酚与⽔分⼦之间会形成氢键:6.4习题6.1⽐较下列各组化合物与卢卡斯试剂反应的相对速度:(1) 正戊醇, 2-甲基-2-戊醇, ⼆⼄基甲醇(2) 苄醇, 对甲基苄醇, 对硝基苄醇(3)(3)苄醇, α-苯基⼄醇, β-苯基⼄醇6.26.2区别下列各组化合物:(1) CH2=CHCH2OH, CH3CH2CH2OH , CH3CH2CH2Br, (CH3)2CHI(2) CH3CH(OH)CH3, CH3CH2CH2OH , C6H5OH , (CH3)3COH , C6H5OCH3(3) α-苯基⼄醇, β-苯基⼄醇, 对⼄基苯酚, 对甲氧基甲苯6.36.3写出下列各反应主要产物:6.4合成题:(1)(1)甲醇, 2-丁醇→ 2-甲基丁醇(2)(2)正丙醇, 异丙醇→ 2-甲基-2-戊醇(3)(3)甲醇, ⼄醇→正丙醇, 异丙醇(4)(4)2-甲基丙醇, 异丙醇→ 2,4-⼆甲基-2-戊烯(5)(5)丙烯→⽢油→三硝酸⽢油酯(6)(6)苯, ⼄烯, 丙烯→ 3-甲基-1-苯基-2-丁烯(7)(7)⼄醇→ 2-丁醇(8)(8)叔丁醇→ 3, 3-⼆甲基-1-丁醇(9)(9)⼄烯→三⼄醇胺(10)(10)丙烯→异丙醚(11)(11)苯, 甲醇→ 2,4-⼆硝基苯甲醚(12)(12)⼄烯→正丁醚(13)(13)苯→间苯三酚(14)(14)苯→对亚硝基苯酚(15)(15)苯→ 2,6-⼆氯苯酚(16)(16)苯→对苯醌⼆肟6.5某醇C5H12O氧化后⽣成酮,脱⽔则⽣成⼀种不饱和烃, 将此烃氧化可⽣成酮和羧酸两种产物的混合物, 试推测该醇的结构.6.6有⼀化合物(A)的分⼦式为C5H11Br, 和NaOH⽔溶液共热后⽣成C5H12O(B). B具有旋光性.能和钠作⽤放出氢⽓, 和浓硫酸共热⽣成C5H10(C). C经臭氧化和在还原剂存在下⽔解, 则⽣成丙酮和⼄醛. 试推测A, B, C的结构, 并写出各步反应式.6.7新戊醇在浓硫酸存在下加热可⽣成不饱和烃. 将这不饱和烃经臭氧化后, 在锌粉存在下⽔解, 可得到⼀种醛和⼀种酮. 试写出反应历程及各步反应产物的构造式.6.8分离下列各组化合物:(1)(1)⼄醚中混有少量⼄醇(2)(2)戊烷, 1-戊炔和1-甲氧基-3-戊醇6.9 下列各醚和过量的浓氢碘酸反应, 可⽣成何种产物?(1)(1)甲丁醚(2)(2)2-甲氧基⼰烷(3)(3)2-甲基-1-甲氧基戊烷6.10有⼀化合物的分⼦式为C6H14O, 常温下不与⾦属钠反应, 和过量的浓氢碘酸共热时⽣成碘烷, 此碘烷与氢氧化银作⽤则⽣成丙醇. 试推测此化合物的结构, 并写出反应式.6.11 有⼀化合物的分⼦式为C7H16O, 并且:(1)(1)在常温下它不和⾦属钠反应;(2)(2)它和过量浓氢碘酸共热时⽣成C2H5I和C5H11I . 后者与氢氧化银反应⽣成的化合物的沸点为138℃.试推测原化合物的结构, 并写出各步反应式.6.12有⼀化合物的分⼦式为C20H21O4N, 与热的浓氢碘酸反应可⽣成碘甲烷. 当此化合物4.24 mg与氢碘酸反应, 所⽣成的碘甲烷通⼈硝酸银的醇溶液, 得到11.62mg碘化银. 问此化合物含有⼏个甲氧基?6.13 写出环氧⼄烷与下列试剂反应的⽅程式:(1)(1)有少量硫酸存在下的甲醇(2)(2)有少量甲醇钠存在下的甲醇6.14 推测下列反应的机理。
物理化学实验习题五

物理化学实验习题五问答题问答题答案问答题1.用氧弹量热计测定有机化合物的燃烧热实验, 有的实验教材上要求在量热测定时,在氧弹中加几滴纯水,然后再充氧气、点火,请说明加的这几滴水的作用是什么?2.某研究所,需要测定牛奶样品的热值,请提出所需仪器及实验步骤。
3.在量热实验中(例如溶解热的测定)经常要用电能对量热计进行能当量的标定, 请绘出电能测量线路, 并加以说明。
4.某种不可燃固体物质, 加热可使它分解成为另一种固体和一种气体, 请设计一个实验以测定上述分解反应的∆H$和∆S$, 简要叙述实验方法和所依椐的热力学原理, 不必绘出实验装置图。
5.现要安装一个50℃以下的恒温水槽, 应如何考虑下列问题:①需要有哪些部件?②如何配置恒温槽各部件?③恒温槽放在20℃的实验室内, 欲控制25.0℃的恒温温度。
恒温槽在25.0℃时的散热速率是0.060℃·min-1, 恒温槽内盛水10.0 dm3, 问应使用多少瓦的控温加热器为好?己知1 dm3水为1000 g , 水的热容为4.184 J·g-1·K-1。
④若恒温槽控制的温度略低于室温, 应采取什么措施才能达到恒温目的(不用现成的致冷器)?6.欲用溶液法测定溴苯的偶极矩,现查得溴苯、苯、乙醇、环己烷、四氯化碳、水的一些物理常数如下:溴苯苯乙醇环己烷四氯化碳水密度ρ20/g·cm-3 1.4950 0.879 0.789 0.7786 1.600 0.9982折光率n20 1.5594 1.5011 1.3614 1.4266 1.4603 1.3330沸点T b/℃156.43 80.3 78 80 75.5 1007.已知某物质的相对分子质量为146, 它溶于环己烷中, 但不知道它在环己烷中是以单体还是二聚体,或两者的平衡状态存在。
请提出一种实验方法, 对该物质在环己烷中的存在状况作出判断(需说明方法、需已知和测定的数据)。
有机化学 习题(新改)2013-8-25

5.烷烃在光照下进行卤代时,最容易被卤素取代的氢原子是()。
A. 1°-H;B. 2°-H;C. 3°-H;D. CH3-H。
6.最稳定的自由基是()。
四、预测并排列下列各组化合物的指定特性,说明理由。
1.下列化合物沸点高低顺序为>>>。
A. 3,3-二甲基戊烷;B.正庚烷;C. 2-甲基庚烷;D. 2-甲基己烷。
三、给出下列各题的正确答案,并做简要说明:
1.具有对映异构现象的链烷烃,所含碳原子数最少应为()。
A.5;B.7;C.9;D.11。
2.一个化合物虽含有不对称碳原子,但其自身可与它的镜像重合,这个化合物叫做()。
A.对映异构体;B.顺反异构体;
C.内消旋化合物;D.外消旋化合物。
3.下列四组化合物互为同分异构体的是()。
3. 某化合物的分子式为C5H8,在液NH3中与NaNH2作用后,在与1-溴丙烷作用,生成分子式为C8H14的化合物B;用KMnO4氧化B得到分子式为C4H8O2的两种不同的酸C和D。A在HgSO4存在下与稀H2SO4作用,可得到酮E(C5H10O)。试写出A-E的构造式,并用反应式表示上述转化过程。
14.苯环一氯化反应活性顺序为____>____>____>____。
四、用化学方法鉴别下列化合物:
1.
2.
五、推导合成路线(以苯、甲苯为原料合成下列化合物)。
六、推导有机化学结构:
1.化合物A的分子式为C8H10,在铁催化下与1molCl2作用只生成一种产物B,B在光照作用下与1molCl2作用生成两种氯代产物C和D。推断A、B、C和D的结构式及推导过程。
3.丙烯与Br2反应生成1,2-二溴丙烷的反应机理是( )。
《现代物理有机化学》习题解答指南

《现代物理有机化学》习题解答指南《现代物理有机化学》习题解答指南一、有机化学基础知识物理有机化学是物理化学和有机化学的综合,涵盖了电子结构、分子结构、分子性质等多个领域,是一门结合能力比较强的学科。
因此,有机化学习者在进行习题解答之前,必须把基本理论学习好,这是所有物理化学习者必备的知识储备。
具体来说,学习者首先应掌握基本的有机分子结构,像有机分子中的一氧化碳、二氧化碳、三氧化碳、四氧化碳、氮气分子等。
其次了解元素的化学性质,包括原子半径、宇称价、最高电子态组、价键类型,元素在化学反应中的变化特性、相互作用等,以及碳元素与其他元素气体以及配合物的综合性研究。
再次,了解化学反应的本质。
这里要特别说明的是,有机化学的主要学习内容是分析分子结构的变化,理清变化的原因以及变化的方向,而且要深入分析这个变化是因为什么,芳香环的稳定性如何变化,碳键的键角等特性的变化的原因及机理。
这一步也是学习者必须要掌握的重要基础,这一点在解答习题中尤为重要。
二、解答习题步骤首先,学习者要阅读习题,了解其背景,同时识别出所提问题中的关键要素。
有机化学习者应从问题中总结出反应物、反应结果以及反应机理等要素,以便于更好地回答问题。
其次,学习者要依据问题的类别和所要解答的内容,根据基本的理论和实验数据,加上自己的分析思考,对习题进行解答,并力求对反应机理和反应的变化等特性做出准确的描述。
例如,电子式的解答要尽可能考虑到分子本质、分子式、化学键的类型以及这些键的变化等;性质解答就要考虑到分子本质、原子半径、宇称价、最高电子态组、价键类型、与气体的相互作用等;还有就是分子结构的描绘,例如对碳键的键角的描述等。
答题的步骤一定要认真,深入。
最后,解题完成后,学习者也可以给出相应的习题分析。
例如,对反应机理的比较和分析,利用实验结果和理论标准来评价有机反应的化学变化情况等,做到全面准确。
三、有效解题为了更有效、深入地解答习题,学习者首先要保证基本理论及实验结果的学习。
有机化学习题册
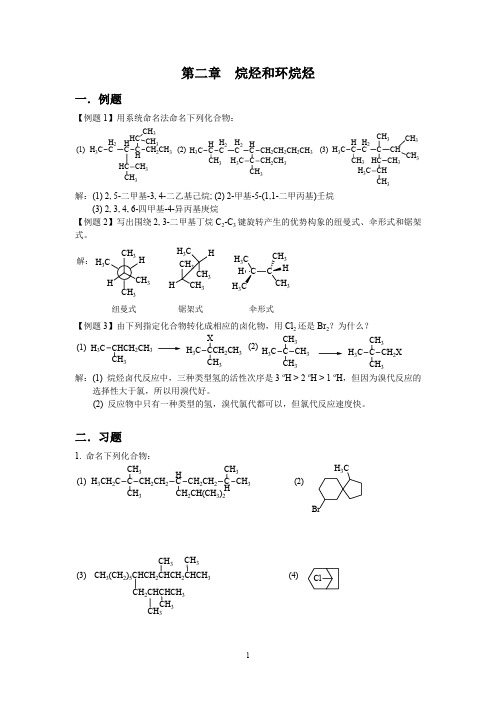
【例 3】异丁烯分别和下列试剂反应,写出反应产物并用反应机理解释。
4
① Br2,CCl4;② Br2,H2O; ③ Br2,HOCH3 解:
【例 4】写出下列反应的产物并简单解释。
解:
烯烃和 HX、H2SO4 + H2O 的反应符合马氏规则,对于 HBr 来说,存在过氧化合物效应,但 只有与 HBr 的加成存在过氧化合物效应。烯烃和 Br2 的加成以及硼氢化氧化反应,具有立体 选择性,前者为反式加成,后者为顺式反马氏规则加成,至于产物的立体化学问题,可在第 5 章之后加以理解。
13
第五章 立体化学
一.例题
[例 1] 判断下列叙述是否正确? (1)具有 R 构型的化合物是右旋的。 (2)具有手性中心的化合物一定是有旋光性的。 (3)非手性化合物可以有手性中心。 (4)无光学活性的物质一定是非手性的化合物。 (5)在化学反应中,由 R 构型反应物变为 S 构型的产物,一定伴随构型的翻转。 解:(1)不对。旋光方向是通过旋光仪测定的,与 R、S 构型之间没有必然联系。R 构 型的化合物可以是右旋的或左旋的,其对映体 S 构型的化合物也可以是左旋的或右旋的。 (2)不对。内消旋体分子中含有手性原子,如内消旋酒石酸,但该化合物有对称面, 因而没有手性,故不具旋光性。
(1)
CH 3 (2)
CH 3 (3)
但只有(2)的氧化产物中含酮基,因此(A)的结构为:
(A)CH2==C—CH2—C≡CH
CH3 则(B)和(C)的结构分别为:
(B)CH2==C—CH2—CH==CH2 (C)O==C—CH2—COOH
CH3 [例 3] 将 1,3-丁二烯转变为:
Br
CH2Br
CH3
H3C Br
有机化学习题与解答

有机化学习题与解答《有机化学》重点课程建设组编印2012.10目录第一章绪论---------------------------------------------------------4 第二章烷烃---------------------------------------------------------5 第三章单烯烃------------------------------------------------------12 第四章炔烃和二烯烃------------------------------------------------18 第五章脂环烃------------------------------------------------------28 第六章对映异构----------------------------------------------------34 第七章芳烃--------------------------------------------------------45 第八章现代物理实验方法的应用--------------------------------------54 第九章卤代烃------------------------------------------------------60 第十章醇酚醚----------------------------------------------------74 第十一章醛酮-----------------------------------------------------84 第十二章羧酸------------------------------------------------------92 第十三章羧酸衍生物------------------------------------------------95 第十四章含氮化合物------------------------------------------------97 第十五章杂环化合物-----------------------------------------------101 第十六章碳水化合物-----------------------------------------------104 第十七章蛋白质和核酸---------------------------------------------113 第十八章甾萜化合物-----------------------------------------------116第一章绪论习题1.甲基橙是一种含氧酸的钠盐,它的含碳量51.4%、氮12.8%、硫9.8%和钠7.0%,问甲基橙的实验式是什麽?2.胰岛素含硫3.4%,其分子量为5734,问一分子中可能有多少硫原子?3.元素定量分析结果,指出某一化合物的实验式为CH,测得其分子量为78,问它的分子式是什麽?4.根据键能数据,当乙烷(CH3-CH3)分子受热裂解时,哪种共价键首先破裂?为什么?这个过程是吸热反应还是放热反应?5.写出下列反应能量的变化?6、根据电负性数据,用和标明下列键或分子中带部分正电荷和部分负电荷的原子。
有机化学习题

第一章绪论一、判断题1、有机化合物的官能团也称为功能团。
2、“有机”二字的原意就是具有生命力。
3、4 个原子轨道能组成4 个分子轨道。
4、氯化铁(FeCl3)是路易斯酸。
5、有机化合物分子中的化学键都是共价键。
6、键的解离能就是键能。
7、有机化合物大多都能溶于浓硫酸。
8、化合物CH3-CH=CH2中双键的稳定性大于单键。
9、三氯化硼(BCl3)是路易斯酸。
10、化合物的碱性强度,也可利用其用共轭酸的解离常数Ka 或pKa 表示,pKa 值越小,其碱性越强。
11、具有偶极矩的分子都是极性分子。
12、成键两个原子的电负性差越大,键的极性就越强。
13、sp3 杂化轨道的形状是正四面体形。
14、杂化轨道的形状是直线形。
15、sp2 杂化轨道的形状是平面三角形。
第二章烷烃和环烷烃一、判断题1、命名环烷烃时,碳环不能作为取代基。
2、环烷烃分子中每个CH2 的燃烧热最高,所以内能最低。
3、环丙烷可使Br2/CCl4 的棕红色褪去,但不能使KMnO4 的紫红色褪去。
4、正壬烷分子中所有碳原子在同一平面上,并呈锯齿形。
5、乙烷只有交叉式和重叠式两种构象异构体。
6、环烷烃和烷烃都是饱和烃,所以分子通式也相同。
H3C 7、CH3和H H的物理性质和化学性质都相同。
H H H3C CH3二、填空题 1、伯碳原子上连有 个氢原子,仲碳原子上连有个氢原子,叔碳原子上连有个氢原子,季碳原子上连有个氢原子。
2、烷烃氯代反应的选择性较溴代反应 。
3、在能量可变的体系中,能量越低,体系就越 。
4、自由基的链反应可分为 、、三个阶段。
5、环烷烃分子中的环碳原子均为 杂化,各原子之间均以 键相连。
6、在环烷烃的椅式构象中,有条α键,条e 键。
α键中有条向上,条向下。
7、室温下烷烃氯代反应时 3。
H 、2。
H 、1。
H 的相对活性比为 ,127℃溴代反应时 3。
H 、2。
H 、1。
H 的相对活性比为。
8、反应的活化能是过渡态与反应物之间的 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有(1)和(2)的平衡假设
[ CH 2CHO][H 2O] k1 ≈ [CH 3CHO][HO ] k1 [ CH 2CHO][HB+ ] k2 ≈ k 2 [CH 3CHO][B]
可以证明:
k2 [B] k 2 [HB+ ] = k1[HO ] k1[H 2O]
所以有:
k2 [B] k1[HO ] =1 k 2 [HB+ ] 1+ k1[H 2O] 1+
13
CONH2 COOH
H218O
13
CO18OH +
13
COOH CO18OH
COOH
1 : 1
13
O
O
HO
O
18
4) 如果下面的反应测得的速度定律只对化合物A是一级的, 试对下面的反应提出一个合理的机理.
Ph + Ph (A) NC NC CN CN Ph
Ph
CN CN CN CN
5) 羟醛缩合反应(以乙醛为例)在碱性条件下也可被一般碱 B所催化, 机理可表示为:
�
CH3CHO CH3CHO CH3CHO + + + OH B k1 k-1 k2 k-2 CH 2CHO CH 2CHO k3 + + H 2O HB H2O, HB fast OH CH3CCH2CHO H P
CH2CHO
O CH3CCH2CHO H
试用稳态近似方法证明: a) 只有当k-1[H2O] + k-2[HB+] >> k3[CH3CHO]时, 才有表观 的特殊碱催化速率方程: d[P]/dt = kobs[HO-][CH3CHO]2 kobs = k1k3/k-1[H2O] b) 若k-1[H2O] + k-2[HB+] << k3[CH3CHO], 则有: d[P]/dt = kobs[CH3CHO] kobs = k1[HO-] + k2[B]
H2ONO2 + NO3
[HONO 2 ]2 k2 K eq [NO3 ]
E
H2ONO2
NO2
+
H2O H NO2
+ X H NO2
NO2
fast X NO2 fast
HNO3 H2ONO2 + + H
NO2
Hபைடு நூலகம்
NO2
X NO2
X
X
X
3) 13C标记的邻苯二甲酰胺酸在18O的水中水解得到18O等同 地分布在每个羧基上的邻苯二甲酸,试用一个合理的机理 解释之.
CH3Cl
+
H
(1)
△H = DC-H – DC-Cl = 104 – 84 = 20 kcal/mol
CH4 +
Cl
CH3 +
H-Cl
(2)
△H = DC-H – DH-Cl = 104 – 103 = 1 kcal/mol
活化能估算 自由基和分子之间的基元反应 A + BC AB + C
如果反应为放热,即H < 0, 则 Ea ≈ 0.05 x DB-C 如果反应为吸热,即H > 0, 则 Ea ≈ △H + 0.05 x DA-B 对于(1)式,Ea = 84 x 0.05 + 20 = 24.2 kcal/mol 对于(2)式,Ea = 103 x 0.05 + 1 = 6.15 kcal/mol
2) 如果在硝基甲烷熔剂中用硝酸把甲苯硝化, 其反应速度与 在同条件下把苯硝化的反应速度相同.虽然如此, 但如果在 上述条件下把苯和甲苯的等量混合物硝化, 则甲苯被优先硝 化.试解释用这两种方法测定相对反应活性时的表面矛盾.
2HONO2 k1 k-1 slow k2
rate = k 2 [HO + NO 2 ] =
d[P] k1[HO- ] + k 2 [B] 2 = k3[CH 3CHO][ CH 2CHO] = k3[CH 3CHO] dt k-1[H 2O] + k-2 [HB+ ] + k3[CH 3CHO] k 2 [B] k1k3[CH 3CHO]2 [HO ] k1[HO ] = k2 [HB+ ] k 1[H 2O] 1+ k 1[H 2O] 1+
物理有机化学习题
1) 评论下面反应作为基元机理步骤的合理性:
(a) CH4
-
2003/11/5
+ Cl Ni(CN)2
CH 3Cl + H
(b) 4 HC=CH
(c)
D2SO4
+ CH 4 +
H Cl ( CH 3 + HCl)
(d) CH4 +
Cl
(a) CH4
+ Cl
CH 3Cl + H
CH4 + Cl
