血液安全技术核查指南医疗机构
血液安全技术核查指南(医疗机构部分1)
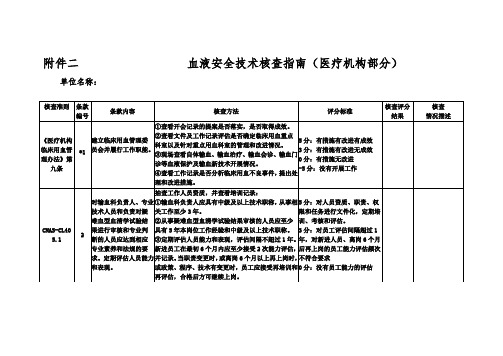
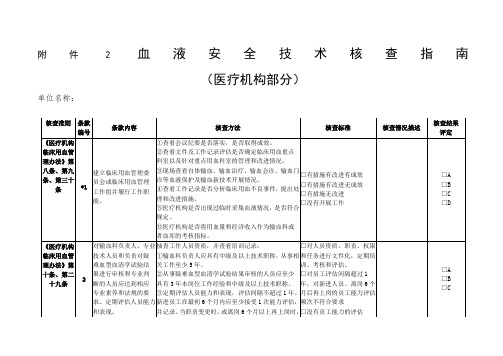
附件二血液安全技术核查指南(医疗机构部分)
单位名称:
核查准则
条款
编号
条款内容
核查方法
评分标准
核查评分结果
核查
情况描述
《医疗机构临床用血管理办法》第九条
环境温、湿度符合要求。
现场核实,查看相关记录及超温处理:
①应有证据表明储存设备的温度有连续的记录,确保温度变化不会超出可接受的温度范围(自动温控记录或人工记录,实验室应规定温度人工记录频次)。
②必要时,配置不间断电源和/或双路电源以保证关键设备的正常工作。
③依据所用分析设备和实验过程的要求,制定环境温湿度控制要求并记录;血液保存条件参照《血液储存要求》行业标准WS399-2012。
现场查看:
①是否按不同品种、血型和采血日期(或有效期),分别有序存放于专用血液储存设备内,并有明显标识。
②血液存放时是否遵循先进先出的原则,确保各种血液成分正常周转,保证血液质量并避免血液浪费。
③全血和悬浮红细胞应按序垂直或平放在专用冰箱内,无紧密堆放现象。
④贮血冰箱内和储血室空气培养每月一次,无霉菌生长或细菌菌落总数<4CFU/(15min.直径9cm平皿)。
②医院是否规定取血的容器,院内流转的血液质量安全如何保障。
③用血科室是否有自行储血的现象。
④输血后血袋保存是否保存24小时。
⑤是否采取措施避免或减少血液报废,如:限制单次发放剂量等。
⑥报废流程是否符合规范。
5分:完全符合要求
3分:≤1项不符合要求
0分:>1项不符合要求
血液安全技术核查指南(2017)-医疗机构部分

血液安全技术核查指南(2017)――医疗机构部分
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为
B,符合第三项评为C,符合第四项评为D (第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B; “良”:所有条款没有得D,同时得到6-9个A或10-14个B; “合格”:所有条款没有得D,同时少于6个A或10个B; “不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“ * ”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
被检查单位临床用血负责人(签名):
核查人员(签名):
核查日期:2017年。
血液安全技术核查指南(2017)-医疗机构部分
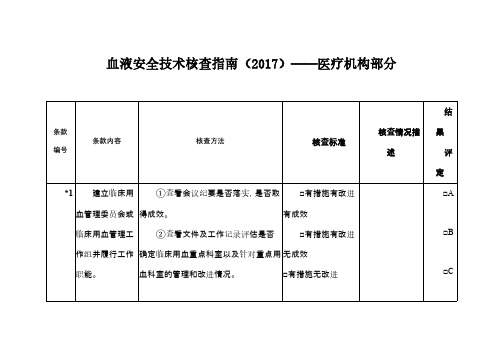
的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:2017年月日。
血液安全技术核查指南医疗机构部分
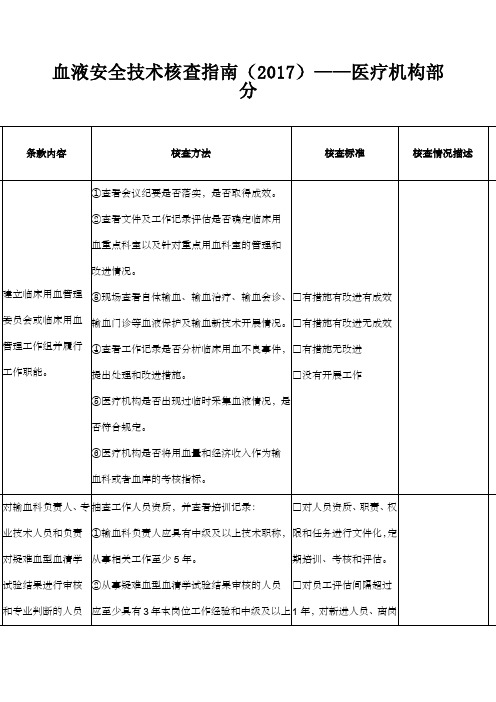
血液安全技术核查指南(2017)——医疗机构部
分
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D (第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:2017年月日。
血液安全技术核查指南医疗机构部分
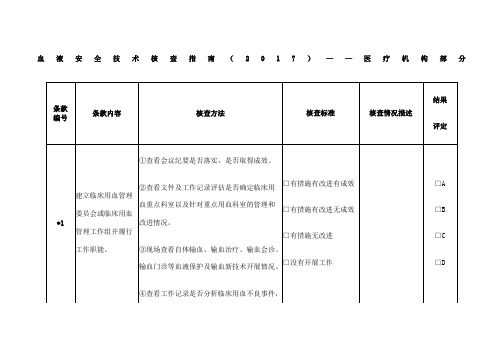
血液安全技术核查指南(2017)——医疗机构部分
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符合第三项评为C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期: 2017年月日。
血液安全技术核查指南医疗机构
附件2血液安全技术核查指南
(医疗机构部分)
单位名称:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项评为B,符
合第三项评为C,符合第四项评为D(第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个及以上的B;
“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况。
4.凡有“*”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查。
5.此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:
核查人员(签名):被检查单位临床用血负责人(签名):
核查日期:2017年月日。
最新血液安全技术核查指南

最新血液安全技术核查指南一、背景血液安全是医疗领域的重要组成部分,涉及到病人的生命安全和社会公共利益。
为确保血液产品的质量和安全,各国都建立了相应的法规和技术标准。
我国自上世纪80年代开始发展血液事业,经过多年的努力,血液安全水平得到了显著提高。
然而,随着血液制品需求的不断增加,血液安全问题仍然面临诸多挑战。
为此,本指南旨在为血液安全技术核查提供一套系统的、科学的方法,以保障血液产品的质量和安全。
二、核查目标1. 确保血液采集、制备、储存、运输和使用的各个环节符合国家法规和技术标准;2. 识别和评估血液安全潜在风险,提高风险防控能力;3. 促进血液制品质量的持续改进和提高;4. 增强血液安全管理体系的科学性、规范性和有效性。
三、核查内容1. 法规与标准:核查血液采集、制备、储存、运输和使用等相关法规和技术标准是否得到有效执行。
2. 人员培训:核查血液工作人员的专业培训情况,包括岗位培训、复训和资格认证等。
3. 设备与设施:核查血液采集、制备、储存、运输和使用的设备与设施是否符合国家法规和技术标准,包括设备性能、设施环境、操作程序等。
4. 质量控制:核查血液质量控制体系的建设及运行情况,包括质量方针、质量目标、质量手册、程序文件等。
5. 生物安全:核查血液制品生物安全管理情况,包括生物防护、废物处理、实验室安全等。
6. 血液制品追溯:核查血液制品追溯系统的建立和运行情况,确保制品可追溯、可追踪。
7. 临床应用:核查血液制品临床应用管理情况,包括临床使用规范、不良反应监测、输血并发症处理等。
四、核查方法1. 文档审查:对血液安全相关文件进行审查,包括法规、标准、操作规程、质量记录等。
2. 现场检查:对血液采集、制备、储存、运输和使用等环节进行现场检查,包括设备设施、操作过程、环境条件等。
3. 访谈调查:与血液工作人员进行访谈,了解其在工作中遇到的问题及建议。
4. 样品抽检:对血液制品进行抽检,检验其质量是否符合国家法规和技术标准。
血液安全技术核查指南(医疗机构部分)-最终版9.17

疗机构
难血型血清学试
核和评估。
上技术职称,从事相关工作至少 5 年。
临床用
验结果进行审核 ②从事疑难血型血清学试验结果审核
□对员工评估间
□C
血管理
和专业判断的人 的人员应至少具有 3 年本岗位工作经验 隔超过 1 年,对新进
办法》第
员应达到相应专 和中级及以上技术职称。
附件 2 单位名称:
血液安全技术核查指南(医疗机构部分)
核查准则 条款 编号
条款内容
核查方法
核查标准
核查情 况描述
核查 结果
评定
* 建立临床用
①查看会议纪要是否落实,是否取 □有措施有改进
□A
《医 1 血管理委员会或 得成效。
有成效
疗机构
临床用血管理工
②查看文件及工作记录评估是否
□有措施有改进
□B
临床用
作组并履行工作 确定临床用血重点科室以及针对重点用 无成效
血管理
职能。
□有措施无改进
办法》第
血科室的 管 理 和 改 进 情况。
□没有开展工作
□C
八条、第
③现场查看自体输血、输血治疗、输
九条、第
血会诊、输血门诊等血液保护及输血新
□D
三十条
技术开展情况。
④查看工作记录是否分析临床用 血不良事件,提出处理和改进措施。
值班室。
□缺少 1 个以上的功
血管理 办法》第
能区域;储血室和发
□C
②宜有:污物存放区、洗消区、宜有
血室未处于清洁区
十条
支持性空间(用于档案存取、库房、示教、
参考书籍的存放)、宜有员工生活区(个
人物品放置区、进餐区、卫生间、浴室)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
血液安全技术核查指南
(医疗机构部分)单位名称:
备注:
1.核查时,应对所列条款进行逐项核查,每个条款的核查结果评定为A、B、C或D。
符合核查标准第一项评为A,符合第二项
评为B,符合第三项评为C,符合第四项评为D (第1、7、9、14和19条款包含第四项)。
2.医疗机构核查总评结果分为优、良、合格或不合格。
“优”的标准:所有条款没有得D,同时得到10个及以上的A或15个
及以上的B;“良”:所有条款没有得D,同时得到6-9个A或10-14个B;“合格”:所有条款没有得D,同时少于6个A或
10个B;“不合格”:得一个及以上的D。
提出批评,并要求限期整改。
3.核查情况描述主要记录亮点工作,需要特殊说明的情况,不合格或提出批评的情况
4.凡有“ * ”标记的条款,均为涉及影响患者安全条款,对此类条款应重点核查
5. 此表格由被检查单位先自查,并对自查结果进行描述,列出支持评分的依据。
核查总评结果:核查人员(签名):被检查单位临床用血负责人(签
名):核查日期:2017 年月日。
