氨基酸的系统命名以及分类
氨基酸结构、分类与命名及应用

L-氨基酸
COOH
H2N
氨基酸的结构、分类和命名及应用
H CH2SH
下列氨基酸可组成无数蛋白质:
结构
名称
缩写
等电点
I、中性 (*为必要氨基酸,人体内不能合成,只能从食物中得到)
NH2CH2COOH
甘酸
Gly
5.97
NH2 H3CHC COOH
丙氨酸
Ala
6.00
NH2 (H3C)2HCCHCOOH
氨基酸的结构、分类和命名及应用
内盐
在水溶液中
在酸性溶液中,主要以正离子的形式存在。 在碱性溶液中,主要以负离子的形式存在。 氨基酸的等电点
在一定的pH值溶液中,正离子和负离子数量相等, 且浓度都很低,而偶级离子浓度最高,此时电解,以 偶级离子形式存在的氨基酸不移动。这溶液的pH值就 叫做氨基酸的等电点。
9.74 10.76 7.59
19-1-2 氨基酸的性质
α-氨基酸都是无色晶体,易溶于水而难溶于无水乙 醇乙醚,由蛋白质水解所得α-氨基酸,除甘氨酸外,都 具有旋光性。他们的α碳原子的结构类型都与L-甘油醛 相同,固都属于L型。
若用R-S标记法,这些α-氨基酸的α碳原子的构型
都是S型。
氨基酸的结构、分类和命名及应用
天冬氨酸
Asp
NH2 HO O C(CH2)2CHCO O H
III 碱性
谷氨酸
Glu
NH2 H2N (CH2)4CHCOOH
NH2 HN CHN(CH2)2CH COOH
NH3
*赖氨酸 精氨酸
Lys Arg
H2N N NH2 CH2CH COO
组氨酸
His
氨基酸的结构、分类和命名及应用
氨基酸概述

第三节氨基酸氨基酸是一类具有特殊重要意义的化合物。
因为它们中许多是与生命活动密切相关的蛋白质的基本组成单位,是人体必不可少的物质,有些则直接用作药物。
α-氨基酸是蛋白质的基本组成单位。
蛋白质在酸、碱或酶的作用下,能逐步水解成比较简单的分子,最终产物是各种不同的α-氨基酸。
水解过程可表示如下:蛋白质→月示→胨→多肽→二肽→α-氨基酸由蛋白质水解所得到的α-氨基酸共有20多种,各种蛋白质中所含氨基酸的种类和数量都各不相同。
有些氨基酸在人体内不能合成,只能依靠食物供给,这种氨基酸叫做必需氨基酸(见表18-3,*)。
一、氨基酸的构造、构型及分类、命名(一)氨基酸的构造和构型分子中含有氨基和羧基的化合物,叫做氨基酸。
由蛋白质水解所得到的α-氨基酸,可用通式表示如下:除甘氨酸(R=H)外,所有α-氨基酸中的α碳原子均是手性碳,故有D型与L型两种构型。
天然氨基酸均为L-氨基酸。
L-氨基酸(二)α-氨基酸的分类和命名氨基酸有脂肪族氨基酸、芳香族氨基酸和杂环氨基酸。
在α-氨基酸分子中可以含多个氨基和多个羧基,而且氨基和羧基的数目不一定相等。
因此,天然存在的α-氨基酸常根据其分子中所含氨基和羧基的数目分为中性氨基酸、碱性氨基酸和酸性氨基酸。
所谓中性氨基酸是指分子中氨基和羧基的数目相等的一类氨基酸。
但氨基的碱性和羧基的酸性不是完全相当的,所以它们并不是真正中性的物质,只能说它们近乎中性。
分子中氨基的数目多于羧基时呈现碱性,称为碱性氨基酸;反之,氨基的数目少于羧基时呈现酸性,称为酸性氨基酸。
氨基酸的系统命名方法与羟基酸一样,但天然氨基酸常根据其来源或性质多用俗名。
例如胱氨酸是因它最先来自尿结石;甘氨酸是由于它具有甜味而得名(见表18-3)。
表18-3 常见的α-氨基酸二、氨基酸的性质>α-氨基酸都是无色晶体,熔点一般都较高(常在230-300℃之间),熔融时即分解放出二氧化碳。
α-氨基酸都能溶于酸性或碱性溶液中,但难溶于乙醚等有机溶剂。
有机化学ppt-氨基酸蛋白质

如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
20种常见氨基酸的分类和结构

20种常见氨基酸的分类和结构氨基酸是构成蛋白质的基本单位,根据其侧链的不同化学性质,可以将氨基酸分为不同的分类。
下面将介绍20种常见氨基酸的分类和结构。
1.非极性氨基酸:- 甘氨酸 (Gly):侧链仅有一个氢原子。
- 丙氨酸 (Ala):侧链为一个甲基基团。
- 缬氨酸 (Val):侧链为一个异丁基基团。
- 亮氨酸 (Leu):侧链为一个异戊基基团。
- 异亮氨酸 (Ile):侧链为一个异戊基基团和甲基基团。
2.非极性芳香氨基酸:- 苯丙氨酸 (Phe):侧链为苯甲基。
- 色氨酸 (Trp):侧链包含类似吲哚的环结构。
- 酪氨酸 (Tyr):侧链为苯酪基。
3.极性非电荷氨基酸:-非极性的侧链:- 蛋氨酸 (Met):侧链为甲硫基。
- 赖氨酸 (Lys):侧链为五碳鏈帶一原子氮的氨基。
-极性的侧链:- 缬氨酸 (Val):侧链为羟基。
- 嘧啶丙氨酸 (Asn):侧链包含一个酰胺基团。
- 谷氨酸 (Gln):侧链为二酰胺基团。
4.极性带正电氨基酸:- 精氨酸 (Arg):侧链带有三个氨基。
- 肌氨酸 (Lys):侧链带有一个氨基。
- 组氨酸 (His):侧链带有一个咪唑环。
5.极性带负电氨基酸:- 谷氨酸 (Glu):侧链呈羧基酸态。
- 天冬氨酸 (Asp):侧链呈羧基酸态。
- 异亮氨酸 (Ile):侧链包含羧乙基。
以上就是20种常见氨基酸的分类和结构。
每种氨基酸都具有不同的化学结构和性质,它们的组合形成了多样的蛋白质结构和功能。
这些氨基酸的分类对于理解蛋白质的结构和功能以及生物学过程的研究非常重要。
有机化学氨基酸
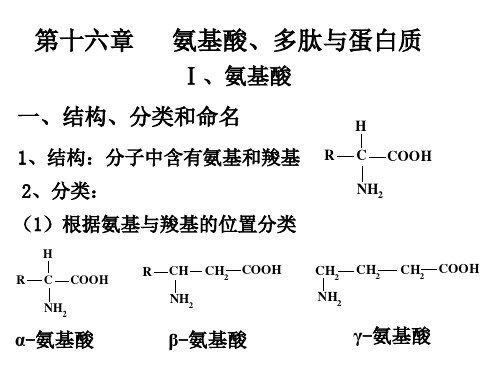
氨基酸、多肽与蛋白质
Ⅰ、氨基酸
一、结构、分类和命名
1、结构:分子中含有氨基和羧基
R
H C NH2 COOH
2、分类:
(1)根据氨基与羧基的位置分类
H R C NH2 COOH
R
CH NH2
CH2 COOH
CH2 NH2
CH2
CH2 COOH
α-氨基酸
β-氨基酸
γ-氨基酸
中性氨基酸
(2) 碱性氨基酸
水蛭素多肽——抗血栓分子药理 1884年Haycraft首先发现新鲜医用水蛭Hirud medicinalis提取物含抗凝血物质,但直至1955年Mark wardt等从医用水蛭中才分离出水蛭素(hirudin,HV),共有 7种异构体。1984年Dodt首先测出其一级结构,确认HV是 一条含65个左右氨基酸的多肽。HV酶是血液凝固、止血过程 和血栓形成的中心酶之一。它专一性地水解纤维蛋白原上的 Agr-Gly键,使之转变成纤维蛋白;纤维蛋白相互作用会进一 步形成血栓。HV的2个结构域通过不同的机制分别和凝血酶 相互作用,抑制其活性。其C端长链通过和凝血酶的纤维蛋白 原识别部位结合,拮抗凝血酶对纤维蛋白原的识别。而HV的N 末端核心结构域通过和凝血酶的活性部位结合而抑制它的催 化活性。临床实验结果也表明,HV的抗栓作用不需要其它因 子的作用;又不会引起出血等副作用。其效果超过小分子肝 素。因此被认为是2010年前最强的可逆性凝血酶直接抑制剂。 全球约有20亿美元市场销售量。
+
O
C O
内盐(偶极离子或两性离子)
-
+
HC l
RCH
+
COOH
+
Cl
NH3
氨基酸

氨基酸氨基酸——具有NH2和COOH的一类含有复合官能团的化合物。
氨基酸已知超过300种,生物体内作为合成蛋白质的原料只有20余种,其中8种为人体必须氨基酸(表15-1,记忆最常用的几个)。
一、分类命名和结构(一)分类1、根据R的不同可分为脂族、芳族、杂环氨基酸;2、根据氨基与羧基的数目可分为中性(氨基与羧基数目相等)、酸性(氨基数少于羧基数)、碱性氨基酸(氨基数大于羧基数),其中中性氨基酸水溶液呈微酸性(因羧基的解离略大于氨基)。
(二)命名氨基酸的命名主要有俗名(根据其来源及用途,最常用)、系统命名(以酸为母体,常用α、β来注明氨基、取代基位置)以及国际通用符号等命名法。
例如:1、HO CH2CHCOOHNH22、N HCH2CHCOOH23、NHCOOH4、HS CH2CHCOOH25、CH2CHCOOH26、3NH2COOHH(D/L)解:1、酪氨酸2、色氨酸3、脯氨酸4、半胱氨酸5、苯丙氨酸6、L-丙氨酸(三)结构20种均为 -氨基酸,除甘氨酸都有旋光性;以相对构型来标记多为L-型;以绝对构型来标记,除半胱氨酸都为S-型。
氨基酸通式:R CH COOH2*甘氨酸(无旋光):NH2CH2COOH构型表示:HCOOHNH2(相对构型均为L,绝对构型除半胱氨酸均为S)半胱氨酸:COOH2SHHH 2N(R)(巯甲基比羧基优先大,故为R 构型)二、氨基酸的化学性质 (一) 两性和等电点 1、两性R CH COOHNH 2R CH COONH 2R CH COOHNH 3H氨基酸是两性化合物,常以内盐形式存在(熔点高、难溶于有机溶剂,易溶于酸和碱):H 3NHC COOR2、等电点R CH COOHNH 3R CH COONH3R CH COONH2R CH COOH2OH 荷电状态与pH 有关负离子两性离子正离子pH > pI pH =pI pH ﹤ pI 向阳极不移动向阴极带等量正负电荷(1)氨基酸是两性化合物,在溶液中,其带电状态与溶液的pH 值有关,即pH 会影响羧基和氨基的解离程度,当羧基解离程度大于氨基时,将带负电荷;反之,氨基解离程度大于羧基时,将带正电荷;(2)改变pH 值,使氨基和羧基的解离程度相等,此时氨基酸带的正负电荷相等,此时溶液的pH 值称为“等电点”,用pI 表示;(3)调节p H <pI ,将抑制COOH 的解离,促进NH 2的解离,氨基酸带正电荷; (4)调节p H >pI ,将抑制NH 2的解离,促进COOH 的解离,氨基酸带负电荷;(5)在pI 的溶液中插入电极,氨基酸因带等量的正负电荷对外不显示电量,故不移动; 在p H <pI 的溶液中插入电极,氨基酸因带正电荷而向阴极(负极)移动; 在p H >pI 的溶液中插入电极,氨基酸因带负电荷而向阳极(正极)移动。
20种常见氨基酸基本信息
氨基酸类型总结:(一)人体8种必需氨基酸,有详细解释1,苯丙氨酸:(生糖兼生酮氨基酸)系统命名法:2-氨基-3-苯丙酸mRNA密码子:UUU,UUC用途:阿斯巴甜(常用的甜味添加剂)正常人氨基酸转化:L-酪氨酸2,亮氨酸系统命名法:2-氨基-3-甲基戊酸mRNA密码子:UUA,UUG,CUU,CUA,CUC,CUG用途:降血糖剂、修复肌肉3,蛋氨酸(甲硫氨酸)说明:鸡蛋白含有大量蛋氨酸,鸡蛋变质变臭是因为蛋氨酸变质生成H2S(臭)系统命名法:2-氨基-4-甲巯基丁酸mRNA密码子:AUG用途:作为抗氧化剂、抗肝硬变、脂肪肝及各种急性、慢性、病毒性、黄疸性肝、解重金属毒、解砷毒转化:在生物体内先从ATP接受腺苷基变成S-腺苷酰甲硫氨酸(活性甲硫氨酸)再进行甲基转移。
失去甲基的同型半胱氨酸经胱硫醚变成半胱氨酸。
或直接脱去甲硫醇和氨,而间接地经同型半胱氨酸分解成α-酮酸。
4,异亮氨酸(生糖兼生酮氨基酸)说明:亮氨酸的作用包括与异亮氨酸和缬氨酸一起合作修复肌肉,控制血糖,并给身体组织提供能量。
系统命名法:2-氨基-3-甲基戊酸mRNA密码子:AUC,AUA,AUU转化:在生物体内从异亮氨酸经氨基转移及脱羧反应生成的a-甲基丁酰辅酶A,进行类似脂肪酸的分解后,生成乙酰辅酶A与丙酰辅酶A,后者成为琥珀酰辅酶A,进入柠檬酸循环。
用细菌合成时,已知它们要由苏氨酸和丙酮酸二羟基酸→a-酮酸。
5,缬氨酸说明:亮氨酸,异亮氨酸和缬氨酸都是支链氨基酸!系统命名法:2-氨基-3-甲基丁酸mRNA密码子:GUU,GUC,GUA,GUG用途:加快创伤愈合的治疗剂6,色氨酸(生糖兼生酮氨基酸)系统命名法:2-氨基-3-吲哚基丙酸mRNA密码子:UGG转化(高等植物):两条途径(1)色氨酸首先氧化脱氨形成吲哚丙酮,再脱羧形成吲哚乙醛;吲哚乙醛在相应酶的催化下最终氧化为吲哚乙酸。
(2)色氨酸先脱羧形成色胺,然后再由色胺氧化脱氨形成吲哚乙酸。
种常见氨基酸基本信息
氨基酸类型总结:(一)人体8种必需氨基酸,有详细解释1,苯丙氨酸:(生糖兼生酮氨基酸)系统命名法:2-氨基-3-苯丙酸mRNA密码子:UUU,UUC用途:阿斯巴甜(常用的甜味添加剂)正常人氨基酸转化:L-酪氨酸2,亮氨酸系统命名法:2-氨基-3-甲基戊酸mRNA密码子:UUA,UUG,CUU,CUA,CUC,CUG 用途:降血糖剂、修复肌肉3,蛋氨酸(甲硫氨酸)说明:鸡蛋白含有大量蛋氨酸,鸡蛋变质变臭是因为蛋氨酸变质生成H2S(臭)系统命名法:2-氨基-4-甲巯基丁酸mRNA密码子:AUG用途:作为抗氧化剂、抗肝硬变、脂肪肝及各种急性、慢性、病毒性、黄疸性肝、解重金属毒、解砷毒转化:在生物体内先从ATP接受腺苷基变成S-腺苷酰甲硫氨酸(活性甲硫氨酸)再进行甲基转移。
失去甲基的同型半胱氨酸经胱硫醚变成半胱氨酸。
或直接脱去甲硫醇和氨,而间接地经同型半胱氨酸分解成α-酮酸。
4,异亮氨酸(生糖兼生酮氨基酸)说明:亮氨酸的作用包括与异亮氨酸和缬氨酸一起合作修复肌肉,控制血糖,并给身体组织提供能量。
系统命名法:2-氨基-3-甲基戊酸mRNA密码子:AUC,AUA,AUU转化:在生物体内从异亮氨酸经氨基转移及脱羧反应生成的a-甲基丁酰辅酶A,进行类似脂肪酸的分解后,生成乙酰辅酶A与丙酰辅酶A,后者成为琥珀酰辅酶A,进入柠檬酸循环。
用细菌合成时,已知它们要由苏氨酸和丙酮酸二羟基酸→a-酮酸。
5,缬氨酸说明:亮氨酸,异亮氨酸和缬氨酸都是支链氨基酸!系统命名法:2-氨基-3-甲基丁酸mRNA密码子:GUU,GUC,GUA,GUG用途:加快创伤愈合的治疗剂6,色氨酸(生糖兼生酮氨基酸)系统命名法:2-氨基-3-吲哚基丙酸 mRNA密码子:UGG转化(高等植物):两条途径(1)色氨酸首先氧化脱氨形成吲哚丙酮,再脱羧形成吲哚乙醛;吲哚乙醛在相应酶的催化下最终氧化为吲哚乙酸。
(2)色氨酸先脱羧形成色胺,然后再由色胺氧化脱氨形成吲哚乙酸。
氨基酸名称及缩写及分类记忆法口诀
一、概述氨基酸是构成蛋白质的基本单元,也是人体内必不可少的营养物质。
对于学习生物化学的学生来说,掌握氨基酸的名称、缩写和分类是基础中的基础。
然而,对于初学者来说,如何快速准确地记住这些信息常常是一大难题。
为了帮助大家更好地掌握氨基酸的相关知识,本文将通过口诀的形式,为大家介绍一种记忆氨基酸名称及缩写的方法。
二、氨基酸名称、缩写及分类记忆口诀1. 非极性氨基酸Ala(丙氨酸), Val(缬氨酸), Leu(亮氨酸), Ile(异亮氨酸), Met(甲硫氨酸), Pro(脯氨酸), Phe(苯丙氨酸), Trp(色氨酸)口诀:氨基联冒跑,非极性氨基含,A-V-L-I-M-P-F-W。
2. 极性无电荷氨基酸Gly(甘氨酸), Ser(丝氨酸), Thr(苏氨酸), Cys(半胱氨酸)、Asn(天冬氨酸), Gln(谷氨酸)口诀:醛硫酰嘌吐,极性无电荷氨基酸,G-S-T-C-N-Q。
3. 极性带电氨基酸Lys(赖氨酸), Arg(精氨酸), His(组氨酸)、Asp(天冬酸),Glu(谷酸)口诀:石粉组蛋显,极性带电氨基酸,K-R-H-D-E。
4. 芳香族氨基酸Phe(苯丙氨酸), Tyr(酪氨酸), Trp(色氨酸)口诀:飞雁乌,芳香族氨基酸,P-T-W。
5. 硫氨基酸cys(半胱氨酸)、Met(甲硫氨酸)口诀:糙米,硫氨基酸C-M。
6. 极性带电氨基酸Lys(赖氨酸)、Arg(精氨酸)口诀:赖赖,两嗓子,极性带电氨基酸,K-R。
7. 极性无电荷氨基酸gly(甘氨酸)、ser(丝氨酸)口诀:甘丝,山顶花,极性无电荷氨基酸,G-S。
三、结论通过以上口诀的记忆方法,我们可以更轻松地掌握氨基酸的名称、缩写和分类。
希望这个方法能够帮助大家更好地学习和掌握相关知识,为日后的学习打下坚实的基础。
同时也希望大家能够在学习中注重练习,不断巩固知识,提高学习效率。
四、口诀记忆法的优势口诀记忆法在学习过程中具有独特的优势,口诀具有鲜明的节奏感和韵律感,这种优势使得我们通过口诀记忆更容易记住、回忆氨基酸的名称、缩写和分类。
氨基酸、蛋白质、核酸的结构、分类和命名
L-α-氨基酸
COOH H2N H 2S
CH3
L-丙氨酸
CH2 C*H COOH
SH NH2
半胱氨酸
COOH
H2N H
2S
CH2CH2COOH
L-谷氨酸
COOH H2N H 2R
CH2SH
L-半胱氨酸
COOH
H2N H
H 2S OH 3R
CH3
L-苏氨酸
二、α-氨基酸的物理性质
α-氨基酸大都为无色晶体,熔点一般在 200~300℃之间,比相应的羧酸或胺类高。 多数氨基酸能溶于水,而难溶于有机溶剂。
正离子 强酸溶液中的主
要存在形式
pH > pI
pH = pI
pH < pI
思考题:
如果把甘氨酸、谷氨酸和赖氨酸 三 种 氨 基 酸 混 合 起 来 , 溶 液 pH 调 至 5.97 , ① 这 些 氨 基 酸 各 带 什 么 电 荷 ? ②在电场中移动方向?
甘氨酸
pH=5.97
偶极离子
在电场中
不移动
谷氨酸 负离子
向正极移动
赖氨酸 正离子
向负极移动
用这种方法可分离不同的氨基酸,这种 方法叫电泳。
在等电点时氨基酸的溶解度最小,易生 成沉淀。也可用分级沉淀的方法分离氨基酸 混合物。
4.与水合茚三酮的反应
O O
O
O OH
OH O
茚
茚三酮
水合茚三酮
氨基酸与水合茚三酮在弱酸性溶液中共热, 经氧化、脱氨、脱羧及缩合等反应,最后生成蓝 紫色的物质。
一、氨基酸的结构、分类和命名
1. 氨基酸的结构:
α
R CH COOH NH2
2. 分类
