Fe的极化曲线
极化曲线的测定

实验九极化曲线的测定【目的要求】1. 掌握稳态恒电位法测定金属极化曲线的基本原理和测试方法.2. 了解极化曲线的意义和应用.3. 掌握恒电位仪的使用方法.【实验原理】1. 极化现象与极化曲线为了探索电极过程机理及影响电极过程的各种因素,必须对电极过程进行研究,其中极化曲线的测定是重要方法之一.我们知道在研究可逆电池的电动势和电池反应时,电极上几乎没有电流通过,每个电极反应都是在接近于平衡状态下进行的,因此电极反应是可逆的.但当有电流明显地通过电池时,电极的平衡状态被破坏,电极电势偏离平衡值,电极反应处于不可逆状态,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大.由于电流通过电极而导致电极电势偏离平衡值的现象称为电极的极化,描述电流密度与电极电势之间关系的曲线称作极化曲线,如图2-19-1所示.图2-19-1 极化曲线A-B:活性溶解区;B:临界钝化点B-C:过渡钝化区;C-D:稳定钝化区D-E:超(过)钝化区金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M→Mn++ne此过程只有在电极电势正于其热力学电势时才能发生.阳极的溶解速度随电位变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象.图2-19-1中曲线表明,从A点开始,随着电位向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜.B点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流.电势到达C点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE段称为过钝化区.2. 极化曲线的测定(1) 恒电位法恒电位法就是将研究电极依次恒定在不同的数值上,然后测量对应于各电位下的电流.极化曲线的测量应尽可能接近体系稳态.稳态体系指被研究体系的极化电流,电极电势,电极表面状态等基本上不随时间而改变.在实际测量中,常用的控制电位测量方法有以下两种:静态法:将电极电势恒定在某一数值,测定相应的稳定电流值,如此逐点地测量一系列各个电极电势下的稳定电流值,以获得完整的极化曲线.对某些体系,达到稳态可能需要很长时间,为节省时间,提高测量重现性,往往人们自行规定每次电势恒定的时间.动态法:控制电极电势以较慢的速度连续地改变(扫描),并测量对应电位下的瞬时电流值,以瞬时电流与对应的电极电势作图,获得整个的极化曲线.一般来说,电极表面建立稳态的速度愈慢,则电位扫描速度也应愈慢.因此对不同的电极体系,扫描速度也不相同.为测得稳态极化曲线,人们通常依次减小扫描速度测定若干条极化曲线,当测至极化曲线不再明显变化时,可确定此扫描速度下测得的极化曲线即为稳态极化曲线.同样,为节省时间,对于那些只是为了比较不同因素对电极过程影响的极化曲线,则选取适当的扫描速度绘制准稳态极化曲线就可以了.上述两种方法都已经获得了广泛应用,尤其是动态法,由于可以自动测绘,扫描速度可控制一定,因而测量结果重现性好,特别适用于对比实验.(2) 恒电流法恒电流法就是控制研究电极上的电流密度依次恒定在不同的数值下,同时测定相应的稳定电极电势值.采用恒电流法测定极化曲线时,由于种种原因,给定电流后,电极电势往往不能立即达到稳态,不同的体系,电势趋于稳态所需要的时间也不相同,因此在实际测量时一般电势接近稳定(如1min~3min内无大的变化)即可读值,或人为自行规定每次电流恒定的时间.【仪器试剂】恒电位仪一台;饱和甘汞电极1支;碳钢电极1支;铂电极1支;三室电解槽1只(见图2-19-2)2 mol·dm-3 (NH4)2CO3溶液;0.5 mol·dm-3H2SO4溶液;丙酮溶液【实验步骤】1. 碳钢预处理:用金相砂纸将碳钢研究电极打磨至镜面光亮,用石蜡蜡封,留出1cm2面积,如蜡封多可用小刀去除多余的石蜡,保持切面整齐.然后在丙酮中除油,在0.5M的硫酸溶液中去除氧化层,浸泡时间分别不低于10S.图2-19-2三室电解槽1.研究电极;2.参比电极;3.辅助电极2. 恒电位法测定极化曲线的步骤:A 准备工作仪器开启前,"工作电源"置于"关","电位量程"置于"20V","补偿衰减"置于"0","补偿增益"置于"2","电流量程"置于"200mA","工作选择"置于"恒电位","电位测量选择"置于"参比".B 通电插上电源,"工作电源"置于"自然"档,指示灯亮,电流显示为0,电位表显示的电位为"研究电极"相对于"参比电极"的稳定电位,称为自腐电位,其绝对值大于0.8V可以开始下面的操作,否则需要重新处理电极.C "电位测量选择"置于"给定",仪器预热5-15min.电位表指示的给定电位为预设定的"研究电极"相对于"参比电极"的电位.D 调节"恒电位粗调"和"恒电位细调"使电位表指示的给定电位为自腐电位,"工作电源"置于"极化".F 阴极极化调节"恒电位粗调"和"恒电位细调"每次减少10mV,直到减少200mV,每减少一次,测定1min后的电流值.测完后,将给定电位调回自腐电位值.G 阳极极化将"工作电源"置于"自然","电位测量选择"置于"参比",等待电位逐渐恢复到自腐电位±5mV,否则需要重新处理电极.重复C,D,F步骤,F步骤中给定电位每次增加10mV,直到做出完整的极化曲线.提示,到达极化曲线的平台区,给定电位可每次增加100mV.H 实验完成,"电位测量选择"置于"参比","工作电源"置于"关".【注意事项】按照实验要求,严格进行电极处理.将研究电极置于电解槽时,要注意与鲁金毛细管之间的距离每次应保持一致.研究电极与鲁金毛细管应尽量靠近,但管口离电极表面的距离不能小于毛细管本身的直径.每次做完测试后,应在确认恒电位仪或电化学综合测试系统在非工作的状态下,关闭电源,取出电极.【数据处理】1. 对静态法测试的数据应列出表格.自腐电位-0.805V阴极极化数据:电位(V)电流(mA)电位(V)电流(mA)阳极极化数据:电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)2. 以电流密度为纵坐标,电极电势(相对饱和甘汞)为横坐标,绘制极化曲线.3. 讨论所得实验结果及曲线的意义,指出钝化曲线中的活性溶解区,过渡钝化区,稳定钝化区,过钝化区,并标出临界钝化电流密度(电势),维钝电流密度等数值.活性溶解区:过渡钝化区:稳定钝化区:;过钝化区:临界钝化电流密度(电势):维钝电流密度:思考题1. 比较恒电流法和恒电位法测定极化曲线有何异同,并说明原因.恒电流法是恒定电流测定相应的电极电势,恒电位法是很定电位测定相应的电流,对于阴极极化来说,两种方法测得的曲线相同,对于阳极极化来说,由于电流和电位不是一一对应的关系,得到不同的曲线.2. 测定阳极钝化曲线为何要用恒电位法用恒电位法能得到完整的极化曲线,用恒电流法只能得到ABEF曲线,即得到活化区以及过钝化区的一部分,得不到完整的几乎曲线.3. 做好本实验的关键有哪些电极的处理;研究电极与鲁金毛细管的距离;甘汞电极的误差;电位的每次改变值;溶液中杂质离子的存在等等【讨论】1. 电化学稳态的含义指定的时间内,被研究的电化学系统的参量,包括电极电势,极化电流,电极表面状态,电极周围反应物和产物的浓度分布等,随时间变化甚微,该状态通常被称为电化学稳态.电化学稳态不是电化学平衡态.实际上,真正的稳态并不存在,稳态只具有相对的含义.到达稳态之前的状态被称为暂态.在稳态极化曲线的测试中,由于要达到稳态需要很长的时间,而且不同的测试者对稳态的认定标准也不相同,因此人们通常人为界定电极电势的恒定时间或扫描速度,此法尤其适用于考察不同因素对极化曲线的影响时.2. 三电极体系极化曲线描述的是电极电势与电流密度之间的关系.被研究电极过程的电极被称为研究电极或工作电极.与工作电极构成电流回路,以形成对研究电极极化的电极称为辅助电极,也叫对电极.其面积通常要较研究电极为大,以降低该电极上的极化.参比电极是测量研究电极电势的比较标准,与研究电极组成测量电池.参比电极应是一个电极电势已知且稳定的可逆电极,该电极的稳定性和重现性要好.为减少电极电势测试过程中的溶液电位降,通常两者之间以鲁金毛细管相连.鲁金毛细管应尽量但也不能无限制靠近研究电极表面,以防对研究电极表面的电力线分布造成屏蔽效应.3. 影响金属钝化过程的几个因素金属的钝化现象是常见的,人们已对它进行了大量的研究工作.影响金属钝化过程及钝化性质的因素,可以归纳为以下几点:(1) 溶液的组成.溶液中存在的H+,卤素离子以及某些具有氧化性的的阴离子,对金属的钝化现象起着颇为显著的影响.在中性溶液中,金属一般比较容易钝化,而在酸性或某些碱性的溶液中,钝化则困难得多,这与阳极产物的溶解度有关系.卤素离子,特别是氯离子的存在,则明显地阻滞了金属的钝化过程,已经钝化了的金属也容易被它破坏(活化),而使金属的阳极溶解速度重新增大.溶液中存在的某些具有氧化性的阴离子(如CrO2-4)则可以促进金属的钝化.(2) 金属的化学组成和结构.各种纯金属的钝化性能不尽相同,以铁,镍,铬三种金属为例,铬最容易钝化,镍次之,铁较差些.因此添加铬,镍可以提高钢铁的钝化能力及钝化的稳定性.(3) 外界因素(如温度,搅拌等).一般来说,温度升高以及搅拌加剧,可以推迟或防止钝化过程的发生,这显然与离子的扩散有关实验十二铁的极化和钝化曲线的测定一、实验目的1. 测定铁在不同pH溶液中的极化曲线。
金属极化曲线

开放实验金属极化曲线的测定[摘 要] 本文采用准稳态法测定金属铁在硫酸溶液和碳酸氢铵溶液中的极化曲线,以金属铁作阳极,通过恒电位仪对研究电极给定一个恒定电位后,测量与之对应的准稳态电流值。
计算超电势和电流密度,采用Origin 软件以超电势对通过被研究电极的电流密度的对数作出极化曲线的图,从钝化曲线上确定出维钝电位范围和维钝电流密度值。
[关键词]金属钝化;极化曲线;电流密度 ;硫酸铁Determination of metal's polarization curveAbstract: This article determination of the metal iron with sulphuric acid or ammonium bicarbonate by method of quasi stationary state. As the metal iron to the anode. Determination the research potential of a constant potential by constant potential detector.Then,determination of the corresponding value of quasi stationary state. And account over potential and current density. Adopt the software of Origin draw a chart of passivation of metals, which through over potential and current density of researched potential of a logarithm,find the value of passivation potential range and passivation current density.Keywords: passivation of metals; polarization curve; current density; iron sulphate 1实验部分1.1 实验原理铁在24H SO 溶液中,将不断被溶解,同时产生H2,即:Fe + 2H + = Fe 2+ + H2 (a)Fe /24H SO 体系是-个二重电极,即在Fe /H+界面上同时进行两个电极反应:22Fe Fe e ++ (b) 222e H H ++ (c)反应(b)、(c)称为共轭反应。
铁的极化曲线物化实验报告
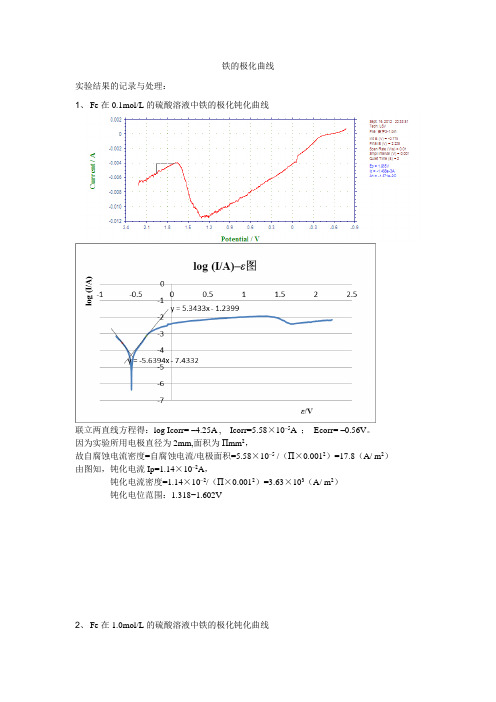
铁的极化曲线实验结果的记录与处理:1、Fe在0.1mol/L的硫酸溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10‒5 /(Π×0.0012)=17.8(A/ m2)由图知,钝化电流Ip=1.14×10‒2A,钝化电流密度=1.14×10‒2/(Π×0.0012)=3.63×103(A/ m2)钝化电位范围:1.318−1.602V2、Fe在1.0mol/L的硫酸溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10‒5 /(Π×0.0012)=17.8(A/ m2)由图知,钝化电流Ip=1.14×10‒2A,钝化电流密度=1.14×10‒2/(Π×0.0012)=3.63×103(A/ m2)钝化电位范围:1.318−1.602V3、Fe在1.0mol/L的HCl溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10‒5 /(Π×0.0012)=17.8(A/ m2)由图知,钝化电流Ip=1.14×10‒2A,钝化电流密度=1.14×10‒2/(Π×0.0012)=3.63×103(A/ m2)钝化电位范围:1.318−1.602V4、Fe在含1%的乌洛托品的1.0mol/L的HCl溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
(完整版)电化学曲线极化曲线阻抗谱分析
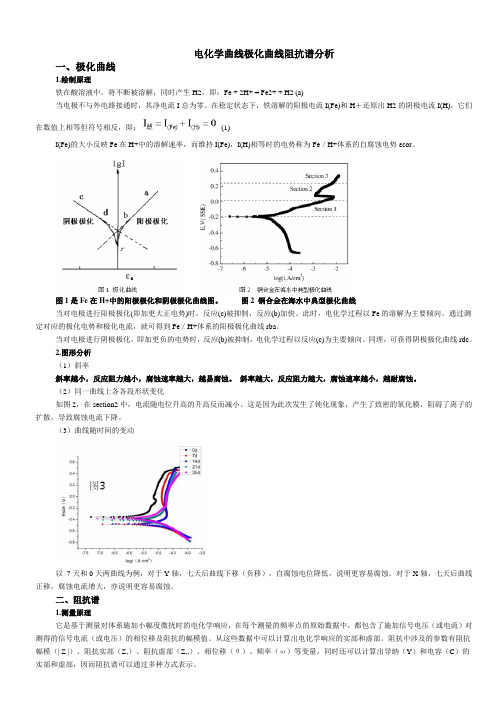
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
电化学曲线极化曲线阻抗谱分析

电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
《铁极化曲线测定》课件

Part
05
铁极化曲线测定的实际应用案 例
在材料科学中的应用
金属材料
铁极化曲线测定被广泛应用于金属材料的电化学性能研究,如不锈钢、铝合金等。通过 测量极化曲线,可以了解金属在腐蚀介质中的腐蚀行为和耐蚀性能,为材料的防腐和防
护提供依据。
涂层材料
铁极化曲线测定也可用于涂层材料的电化学性能研究。通过测量涂层材料与基体材料之 间的极化曲线,可以评估涂层的保护性能和耐蚀性,为涂层材料的选择和应用提供依据
详细描述
通过铁极化曲线测定结果,可以评估金属材料的耐腐蚀性能和电化学保护效果,为金属材料的研发、生产和应用 提供科学依据。同时,测定结果还可以指导金属材料的表面处理、涂层保护等措施,提高金属材料的耐腐蚀性能 和使用寿命。
结果误差分析
总结词
对铁极化曲线测定结果进行误差分析是确保结果准确性和可靠性的必要步骤。
环境监测
铁极化曲线测定还可应用于环境监测 领域,如土壤、水体等自然环境的电 化学性质测定,评估环境的腐蚀风险 和污染程度。
生物医学
在生物医学领域,铁极化曲线测定可 用于研究生物材料的电化学性能和生 物相容性,如人工关节、心脏起搏器 等医疗设备的电化学
总结词
正确解读铁极化曲线测定结果对于评估金属的电化学性能至 关重要。
详细描述
铁极化曲线测定结果可以反映金属在电解液中的电化学行为 ,包括金属的阳极和阴极反应、反应速率常数、腐蚀电位和 腐蚀电流等参数。这些参数对于评估金属的耐腐蚀性能和电 化学保护措施具有重要意义。
结果应用
总结词
铁极化曲线测定结果可以为金属材料的研发、生产和应用提供指导。
设置参数
设置恒流电源的电流值,以控制电场 强度的变化,同时设置电压表的量程 和采样频率等参数。
最新电化学曲线极化曲线阻抗谱分析
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)I(Fe)的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图1是Fe在H+中的阳极极化和阴极极化曲线图。
图2 铜合金在海水中典型极化曲线当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
2.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
斜率越大,反应阻力越大,腐蚀速率越小,越耐腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(| Z |)、阻抗实部(Z,)、阻抗虚部(Z,,)、相位移(θ)、频率(ω)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
极化曲线的测定
实验九极化曲线的测定【目的要求】1. 掌握稳态恒电位法测定金属极化曲线的基本原理和测试方法.2. 了解极化曲线的意义和应用.3. 掌握恒电位仪的使用方法.【实验原理】1. 极化现象与极化曲线为了探索电极过程机理及影响电极过程的各种因素,必须对电极过程进行研究,其中极化曲线的测定是重要方法之一.我们知道在研究可逆电池的电动势和电池反应时,电极上几乎没有电流通过,每个电极反应都是在接近于平衡状态下进行的,因此电极反应是可逆的.但当有电流明显地通过电池时,电极的平衡状态被破坏,电极电势偏离平衡值,电极反应处于不可逆状态,而且随着电极上电流密度的增加,电极反应的不可逆程度也随之增大.由于电流通过电极而导致电极电势偏离平衡值的现象称为电极的极化,描述电流密度与电极电势之间关系的曲线称作极化曲线,如图2-19-1所示.图2-19-1 极化曲线A-B:活性溶解区;B:临界钝化点B-C:过渡钝化区;C-D:稳定钝化区D-E:超(过)钝化区金属的阳极过程是指金属作为阳极时在一定的外电势下发生的阳极溶解过程,如下式所示:M→Mn++ne此过程只有在电极电势正于其热力学电势时才能发生.阳极的溶解速度随电位变正而逐渐增大,这是正常的阳极溶出,但当阳极电势正到某一数值时,其溶解速度达到最大值,此后阳极溶解速度随电势变正反而大幅度降低,这种现象称为金属的钝化现象.图2-19-1中曲线表明,从A点开始,随着电位向正方向移动,电流密度也随之增加,电势超过B点后,电流密度随电势增加迅速减至最小,这是因为在金属表面生产了一层电阻高,耐腐蚀的钝化膜.B点对应的电势称为临界钝化电势,对应的电流称为临界钝化电流.电势到达C点以后,随着电势的继续增加,电流却保持在一个基本不变的很小的数值上,该电流称为维钝电流,直到电势升到D点,电流才有随着电势的上升而增大,表示阳极又发生了氧化过程,可能是高价金属离子产生也可能是水分子放电析出氧气,DE段称为过钝化区.2. 极化曲线的测定(1) 恒电位法恒电位法就是将研究电极依次恒定在不同的数值上,然后测量对应于各电位下的电流.极化曲线的测量应尽可能接近体系稳态.稳态体系指被研究体系的极化电流,电极电势,电极表面状态等基本上不随时间而改变.在实际测量中,常用的控制电位测量方法有以下两种:静态法:将电极电势恒定在某一数值,测定相应的稳定电流值,如此逐点地测量一系列各个电极电势下的稳定电流值,以获得完整的极化曲线.对某些体系,达到稳态可能需要很长时间,为节省时间,提高测量重现性,往往人们自行规定每次电势恒定的时间.动态法:控制电极电势以较慢的速度连续地改变(扫描),并测量对应电位下的瞬时电流值,以瞬时电流与对应的电极电势作图,获得整个的极化曲线.一般来说,电极表面建立稳态的速度愈慢,则电位扫描速度也应愈慢.因此对不同的电极体系,扫描速度也不相同.为测得稳态极化曲线,人们通常依次减小扫描速度测定若干条极化曲线,当测至极化曲线不再明显变化时,可确定此扫描速度下测得的极化曲线即为稳态极化曲线.同样,为节省时间,对于那些只是为了比较不同因素对电极过程影响的极化曲线,则选取适当的扫描速度绘制准稳态极化曲线就可以了.上述两种方法都已经获得了广泛应用,尤其是动态法,由于可以自动测绘,扫描速度可控制一定,因而测量结果重现性好,特别适用于对比实验.(2) 恒电流法恒电流法就是控制研究电极上的电流密度依次恒定在不同的数值下,同时测定相应的稳定电极电势值.采用恒电流法测定极化曲线时,由于种种原因,给定电流后,电极电势往往不能立即达到稳态,不同的体系,电势趋于稳态所需要的时间也不相同,因此在实际测量时一般电势接近稳定(如1min~3min内无大的变化)即可读值,或人为自行规定每次电流恒定的时间.【仪器试剂】恒电位仪一台;饱和甘汞电极1支;碳钢电极1支;铂电极1支;三室电解槽1只(见图2-19-2)2 mol·dm-3 (NH4)2CO3溶液;0.5 mol·dm-3H2SO4溶液;丙酮溶液【实验步骤】1. 碳钢预处理:用金相砂纸将碳钢研究电极打磨至镜面光亮,用石蜡蜡封,留出1cm2面积,如蜡封多可用小刀去除多余的石蜡,保持切面整齐.然后在丙酮中除油,在0.5M的硫酸溶液中去除氧化层,浸泡时间分别不低于10S.图2-19-2三室电解槽1.研究电极;2.参比电极;3.辅助电极2. 恒电位法测定极化曲线的步骤:A 准备工作仪器开启前,"工作电源"置于"关","电位量程"置于"20V","补偿衰减"置于"0","补偿增益"置于"2","电流量程"置于"200mA","工作选择"置于"恒电位","电位测量选择"置于"参比".B 通电插上电源,"工作电源"置于"自然"档,指示灯亮,电流显示为0,电位表显示的电位为"研究电极"相对于"参比电极"的稳定电位,称为自腐电位,其绝对值大于0.8V可以开始下面的操作,否则需要重新处理电极.C "电位测量选择"置于"给定",仪器预热5-15min.电位表指示的给定电位为预设定的"研究电极"相对于"参比电极"的电位.D 调节"恒电位粗调"和"恒电位细调"使电位表指示的给定电位为自腐电位,"工作电源"置于"极化".F 阴极极化调节"恒电位粗调"和"恒电位细调"每次减少10mV,直到减少200mV,每减少一次,测定1min后的电流值.测完后,将给定电位调回自腐电位值.G 阳极极化将"工作电源"置于"自然","电位测量选择"置于"参比",等待电位逐渐恢复到自腐电位±5mV,否则需要重新处理电极.重复C,D,F步骤,F步骤中给定电位每次增加10mV,直到做出完整的极化曲线.提示,到达极化曲线的平台区,给定电位可每次增加100mV.H 实验完成,"电位测量选择"置于"参比","工作电源"置于"关".【注意事项】按照实验要求,严格进行电极处理.将研究电极置于电解槽时,要注意与鲁金毛细管之间的距离每次应保持一致.研究电极与鲁金毛细管应尽量靠近,但管口离电极表面的距离不能小于毛细管本身的直径.每次做完测试后,应在确认恒电位仪或电化学综合测试系统在非工作的状态下,关闭电源,取出电极.【数据处理】1. 对静态法测试的数据应列出表格.自腐电位-0.805V阴极极化数据:电位(V)电流(mA)电位(V)电流(mA)阳极极化数据:电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)电位(V)电流(mA)2. 以电流密度为纵坐标,电极电势(相对饱和甘汞)为横坐标,绘制极化曲线.3. 讨论所得实验结果及曲线的意义,指出钝化曲线中的活性溶解区,过渡钝化区,稳定钝化区,过钝化区,并标出临界钝化电流密度(电势),维钝电流密度等数值.活性溶解区:过渡钝化区:稳定钝化区:;过钝化区:临界钝化电流密度(电势):维钝电流密度:思考题1. 比较恒电流法和恒电位法测定极化曲线有何异同,并说明原因.恒电流法是恒定电流测定相应的电极电势,恒电位法是很定电位测定相应的电流,对于阴极极化来说,两种方法测得的曲线相同,对于阳极极化来说,由于电流和电位不是一一对应的关系,得到不同的曲线.2. 测定阳极钝化曲线为何要用恒电位法用恒电位法能得到完整的极化曲线,用恒电流法只能得到ABEF曲线,即得到活化区以及过钝化区的一部分,得不到完整的几乎曲线.3. 做好本实验的关键有哪些电极的处理;研究电极与鲁金毛细管的距离;甘汞电极的误差;电位的每次改变值;溶液中杂质离子的存在等等【讨论】1. 电化学稳态的含义指定的时间内,被研究的电化学系统的参量,包括电极电势,极化电流,电极表面状态,电极周围反应物和产物的浓度分布等,随时间变化甚微,该状态通常被称为电化学稳态.电化学稳态不是电化学平衡态.实际上,真正的稳态并不存在,稳态只具有相对的含义.到达稳态之前的状态被称为暂态.在稳态极化曲线的测试中,由于要达到稳态需要很长的时间,而且不同的测试者对稳态的认定标准也不相同,因此人们通常人为界定电极电势的恒定时间或扫描速度,此法尤其适用于考察不同因素对极化曲线的影响时.2. 三电极体系极化曲线描述的是电极电势与电流密度之间的关系.被研究电极过程的电极被称为研究电极或工作电极.与工作电极构成电流回路,以形成对研究电极极化的电极称为辅助电极,也叫对电极.其面积通常要较研究电极为大,以降低该电极上的极化.参比电极是测量研究电极电势的比较标准,与研究电极组成测量电池.参比电极应是一个电极电势已知且稳定的可逆电极,该电极的稳定性和重现性要好.为减少电极电势测试过程中的溶液电位降,通常两者之间以鲁金毛细管相连.鲁金毛细管应尽量但也不能无限制靠近研究电极表面,以防对研究电极表面的电力线分布造成屏蔽效应.3. 影响金属钝化过程的几个因素金属的钝化现象是常见的,人们已对它进行了大量的研究工作.影响金属钝化过程及钝化性质的因素,可以归纳为以下几点:(1) 溶液的组成.溶液中存在的H+,卤素离子以及某些具有氧化性的的阴离子,对金属的钝化现象起着颇为显著的影响.在中性溶液中,金属一般比较容易钝化,而在酸性或某些碱性的溶液中,钝化则困难得多,这与阳极产物的溶解度有关系.卤素离子,特别是氯离子的存在,则明显地阻滞了金属的钝化过程,已经钝化了的金属也容易被它破坏(活化),而使金属的阳极溶解速度重新增大.溶液中存在的某些具有氧化性的阴离子(如CrO2-4)则可以促进金属的钝化.(2) 金属的化学组成和结构.各种纯金属的钝化性能不尽相同,以铁,镍,铬三种金属为例,铬最容易钝化,镍次之,铁较差些.因此添加铬,镍可以提高钢铁的钝化能力及钝化的稳定性.(3) 外界因素(如温度,搅拌等).一般来说,温度升高以及搅拌加剧,可以推迟或防止钝化过程的发生,这显然与离子的扩散有关实验十二铁的极化和钝化曲线的测定一、实验目的1. 测定铁在不同pH溶液中的极化曲线。
电化学曲线极化曲线阻抗谱分析
电化学曲线极化曲线阻抗谱分析一、极化曲线1.绘制原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流在数值上相等但符号相反,即: 1 1 - 12.图形分析(1)斜率斜率越小,反应阻力越小,腐蚀速率越大,越易腐蚀。
(2)同一曲线上各各段形状变化如图2,在section2中,电流随电位升高的升高反而减小。
这是因为此次发生了钝化现象,产生了致密的氧化膜,阻碍了离子的扩散,导致腐蚀电流下降。
(3)曲线随时间的变动以7天和0天两曲线为例,对于Y轴,七天后曲线下移(负移),自腐蚀电位降低,说明更容易腐蚀。
对于X轴,七天后曲线正移,腐蚀电流增大,亦说明更容易腐蚀。
二、阻抗谱1.测量原理它是基于测量对体系施加小幅度微扰时的电化学响应,在每个测量的频率点的原始数据中,都包含了施加信号电压(或电流)对测得的信号电流(或电压)的相位移及阻抗的幅模值。
从这些数据中可以计算出电化学响应的实部和虚部。
阻抗中涉及的参数有阻抗幅模(I Z |)、阻抗实部(Z,)、阻抗虚部(乙,)、相位移(B )、频率(3)等变量,同时还可以计算出导纳(Y)和电容(C)的实部和虚部,因而阻抗谱可以通过多种方式表示。
I(Fe)的大小反映而维持I(Fe), I(H)相等时的电势称为Fe/H+体系的自腐蚀电势& corFe在H+中的溶解速率,图丄极化曲线图1是Fe在H+中的阳极极化和阴极极化曲线图。
当对电极进行阳极极化定对应的极化电势和极化电流,当对电极进行阴极极化,图2铜合金在海水中典型极化曲线(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以就可得到Fe/ H+体系的阳极极化曲线rba。
即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
Fe的溶解为主要倾向。
通过测同理,可获得阴极极化曲线rdc。
实验报告铁极化
铁的极化曲线的测定董兴1.Fe在0.1M硫酸中的极化钝化曲线。
测得开路点位:-0.49V极化曲线如下图:联立两直线方程计算得:I corr=5.20⨯10-5A,E corr=-0.54V。
因为实验所用电极是标准电极,直径是2mm,面积是∏mm2,故自腐蚀电位密度为I corr/S=1.66⨯10-5A/mm22.Fe在1M硫酸中的极化钝化曲线。
测得开路点位:-0.49V极化钝化曲线如下图:联立两直线方程计算得:I corr=7.76⨯10-5A,E corr=-0.52V。
因为实验所用电极是标准电极,直径是2mm ,面积是∏mm 2,故自腐蚀电流密度为I corr /S=2.47⨯10-5A/mm 2 由图中知:钝化电流为A I 310999.4-⨯=,钝化电流密度=4.999×10-3/π=1.59×10-3 A/mm 2钝化电位范围为0.406V-1.606V由Fe 在0.1M 和1M 硫酸中的极化钝化曲线可知:硫酸浓度越大,其钝化电流密度越小,而且钝化电位范围越长,而在0.1M 硫酸中,由于硫酸浓度极低,因此,基本不存在稳定的钝化去。
3.Fe 在1MHCl 中的极化曲线。
测得开路点位:-0.53V联立两直线方程计算得:联立两直线方程计算得:I corr =5.01⨯10-5A ,E corr =-1.09V 。
因为实验所用电极是标准电极,直径是2mm ,面积是∏mm 2,故自腐蚀电位密度为I corr /S=1.60⨯10-5A/mm 2=16.0A/m 2自腐蚀速率与自腐蚀电流密度有如下关系:v=3600MI/nF,可得:腐蚀速率:v=16.7g/(m 2·h)(其中M=56g/mol,n=2,F=96484C/mol)Fe 在盐酸中不钝化。
4.Fe 在含1%乌洛托品的1.0 M HCl 中的极化曲线。
测得开路点位:-0.53V联立两直线方程计算得:联立两直线方程计算得:I corr=1.58⨯10-5A,E corr=-0.529V。
