(推荐)高中化学常见物质的分类
高一化学 物质的分类、分散系及其分类
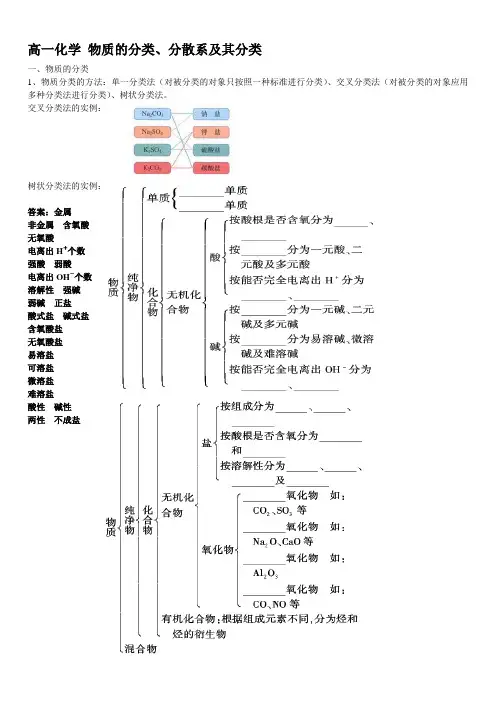
高一化学物质的分类、分散系及其分类一、物质的分类1、物质分类的方法:单一分类法(对被分类的对象只按照一种标准进行分类)、交叉分类法(对被分类的对象应用多种分类法进行分类)、树状分类法。
交叉分类法的实例:树状分类法的实例:答案:金属非金属含氧酸无氧酸电离出H+个数强酸弱酸电离出OH-个数溶解性强碱弱碱正盐酸式盐碱式盐含氧酸盐无氧酸盐易溶盐可溶盐微溶盐难溶盐酸性碱性两性不成盐氧化物的分类:特别提示:碱性氧化物都是金属氧化物;金属氧化物可能是碱性氧化物(如Na 2O 、CaO),也可能是酸性氧化物(如Mn 2O 7),还可能是两性氧化物(如Al 2O 3);非金属氧化物可能是酸性氧化物(如SO 2、SO 3、CO 2等),也可能是不成盐氧化物(如CO 、NO 等);酸性氧化物可能是非金属氧化物,也可能是金属氧化物。
二、分散系及其分类1、分散系:一种(或多种)物质分散到另一种(或多种)物质里得到的体系。
分散质:被分散的物质。
分散剂:容纳分散质的物质。
[思考]按照分散质或分散剂所处的状态,有几种两两组合的方式? 能否在这些组合中举些分散系的例子?实验:Fe(OH)3胶体的制备①将烧杯中的蒸馏水________;②向沸水中逐滴加入1 mL~2 mL饱和________;③继续煮沸至溶液呈________,停止加热,即制得Fe(OH)3胶体。
化学方程式为____ ____。
胶体之所以具有介稳性的原因:①胶体粒子可以通过吸附带上电荷、同种胶体粒子的电性相同,在通常状况下,它们之间的相互排斥阻碍了胶体利字变大,使它们不易聚集。
②胶体粒子所做的布朗运动也使它们不容易聚集成质量较大的颗粒而沉降下来。
特别提示:电泳现象表明胶体粒子带电荷,但胶体都是电中性的。
胶体粒子由许许多多分子组成。
如果胶体粒子带正电,它将向阴极移动;如果胶体粒子带负电,它将向阳极移动。
思考:为什么豆浆里放入盐卤(MgCl2)或石膏可制成豆腐?豆浆里的蛋白质胶体,遇电解质形成凝胶。
高考化学一轮复习:物质的分类

高考化学一轮复习:物质的分类化学中两种不同的物质分类方法,即树状分类法和交叉分类法。
一、树状分类法特点:同一层次的物质类别间一般是相互独立,没有交叉的。
归纳与总结:①酸的分类:酸是由氢离子和酸根离子组成。
按是否含氧分为含氧酸(硫酸,硝酸和碳酸)和无氧酸(盐酸,硫化氢);按性质分为易挥发性酸(盐酸,硝酸)和难挥发性酸(硫酸,磷酸)。
②碱的分类:碱是由金属离子(铵根离子)和氢氧根离子组成。
按溶解性分为易溶碱(氢氧化钠,氢氧化钾,氨水,氢氧化钡)和难溶碱(氢氧化铜,氢氧化铁)。
③盐的分类:盐是由金属离子(铵根离子) 和酸根离子组成。
按溶解性分为可溶盐(氯化钠、硝酸银、硫酸铜、氯化铵)和难溶盐(碳酸钙、碳酸钡、硫酸钡);按组成离子分为铵盐,钾盐,钠盐,硝酸盐,碳酸盐,硫酸盐;按酸根是否含氧分为含氧酸盐(硝酸钾,高锰酸钾,亚硫酸铁)和无氧酸盐(氯化钠,氯化钙)。
④氧化物的分类:成盐氧化物分为酸性氧化物(二氧化碳,七氧化二锰),碱性氧化物(氧化钠),两性氧化物(三氧化二铝);不成盐氧化物(一氧化碳,一氧化氮,一氧化二氮);过氧化物(过氧化钠,过氧化氢),其它氧化物(四氧化三铁,四氧化三铅,二氧化氮)。
⑤单质的分类:金属单质和非金属单质。
金属单质分为活泼金属(钾,钙,钠),较活泼金属(铁锡,铅),不活泼金属(银,铂,铜);非金属单质由原子构成(金刚石,石墨,稀有气体),由分子构成(氢气,氮气,氯气,氧气)。
二、交叉分类法特点:依据物质的不同属性从不同的角度对物质进行分类的方法,物质类别之间有部分交叉。
应用举例:如碳酸钠即属于钠盐,也属于碳酸盐。
交叉分类法涉及分类的不同角度,所以比较复杂多样,同学们在实际应用当中需灵活处理。
三、两种分类方法的对比。
高一化学物质分类

常见物质分类
1.物质的分类
物质包括:纯净物和混合物
金属单质(Na,Cu,Fe等)
单质
纯净物非金属单质(S,氮气,氯气等)
化合物:氧化物,酸,碱
酸性氧化物(二氧化硫,二氧化碳等)
氧化物碱性氧化物(氧化钠,氧化镁等)
两性氧化物(三氧化二铝等)
不成盐氧化物(一氧化碳,一氧化氮等)
按强弱分:强酸(HCl,硝酸,硫酸等)酸弱酸(醋酸,碳酸等)
按电离出一元酸(HCl,HI等)
氢离子数二元酸(硫酸,碳酸等)
多元酸(磷酸等)
按强弱分:强碱(氢氧化钠,氢氧化钾等)碱弱碱(氨水等)
按电离出氢一元酸(HCl,HI等)
氧离子数二元酸(硫酸,碳酸等)
多元酸(磷酸等)
正盐(碳酸钠,硫酸钠等)
盐酸式盐(碳酸氢钠,硫酸氢钠等)
碱式盐(碳酸氢氧化二铜等)
溶液(氯化钠溶液,硝酸钾溶液)
混合物悬浊液(泥水混合物),乳浊液(油水混合物)
胶体(氢氧化铁胶体,碘化银胶体等)
2.物质分类中要注意以下两点
(1)金属氧化物不一定属于碱性氧化物,如过氧化钠属于过氧化物,三氧化二铝属于两性氧化物,七氧化二锰属于酸性氧化物。
(2)非金属氧化物也不一定属于酸性氧化物,如一氧化碳,一氧化氮等。
化学高一知识点物质分类

化学高一知识点物质分类化学是自然科学的一门重要学科,涉及到物质的性质、组成和变化。
在化学学习的初期,高一学生需要了解各种物质的分类,这对于后续的学习和实验是至关重要的。
本文将介绍化学高一知识点中的物质分类。
一、基础概念在学习物质分类之前,我们先了解一些基础概念。
1. 物质物质是组成一切实物的基本单位,包括固体、液体和气体。
2. 纯物质纯物质是由同一种物质组成的,具有一定的化学性质和物理性质。
3. 混合物混合物是由两种或两种以上的物质混合而成,每种物质保留自己的性质。
4. 纯净物质和杂质纯净物质是指纯物质中不含有杂质的物质。
而杂质是指混合物中除了主要成分以外的其他物质。
二、物质分类根据物质的组成和性质,我们可以将物质分为以下几类。
1. 单质单质是由同一种原子组成的的物质,具有一定的性质。
例如金属、非金属和惰性气体都是单质。
金属是一类具有典型金属性质的单质。
金属通常具有良好的延展性、导电性和热传导性。
常见的金属有铁、铜和铝。
非金属是金属以外的元素。
非金属通常具有不良的导电性和热传导性,大部分非金属在常温下呈固体或气体状态。
常见的非金属有氧气、磷和硫。
惰性气体又称稀有气体,它们是化学上非常稳定的元素,很少参与化学反应。
常见的惰性气体有氦、氩和氖。
2. 化合物化合物是由不同种类原子按照一定比例组合而成的物质,具有一定的性质。
例如水、二氧化碳和氨都是常见的化合物。
水是一种氢和氧按照2:1的比例组成的化合物,具有透明、无味和无色的性质。
水是生命中不可缺少的物质。
二氧化碳是由一份碳和两份氧组成的化合物,具有无色、无味、不可燃和不支燃的性质。
二氧化碳在自然界中普遍存在,是植物进行光合作用的产物。
氨是由一份氮和三份氢组成的化合物,具有刺激性气味和可燃的性质。
氨广泛用于农业领域,作为合成化肥的主要成分。
3. 混合物混合物是由两种或两种以上物质混合而成的物质,每种物质都保留自己的性质。
混合物可以是均匀混合物,也可以是非均匀混合物。
高中化学知识点物质分类

高中化学知识点物质分类高中化学知识点:物质分类在化学研究中,物质是一个极其重要的概念。
它可以看作是一切化学变化的基础和结果,可以用来描述生物体内和自然界中的无数化学现象。
对于高中化学学生来说,了解和掌握物质分类的知识是非常重要的,本文就为大家介绍一下此方面的知识要点。
1.物质的基本分类方式按照物质的物理性质和化学性质,可以将物质划分为元素、化合物和混合物三类。
其中,元素是由一种或几种相同的原子构成的;化合物是由两种或以上不同的元素以一定的比例组合形成的化学物质;混合物则是指由两种或两种以上不同的物质混合而成的物质。
2.元素的分类及性质元素是组成物质世界的基本单位,目前已知元素的种类有118种。
元素的分类又可以按照周期表中的位置进行分类。
以周期表第一周期元素“氢”和第二周期元素“氦”为例,由于它们的电子壳层数量不同,故不同于不在同一周期中的其他元素。
此外,元素还可以按照物理性质和化学性质等方面进行分类,这些分类方法通常用于高级化学知识的研究。
3.化合物的分类及性质化合物是由两种或以上不同的元素以一定的比例结合而成,根据化合物的组成与化学性质,化合物可分为离子化合物和分子化合物两大类。
离子化合物是由大量正、负离子以离子结晶的形式组成的。
例如氯化钠(NaCl)就是一个典型的离子化合物,其中,正离子为钠(Na+),负离子为氯(Cl-)。
分子化合物是由两种或以上不同的非金属原子以共价键结合而成的。
例如水(H2O)、二氧化碳(CO2)等都是典型的分子化合物。
4.混合物的分类及性质混合物是由两种或两种以上不同的物质混合而成的物质,其中各种成分相对独立,既没有明显的化学反应,也没有固定的比例关系。
混合物又可以按照成分的性质分为均相混合物和非均相混合物两类。
均相混合物也叫做溶液,是由两种或两种以上的物质组成的代表性混合物。
例如,饮料、果汁等都是典型的均相混合物。
非均相混合物则是形态不一的两种或以上物质混合在一起形成的,例如土壤、岩石等,其组成也是变化多样的。
化学物质的分类

化学物质的分类化学物质是指由不同元素组成的物质,根据其组成成分、物理性质和化学性质的不同,可以将化学物质分为许多不同的类别。
化学物质分类的目的是为了更好地理解和研究物质的性质和特点。
本文将介绍几种常见的化学物质分类方法。
一、按化学成分分类1. 无机物和有机物根据化学成分的不同,化学物质可以分为无机物和有机物两大类。
无机物主要是由无机元素组成的物质,如金属、非金属离子和化合物。
有机物则是由碳元素和氢元素以及其他元素构成的化合物,如烃类、醇类、醚类等。
无机物和有机物在化学性质、物理性质和用途上存在着很大的差异。
2. 元素和化合物根据化学成分是否为纯元素,化学物质可以分为两类:元素和化合物。
元素是由同一种原子组成的纯物质,如金、银、氧、氮等。
而化合物则是由不同种类的元素组合而成的物质,如水(H2O)、二氧化碳(CO2)等。
二、按物理性质分类1. 固体、液体和气体根据物质的物态变化,化学物质可分为固体、液体和气体三种状态。
固体具有一定的形状和体积,其分子之间的排列较为紧密;液体具有一定的体积但没有固定的形状,分子之间的排列相对较松散;气体则没有固定的形状和体积,分子之间的排列较为稀疏。
2. 金属、非金属和半金属根据物质的导电性和导热性,化学物质可以分为金属、非金属和半金属三种类型。
金属具有良好的导电性和导热性,一般呈固态存在;非金属则导电性和导热性较差,可呈固态、液态或气态存在;而半金属则介于金属和非金属之间,具有介于二者之间的导电性和导热性。
三、按化学性质分类1. 酸、碱和盐根据物质的酸碱性质,化学物质可以分为酸、碱和盐三种类型。
酸具有酸性,可以与碱反应生成盐和水;碱具有碱性,可以与酸反应生成盐和水;盐是由酸和碱中和反应所生成的化合物。
2. 氧化物和还原物根据物质的氧化还原性质,化学物质可以分为氧化物和还原物两种类型。
氧化物是含氧元素的化合物,具有将其他物质氧化的性质;还原物则是具有还原其他物质的能力。
高中化学常见物质及应用
高中化学常见物质及应用高中化学常见物质及其应用:一、无机化合物:1. 水(H2O):水是一种无机化合物,常见于生活中。
它有很多应用,包括饮用、煮饭、清洗、浇灌植物等。
此外,水也是化学反应中的重要参与物,许多反应都需要水作为溶剂。
2. 氧气(O2):氧气是一种气体,在空气中占据很大比例。
它可以用于人类呼吸、火的燃烧和细胞呼吸等生物过程中。
此外,氧气还可以用于氧疗、高效燃烧和氧化反应等许多实验和工业应用中。
3. 二氧化碳(CO2):二氧化碳在大气中也很常见,是一种重要的温室气体。
它还可以用于饮料制作中的注气、灭火装置、气泡发生器等应用。
4. 氯化钠(NaCl):氯化钠是食盐的化学名。
它是一种普遍使用的调味品,用于食品的烹饪和保存。
此外,氯化钠还可以用于净水、制氯和防腐剂等。
5. 重要金属:铁、铜、锌等金属常见于生活中,具有广泛的应用。
铁可用于建筑、制造机械和生产钢铁。
铜可用于电气导线、水管和制作乐器等。
锌可用于镀锌、蓄电池和合金制造等。
6. 硫酸(H2SO4):硫酸是一种强酸,广泛用于实验室和工业领域。
它可用于制作化肥、染料、肥皂和清洗剂等。
7. 氨气(NH3):氨气是一种具有刺激性气味的无色气体。
它可用于制作氮肥、清洗剂、合成纤维等。
8. 氧化铜(CuO):氧化铜是一种黑色固体,可用于制作铜盐、颜料、导电材料等。
二、有机化合物:1. 葡萄糖(C6H12O6):葡萄糖是一种常见的单糖,是人类和其他生物的重要能量来源。
它还用于食品加工、饮料制作和制药工业。
2. 乙醇(C2H5OH):乙醇是一种无色液体,广泛应用于食品饮料、消毒剂、溶剂等。
3. 甘油(C3H8O3):甘油是一种可溶于水的有机液体,主要用于制造肥皂和面霜等化妆品。
4. 丙酮(C3H6O):丙酮是一种无色液体,具有良好的溶剂性,可用于涂料、塑料和胶水的制造。
5. 苯(C6H6):苯是一种无色液体,具有特殊的芳香气味。
它是合成塑料、橡胶、染料和药物的重要原料。
高考化学知识点:物质的分类
高考化学知识点:物质的分类1500字物质的分类是化学学科中的重要内容之一。
它是根据物质的性质、组成、结构等方面的不同特征,将物质划分为不同的类别。
一、按物质的聚集状态分类根据物质的聚集状态,可以将物质分为固体、液体和气体三大类。
1. 固体:具有一定形状和体积的物质被称为固体。
固体的分子之间存在着比较密集的排列。
固体的特点是具有一定的形状和体积,呈现出坚固的结构和不可压缩性。
例如,金属、石头、木头等都是固体物质。
2. 液体:具有一定体积,但没有一定的形状,可以流动的物质被称为液体。
液体的分子间距离较固体大,分子之间的相互作用较弱。
液体具有一定的体积和可流动性的特点,但不具备固体的形状稳定性和可压缩性。
例如,水、酒精等都是液体物质。
3. 气体:具有一定体积和可压缩性,没有一定形状,能自由扩散和流动的物质被称为气体。
气体的分子之间的距离较大,分子间的相互作用相对较弱。
气体具有高度的可压缩性和自由扩散性,但没有一定的形状和体积。
例如,空气、氢气等都是气体物质。
二、按物质的组成分类根据物质的组成方式,可以将物质分为单质和化合物两大类。
1. 单质:由同一种元素组成的纯净物质称为单质。
单质的组成方式非常简单,只包含一个元素。
例如,金属元素、非金属元素等都是单质物质。
2. 化合物:由两种或两种以上元素组成的物质被称为化合物。
化合物的组成方式比较复杂,由不同种类的元素按照一定的比例组合而成,具有独特的化学性质。
例如,水(H2O)、二氧化碳(CO2)等都是化合物。
三、按物质的化学结构分类根据物质的化学结构特征,可以将物质分为有机物和无机物两大类。
1. 有机物:由碳元素与氢元素以及其他元素构成的化合物被称为有机物。
有机物的化学结构相对复杂,具有较为丰富的化学性质。
例如,脂肪、蛋白质、糖等都属于有机物。
2. 无机物:不含碳元素或者只含碳元素与少量其他元素构成的化合物被称为无机物。
无机物的化学结构相对简单,具有较为单一的化学性质。
高一化学物质的分类及转化知识点。
高一化学物质的分类及转化知识点。
一、物质的分类物质是构成一切物体的基本单位,根据其组成和性质的不同,可以将物质分为纯物质和混合物。
1. 纯物质纯物质是由同种类型的分子或原子组成的物质,具有确定的化学组成和独特的性质。
根据纯物质的组成和性质,可以分为元素和化合物。
元素是由同种类型的原子组成的纯物质,无法通过化学方法分解成其他物质。
元素可以进一步分为金属元素、非金属元素和半金属元素等。
化合物是由两种或两种以上不同元素的原子通过化学键结合而成的纯物质。
化合物具有独特的化学性质,可以通过化学方法分解成其他物质。
2. 混合物混合物是由两种或两种以上不同纯物质按一定比例混合而成的物质。
混合物可以通过物理方法分离成组成它的纯物质。
根据混合物的形态和组成,可以分为气体混合物、液体混合物和固体混合物等。
二、物质的转化物质的转化是指物质在化学反应中发生原子、分子或离子的重组,形成新的物质的过程。
物质的转化可以分为化学变化和物理变化两种类型。
1. 化学变化化学变化是指物质在化学反应中发生原子、分子或离子的重组,形成新的物质的过程。
化学变化伴随着化学键的形成、断裂和能量的释放或吸收。
化学变化是永久性的,不可逆转的。
化学变化的特征包括:(1) 颜色的变化:反应前后物质的颜色发生明显变化。
(2) 气体的产生:反应中产生气体,如气泡、气味等。
(3) 沉淀的生成:反应中形成不溶于反应溶液的固体沉淀。
(4) 温度的变化:反应过程中放热或吸热,导致温度的升高或降低。
(5) 光的发射或吸收:反应中产生光的现象,如发光、发热等。
2. 物理变化物理变化是指物质在物理条件下发生形态或性质的改变,但其化学组成不发生变化的过程。
物理变化可以是可逆的,通过改变物理条件可以恢复原有的物质。
常见的物理变化包括:(1) 相变:物质由一个相态转变成另一个相态,如固体溶解成液体、固体升华成气体等。
(2) 研磨、切割等:物质的形态或大小发生改变,但其化学组成没有发生变化。
高中化学必修一物质的分类知识点
高中化学必修一物质的分类知识点1.物质分类:纯净物和混合物a、纯净物:由一种物质组成的,纯净是相对的,绝对纯净的物质是没有的,只要杂质含量低,不至于对生产和科学研究产生影响的物质就是纯净物。
b、混合物:由两种或多种物质组成,这些物质相互间没有发生化学反应,各物质都保持各自的性质(例如:空气、雨水、溶液、碳酸饮料、牛奶等)。
2.注意事项:划分纯净物、混合物的标准是根据物质的种类来划分的。
只含一种物质的就属于纯净物,含有几种物质的就属于混合物。
另:水、蒸馏水、冰水混合物都是纯净物;自然界的水、矿泉水、盐水、糖水、雪碧饮料等都是混合物1.物质的组成从宏观的角度看,物质由元素组成;从微观的角度看,原子?分子?离子等是构成物质的基本粒子?物质组成的判断依据有:(1)根据有无固定的组成或有无固定的熔?沸点可判断该物质是纯净物还是混合物?其中:油脂?高分子化合物?玻璃态物质及含有同种元素的不同同素异形体的物质均属于混合物?(2)对于化合物可根据晶体类型判断:离子晶体是由阴?阳离子构成的;分子晶体是由分子构成的;原子晶体是由原子构成的?(3)对于单质也可根据晶体类型判断:金属单质是由金属阳离子和自由电子构成的;原子晶体?分子晶体分别由原子?分子构成?2.物质的分类(1)分类是研究物质化学性质的基本方法之一,物质分类的依据有多种,同一种物质可能分别属于不同的物质类别?(2)物质的分类依据不同,可以有多种分类方法,特别是氧化物的分类是物质分类的难点,要掌握此类知识,关键是明确其分类方法。
氧化物的分类比较复杂,判断氧化物所属类别时,应注意以下几个问题:①酸性氧化物不一定是非金属氧化物,如CrO3是酸性氧化物;非金属氧化物不一定是酸性氧化物,如CO、NO和NO2等?②碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Na2O2为过氧化物(又称为盐型氧化物),Pb3O4和Fe3O4为混合型氧化物(一种复杂氧化物),Al2O3和ZnO为两性氧化物,Mn2O7为酸性氧化物?③酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸?碱(如SiO2、MgO)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的分类
一、单质
按元素组成分为
1.金属单质
K钾、Ca钙、Na纳、Mg镁、Al铝、Zn锌、Fe铁、
Sn锡、Pb铅、Cu铜、Hg汞、Ag银、Pt铂、Au金
2.非金属单质
氢气H2、碳C、氮气N2、氧气O2、臭氧O3、氟气F2、硅Si、磷P、硫S、氯气Cl2、液溴Br2、碘I2、氦气He、氖气Ne、氩气Ar、
二、化合物
1.有机化合物
乙醇、甲烷、乙烷、乙烯、葡萄糖
2.无机化合物
三、氧化物
(1)按元素组成分为金属氧化物和非金属氧化物
1.金属氧化物
氧化钠Na2O、过氧化钠Na2O2、氧化钙CaO、氧化镁MgO、氧化铝Al2O3、氧化锌ZnO、氧化铁Fe2O3、氧化亚铁FeO、四氧化三铁Fe3O4、氧化铜CuO、氧化汞HgO、七氧化二锰Mn2O7
2.非金属氧化物
水H2O,过氧化氢H2O2、一氧化碳CO、二氧化碳CO2、一氧化氮NO、五氧化二氮N2O5、二氧化硅SiO2、五氧化二磷P2O5、二氧化硫SO2、三氧化硫SO3
(2)按照性质分为
碱性氧化物
酸性氧化物
不成盐氧化物
两性氧化物
过氧化物
1.碱性氧化物
大部分的金属氧化物为碱性氧化物,但有特例:过氧化钠Na2O2为过氧化物、氧化铝Al2O3为两性氧化物、七氧化二锰Mn2O7为酸性氧化物、四氧化三铁Fe3O4、
碱性氧化物有:氧化钠Na2O、氧化钙CaO、氧化镁MgO、氧化锌ZnO、氧化铁Fe2O3、氧化亚铁FeO、氧化铜CuO、氧化汞HgO、
碱性氧化物一定为金属氧化物,金属氧化物不一定为碱性氧化物
2.酸性氧化物
大部分的非金属氧化物为,但有特例:水H2O,一氧化碳CO、一氧化氮NO不是酸性氧化物,七氧化二锰Mn2O7虽然为金属氧化物但属于酸性氧化物、
非金属氧化物不一定为酸性氧化物
3.不成盐氧化物:一氧化碳CO、一氧化氮NO
4.两性氧化物:氧化铝Al2O3
5.过氧化物:过氧化氢H2O2、过氧化钠Na2O2
四、酸
中学常见的酸:
盐酸HCl、硫酸H2SO4、硝酸HNO3、碳酸H2CO3、磷酸H3PO4、次氯酸HClO、氯酸HClO3、高氯酸HClO4、亚硫酸H2SO3、硅酸H2SiO3、氢硫酸H2S、氢碘酸HI、氢溴酸HBr、氢氟酸HF、乙酸CH3COOH
(1)依据组成分为含氧酸和无氧酸
1.含氧酸
硫酸H2SO4、硝酸HNO3、碳酸H2CO3、磷酸H3PO4、次氯酸HClO、氯酸HClO3、高氯酸HClO4、亚硫酸H
2SO3、硅酸H2SiO3、乙酸CH3COOH
2.无氧酸
盐酸HCl、氢硫酸H2S、氢碘酸HI、氢溴酸HBr、氢氟酸HF
(2)依据一个分子能电离出氢离子的数目分为
一元酸:盐酸HCl、氢碘酸HI、氢溴酸HBr、氢氟酸HF、硝酸HNO3、次氯酸HClO、氯酸HClO3、高氯酸HClO4、乙酸CH3COOH
二元酸:硫酸H2SO4、碳酸H2CO3、亚硫酸H2SO3、硅酸H2SiO3、氢硫酸H2S、
多元酸:磷酸H3PO4
(3)依据酸性的强弱分为
强酸:盐酸HCl、硫酸H2SO4、硝酸HNO3、高氯酸HClO4、氢碘酸HI、氢溴酸HBr、
弱酸:碳酸H2CO3、磷酸H3PO4、次氯酸HClO、亚硫酸H2SO3、硅酸H2SiO3、氢硫酸H2S、
氢氟酸HF、乙酸CH3COOH
(4)依据氧化性分为
强氧化性酸:浓硫酸H2SO4、硝酸HNO3、次氯酸HClO、
非氧化性酸:盐酸HCl、稀硫酸H2SO4、氢碘酸HI、氢溴酸HBr、碳酸H2CO3、磷酸H3PO4、
(5)依据挥发性分
难挥发性酸:硫酸H2SO4、磷酸H3PO4、
易挥发性酸:盐酸HCl、硝酸HNO3、
五、碱
中学常见的碱:
氢氧化钾KOH、氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钡Ba(OH)2、一水合氨NH3·H2O、氢氧化铜Cu(OH)2、氢氧化铁Fe(OH)3、氢氧化亚铁Fe(OH)2、氢氧化镁Mg(OH)2、氢氧化铝Al2(OH)3
(1)依据可溶性分为
可溶性碱:氢氧化钾KOH、氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钡Ba(OH)2、一水合氨NH3·H2O、
难容性碱:氢氧化铜Cu(OH)2、氢氧化铁Fe(OH)3、氢氧化亚铁Fe(OH)2、氢氧化镁Mg(OH)2、氢氧化铝Al2(OH)3(2)依据强弱分为
强碱:氢氧化钾KOH、氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钡Ba(OH)2、
弱碱:一水合氨NH3·H2O、氢氧化铜Cu(OH)2、氢氧化铁Fe(OH)3、氢氧化亚铁Fe(OH)2、氢氧化镁Mg(OH)2、氢氧化铝Al2(OH)3
六、盐
正盐:氯化钠NaCl、氯化钾KCl、碳酸钠Na2CO3、硝酸银AgNO3、碳酸钙CaCO3、硫酸钡BaSO4等
酸式盐:碳酸氢钠NaHCO3、硫酸氢钠NaHSO4、亚硫酸氢钠NaHSO3
碱式盐:碱式碳酸铜Cu2(OH)2CO3
复盐:十二水合硫酸铝钾KAl(SO4)2·12H2O
物质的性质
碱性氧化物:与酸反应生成盐和水 CaO + 2HCl = CaCl2 + H2O
酸性氧化物:与碱反应生产盐和水 CO2 + 2NaOH = Na2CO3 + H2O
酸的通性:
(1)与酸碱指示剂作用,如石蕊遇酸变红
(2)与活泼金属反应生成氢气和盐 Zn + H2SO4 = H2↑+ ZnSO4
(3)与碱性氧化物反应生成盐和水CaO + 2HCl = CaCl2 + H2O
(4)与碱反应生成盐和水 NaOH + HCl = NaCl + H2O
(5)与某些盐反应生成新酸和新盐 2HCl + CaCO3 = CaCl2 + H2O + CO2↑
碱的通性
(1)与酸碱指示剂作用:能使紫色石蕊溶液变为蓝色,无色酚酞溶液变为红色
(2)与酸性氧化物反应生成盐和水CO2 + 2NaOH = Na2CO3 + H2O
(3)与酸反应生成盐和水 NaOH + HCl = NaCl + H2O
(4)与盐反应生成新碱和新盐 MgCl2 + 2NaOH = Mg(OH)2↓+ 2NaCl
△
(5)不溶性碱受热分解为氧化物和水 Mg(OH)2 == MgO + H2O
(注:文档可能无法思考全面,请浏览后下载,供参考。
可复制、编制,期待你的好评与关注!)。
