高一化学方程计算专题
化学方程式计算专题
化学方程式计算(一)——常见题型1、计算步骤:(一设 二写 三排 四列 五解 六答)2、计算要领:①步骤要完整 ②格式要规 ③得数要准确3、计算关键:①准确书写化学方程式 ②化学方程式要配平 ③准确计算相对分子质量④代入计算的必须是纯物质质量4、常见题型:①文字叙述题、②表格题、③图像题24、专题练习C-12 H-1 O-16 N-14 S-32 Cl-35.5 K-39 Mn-55 Ca-40 Zn-65 Fe-56 Cu-64 1.利用右图装置能制取氢气并测定所收集气体的体积。
聪聪同学在锥形瓶中装入0.65g 锌粒,往长颈漏斗中加入100g 稀硫酸,两者恰好完全反应。
(1)求生成氢气的质量。
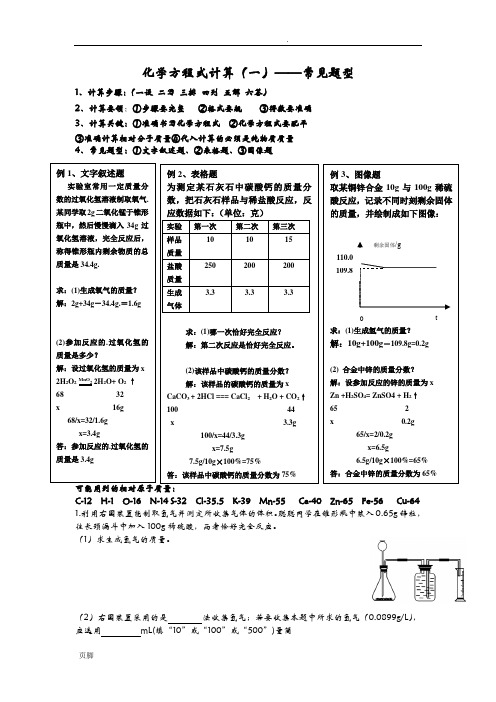
(2)右图装置采用的是 法收集氢气;若要收集本题中所求的氢气(0.0899g/L ),应选用 mL(填“10”或“100”或“500”)量筒 例1、文字叙述题 实验室常用一定质量分数的过氧化氢溶液制取氧气.某同学取2g 二氧化锰于锥形瓶中,然后慢慢滴入34g 过氧化氢溶液,完全反应后,称得锥形瓶内剩余物质的总质量是34.4g.求:(1)生成氧气的质量? 解:2g+34g-34.4g.=1.6g(2)参加反应的.过氧化氢的质量是多少?解:设过氧化氢的质量为x2H 2O 2MnO 2 2H 2O+ O 2 ↑ 6832x 16g68/x=32/1.6gx=3.4g答:参加反应的.过氧化氢的质量是3.4g例2、表格题为测定某石灰石中碳酸钙的质量分数,把石灰石样品与稀盐酸反应,反应数据如下:(单位:克)实验 第一次第二次 第三次样品 质量 101015盐酸 质量 250200200生成 气体3.33.33.3求:(1)哪一次恰好完全反应? 解:第二次反应是恰好完全反应。
(2)该样品中碳酸钙的质量分数? 解:该样品的碳酸钙的质量为x CaCO 3 + 2HCl === CaCl 2 + H 2O + CO 2↑ 100 44 x 3.3g100/x=44/3.3gx=7.5g7.5g/10g ×100%=75%答:该样品中碳酸钙的质量分数为75% 例3、图像题取某铜锌合金10g 与100g 稀硫酸反应,记录不同时刻剩余固体的质量,并绘制成如下图像:求:(1)生成氢气的质量?解:10g+100g -109.8g=0.2g(2) 合金中锌的质量分数? 解:设参加反应的锌的质量为x Zn +H 2SO 4= ZnSO4 + H 2↑ 65 2 x 0.2g65/x=2/0.2g x=6.5g6.5g/10g ×100%=65%答:合金中锌的质量分数为65% 剩余固体/gt109.8 0110.02、某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成。
高一化学计算专题--教师版

各类化学计算专题上节课复习:1. 在一定体积的密闭容器中放入3升气体R 和5升气体Q ,在一定条件下发生反应:2R (气)+5Q (气)4X (气)+nY (气)。
反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n 值是 A 2B 3C 4D 52.(15分)t ℃时,将2molSO 2和1molO 2通入体积为2L 的恒温恒容密闭容器中,发生如下反应:2SO 2(g )+O 2(g ) 2SO 3(g ),△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O 2还乘余0.8mol ,请填写下列空白:(1)从反应开始到达化学平衡,生成SO 3的平均反应速率为 ;平衡时SO 2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) 。
A .溶器内压强不再发生变化B .SO 2的体积分数不再发生变化C .容器内气体原子总数不再发生变化D .相同时间内消耗2nmolSO 2的同时消耗nmolO 2E .相同时间内消耗2nmolSO 2的同时生成nmolO 2(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO 2转化率的是 。
A .向容器中通入少量O 2B .向容器中通入少量SO 2C .使用催化剂D .降低温度E .向容器中通入少量氦气(已知:氦气和SO 2、O 2、SO 3都不发生反应)(4)t 2℃时,若将物质的量之比n (SO )2:n (O 2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。
SO 2的转化率为 。
答案:(1)0.1mol/L·min (3分) 20%(3分)(2)ABE (3分)(3)AD (3分) (4)80%(3分)各类计算方法讲解守恒法1.守恒法——已知变化前后某一特定不变的量,建立等式计算的方法 (1)质量守恒例1 在臭氧发生器中装入100mLO 2,经反应3O 2→2 O 3,最后气体体积变为95mL (体积均为标准状况下测定),则反应后混合气体的密度为( )A.1.43g ·L -1B.1.50 g ·L -1C.2.14g ·L -1D.无法判断 聚焦解题策略:根据质量守恒定律反应前后容器中气体的质量不变,等于反应前100mL O 2的质量。
高一化学 计算题 二元一次方程解法

高一化学计算题二元一次方程解法
我们要解决一个化学问题,涉及到二元一次方程的解法。
首先,我们需要理解题目中的化学方程式,并使用数学模型帮助我们解决这个问题。
假设反应物A的浓度为 a mol/L,反应物B的浓度为 b mol/L。
反应方程式为:A + 2B → 3C
根据化学反应的平衡原理,我们可以建立以下方程:
1. 初始时,A的浓度是 a mol/L,B的浓度是 b mol/L。
2. 反应后,A的浓度变为 (a - x) mol/L,B的浓度变为 (b - 2x) mol/L,C 的浓度变为 3x mol/L。
根据质量守恒定律,反应前后各物质的浓度之和不变,所以:
a +
b = (a - x) + (b - 2x) + 3x
现在我们要来解这个方程,找出 x 的值。
计算结果为: [{x: (a + b)/4}]
所以,反应后C的浓度为:3x = (3/4)(a + b) mol/L。
高中化学必修一有关化学方程式计算例题及变式练习

高中化学必修一有关化学方程式计算例题及变式练习The document was prepared on January 2, 2021有关化学方程式的计算其中包括守恒法.所谓“守恒”就是以化学反应过程中存在的某些守恒关系如质量守恒、元素守恒、得失电子守恒,电荷守恒等.运用守恒法解题可避免在纷纭复杂得解题背景中寻找关系式,提高解题的准确度. 在进行多步反应的计算时,一般的解题步骤为: 1写出各步反应的化学方程式;2根据化学方程式找出作为中介的物质,并确定已知物质、中介物质、所求物质之间的量质量或物质的量或相同条件下气体的体积的关系; 3确定已知物质和所求物质之间的量的关系;4根据所确定的已知物质和所求物质之间的量的关系和已知条件进行计算.1.关系式法实际化工生产中以及化学工作者进行科学研究时,往往涉及到多步反应:从原料到产品可能要经过若干步反应;测定某一物质的含量可能要经过若干步中间过程.对于多步反应体系,依据若干化学反应方程式,找出起始物质与最终物质的量的关系,并据此列比例式进行计算求解的方法,称为“关系式”法. 关系式法常常应用于多步进行的连续反应..........在多步反应中,第一步反应的产物,即是下一步反应的反应物.根据化学方程式,每一步反应的反应物和生成物之间有一定的量的关系,即物质的量之比是一定的.所以,可以利用某中间物质作为“中介”,找出已知物质和所求物质之间的量的关系.它是化学计算中的基本解题方法之一,利用关系式法可以将多步计算转化为一步计算,免去逐步计算中的麻烦,简化解题步骤,减少运算量,且计算结果不易出错,准确率高.例题1用CO 还原10.0 g 某磁铁矿石样品所含的杂质不参加反应,生成的CO 2再跟过量的石灰水反应,得到12.8 g 沉淀.求磁铁矿石中Fe 3O 4的质量分数.解析:本题发生的化学反应有: Fe 3O 4+4CO3Fe+4CO 2CO 2+CaOH 2=CaCO 3↓+H 2O可以用CO 2作为“中介”得出下列关系:Fe 3O 4——4 CO 2——4 CaCO 3,即:Fe 3O 4——4 CaCO 3.然后利用两者之间的质量关系或物质的量关系进行计算. Fe 3O 4+4CO3Fe+4CO 2CO 2+CaOH 2=CaCO 3↓+H 2O 根据化学方程式,找出关系式: Fe 3O 4 —— 4 CaCO 3 232400mFe 3O 4 12.8 g mFe 3O 4 = 4008.12232g⨯= 7.42 gωFe 3O 4 =%1000.1042.7⨯gg= % 答:该磁铁矿石中Fe 3O 4的质量分数为%.例题2 mol 镁与足量稀硫酸反应,得到的氢气与多少克氯酸钾完全分解制得的氧气恰好完全反应解析:此题涉及三个化学方程式 Mg + H 2SO 4 = MgSO 4 + H 2↑ 2H 2 + O 22H 2O2KClO3 2KCl + 3O2↑由以上方程式可得下列关系式Mg ── H2── 1/2 O2──1/3 KClO3即3Mg ── KClO33 mol 122.5 gmol m KClO3m KClO3=mol3mol0.6g5.122= g例2将纯铁丝5.21g溶于过量稀盐酸中,在加热条件下,用去氧化溶液中Fe2+,待反应后剩余的Fe2+离子尚需LKMnO4溶液才能完全氧化,则KNO3被还原后的产物为A、N2B、NOC、NO2D、NH4NO3解析根据氧化还原反应中得失电子的总数相等,Fe2+变为Fe3+失去电子的总数等于NO3-和MnO4-得电子的总数设n为KNO3的还原产物中N的化合价,则5.21g÷56g/moL×3-2=0.012L×L×7-2+2.53g÷101g/mol×5-n解得 n=3 故KNO3的还原产物为NO. 答案为B典例变式11. 1 根据下列反应找出FeS2与KMnO4的关系式4FeS2+11O2 2Fe2O3 + 8SO22KMnO4+5SO2+2H2O = K2SO4+2MnSO4+2H2SO42 根据下列反应找出C和NH3的关系C+H2Og高温CO+H2CO+H2Og催化剂△CO2+H2N2+3H2催化剂高温高压2NH32. 2.7 g某铵态氮肥不含NO-3与过量氢氧化钙混合后加热,将放出的氨气通入25 mL 2 mol/L的H2SO4溶液中,氨被充分吸收后,剩余的H2SO4恰好跟20 mL 3 mol/L的NaOH溶液反应.求该铵态氮肥中N的质量分数.例1、有一在空气中放置了一段时间的KOH固体,经分析测知其含水%、含% 取1g该样品投入25mL2mol/L的盐酸中后,多余的盐酸用/LKOH溶液恰好完全中和,蒸发中和后的溶液可得到固体的质量为多少解析本题化学反应复杂,数字处理烦琐,所发生的化学反应:KOH+HCl=KCl+H2OK 2CO3+2HCl=2KCl+H2O+CO2↑若根据反应通过所给出的量计算非常繁琐.但若根据Cl—守恒,便可以看出:蒸发溶液所得KCl固体中的Cl—,全部来自盐酸中的Cl-,即:生成的nKCl=nHCl=0.025L×2mol/LmKCl=0.025L×2mol/L×74.5g/mol=3.725g2.差值法差值法依据:化学反应前后的某些变化找出所谓的理论差量固体质量差、溶液质量差、气体体积差、气体物质的量之差等,与反应或生成物的变化量成正比而建立的一种解题方法.差值法解题方法:此法将“差值”看作化学方程式右端的一项,将已知差量实际差量与化学方程式中的对应差量理论差量列成比例,其他解题步骤与按化学方程式列比例或解题完全一样.例1、将质量为m1的NaHCO3固体加热分解一段时间后,测得剩余固体的质量为m2.1未分解的NaHCO3的质量为___________.2生成的Na2CO3的质量为__________.3当剩余的固体的质量为___________,可以断定NaHCO3已完全分解.解析固体加热减轻的质量为m 1-m 22NaHCO 3=Na 2CO 3+H 2O+CO 2↑ 质量减量 2×84 106 18+44m 1-m 2 未分解的NaHCO 3的质量为31538412m m - 生成的Na 2CO 3的质量为31)(5321m m -NaHCO 3完全分解则剩余固体质量为53841m变式训练加热10.0g 碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数.例2、向50gFeCl 3溶液中放入一小块Na,待反应完全后,过滤,得到仍有棕黄色的溶液45.9g,则投入的Na 的质量为A 、4.6gB 、4.1gC 、6.9gD 、9.2g 解析 Na 投入到FeCl 3溶液发生如下反应 6Na +2FeCl 3+6H 2O=6NaCl +2FeOH 3↓+3H 2↑若2mol FeCl 3与6molH 2O 反应,则生成6molNaCl,溶液质量减少82g,此时参加反应的Na 为6mol ;现溶液质量减少4.1g,则参加反应Na 应为,质量应为6.9g. 答案为C例3、在空气中将无水的硝酸铜和铜粉的混合物灼烧后即生成CuO,所得物质的质量与原混合物的质量相等,求原混和物中硝酸铜的百分含量.解析因为灼烧前后混和物的质量相等,所以发生反应时CuNO 32分解减少的质量与Cu 被氧化增加的质量相等.设原混和物的质量为1g,其中含CuNO 32为Xg,Cu 粉为1-Xg.2CuNO 322CuO +4NO 2↑+O 2↑ 质量减量2×188g 216gX克2Cu+O22CuO 质量增量2×64g 32g例1:将铜片放入足量AgNO3溶液中,一段时间后,取出铜片洗净烘干后,称得质量为,计算有多少克铜被氧化.解析:铜与AgNO3发生反应:Cu+2AgNO3=CuNO32+2Ag,从反应方程式可以看出,有64g铜被氧化,会生成216g金属银,固体质量增加152g,它与题中给出固体质量差量构成对应比例关系,可用差量法求解.解:Cu+2AgNO3=CuNO32+2Ag 固体增加质量△m64g 216g 216g-64g=152gmCu =mCu=②液体质量差量法例2:天平两端各放一只质量相等的烧杯,内盛等体积等浓度的足量稀盐酸,将物质的量都为a mol的铝和镁分别放入左盘和右盘的烧杯中,反应完毕后,在哪一盘的烧杯中加入多少克同种金属才能平衡.解析:开始反应前和反应后均要求天平平衡,实质上是要求最终增加溶液的质量相等,即可采用溶液质量增加这一实质即可求解.解:右盘:Mg+2HCl=MgCl2+H2↑ 溶液质量增加△m1 mol 2g 24g-2g=22ga mol 22a左盘:2Al+6HCl=2AlCl3+3H2↑ 溶液质量增加△m2 mol 6g 54g-6g=48ga mol 24a2、气体物质的量差量法例3:CS2是实验室常用有机溶剂,取一定量CS2在氧气中充分燃烧,生成SO2和CO2,若 mol CS2在1 mol O2中完全燃烧反应生成气体混合物在标准状况下的体积是解析:由于CS2+3O2=CO2+2SO2,从量上来分析CS2全部反应,O2有剩余,故最后气体为O2,CO2和SO2的混合气,从状态来分析,只有CS2是液体,其余全为气体,再从反应方程式各物质的系数分析,反应前后气体的物质的量不变,△n=O,故最后混合气体的物质的量仍为1 mol,在标况下其体积为,故正确答案为D.3.分析讨论法分析和计算结合的题,是一种十分流行的习题类型.这类题中的条件隐蔽得很巧妙,从题中给出的条件解题,往往觉得缺乏一些直接条件或似乎无解,只有通过反复推敲、周密分析,找出暗藏在字里行间的间接条件,才有获得的希望.例1、通常情况下,CO 和O 2混合气体mL, 用电火花引燃,体积变为 nL 前后条件相同.1试确定混合气体中CO 和O 2的体积用VCO,VO 2表示.2当反应的气体密度在相同条件下为H 2密度的15倍时,试确定气体的成分.解析12CO+O 2=2CO 2体积减少 单位2 1 2 1 x y m-n ① 若CO 过量,即)()(2O V CO V 2应有:VO 2=m-n 升, VCO=m-m-n=n 升 ②若O 2过量,即)()(2O V CO V <2应有: VCO=2m-n 升 VO 2=m-2m-n=2n-m 升 ⑵平均摩尔质量M=dMH 2=30依平均值规律:M min ≤M ≤M max ,而MO 2=32, MCO=28, MCO 2=44故混合气体只能是CO 和CO 2由于有CO 2,而且CO 和O 2只有一种或全无. 练习:用足量CO 还原14.4g 某铁的氧化物,将生成的CO 2全部通入L 的石灰水中得到20g 白色沉淀,通过计算求出铁的氧化物的化学式. 成才之路133页第22题1、有一表面被部分氧化的金属钠,质量为10.8g,投入到100g 水中完全反应后,收集到0.2g 氢气,试计算:1被氧化的金属钠的质量是多少克 2反应后所得溶质的质量分数3、将Na 2CO 3和NaHCO 3混合物19g,充分加热后,收集到CO 2有1.12L 标准状况,冷却后将剩余固体溶于300ml 水中,求: 1原混合物中Na 2CO 3的质量.2 配制的溶液的物质的量浓度4.将一定质量的镁、铝合金,投入100 mL 一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加5 mol/L NaOH 溶液,生成的沉淀质量与加入NaOH 溶液体积如图所示,由图中数据分析计算:①原合金中镁的质量为______________g②铝的质量为___________________g③盐酸的物质的量浓度为_____________mol/L5、把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入NaOHLmol11-⋅溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示.求:1镁铝合金的质量组成.2盐酸的物质的量浓度.3B点沉淀的质量.6、现有MgO和AL2O3的固体混合物,向其中加入100 mL 1 moL·L-1稀H 2SO4,充分反应后向溶液中逐滴加入 1 moL·L-1 的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:已知MgO为碱性氧化物⑴NaOH溶液加至220 ml 时溶液中含有的金属元素的离子有 .⑵混合物中,MgO与AL2O3的物质的量之比为.⑶根据以上所给数据求出 x = .7、将5.6g 铁粉放入100 mL CuSO4溶液中,充分反应后,再向溶液中加入足量的稀硫酸,又产生1.12L气体标准状况下.试计算:1最后所得溶液中FeSO4的物质的量;2原CuSO4溶液的物质的量浓度.8.在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L标准状况.已知MnO2+4HCl浓MnCl2+Cl2↑+2H2O 1需要消耗MnO2多少克2被氧化的HCl的物质的量是多少3若反应后溶液的体积不变,则反应后溶液中Cl-物质的量浓度是多少9.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物.进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于 L mol·L-1盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出 L标况气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色.请填空:1①中产物的单质B是2②中所发生的各反应的化学方程式是.3③中所发生的各反应的离子方程式是.4若溶液D的体积仍视为 L,则该溶液中c Mg2+为 ,c Fe2+为 .。
高中解方程50题(打印版)

高中解方程50题(打印版)1.一元一次方程1.求解方程:2x + 3 = 9解答:移项得2x = 9 - 3,再计算得x = 6/2 = 32.求解方程:3(x - 1) + 2 = 5x + 7解答:先进行分配得3x - 3 + 2 = 5x + 7,合并同类项得3x - 1 = 5x + 7,再移项得3x - 5x = 7 + 1,计算得-2x = 8,最后得x = -4。
2.一元二次方程1.求解方程:x^2 - 5x + 6 = 0解答:通过因式分解或公式法得到(x - 2)(x - 3) = 0,因此x - 2 = 0 或 x - 3 = 0,解得x = 2 或 x = 32.求解方程:2x^2 + 3x - 2 = 0解答:通过公式法计算得x = (-3 ± √(3^2 - 4(2)(-2))) / (2(2))。
3.一元三次方程1.求解方程:x^3 + 2x^2 + 3x + 4 = 0解答:通过试根法或其他方法,解得x = -12.求解方程:x^3 - 3x^2 - 4x = 0解答:通过因式分解得x(x - 4)(x + 1) = 0,因此x = 0.4.或 -1。
4.二元一次方程1.求解方程组:{方程组1}解答:通过消元法或代入法解得{x =。
y =。
}2.求解方程组:{方程组2}解答:通过消元法或代入法解得{x =。
y =。
} 。
5.二元二次方程1.求解方程组:{方程组3}解答:通过消元法或代入法解得{x =。
y =。
}2.求解方程组:{方程组4}解答:通过消元法或代入法解得{x =。
y =。
}。
尽管本文档仅提供了部分题目解答,但提供了不同类型的方程解法,希望对您的研究有所帮助。
注意:本文档中的解答仅供参考,请自行核对答案。
高一化学方程式计算专题

计算专题【方法讲解】物质是由原子、分子、离子等粒子构成的,物质之间的化学反应是这些粒子按一定的数目关系进行的。
化学方程式中的化学计量数(方程式系数)可以明确地表示出化学反应中粒子之间的数目关系。
即可理解为:方程式系数表示参加反应粒子个数例:2 Na + 2H2O == 2 NaOH + H2↑化学计量数之比: 2 : 2 : 2 : 1扩大6.02×1023倍:2×6.02×1023 :2×6.02×1023 :2×6.02×1023 :6.02×1023物质的量之比: 2 mol : 2 mol : 2 mol : 1 mol化学计量数之比== 物质的量之比【例题】1、把6.5g Zn放入足量盐酸中,锌完全反应。
计算:(1) 6.5g Zn的物质的量;(2) 参加反应的HCl的物质的量;(3) 生成H2的体积(标准状况)。
2、CO是大气污染物之一。
用氯化钯(PdCl2)可以测定微量CO的存在,该反应的化学方程式为PdCl2+CO+H2O Pd↓+2HCl+CO2。
(已知Pd的相对原子质量为106)(1)若反应后得到Pd的质量为1.06 g,则测得CO的质量为多少克?多少摩尔?(2)若存在标况下4.48 L的CO,则反应后会得到Pb的物质的量?质量?3、(中考09)钛(Ti)和钛合金被认为是21世纪的重要金属材料。
钛可通过如下反应制得:TiCl4+2Mg Ti+2MgCl2,(已知Ti的相对原子质量为48)(1)若要制得24 g钛,需要镁的质量是多少克?需要镁的物质的量?(2)若要制得2 mol钛,需要镁的质量是多少克?需要镁的物质的量?(3)若反应生成了MgCl2 3 mol,则制得钛多少摩尔?例1(1)解:设测得CO 的质量为x 。
PdCl 2+CO +H 2O Pd ↓+2HCl +CO 228 106x 1.06 g g 06.110628=x g 28.0106g 06.128=⨯=x 答:测得CO 的质量为0.28 g 。
高中化学方程式配平100题

高中化学方程式配平100题在高中化学学习过程中,化学方程式的配平是一个基础且重要的环节。
正确配平方程式可以帮助我们理解化学反应的过程,掌握化学方程式的规律性。
下面就为大家提供100道高中化学方程式配平的练习题,希望对大家的学习有所帮助。
1. H₂ + O₂ → H₂O2. Na + Cl₂ → NaCl3. Fe + O₂ → Fe₂O₃4. Al + O₂ → Al₂O₃5. Ca + H₂O → Ca(OH)₂ + H₂6. Mg + HCl → MgCl₂ + H₂7. H₂SO₄+ NaOH → Na₂SO₄ + H₂O8. HCl + NaOH → NaCl + H₂O9. S + O₂ → SO₂10. N₂ + H₂ → NH₃11. CO + O₂ → CO₂12. C₃H₈ + O₂ → CO₂ + H₂O13. CH₄ + O₂ → CO₂ + H₂O14. NH₄NO₃ → N₂O + O₂ + H₂O15. FeCl₃ + NaOH → Fe(OH)₃ + NaCl16. Pb(NO₃)₂ + KI → PbI₂ + KNO₃17. AgNO₃+ NaCl → AgCl + NaNO₃18. CuCl₂ + NaOH → Cu(OH)₂ + NaCl19. H₂O₂ → H₂O + O₂20. Fe(NO₃)₃ + NaOH → Fe(OH)₃ + NaNO₃21. Na₂CO₃ + HCl → NaCl + H₂O + CO₂22. H₂SO₄ + Na₂CO₃ → Na₂SO₄ + H₂O + CO₂23. Pb(NO₃)₂ + Na₂SO₄ → PbSO₄ + NaNO₃24. FeCl₃ + NaOH → Fe(OH)₃ + NaCl25. Zn + H₂SO₄ → ZnSO₄ + H₂26. Al + Fe₂O₃ → Al₂O₃ + Fe27. H₂ + N₂ → NH₃28. K + H₂O → KOH + H₂29. BaCl₂ + Na₂SO₄ → BaSO₄ + NaCl30. Mg + Br₂ → MgBr₂31. Fe + CuSO₄ → FeSO₄ + Cu32. Ca(OH)₂ + H₃PO₄ → Ca₃(PO₄)₂ + H₂O33. H₂ + F₂ → HF34. KOH + H₂SO₄→ K₂SO₄ + H₂O35. Al + HCl → AlCl₃ + H₂36. HNO₃ + NaOH → NaNO₃ + H₂O37. Pb(NO₃)₂ + KCl → PbCl₂ + KNO₃38. Zn + HCl → ZnCl₂ + H₂39. H₂O + C → CO + H₂40. CH₄ + Cl₂ → CCl₄ + HCl41. H₃PO₄ + NaOH → Na₃PO₄ + H₂O42. H₂O₂ + HCl → H₂O + Cl₂43. Al + FeCl₃ → AlCl₃ + Fe44. Na + H₂O → NaOH + H₂45. H₂O₂ + KI → KOH + I₂ + H₂O46. Ca + O₂ → CaO47. Na₂CO₃ + HCl → NaCl + H₂O + CO₂48. Na + Br₂ → NaBr49. Ca + HCl → CaCl₂ + H₂50. H₂ + Cl₂ → HCl51. H₂O₂ + KMnO₄ → K₂MnO₄ + O₂ + H₂O52. Mg + Cl₂ → MgCl₂53. C₄H₁₀ + O₂ → CO₂ + H₂O54. NH₄Cl + KOH → NH₃ + KCl + H₂O55. FeSO₄ + NaOH → Fe(OH)₂ + Na₂SO₄56. NH₄NO₃ → N₂O + H₂O57. Al + H₂SO₄ → Al₂(SO₄)₃ + H₂58. Fe + HCl → FeCl₃ + H₂59. O₂ + C₆H₁₂O₆ → CO₂ + H₂O60. NaCl + F₂ → NaF + Cl₂61. Ba + H₂O → Ba(OH)₂ + H₂62. HCl + Ca(OH)₂ → CaCl₂ + H₂O63. Mg + H₂O → MgO + H₂64. Na + Cl₂ → NaCl65. FeCl₃ + NaOH → Fe(OH)₃ + NaCl66. Na₂CO₃ + H₃PO₄ → Na₃PO₄ + H₂CO₃67. H₂O + Na → NaOH + H₂68. Zn + HNO₃ → Zn(NO₃)₂ + N₂O + H₂O69. CuO + H₂ → Cu + H₂O70. Mg + HCl → MgCl₂ + H₂71. Cu + HNO₃ → Cu(NO₃)₂ + NO₂ + H₂O72. NaCl + H₂O₂ → NaClO + HCl + H₂O73. Fe + H₂SO₄ → FeSO₄ + H₂74. H₂ + O₂ → H₂O75. Na + Cl₂ → NaCl76. Fe + O₂ → Fe₂O₃77. Al + O₂ → Al₂O₃78. Ca + H₂O → Ca(OH)₂ + H₂79. Mg + HCl → MgCl₂ + H₂80. H₂SO₄ + NaOH → Na₂SO₄ + H₂O81. HCl + NaOH → NaCl + H₂O82. S + O₂ → SO₂83. N₂ + H₂ → NH₃84. CO + O₂ → CO₂85. C₃H₈ + O₂ → CO₂ + H₂O86. CH₄ + O₂ → CO₂ + H₂O87. NH₄NO₃ → N₂O + O₂ + H₂O88. FeCl₃ + NaOH → Fe(OH)₃ + NaCl89. Pb(NO₃)₂ + KI → PbI₂ + KNO₃90. AgNO₃ + NaCl → AgCl + NaNO₃91. CuCl₂ + NaOH → Cu(OH)₂ + NaCl92. H₂O₂ → H₂O + O₂93. Fe(NO₃)₃ + NaOH → Fe(OH)₃ + NaNO₃94. Na₂CO₃ + HCl → NaCl + H₂O + CO₂95. H₂SO₄ + Na₂CO₃ → Na₂SO₄ + H₂O + CO₂96. Pb(NO₃)₂ + Na₂SO₄ → PbSO₄ + NaNO₃97. FeCl₃ + NaOH → Fe(OH)₃ + NaCl98. Zn + H₂SO₄ → ZnSO₄ + H₂99. Al + Fe₂O₃ → Al₂O₃ + Fe100. H₂ + N₂ → NH₃希望通过这100道方程式配平练习题,大家可以熟练掌握化学方程式配平的方法和技巧,提升自己的化学学习水平。
解方程练习题100道高中

解方程练习题100道高中题目1:解方程:3x + 5 = 14解题过程:首先,将方程式变形为3x = 14 - 5计算得3x = 9然后,将方程式化简为x = 9 / 3计算得x = 3所以,方程的解为x = 3题目2:解方程:4(2x + 3) = 32解题过程:首先,将方程式展开为8x + 12 = 32然后,将方程式变形为8x = 32 - 12计算得8x = 20接下来,将方程式化简为x = 20 / 8计算得x = 2.5因此,方程的解为x = 2.5题目3:解方程:2x - 3 = 5x + 1解题过程:首先,将方程式变形为2x - 5x = 1 + 3计算得-3x = 4然后,将方程式化简为x = 4 / -3计算得x = -4/3所以,方程的解为x = -4/3题目4:解方程:3(x - 1) + 4x = 17解题过程:首先,将方程式展开为3x - 3 + 4x = 17然后,将方程式变形为7x - 3 = 17接下来,将方程式化简为7x = 17 + 3计算得7x = 20最后,将方程式化简为x = 20 / 7因此,方程的解为x ≈ 2.857题目5:解方程:5(2 - 3x) - 4(5x - 1) = -16解题过程:首先,将方程式展开为10 - 15x - 20x + 4 = -16然后,将方程式化简为-35x - 6 = -16接下来,将方程式变形为-35x = -16 + 6计算得-35x = -10最后,将方程式化简为x = -10 / -35计算得x ≈ 0.286因此,方程的解为x ≈ 0.286题目6:解方程:√(3x + 2) = 5解题过程:首先,将方程两边进行平方操作,得到3x + 2 = 25然后,将方程式变形为3x = 25 - 2接下来,将方程式化简为x = 23 / 3计算得x ≈ 7.667因此,方程的解为x ≈ 7.667题目7:解方程:2(3x - 1) + 5x = 4(x + 2) - 3解题过程:首先,将方程式展开为6x - 2 + 5x = 4x + 8 - 3然后,将方程式化简为11x - 2 = 4x + 5接下来,将方程式变形为11x - 4x = 5 + 2计算得7x = 7最后,将方程式化简为x = 7 / 7计算得x = 1因此,方程的解为x = 1题目8:解方程:2(4x - 3) = 3[2(x - 1) - 5]解题过程:首先,将方程式展开为8x - 6 = 6x - 9 - 15然后,将方程式变形为8x - 6 = 6x - 24接下来,将方程式化简为8x - 6x = -24 + 6计算得2x = -18最后,将方程式化简为x = -18 / 2计算得x = -9因此,方程的解为x = -9题目9:解方程:3/5x + 4 = 16解题过程:首先,将方程式变形为3/5x = 16 - 4计算得3/5x = 12然后,将方程式化简为x = 12 * 5 / 3计算得x = 20因此,方程的解为x = 20题目10:解方程:3(2x + 1) - 2(3x - 4) = 5x首先,将方程式展开为6x + 3 - 6x + 8 = 5x 然后,将方程式化简为11 = 5x接下来,将方程式变形为5x = 11最后,将方程式化简为x = 11 / 5计算得x ≈ 2.2因此,方程的解为x ≈ 2.2题目11:解方程:4x - (2x + 1) = 3(x - 2) + 2解题过程:首先,将方程式展开为4x - 2x - 1 = 3x - 6 + 2然后,将方程式化简为2x - 1 = 3x - 4接下来,将方程式变形为2x - 3x = -4 + 1计算得-x = -3最后,将方程式化简为x = (-3) / (-1)计算得x = 3因此,方程的解为x = 3解方程:8x - 5(x + 3) = 3(2x - 1) + 4x解题过程:首先,将方程式展开为8x - 5x - 15 = 6x - 3 + 4x 然后,将方程式化简为3x - 15 = 10x - 3接下来,将方程式变形为3x - 10x = -3 + 15计算得-7x = 12最后,将方程式化简为x = 12 / -7计算得x ≈ -1.71因此,方程的解为x ≈ -1.71题目13:解方程:5(2x - 1) - 3(4x + 5) = 7解题过程:首先,将方程式展开为10x - 5 - 12x - 15 = 7然后,将方程式化简为-2x - 20 = 7接下来,将方程式变形为-2x = 7 + 20计算得-2x = 27最后,将方程式化简为x = 27 / -2计算得x ≈ -13.5因此,方程的解为x ≈ -13.5题目14:解方程:2(3x - 1) + 4 = 3(2x + 5) - x解题过程:首先,将方程式展开为6x - 2 + 4 = 6x + 15 - x然后,将方程式化简为6x + 2 = 5x + 15接下来,将方程式变形为6x - 5x = 15 - 2计算得x = 13因此,方程的解为x = 13题目15:解方程:√(2x + 1) + 1 = 5解题过程:首先,将方程两边进行移项,得到√(2x + 1) = 5 - 1计算得√(2x + 1) = 4然后,将式子两边进行平方操作,得到2x + 1 = 16计算得2x = 15最后,将方程式化简为x = 15 / 2计算得x = 7.5因此,方程的解为x = 7.5题目16:解方程:3(4x - 2) = -15解题过程:首先,将方程式展开为12x - 6 = -15然后,将方程式化简为12x = -15 + 6计算得12x = -9接下来,将方程式化简为x = -9 / 12计算得x = -0.75因此,方程的解为x = -0.75题目17:解方程:4x + 3 = 2 - 3x解题过程:计算得7x = -1然后,将方程式化简为x = -1 / 7因此,方程的解为x = -1 / 7题目18:解方程:2(5x - 2) = 1 - 3(x + 4)解题过程:首先,将方程式展开为10x - 4 = 1 - 3x - 12然后,将方程式化简为10x + 3x = 1 - 12 + 4计算得13x = -7最后,将方程式化简为x = -7 / 13因此,方程的解为x = -7 / 13题目19:解方程:5(3x - 1) + 4 = 8x - 2解题过程:首先,将方程式展开为15x - 5 + 4 = 8x - 2然后,将方程式化简为15x - 1 = 8x - 2接下来,将方程式变形为15x - 8x = -2 + 1计算得7x = -1最后,将方程式化简为x = -1 / 7因此,方程的解为x = -1 / 7题目20:解方程:2x + 3 = 5(x - 1)解题过程:首先,将方程式展开为2x + 3 = 5x - 5然后,将方程式化简为2x - 5x = -5 - 3计算得-3x = -8最后,将方程式化简为x = -8 / -3计算得x ≈ 2.667因此,方程的解为x ≈ 2.667题目21:解方程:√(4x + 1) = 3解题过程:首先,将方程式两边进行平方操作,得到4x + 1 = 3^2计算得4x + 1 = 9然后,将方程式变形为4x = 9 - 1计算得4x = 8最后,将方程式化简为x = 8 / 4计算得x = 2因此,方程的解为x = 2题目22:解方程:4(3x - 2) = 5x + 6解题过程:首先,将方程式展开为12x - 8 = 5x + 6然后,将方程式化简为12x - 5x = 6 + 8计算得7x = 14最后,将方程式化简为x = 14 / 7计算得x = 2因此,方程的解为x = 2题目23:解方程:3(4 - 2x) = 2(x - 3) + 5解题过程:首先,将方程式展开为12 - 6x = 2x - 6 + 5然后,将方程式化简为12 - 6x = 2x - 1接下来,将方程式变形为12 - 2x = 2x - 1计算得-2x - 2x = -1 - 12计算得-4x = -13最后,将方程式化简为x = -13 / -4计算得x ≈ 3.25因此,方程的解为x ≈ 3.25题目24:解方程:√(5x + 2) = 6解题过程:首先,将方程式两边进行平方操作,得到5x + 2 = 6^2计算得5x + 2 = 36然后,将方程式变形为5x = 36 - 2计算得5x = 34最后,将方程式化简为x = 34 / 5因此,方程的解为x ≈ 6.8题目25:解方程:5 - 4(3x + 2) = 3(2x + 1) - 2解题过程:首先,将方程式展开为5 - 12x - 8 = 6x + 3 - 2然后,将方程式化简为-12x - 3 = 6x + 1接下来,将方程式变形为-12x - 6x = 1 + 3计算得-18x = 4最后,将方程式化简为x = 4 / -18计算得x ≈ -0.222因此,方程的解为x ≈ -0.222题目26:解方程:3(4x - 1) = 8 - 5x解题过程:首先,将方程式展开为12x - 3 = 8 - 5x然后,将方程式化简为12x + 5x = 8 + 3最后,将方程式化简为x = 11 / 17计算得x ≈ 0.647因此,方程的解为x ≈ 0.647题目27:解方程:2(5x - 1) - (4 - x) = 3x + 2解题过程:首先,将方程式展开为10x - 2 - 4 + x = 3x + 2然后,将方程式化简为11x - 6 = 3x + 2接下来,将方程式变形为11x - 3x = 2 + 6计算得8x = 8最后,将方程式化简为x = 8 / 8计算得x = 1因此,方程的解为x = 1题目28:解方程:3(2x + 1) - 4x = 5(x - 1) + 3解题过程:首先,将方程式展开为6x + 3 - 4x = 5x - 5 + 3然后,将方程式化简为2x +。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
计算专题【方法讲解】物质是由原子、分子、离子等粒子构成的,物质之间的化学反应是这些粒子按一定的数目关系进行的。
化学方程式中的化学计量数(方程式系数)可以明确地表示出化学反应中粒子之间的数目关系。
即可理解为:方程式系数表示参加反应粒子个数例:2 Na + 2H2O == 2 NaOH + H2↑化学计量数之比: 2 : 2 : 2 : 1扩大6.02×1023倍:2×6.02×1023 :2×6.02×1023 :2×6.02×1023 :6.02×1023物质的量之比: 2 mol : 2 mol : 2 mol : 1 mol化学计量数之比== 物质的量之比【例题】1、把6.5g Zn放入足量盐酸中,锌完全反应。
计算:(1) 6.5g Zn的物质的量;(2) 参加反应的HCl的物质的量;(3) 生成H2的体积(标准状况)。
2、CO是大气污染物之一。
用氯化钯(PdCl2)可以测定微量CO的存在,该反应的化学方程式为PdCl 2+CO+H2O Pd↓+2HCl+CO2。
(已知Pd的相对原子质量为106)(1)若反应后得到Pd的质量为1.06 g,则测得CO的质量为多少克?多少摩尔?(2)若存在标况下4.48 L的CO,则反应后会得到Pb的物质的量?质量?3、(中考09)钛(Ti)和钛合金被认为是21世纪的重要金属材料。
钛可通过如下反应制得:TiCl4+2Mg Ti+2MgCl2,(已知Ti的相对原子质量为48)(1)若要制得24 g钛,需要镁的质量是多少克?需要镁的物质的量?(2)若要制得2 mol钛,需要镁的质量是多少克?需要镁的物质的量?(3)若反应生成了MgCl2 3 mol,则制得钛多少摩尔?例1(1)解:设测得CO 的质量为x 。
PdCl 2+CO +H 2O Pd ↓+2HCl +CO 228 106x 1.06 g g 06.110628=x g 28.0106g 06.128=⨯=x 答:测得CO 的质量为0.28 g 。
(2)解:设测得CO 的物质的量为x 。
① 方程式: PdCl 2+CO +H 2O Pd ↓+2HCl +CO 2② 化学计量数: 1 1③ 物质的量: x 0.01 mol已知:输入物质的量的准备:1.06 g / 106 g-mol -1 = 0.01 mol未知:输出物质的量的计算:1 / x = 1 / 0.01 ---化学计量数之比=物质的量之比x = 0.01 mol答:测得CO 的物质的量为0.01mol 。
例2(1)解:设需要镁的质量为x 。
(2)TiCl 4+2Mg Ti +2MgCl 2 ⎭⎬⎫⨯g 2448242x g2448242=⨯x 24g 4824g 242=⨯⨯=x 答:需要镁的质量为24 g 。
【课堂练习】【题型1】单一方程式,直接利用系数计算1、2.3 g金属钠投入足量水中充分反应后,收集到标准状况下氢气的体积为( )A.1.12 L B.22.4 L C.44.8 L D.11.2 L2、足量的铝粉投入20 mL NaOH溶液中,充分反应后放出标准状况下6.72 L H2,则NaOH溶液的物质的量浓度为A.15 mol·L-1B.10 mol·L-1 C.5 mol·L-1D.1 mol·L-13、一定条件下,将6.4g铜粉投入足量的稀硝酸中,充分反应后铜粉无剩余。
计算:(1)生成硝酸铜的物质的量?(2)制得标准状况下一氧化氮体积?【题型2】单一方程式,间接利用系数计算1、铁粉在加热条件下与水蒸气反应,当固体质量增加32g,则参加反应铁粉的物质的量是()A.0.5mol B.1mol C.1.5mol D.2mol2、加热10.0 g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45 g,计算混合物中碳酸钠的质量分数。
3、室温时,在体积相同的容器内混合下列气体,混合后压强最小的是( )A.100 mL H2和50 mL O2B.100 mL HCl和100 mL NH3C.100 mL NO和100 mL O2 D.100 mL N2和200 mL H2【题型3】多个方程式综合计算1、分别取两份铝屑,第一份与足量稀盐酸反应,第二份与足量氢氧化钠溶液反应,产生氢气的体积比为1∶2,则第一份与第二份铝屑的质量比为( )A.1∶1 B.1∶2 C.1∶3 D.2:12、将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是()A.a=b B.a>b C.a<b D.无法确定3、标准状况下,NO2和O2按4∶1的体积比混合充满一个大试管,把大试管倒立于水中,水面逐渐上升,最后试管中溶液的物质的量浓度(不考虑试管中溶液扩散)为()A.0.8 mol·L-1B.0.72 mol·L-1 C.0.1 mol·L-1D.0.036 mol·L-1※4、m g 铁粉与含有H2SO4的CuSO4 溶液完全反应后,得到m g 铜,则参与反应的CuSO4与H2SO4的物质的量之比为A.7:1 B.1:7 C.7:8 D.8:75、某实验小组验证某种镁铝合金的成分。
操作如下:将样品粉末分成等量的两份,一份放入过量的氢氧化钠溶液中,得到3.36 L H2(标准状况下);另一份放入过量的盐酸中,得到5.6 L H2(标准状况下)。
试计算:(1)该合金中铝的质量。
(2)该合金中铝和镁的物质的量之比。
6、将4.6 g金属钠和8.1 g铝放入90.8 g水中,充分反应后,得到的溶液密度为1.25 g·cm-3。
计算:(1)铝在反应中共产生氢气的体积(H2的密度为0.0893 g·L-1)。
(2)所得溶液的物质的量浓度。
7、将6 g的铁粉加入200 mL Fe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL 0.5 mol·L-1FeSO4溶液和5.2 g固体沉淀物。
试计算:(1)反应后生成铜的质量。
(2)原Fe2(SO4)3溶液的物质的量浓度。
期末真题举例:【东城08A】21.(4分)氯气和二氧化硫在水中可发生下列反应:Cl2 + SO2 + 2H2O = H2SO4 + 2HCl,其中氧化剂是,还原剂是;若产生4.9 g H2SO4,则需要二氧化硫的体积(标准状况)为L,反应中转移的电子为mol。
27(1)浓硫酸与木炭在加热条件下发生反应的化学方程式为;若反应中消耗2.4 g 碳,则参加反应的硫酸的物质的量为mol。
28.(6分)取100mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到29.02g白色沉淀,用过量稀硝酸处理后沉淀量减少到9.32g,并有气体放出。
试计算:(1)原混和溶液中Na2SO4的物质的量浓度;(2)产生的气体在标准状况下的体积。
附加(1)化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为3Cl2 + 8NH3 = 6NH4Cl + N2 。
若反应后气体的总物质的量减少了1.5 mol,则参加反应的NH3在标准状况下的体积为L。
【东城08 B 】19.工业上以CaO 和HNO 3溶液为原料制备Ca(NO 3)2•4H 2O 晶体。
为确保制备过程中既不补充水分,也无多余的水分,所用HNO 3溶液中溶质的质量分数应为( )A .53.8%23.(2)铝与氢氧化钠溶液反应的离子方程式为 。
同温同压下,在浓度和体积均为100 mL 2 mol / L 的盐酸及NaOH 溶液中各加入等质量的Al ,产生气体的体积比为5:6,则所加Al 的质量为 。
【09东城】将一定质量的23Na CO 和3NaHCO 混合物灼烧至恒重,将放出的气体通入足量的2Ca(OH)饱和溶液中,充分反应后得到沉淀的质量是1.0g ,加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g 气体,计算原固体混合物中23Na CO 与3NaHCO 的质量各是多少?锌与100 mL 18.5 mol ·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6L (标准状况)。
将反应后的溶液稀释至1 L ,测得溶液中c (H+)=0.1 mol/L ,下列叙述正确的是A .反应中共消耗1.85 mol H2SO4B .反应中共消耗97.5 g ZnC .反应中共转移6 mol 电子D .气体甲中SO2与H2的体积比为4:1【课后练习】1、一块表面已被氧化为Na2O的钠块10.8 g,将其投入100 g水中,产生H2 0.2 g,则被氧化的钠是( )A.9.2 g B.10.6 g C.6.2 g D.4.6 g2、取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下,产生的气体体积之比是( )A.1∶1 B.1∶2 C.1∶3 D.3∶23、1.4 g铁溶于盐酸中,加入NaOH溶液得到红褐色沉淀,过滤后给红褐色沉淀物加强热,得红色物质,其质量为()A.1 g B.1.5 g C.3 g D.2 g4、一定量铁粉与FeCl3溶液反应,待完全反应后,溶液中Fe3+和Fe2+的浓度相等,则参加反应的Fe3+和未反应的Fe3+的物质的量之比()A.3∶2 B.1∶2C.2∶1 D.2∶35、用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后.烧瓶内的氨水的物质的量浓度是(按标准状况下计算)()A.0.045 mol·L-1B.1 mol·L-1C.0.029 mol·L-1D.不能确定6、________g钠跟水反应放出的氢气与13 g锌与100 mL 5 mol·L-1的盐酸反应放出的氢气的质量相等。
7、铝分别与足量的NaOH溶液和盐酸反应,若两个反应在相同状况下放出等量的气体,则反应中消耗的NaOH和HCl物质的量之比为________。
8、工业上在电炉中用炭粉与二氧化硅反应制硅,反应为SiO2+2C Si+2CO↑。
(1)该反应中还原剂为________,若1mol SiO2参加反应,有________mol电子发生转移。
(2)若在电炉中加入120 g SiO2和一定量炭粉,反应后,可生成标准状况下CO的体积是________L。
9、超氧化钾(KO2)和过氧化钠一样,能吸收CO2变成碳酸盐放出O2。
若有0.5 mol KO2与过量CO2作用,计算产生O2的质量及物质的量。
10、将30.5 g Na2 CO3和NaHCO3的混合物加热至质量不再减少为止,待冷却后,称得剩余固体质量为21.2 g。
