药品生产专项检查表
药品生产专项检查报告表

药品生产专项检查报告表1. 背景药品生产是关乎人民生命健康的重要行业,为了保障药品质量和安全,需要进行专项检查以确保生产企业的合规性。
本报告表旨在对药品生产企业进行全面的专项检查,以评估其合规性和质量安全水平。
2. 检查信息•企业名称: [待填写]•经营范围: [待填写]•检查日期: [待填写]•检查人员: [待填写]3. 检查内容3.1 生产设备和环境在本次检查中,我们对企业的生产设备和环境进行了全面的检查和评估。
以下是我们的主要发现和评价:•设备状态良好:生产设备的外观整洁,无明显的损坏或老化现象。
•设备运行正常:生产设备的正常使用和维护记录完整,无异常情况。
•生产环境清洁:生产车间和储存区域保持干净整洁,无积尘和异味。
3.2 原材料采购和质量控制本次检查中,我们对企业的原材料采购和质量控制体系进行了审查。
以下是我们的主要发现和评价:•采购渠道可靠:原材料采购合同和记录完整,供应商资质齐全。
•原材料质量可控:企业建立了完善的原材料质量控制程序,并对供应商提供的原材料进行了检验和评估。
•不合格品处理及记录:企业建立了不合格品的处理程序,并记录处理过程和结果。
3.3 生产过程控制我们对企业的生产过程进行了详细的检查和评估。
以下是我们的主要发现和评价:•生产工艺标准化:企业建立了标准化的生产工艺,并按照要求进行操作。
•在线监控系统:企业安装了在线监控系统,并进行了有效的监控和记录。
•生产记录完整:生产记录包括原料投入、操作步骤、设备维护、环境监测等内容完整、准确。
3.4 质量管理体系我们对企业的质量管理体系进行了审查和评估。
以下是我们的主要发现和评价:•质量管理人员:企业配备了专业的质量管理人员,并有明确的职责和权责。
•内审和改进措施:企业开展了定期的内审,并采取了相应的改进措施。
•不良事件报告和处理:企业建立了不良事件报告和处理程序,并记录不同阶段的不良事件及处理结果。
4. 结论根据本次专项检查的结果,对该企业的合规性和质量安全水平进行综合评价如下:•该企业在生产设备和环境、原材料采购和质量控制、生产过程控制以及质量管理体系方面均符合相关要求,表现良好。
药品注册生产现场检查自查表

附件1:承诺书作为本生产现场检查申请(品名________,批件号_________)的申请机构及法人代表,我单位已确认:1、所提交的生产工艺与原注册申请(受理号________)申报且经审评通过的生产工艺完全一致,无任何变更。
2、如因提交生产工艺不真实或不一致而导致的任何问题,我单位及本人愿承担所有责任及由此造成的一切后果。
本承诺书一式二份申请单位公章:申请单位法人代表签字:日期:年月日(品名及规格)工艺验证情况的说明生产企业在申报的工艺和参数范围内仅进行了部分参数验证的,应对工艺验证实际完成情况作出具体说明,并承诺:在(申报品种)获得生产批件后,将严格按GMP要求完善相关工艺验证工作以后,才开始正式生产。
如因工艺验证工作不完善导致的上市后产品质量问题及相关后果,本企业将承担所有责任。
对于申报的生产工艺和工艺验证资料中生产工艺各步骤和参数设置不够具体的,在情况说明中还应详细列出生产工艺规定的、生产中应用的、验证中应用的工艺各步骤和参数设定值(可以列表形式表明)。
申请单位公章:申请单位法人代表签字:日期:年月日附表10 药品注册生产现场检查自查表本单位承诺以下内容均属实,如查有不实之处,本单位将承担由此造成的一切后果。
产品名称申请编号单位负责人(签名)申请单位(盖章)药品注册生产现场检查自查表6 / 17附表11 药品注册工艺流程图本单位承诺以下内容均属实,如查有不实之处,本单位将承担由此造成的一切后果。
单位负责人(签名) 产品名称 申请单位(盖章) 申请编号 产品工艺规程编号 批准日期 批量产品工艺流程图例注:说明图中所用代码及注释。
同时附上申报产品的生产车间平面图药品注册生产现场检查自查表填表说明各附表系为保证药品注册生产现场检查工作顺利有序进行而制定,请申请单位在生产现场检查之前按各表内容并结合GMP要求予以自查。
附表10:按照生产现场检查要点制订,要求企业按照各个检查要点检查自己申报品种的生产情况。
药品生产企业检查记录表
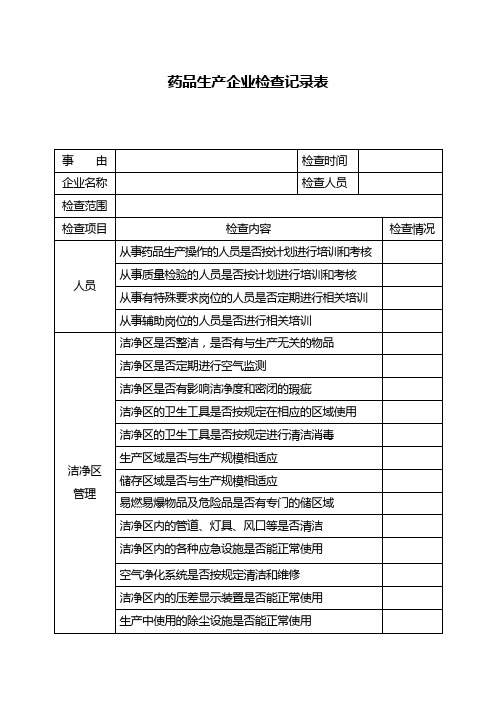
质量管理部门是否按规定对生产用水进行检验
质量管理部门是否按规定取样和留样
留样室的管理是否符合要求
质量管理部门是否按规定对标准品、滴定液进行标定
质量管理部门是否按规定对检验设备、量具进行校正
标准品、滴定液等是否按规定进行管理
检验用试剂、培养基等是否按规定条件储藏
空气净化系统是否按规定清洁和维修
洁净区内的压差显示装置是否能正常使用
生产中使用的除尘设施是否能正常使用
生产中使用的器具是否按规定清洗和消毒
有特殊要求的物品是否使用专用的器具
仪器设备管理
生产设备是否有明显的状态标志
生产和检验用仪器、量具、衡器等是否定期校验
有毒物品的衡器是否专用
生产设备是否按规定进行维修保养
质量管理部门是否定期对物料供应商进行评估
销售管理
产品销售是否有能追查到每批产品售情况的记录
产品退货和回收是否有能反映处理过程的记录
因质量原因退货和收回的产品,是否有详细的处理记录
是否建立药品不良反应监测制度
对有关药品质量和投诉和药品不很反应,是否有进行调查处理并有记录
纯化水系统是否按规定清洁消毒
物料管理
原辅料是否从指定的供应商购进有明显的物料标志及状态标志
原辅料是否经过检验合格后方投入使用
原辅料是否按规定条件储藏,并分别存放
原辅料发放是否有详细记录
进口原料药、中药材、中药饮片是否合法购进
待验、合格及不使用物料是否按规定严格管理
药品生产人员是否定期进行健康检查
生产管理
批生产记录是否及时按规定填写
批记录是否能如实和全面反映整个生产过程
生产用设备、容器是否有正确的状态标志
药品生产专项检查报告表

药品生产专项检查报告表1. 概述本文档是针对药品生产专项检查的报告表,旨在对药品生产环节进行全面的检查和评估。
通过填写该报告表,能够清晰地记录和总结药品生产过程中的问题和改进措施,为提高药品质量和加强药品生产管理提供参考依据。
2. 基本信息项目内容报告编号报告时间检查人员被检查单位被检查部门检查范围检查目的3. 检查内容3.1 生产设备检查设备编号设备名称设备状态备注3.2 原材料采购检查原材料名称供应商采购数量检查结果备注3.3 生产过程检查工序名称检查内容检查结果改进措施3.4 药品质量检查药品名称检查项目检查结果备注4. 检查结论根据对药品生产环节的全面检查,我们得出以下结论:1.生产设备状态良好,满足生产要求。
2.原材料采购方面存在一些问题,需加强供应商的质量管理。
3.生产过程中发现一些不规范操作,建议加强操作规范培训和管理。
4.药品质量检查结果表明存在一些质量问题,需加强产品质量控制和监督。
根据以上结论,我们提出了以下改进措施:1.定期对生产设备进行维护和保养,确保设备的正常运行。
2.加强原材料采购前的供应商审核与质量把关,确保原材料的质量稳定可靠。
3.培训生产操作人员,强化操作规范,减少不规范操作的发生。
4.建立严格的药品质量控制体系,加强质量监管,确保产品质量符合要求。
5. 结束语本报告表总结了药品生产专项检查的结果和改进措施,并提供了针对存在问题的解决方案。
通过对药品生产环节的全面检查和改进措施的实施,可以提高药品质量,降低生产风险,保证患者用药安全。
医药产品生产检查记录表

医药产品生产检查记录表医药产品生产检查记录表是用于记录医药产品生产过程中各个环节的检查情况,以确保产品质量和符合相关法规、标准的一种重要文件。
下面是关于医药产品生产检查记录表的参考内容:医药产品生产检查记录表产品名称:___________ 生产日期:___________产品批号:___________ 检查日期:___________检查项目检查结果检查人员1. 原辅材料检查1.1 原辅材料名称1.2 供应商名称1.3 进货合格证明检查1.4 外观检查1.5 化学成分检查1.6 纯度及含量检查1.7 微生物检查1.8 检查结论2. 生产设备检查2.1 生产设备名称2.2 生产设备编号2.3 设备清洁度检查2.4 设备运行状态检查2.5 传动系统检查2.6 控制系统检查2.7 检查结论3. 生产操作检查3.1 操作员姓名3.2 操作员资质检查3.3 工艺操作规程检查3.4 操作步骤执行情况检查3.5 操作参数记录检查 3.6 管理记录检查3.7 检查结论4. 中间检验4.1 中间产品名称4.2 中间产品批号4.3 中间产品外观检查 4.4 中间产品含量检查 4.5 中间产品满意度检查4.6 检查结论5. 成品检验5.1 成品名称5.2 成品批号5.3 外观检查5.4 化学成分检查5.5 纯度及含量检查 5.6 微生物检查5.7 检查结论6. 包装检查6.1 包装材料检查6.2 包装过程检查6.3 外观检查6.4 包装记录检查6.5 检查结论7. 质量控制记录7.1 温湿度记录7.2 灭菌记录7.3 检测设备校准记录7.4 不合格品处理记录7.5 索证索票记录7.6 检查结论检查总结及签名:____________________以上是医药产品生产检查记录表的参考内容,在实际使用时,可以根据具体的医药产品生产过程进行调整和细化。
同时,记录表中应包含签名栏,在每次检查完成后由相关人员进行签字确认,以确保记录的真实性和有效性。
医院药品质量管理监督检查表

医院药品质量管理监督检查表部门:1、特殊药品(麻醉药品、一类精神药品、医疗用毒性药品、贵重药品等)管理执行情况⑴“五专”管理:⑵数量管理:⑶处方书写等情况:2、药品质量控制、制度执行情况⑴含效期药品管理:⑵有无伪劣药品:⑶药品变质、霉烂、虫蛀、鼠患等现象:⑷有无中药串斗现象:⑸药品储存条件(尤其是需低温保存的药品):⑹药品摆放情况:3、《处方管理办法》、《医院中药饮片管理办法》等有关法律法规和规范落实情况⑴调配质量检查(现场查看已调配处方复核签字、调剂误差)调配人处方中药品总量西药种经复核调配人处方中药品总量西药种经复核调配人处方中药品总量中成药种经复核调配人处方中药品总量中草药味共克经回戥称量克误差%调配人处方中药品总量中草药味共克经回戥称量克误差%⑵处方书写质量状况与点评抽查年月日处方共张,处方书写不规范张,处方调配、复核等签名不完整张;用药不适宜张,超常处方张,共张,占处方总数%,合格处方张占处方总数%。
处方点评结果:中成药用药不合理张,其中无辨证诊断张、配伍不合理张、用法用量错误张。
(处方点评另见处方点评表)⑶中药煎药业务质量检查①煎药室卫生状况: ②用具、容器卫生状况:③包装材料是否符合规定:④煎药质量(有无糊状块、白心、硬心等):⑤有无错装、错发、漏发等情况:⑥急煎处方服务是否超过规定时限(二小时):3、服务质量状况⑴工作人员着装:⑵有无拒推处方现象:⑶有无病人及家属举报现象: ⑷发药交待是否清楚:⑸药袋书写情况:⑹药房环境卫生:⑺药品卫生状况:⑻病患对药剂服务质量的评价:当班人员:部门负责人:质量监督检查人:检查日期年月日药剂科对检查结果的处理意见:科主任:日期:。
药品生产专项检查表

药品生产专项检查表编号:(盖章)二〇〇六年月日出师表两汉:诸葛亮先帝创业未半而中道崩殂,今天下三分,益州疲弊,此诚危急存亡之秋也。
然侍卫之臣不懈于内,忠志之士忘身于外者,盖追先帝之殊遇,欲报之于陛下也。
诚宜开张圣听,以光先帝遗德,恢弘志士之气,不宜妄自菲薄,引喻失义,以塞忠谏之路也。
宫中府中,俱为一体;陟罚臧否,不宜异同。
若有作奸犯科及为忠善者,宜付有司论其刑赏,以昭陛下平明之理;不宜偏私,使内外异法也。
侍中、侍郎郭攸之、费祎、董允等,此皆良实,志虑忠纯,是以先帝简拔以遗陛下:愚以为宫中之事,事无大小,悉以咨之,然后施行,必能裨补阙漏,有所广益。
将军向宠,性行淑均,晓畅军事,试用于昔日,先帝称之曰“能”,是以众议举宠为督:愚以为营中之事,悉以咨之,必能使行阵和睦,优劣得所。
亲贤臣,远小人,此先汉所以兴隆也;亲小人,远贤臣,此后汉所以倾颓也。
先帝在时,每与臣论此事,未尝不叹息痛恨于桓、灵也。
侍中、尚书、长史、参军,此悉贞良死节之臣,愿陛下亲之、信之,则汉室之隆,可计日而待也。
臣本布衣,躬耕于南阳,苟全性命于乱世,不求闻达于诸侯。
先帝不以臣卑鄙,猥自枉屈,三顾臣于草庐之中,咨臣以当世之事,由是感激,遂许先帝以驱驰。
后值倾覆,受任于败军之际,奉命于危难之间,尔来二十有一年矣。
先帝知臣谨慎,故临崩寄臣以大事也。
受命以来,夙夜忧叹,恐托付不效,以伤先帝之明;故五月渡泸,深入不毛。
今南方已定,兵甲已足,当奖率三军,北定中原,庶竭驽钝,攘除奸凶,兴复汉室,还于旧都。
此臣所以报先帝而忠陛下之职分也。
至于斟酌损益,进尽忠言,则攸之、祎、允之任也。
愿陛下托臣以讨贼兴复之效,不效,则治臣之罪,以告先帝之灵。
若无兴德之言,则责攸之、祎、允等之慢,以彰其咎;陛下亦宜自谋,以咨诹善道,察纳雅言,深追先帝遗诏。
臣不胜受恩感激。
今当远离,临表涕零,不知所言。
药品生产专项检查报告表

物料验收、抽样、检验、发放规范、顺序及其执行状况;
1.反省物料验收
1.1检查相关制度规则及操作顺序能否契合要求。
1.2检查验收记载,内容能否包括反省核对批号、代号、本企业编号〔或批号〕、到货数量和包装有否损坏等状况。
2.反省抽样及检验
2.1 查能否有相关的管理文件。
2.2物料的进货量、样本数、取样时间、取样量、取样容器,看能否按批、按书面规则取样;取样后,被取样物料包装的密封、标志状况,样品的注销、贮存和分发〔化验室〕状况能否契合要求。
3.企业能否以«药品不良反响/事情活期汇总表»的方式停止年度汇总后,向所在地的省、自治区、直辖市药品不良反响监测中心报告。对新药监测期内的药品,每年汇总报告一次; 对新药监测期已满的药品, 在初次药品同意证明文件有效期届满当年汇总报告一次,以后每5年汇总报告一次。
4.不良反响的档案资料能否明晰、完整。
药品生产专项检查报告表
编号:〔省〕200600**
企业称号
容许证
编号
消费范围
反省时间
反省人员
条款
反省内容
反省结果
契合
局部契合
不契合
0101
企业担任人专业、学历、资历及其培训状况,实行职责的实践才干;
1.企业主要担任人
1.1反省毕业证书原件。
1.2现场考核能否熟习相关法律法规。
2.主管质量的担任人
2.1反省毕业证书原件。能否有医药或相关专业大专以上学历。相关专业即指化学、生物学、化学工程、微生物学等与医药相关的学科专业。
2. 以上这些重要职责不得委派系人。
3.反省能否有物料取样、抽样规则。
3.1能否规则检查供货商的质检报告,并按批抽样。
3.2能否规则抽样时间、容器、方法及数量,并在抽样后标明抽样标志。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号:
企业名称
许可证编号
生产范围
检查时间
检查人员
条款
检查内容
检查结果
符合
部分符合
不符合
0101
企业负责人专业、学历、资历及其培训情况,履行职责的实际能力;
0102
质量保证部门负责人及其工作人员专业、学历、资历及其培训情况,履行职责的实际能力;
0103
质量控制部门负责人及其工作人员专业、学历、资历及其培训情况,履行职责的实际能力;
□收回《药品GMP证书》
□吊销《药品生产许可证》
(盖章)
二〇〇六年月日
0301
质量控制部门按规定独立履行职责;
0302
每种物料、中间产品、产品检验采用的标准及方法符合规定;
0303
按规定实行检验及留样,如部分检验,其确定原则;
0304
按实验数据如实出具检验报告;
0305
如有委托检验,接受委托方的选择原则、资质、协议及其执行情况。
0401
物料供应商选择原则、审计内容、认可标准、审计人员的组成及资格、实地考核确定原则、考核周期及其执行情况;
接受检查、跟踪检查发现缺陷的整改落实情况。
0901
药品委托生产符合规定;
0902ቤተ መጻሕፍቲ ባይዱ
委托生产或受托生产药品质量监控执行情况。
检查中发现的其它缺陷
严重缺陷
一般缺陷
(此栏不够可附页)
检查和跟踪检查次数
曾经的违法违规行为及处理情况
其它需要
说明的问题
省级药监部门综合评定意见
省级药监部门处理结果
□限期整改
□停产整顿
0104
药品生产负责人专业、学历、资历及其培训情况,履行职责的实际能力;
0105
物料管理负责人专业、学历、资历及其培训情况,履行职责的实际能力。
0201
质量保证部门按规定独立履行对物料抽样、不合格物料不准投入生产、不合格产品不准放行、不合格物料及不合格成品处理等职责;
0202
质量保证部门具有对物料供应商质量保证体系审计、评估及决策等质量否决权。
0601
所有药品按照法定标准、生产工艺组织生产;
0602
物料平衡、偏差处理及不合格品处理情况。
0701
销售记录能够全面、准确反映每批药品的去向,必要时能够追查并及时收回全部产品;
0702
退回产品及收回产品的处理程序及其执行情况;
0703
药品不良反应报告及其执行情况。
0801
企业自检执行情况;
0802
0402
批准及变更供应商的审批程序及其执行情况;
0403
按规定与物料供应商签订合同;
0404
供应商资质证明资料具有供应商印章;
0405
每种物料供应商的档案齐全、完整。
0501
原料、辅料的物料使用及产品放行情况;
0502
物料验收、抽样、检验、发放标准、程序及其执行情况;
0503
如采用计算机控制系统,其验证能够确保不合格物料及不合格产品不放行。
