大学二年级分析化学-第5章酸碱滴定法2
第5章 酸碱滴定法

一. 物料平衡 在一个化学平衡体系中,某一给定物质的
总浓度,必然等于各有关型体平衡浓度之和,
这种等衡关系称为物料平衡,其数学表达式
称为物料平衡方程,用MBE表示。
(Material Balance Equation)
例1:写出cmol· -1下列溶液的MBE L
(1)HAc (2)Na2CO3 (3)NaNH4HPO4
(1)Cl-的浓度
(2)Al3+的电荷
结 论
当离子强度相同时,离子的价态越高, 则γ越小。
6
(2)德拜-休克尔极限公式
lg i 0.512Zi
2
I
通常运用该式对活度系数随离子强度的 改变进行定性描述
(3)戴维斯(Davies)经验公式
I lg i 0.50 Z i 0.30 I 1 I
I lg i 0.512 Z i 1 Ba I
2
Z i — i 离子所带电荷
B —常数,25℃时为0.00328 I —离子强度
a —离子体积系数
1 2 I ci Z iห้องสมุดไป่ตู้2
ci 、Zi — 溶液中i 种离子的浓度和电荷
4
例1: 计算0.10mol· -1HCl溶液中H+的活度 L (武大本P111例1)
27
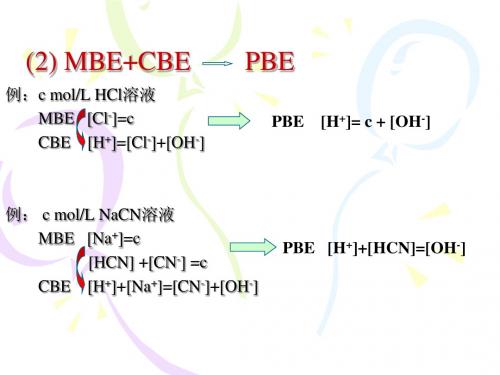
4、CBE的书写步骤
(1)首先写出溶液中存在的所有平衡(特别注意: 不要漏掉水的解离作用); (2)写出溶液中所有的阳离子和阴离子; (3)将离子的电荷浓度正确表示出来; (4)将阳离子和阴离子分列等式两边,写出CBE。 例2:写出c mol· -1下列溶液的CBE L (1)NaCl (2)BaCl2 (3)Na2CO3
分析化学第5章
0.0 0 2 4 3.04 4.37 pKa1 pKa2 H2A HApKa= 1.33 6 8 10 12 pH
A2-
pH
1.0 H3PO4
δ
磷酸(H A)的分布系数图 磷酸(H3A)的分布系数图
H2PO4HPO42PO43-
0.0 0
2
4
6
8
10
12
pH
优势区域图 2.16
pKa1 H3PO4
优势区域图
pKa±1.3
HAc 3.46 4.76
6.06
Ac-
pH
HF的分布分数图(pKa=3.17) HF的分布分数图( =3.17) 的分布分数图
δ 1.0 HF 0.5 F-
0.0 0 2 HF
优势区域图
4 3.17 pKa 3.17
6
8 F-
10
12
pH
pH
HCN的分布分数图( HCN的分布分数图(pKa=9.31) =9.31) 的分布分数图
例:C1 mol/L H2SO4+C2 mol/L HAc
+
0 (H2SO4) HSO4HAc H2O
C1 SO42AcOH-
H+
[H+]=C1+[SO42-]+[Ac-]+[OH-]
C1 mol/L NaH2PO4 + C2 mol/L HCl +C3 mol/LNH4HCO3 + H3PO4 0 H2PO4HCl NH4+ HCO3H2O HPO42-、PO43C2 NH3 CO32OH-
-
HAc分布系数与溶液 关系曲线 HAc分布系数与溶液pH关系曲线: 分布系数与溶液pH关系曲线:
大学分析化学第5章-1

Ac- + H2O
共轭酸碱对
醋酸与氨在水溶液中的中和反应 HAc + NH3 NH4+ + Ac-
共轭酸碱对
结论(conclusion)!
酸碱半反应不可能单独发生 酸碱反应是两对共轭酸碱对共同作用的结果 酸碱反应的实质是质子的转移 质子的转移是通过溶剂合质子来实现的
二、 酸碱反应的平衡常数
二、酸度对弱酸(碱)各形体分布的影响
• 分布分数(distribution fraction): • 溶液中某酸或碱组分的平衡浓度占其总浓度 的分数, 以表示. c
i
c
• 分布曲线——不同pH值溶液中酸碱存在形式 的分布
作用:
(1)深入了解酸碱滴定过程; (2)判断多元酸碱分步滴定的可能性。 滴定是溶液pH与溶液中各物种的量、比例 不断变化的过程。
• 则 [H2C2O4] = 0c, [HC2O4-] = 1c, [C2O42-] = 2c •
2
0+1+ 2=1
多 元 酸 溶 液
[ H 2C2O4 ] [ H 2C2O4 ] 0 2 c [ H 2C2O4 ] [ HC2O4 ] [C2O4 ] 1 1 2 K a1 K a1 k a2 [ HC2O4 ] [C2O4 ] 1 2 1 [H ] [H ] [ H 2C2O4 ] [ H 2C2O4 ] [ H ]2 2 [ H ] K a1 [ H ] K a1 k a2
+
展开得一元三次方程
[H+]3 + Ka[H+]2- (Kaca+Kw)[H+] - KaKw= 0
《大学化学教学》5酸碱滴定法(修改稿)

标准溶液(滴定剂):已知准确浓度的试剂溶液
试样:被检测的物质。
滴定:用滴定管将标准溶液逐滴加到被分析组分
溶液中的操作过程。
编辑ppt
6
化学计量点(理论终点) :标准溶液与被测 组分按滴定反应式所表示的化学计量关系,恰好完 全反应的计量点。
配位滴定法
沉淀滴定法
编辑ppt
3
滴定分析法分类(按照化学反应分类)
(1)酸碱滴定法(中和法):以质子传递反应为基础。 H++ B- = HB
(2) 沉淀滴定法:以沉淀反应为基础。 Ag+ + Cl- = AgC1↓
(3) 配位滴定法:以配位反应为基础。
M2++ Y4- = MY2 -
(4) 氧化还原滴定法:以氧化还原反应为基础
4.掌握标准溶液的配制方法和标定方法。
5.掌握酸碱滴定法的基本原理,了解各种酸碱滴 定曲线,滴定突跃范围和指示剂的选择依据。
6.掌握酸碱滴定法测定结果的计算。
7.理解有效数字的意义,掌握有效数字的修约规 则和运算规则。
编辑ppt
2
分析化学
定性分析
化学分析 定量分析 仪器分析
化学分析
重量分析法 酸碱滴定法 滴定分析法 氧化还原滴定法
第12章 滴定分析
§12.1 滴定分析概述 §12.2 分析结果的误差和有效数字 §12.3 酸碱滴定法 §12.4 氧化还原滴定法 §12.5 配位滴定法
编辑ppt
1
教学要求
1.了解滴定分析法的分类方法和应用范围。
2.熟悉误差的分类及其产生的原因,掌握误差和 偏差的几种常用的表示方法。
第5章-酸碱滴定法

H
K a c H
H 2 K a H K ac 0
c / K a 500
H OH
H A HA OH K aK b Kw HA A
水的质子自递常数
水既可以接受质子,又可以给出质子,是两性物质。
水的质子自递反应
H2O H2O
Kw H3O OH H 2O H 2O
0 10
H3O O H
H OH
有关酸碱的浓度
活度:离子在化学反应中起作用的有效浓度
c
或分析浓度,用c表示。
溶液无限稀时:=1 中性分子:=1 溶剂活度:=1
分析浓度:各种存在形式平衡浓度之和称为总浓度
平衡浓度:达到平衡时,溶液中存在的各种形式的 浓度,称平衡浓度,用[]表示。
Debye-Hückel公式
0.509Z I lg i I 1 B
pK a 5.05
pK a 5.11
大家写出计算公式?
五、 酸碱溶液pH的计算
根据溶液中三大平衡关系,可以计算pH 值。也可以直接由质子条件式(PBE)得到 计算的精确公式,然后根据具体条件再简化 得到最简式。
一元弱酸(碱)溶液pH值的计算
HA的PBE:
Kw O H H
例:写出Na2HPO4的PBE 零水准:H 2O
3 PBE: H 2H3 PO4 H2 PO4 OH PO4
2 HPO4
四、酸度对弱酸(碱)各型体分布的影响
HA
H A
根据物料平衡,可知:
c HA:分析浓度
酸碱滴定法(2)

25
• 滴定突跃:化学计量点前后 0.1%范围内,溶液pH 值的突变。
• 滴定突跃范围:突跃所在的pH范围。 4.3 ~ 9.7
• 指示剂的选择:指示剂的变色范围全部或部分在滴 定突跃范围内。(pHs与pKIn相近)
酚 酞、甲基红、甲基橙 • 滴定突跃与HCl的浓度有关。
例如:
酸式色 中间色 碱式色
甲基红 溴甲酚绿 红色 + 黄色 橙色 + 绿色 黄色 + 蓝色
混合后 暗红色 灰色 绿色
14
四、酸碱滴定法的基本原理
15
滴定曲线
pH
选择指示剂 判断酸或碱能否被准确滴定
动画
VT
16
1. 强酸(碱)的滴定
强碱滴定强酸滴定曲线的计算过程
例:0.1000 mol/L NaOH 溶液滴定 20.00 ml 0.1000 mol/L HCl溶液
sp后:
22
cb 23
滴加体积:0—19.98 mL; pH=4.30-1.00=3.30 滴加体积:19.98 —20.02 mL;pH=9.70-4.30= 5.40
24
强碱滴定强酸滴定曲线的讨论:
a. 指示剂变色点(滴定终点)与 化学计量点并不一定相同,但 相差不超过±0.02mL,相对误 差不超过±0.1%。符合滴定分 析要求。
设HCl的浓度为ca(0.1000 mol/L),体积为Va(20.00 mL);NaOH的浓度为cb(0.1000 mol/L),滴定时 加入的体积为Vb mL
17
(1) 滴定前(Before titration)
加入滴定剂(NaOH)体积为 0.00 ml时,溶液的组成为 HCl( 0.1000 mol/L ,20.00 ml ),此时(Vb=0) ,溶液pH取决于HCl的浓度Ca,即
分析化学酸碱滴定法

分析化学酸碱滴定法分析化学中的酸碱滴定法是一种常用的定量分析方法,广泛应用于各种领域,包括环境监测、制药、食品检验等。
该方法通过在化学反应中加入一种已知浓度的酸或碱溶液,利用滴定终点的指示剂的颜色变化或电动势的变化来确定待测溶液的浓度。
酸碱滴定法的基本原理是酸和碱反应的定量关系:n1V1=n2V2,其中n1和n2分别是酸和碱的摩尔数,V1和V2分别是酸和碱的体积。
根据这一关系,可以确定待测溶液中酸或碱的浓度。
在酸碱滴定法中,滴定终点的判断是关键步骤。
常用的指示剂有酚酞、溴酸甲基橙、甲基红等,其颜色在酸碱反应过程中发生明显变化。
当滴加的酸或碱溶液足够与待测溶液中的酸或碱反应到足够数量时,指示剂的颜色发生转变,即达到了滴定终点。
酸碱滴定法有以下几个主要步骤:1.准备滴定溶液:根据待测溶液的性质选择合适的酸或碱溶液作为滴定溶液,调整其浓度,使其能够反应到滴定终点。
2.准备待测溶液:将待测溶液取出一定容积,用烧杯或容量瓶装放。
3.添加指示剂:根据待测溶液的酸碱性质选择合适的指示剂,加入待测溶液中。
4.滴定:用滴定管将滴定溶液滴加到待测溶液中,直到指示剂颜色发生转变,即达到滴定终点。
5.计算结果:根据酸碱反应的定量关系,使用酸碱滴定公式计算出待测溶液中酸或碱的浓度。
酸碱滴定法的优点是操作简单,结果准确可靠。
然而,该方法也有一些局限性。
首先,滴定终点的判断具有主观性,可受到操作人员的视力、光线等因素的影响。
其次,在滴定过程中,应该严格控制滴加速度,以避免溅液影响滴定结果。
此外,滴定终点对于复杂样品或多种酸碱的滴定来说可能会出现困难。
为了提高酸碱滴定法的准确性和灵敏度,人们引入了一些改进方法,如自动滴定器和电位滴定法。
自动滴定器可以自动控制滴加速度和滴定终点的判断,减少了人为误差。
电位滴定法则通过跟踪滴定过程中的电位变化来确定滴定终点,提高了滴定方法的精确性。
总之,酸碱滴定法是一种常用的分析化学方法,其简单易行、结果可靠的特点使其得到广泛应用。
大二分析化学酸碱滴定法

上一内容 下一内容 回本章目录 回主目录
R. Boyle 波义耳(1627-1691,英国)
波义耳把化学确立为科学。 ——恩格斯
罗伯特·波义耳
T. M. Lowry 劳里 (1874-1936,英国)
上一内容 下一内容 回本章目录 回主目录
12
酸碱电子理论的建立
提出“逸度”和“活度”的概念; 提出共价键的电子理论; 提出了酸碱电子理论(路易斯酸碱
理论)。 G. N. Lewis 路易斯 培养出五位诺贝尔奖获得者。
(1875-1946,美国)
上一内容 下一内容 回本章目录 回主目录
10
酸碱电离理论的建立
F. W. Ostwald 奥斯特瓦尔德 (1853-1932,德国 )
S. A. Arrhenius 阿累尼乌斯 (1859-1927,瑞典)
上一内容 下一内容 回本章目录 回主目录
11
酸碱质子理论的建立
J. N. Brønsted 布朗斯特 (1879-1947,丹麦)
The acid species (proton donor) is thereby converted to its conjugate base and the base (proton acceptor) becomes protonated to form its conjugate acid.
推翻了燃素学说,提出了 燃烧的氧化学说;
证明了水可以分解成氢气 和氧气;
认为凡是包含有氧元素的 化合物,都是酸性。
上一内容 下一内容 回本章目录 回主目录
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
上一内容 下一内容 回本章目录 回主目录
5.5.2 缓冲缓冲溶液 pH 值的计算
弱酸 HB 及其共轭碱 NaB 组成的缓冲溶液,设它们的 浓度分别为 cHB、cB- , 计算 该缓冲溶液的 pH 值。
物料平衡式: [Na ] cB , [HB] [B- ] cHB cB (1)
电荷平衡式: [Na ] [H ] [B ] [O H ]
[B- ] cB [H ][OH- ]
(2)
将(2)式代入(1)得
[HB] cH B [H ] [OH - ]
(3)
上一内容 下一内容 回本章目录 回主目录
5.5.2 缓冲缓冲溶液 pH 值的计算
根据解离平衡可得计算缓冲溶液的 pH 值的精确公式:
5.5.1 缓冲作用与缓冲溶液
缓冲溶液:是一类对溶液的酸度有稳定作用的溶液。
缓冲作用: 向溶液中加入少量的酸或碱,或者将溶液稍 加稀释,溶液的酸度都能基本保持不变,这种作用称 为缓冲作用。 缓冲溶液的组成:一般是由浓度较大的弱酸及其共轭 碱所组成。 ➢ 如 HAc-Ac-、NH4+-NH3; ➢ 高浓度的强酸或强碱溶液,只适合做高酸度(pH<2)
解: Ka K W / Kb 5.6 1010
按最简式(7)计算
pH pKa
lg cB cHB
9.26 lg 0.20 0.10
9.56
注意:
(1)Ka 的正确选择; (2)共轭酸碱对的相应浓度
上一内容 下一内容 回本章目录 回主目录
缓冲溶液 pH 值的计算例 2
计算 0.0800 mol·L-1 二氯乙酸 - 0.120 mol·L-1 二氯乙
5~ 9 节作业
P164 P165
第 12, 15, 17, 19 题 第 24, 28 题
上一内容 下一内容 回本章目录 回主目录
5.5 酸碱缓冲溶液(Buffer)
5.5.1 缓冲作用与缓冲溶液 5.5.2 缓冲溶液 pH 值的计算
5.5.3 缓冲容量
5.5.4 几种重要的缓冲溶液
上一内容 下一内容 回本章目录 回主目录
酸钠缓冲溶液的 pH 值,已知二氯乙酸的 pKa=1.26。
解: 先按最简式(7)计算
pH
pKa
lg cB cHB
1.26 lg 0.120 0.0800
1.44
[H ] 101.44mol L1 0.036 mol L1
[H
]
Ka
cHB cB
[H ] [H ]
[H+] = 0.036 mol·L-1,与共轭酸碱对的浓度比较可知,
上一内容 下一内容 回本章目录 回主目录
5.5.3 缓冲容量
缓冲容量:衡量缓冲溶液缓冲能力大小的尺度。
缓冲容量b 的数学表达式: β db da dpH dpH
缓冲容量的大小表明溶液抵抗外加酸碱影响的能力。
计算 b 的近似式为:
ቤተ መጻሕፍቲ ባይዱ
β
2.30
c Ka[H ] ([H ] K a )2
式中 c 为缓冲剂 HB 与 B 的总浓度。b 越大,缓冲容
[H ]
Ka
[HB] [B- ]
Ka
cHB cB
[H ] [OH- ] [H ] [OH- ]
(4)
精确公式比较复杂,在实际工作中,缓冲剂本身的浓度 往往较大,多数情况下,缓冲溶液酸度的计算采用近似 方法。分以下三种情况对 (4)式进行讨论。
上一内容 下一内容 回本章目录 回主目录
5.5.2 缓冲缓冲溶液 pH 值的计算
Ka
cHB
c B
[OH- ] [OH- ]
近似公式 (6)
上一内容 下一内容 回本章目录 回主目录
5.5.2 缓冲缓冲溶液 pH 值的计算
[H ]
Ka
[HB] [B- ]
Ka
cHB [H ] [OH - ] cB [H ] [OH - ]
(4)
3. 当 cHB [O H ] [H ] 和 cB [H ][OH ]
0.036 与 0.022 的相对误差有 64%。
上一内容 下一内容 回本章目录 回主目录
缓冲溶液 pH 值的计算例 3
计算 0.30 mol·L-1 吡啶和 0.10 mol·L-1 HCl 等体积混合 组成的缓冲溶液的 pH 值,已知吡啶的 Kb=1.7ⅹ10-9。
解:先确定共轭酸碱对的浓度
+ H+=
第 5 章 酸碱滴定法
5.1 溶液中的酸碱反应与平衡 5.2 酸碱组分的平衡浓度与分布分数 5.3 溶液中 pH 值的计算 5.4 对数图解法 5.5 酸碱缓冲溶液 5.6 酸碱指示剂 5.7 酸碱滴定原理 5.8 终点误差 5.9 酸碱滴定法的应用
上一内容 下一内容 回本章目录 回主目录
1
作业 (二)
不能应用最简式,要采用(5)式计算。
上一内容 下一内容 回本章目录 回主目录
缓冲溶液 pH 值的计算例 2
[H
]
Ka
cHB cB
[H ] [H ]
101.26
0.080 [H ] 0.12 [H ]
整理得 [H ]2 0.175[H ] 0.0044 0 解一元二次方程,得
[H ] 101.65 mol L-1 0.022 mol L-1 pH 1.65
ca 0.10 mol L1 / 2 0.050 mol L1 N
N H+
cb (0.30 0.10) mol L1 / 2 0.10 mol L1
Ka K W / Kb 5.9 106
pH
pKa
lg cB cHB
5.23 lg 0.10 0.050
5.53
重点:共轭酸碱对浓度的计算
时,式(4)进一步化简为最简公式:
[H ]
Ka
cHB
c B
pH
pKa
lg
cB cHB
(7)
由
上
式
可
知
:当
c B
cHB
时 ,pH
pKa 。
上一内容 下一内容 回本章目录 回主目录
缓冲溶液 pH 值的计算例 1
计算 0.10 mol·L-1 NH4Cl - 0.20 mol·L-1 NH3 缓冲溶 液的 pH 值,已知 Kb(NH3) = 1.8×10-5。
[H ]
Ka
[HB] [B- ]
Ka
cHB [H ] [OH - ] cB [H ] [OH - ]
(4)
1. 当溶液 pH<6 时,忽略式(4)中的 [OH-]:
[H ]
Ka
cHB cB
[H ] [H ]
近似公式 (5)
2. 当溶液 pH>8 时,忽略式(4)中的 [H+]:
[H
]
