分析化学酸碱滴定公式整理
分析化学--第四章 酸碱滴定

第三节 酸碱滴定法的基本原理
第三节 酸碱滴定法的基本原理
一、强酸(强碱)的滴定 基本反应为: H++OH- ===H2O
例: 0.1000mol/L NaOH滴定 20.00mL 0.1000mol/L HCl
第四章 酸碱滴定
(acid-base titration)
第四章 酸碱滴定
●酸碱滴定 :以质子传递反应为基础的滴定分析方法。 强酸 滴定 强碱 或 强碱 滴定 强酸
强酸 滴定 弱碱 或 强碱 滴定 弱酸
滴定 强酸
多元弱碱
或
强碱 滴定 多元弱酸
第四章 酸碱滴定
第一节 酸碱溶液中氢离子浓度的计算
一、质子酸碱理论(复习内容) ◆酸碱定义和共轭酸碱对 ◆酸碱反应 ◆共轭酸碱对的Ka和Kb的关系
6
6.25 ·
4
4.30
·
2
酚酞8.0~10.0
0
10
20
百里酚酞9.4~10.6
30 Vb(mL)
第三节 酸碱滴定法的基本原理
2.一元弱碱(被滴定物质)的滴定
例:
H
NH 3
H2O
NH
4
H2O
1、滴定突跃区间
pH
14
pH=6.25~4.30
12
2、指示剂的选择
10
NH3
8
3、影响滴定突跃区
入甘油后可生成Ka= 8.4×10-6的甘油硼酸,就可 以准确滴定。
第三节 酸碱滴定法的基本原理
2.一元弱碱(被滴定物质)的滴定
滴定naoh溶液的公式

滴定naoh溶液的公式滴定NaOH溶液的公式引言:在化学试验中,滴定是一种重要的分析方法。
滴定的本质是将一种容易反应的化学物质(称作“滴定液”)加入到要测定物中,观察两者在一定条件下反应的情况,并确定它们反应滴定过程中所需要的滴定量。
本文将详细介绍滴定NaOH溶液的公式。
一、NaOH和酸的反应方程式NaOH和酸反应,会产生水和相应的盐酸。
在NaOH和HCl的反应中,反应方程式为:NaOH + HCl →H2O + NaCl方程式表明,在1mol NaOH与1mol HCl反应时,可以产生1mol水和1mol NaCl。
二、滴定NaOH溶液的公式滴定NaOH溶液的公式是指测定酸性样品时,向其中滴加NaOH标准溶液,最终达到酸性和碱性物质相互抵消的状态的公式。
1.标准溶液浓度计算标准溶液的浓度一般通过以下公式计算得到:标准浓度 = 重量 ÷(分子量×溶液容量)其中,重量表示物质的质量,单位为克;分子量指的是溶液中分子的相对分子量,单位为克/摩尔;溶液容量指的是在标准状况下,溶液的总体积,单位为升(1L)或毫升(1mL)。
2.滴定公式的计算在滴定NaOH溶液时,需要先用该标准溶液进行滴定,直到酸性物质中的酸和其滴加的NaOH完全反应,从而得到反应滴定量。
通过该量,可以计算出NaOH的浓度,即:滴定盐酸溶液的浓度(单位:mol/L) ×滴定NaOH溶液的体积(单位:L) × 1 = NaOH溶液的摩尔浓度其中,滴定盐酸溶液的浓度是已知的,滴定NaOH溶液的体积需要通过实验测定得到,1表示反应中需要用1mol NaOH反应1mol盐酸。
三、实验注意事项1.选择合适的指示剂滴定过程需要选择合适的指示剂,它能够与酸性和碱性物质反应,从而产生颜色变化,指示此时溶液达到终点。
常用的指示剂有甲基红、溴酚蓝等。
2.控制滴定速度在滴定NaOH溶液时,需要逐渐添加NaOH滴液,且控制滴定速度,一般每次滴定1-2滴,并轻摇容器使混合均匀。
分析化学酸碱滴定公式整理
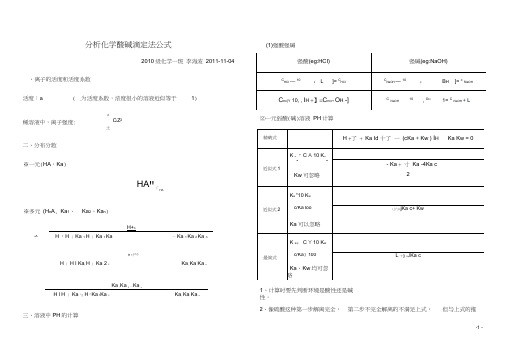
分析化学酸碱滴定法公式(1)强酸强碱、离子的活度和活度系数活度:a i(稀溶液中,离子强度: 二、分布分数※一元(HA,Ka)※多元(H n A, Ka1、n A 2010级化学一班李海波2011-11-04i为活度系数,浓度很小的溶液近似等于1)nC i Z2i 土HA"「HAKa2、Ka n)H+nH 『H 丨Ka 1 H 丨Ka 1 Ka 亠Ka 1 Ka 2 Ka nH +尸©H 丨H l Ka, H 丨Ka 2 2Ka, Ka Ka nKa ,Ka 2…Ka nH l H 丨°Ka 勺H『Ka t Ka 2Ka, Ka Ka n三、溶液中PH的计算⑵一元弱酸(碱)溶液PH计算1、计算时要先判断环境是酸性还是碱性。
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推导过程类似,应用质子守恒列方程, [0H -]太小,忽略。
(3)多元弱酸(碱)溶液 一般都按二元酸处理, Ka 太小省略掉。
(4)两性物质溶液pH 的计算①酸式盐,eg : NaHA②弱酸弱碱盐(1:1 型),eg : CH 2CIC00NH 4 (CH 2CICOOH *a , NH 3^Ka')(非1:1 ), eg : (NH4)2CO3 (1、溶液弱碱性,H2CO3、H+可忽略,只要是c不是很小,Kw 也可忽略)HCO 37:“ N H3 1 T ':HCO _c =、:NH3%(5)混合溶液①两种弱酸:H丄Ka! c, Ka 2c2②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
③一种弱碱和一种弱酸:H Ka Ka C酸1 2 c碱(6)缓冲溶液(弱酸HA浓度c i,共轭碱A-浓度C2)※标准缓冲溶液要考虑离子强CK ai _10 -,冰玄2 10 - 可准确滴定HA-六、终点误差公式(以NaOH滴定酸为例)强酸(HCI)滴定兀弱酸(HA)滴定sp epC HA C HAspCHAE t10 ■p H i0』H多元弱酸(H2A )滴定10 •叩_.10款HA和HB混酸(K HA>K HB)10拽_10少E tK CI. HA HA-K CHB HB。
大学,分析化学第05章,酸碱平衡及酸碱滴定法

质子平衡 溶液中酸失去质子数目等于碱得到质子数目。 质子条件式(PBE)
(1) 先选零水准 (大量存在,参与质子转移的物质), 一般选取投料组分及H2O
(2) 将零水准得质子产物写在等式一边,失质子产物 写在等式另一边 (3) 浓度项前乘上得失质子数
例:Na2HPO4水溶液
零水准:H2O、HPO42[H+] + [H2PO4- ]+2[H3PO4] = [OH-] +[PO43-]
H2O
1 Kt = =10 14.00 Kw
H+ + Ac-
HAc
Kb 1 Kt = = Ka Kw
OH- + HAc
Ka 1 Kt = = Kb Kw H2O + Ac-
3 活度与浓度
活度:在化学反应中表现出来的有效浓度,
通常用a表示
a i = g i ci
溶液无限稀时: g =1 中性分子: g =1
+ -
-
gHB gA
+
K◦
4 质子条件式
物料平衡 (Material (Mass) Balance): 各物种的平衡浓度之和等于其分析浓度。 电荷平衡 (Charge Balance): 溶液中正离子所带正电荷的总数等于负离子所带 负电荷的总数(电中性原则)。 质子平衡 (Proton Balance): 溶液中酸失去质子数目等于碱得到质子数目。
分布分数-多元弱酸
二元弱酸H2A
H2AH++HA- H++A2- c H CO =[H2CO3]+[HCO3-]+[CO32-]
2 3
物料平衡 δH A
2
分析化学需记忆的公式

c c Red2
Ox1
θ' 1
θ' 2
0.059 1
lg
K'
0.35V
n1=1,n2=2 2Ox1 Red2 2 Red1 Ox2
K'
c Ox 2 cRed2
cRed1 cOx1
2
109
1'
' 2
0.059 lg K' 2
0.27V
n1=2,n2=2 Ox1 Red2 Red1 Ox2
共轭酸碱体系(HA-A-)
H
ca cb
Ka
pH
pK
a
lg
cb ca
酸(碱)滴定可行性条件
Et
10 pH 10 pH c sp K t 1 2
Et:终点误差 pH=pHsp-pHep Kt:滴定反应常数 csp:终点时反应物浓度
Et 0.1% pH 0.3
Kaca 108 Kbcb 108
例:某有色溶液以试剂空白作参比时,选用1.0 cm吸收池,测 得T=8.0%。已知=1.1104,若用示差法测定上述溶液,应选 择多大浓度的溶液作参比才能使测量的相对误差最小?
解:
A As Ar
0.434 cr
Ar l
As A l
cr
lg 8.0% 0.434 1.1104 1.0
6.0105 mol L1源自Flg H ELE K 2.303RT pH F
E K 0.059pH25C
常数K´包括: 外参比电极电位 内参比电极电位 不对称电位
液接电位
pH测定的原理和方法(2)
Es
K'
RT F pH s
Ex
分析化学 滴定分析

实际变色范围 1-2pH单位
理论:pKa±1
pKHIn=3.4 pKHIn=9.1 pKHIn=5.0
甲基橙:pH = 3.1-4.4(红-黄) 酚酞: pH = 8-10(无-红)
甲基红:pH = 4.4 -6.2(红-黄)
变色范围越窄,越敏锐,越好!
指示剂选择:
变色范围部分或全部落在滴定突跃范围内。 原则 不宜过多 适量即可
[HAc ]〔Ac-〕 达平衡时实际存在的浓度
有关形式平衡浓度的总和
cHAC=[HAc ]+[Ac-] 滴定测得分析浓度
精确法
列出质子平衡方程 基于溶液平衡 列出有关[H+]浓度的方程式
近似法
或许很复杂 高次方程
合理忽略(误差5%以内,即20倍浓度) 进行简化!
质子条件式:得、失质子的物质量等衡 1.选择零水准;溶液中参与质子转移的物质; 2.以此为参照,分别列出得到质子后的产物和失去 质子后的产物. 3.列出等衡关系。 如:HAc: H2O, HAc
m 10 1.200g混合碱溶于水,用0.5000mol/LHCl滴定 VPP=30.00ml, V30=12.00ml。 ) 40 .01 0.5000 ( MO .00 12 .00
判断试样组成,计算百分含量。 1.200 10
% NaOH
30 .01
% Na 2 CO 3
Ka [H ]
指示剂的颜色完全由溶液中的[H+]来决定。
10 碱色 1 10 碱色略带酸色 1 Ka [ In ] 1 中间色 [ HIn ] [ H ] 1 10 酸色略带碱色 110 酸色
变 色 范 围
分析化学5.酸碱滴定(2)ok
H
(H2CO3 饱和溶液,0.04mol/L)
C a K a1 4.3 10 7 0.04 1.3 10 4 mol / L
pH 3.9
甲基橙
多元碱的滴定
讨论
根据变色点pH选择指示剂 第一变色点 pH=8.37 选酚酞 第二变色点 pH=3.9 选甲基橙
续强碱滴定弱酸
1.滴定过程中pH值的变化
(1)Vb = 0
[ H ] C a K a 1.8 10 5 0.1000 1.34 10 3 mol / L
pH 2.88
(2)Vb < Va :HAc + NaAc
SP前0.1% 时 ,已加入NaOH 19.98mL
C AC Cb pH pKa lg pKa lg pH 7.76 Ca C HAC 20.00 19.98 CHAC 01000 . 5.0 10 5 mol / L 20.00 19.98 19.98 C AC 01000 . 5.0 10 2 mol / L 20.00 19.98
酚酞,百里酚酞
多元酸的滴定
讨论
根据变色点pH选择指示剂 第一变色点 pH=4.66 选甲基橙,甲基红 第二变色点 pH=9.94 选酚酞,百里酚酞
pKa1(2.16) H3PO4
pKa2(7.21)
-
pKa3(12.32)
H2PO4
HPO42-
PO43-
pHsp1= 4.7
pHsp2= 9.7
(3)选酚酞指示剂
第八节
酸碱滴定的应用
一、酸碱溶液的配制与标定 酸标准溶液 碱标准溶液
一、酸碱溶液的配制与标定
分析化学-酸碱滴定
溶剂的影响:极性 →介电常数→KIn→变色范围 滴定次序: 无色 → 有色; 浅色→ 有色
第四章
酸碱滴定法
化学分析
指示剂的用量: 尽量少加,否则终点不敏锐
双色指示剂:甲基橙
K In [H ]
[In ] [HIn]
变色点pH取决于酸、碱式体浓度的比值,与cHIn无关
单色指示剂:酚酞
KIn [H ]
pH的变化速率不同
HAc~Ac–的缓冲作用使溶液pH值 的增加速度减慢
突跃范围小
pH从7.75→9.70,滴定产物NaAc 为弱碱,使化学计量点处于碱性区域 (pH8.73)。
选用在碱性区域内变色的指示剂
第四章
酸碱滴定法
化学分析
影响滴定突跃的因素
溶液ca一定,Ka↓,△pH↓, 滴定突跃↓ 。 酸的Ka值一定,ca, △pH↑, 滴定突跃范围↑。
精确式
] 若ca和cb≥ 20 [H ,得Henderson缓冲公式:
[H ] K a
ca cb
pH p K a lg
cb ca
第四章
酸碱滴定法
化学分析
第二节
酸碱指示剂
第四章
酸碱滴定法
化学分析
指示剂的变色原理
酸碱指示剂(acid-base indicator) 的特点
质子条件式: [H ] [A ] [OH ]
[H ] [A ] c a [H ] c a
第四章
酸碱滴定法
化学分析
强酸在溶液中完全离解,则[A-] = ca, 代入质子式得: Kw
[H ] c a [H ]
分析化学四大滴定总结
分析化学四大滴定总结滴定分析法又称为容量分析法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
这其中又有重要的四大滴定方法。
以下是店铺整理的分析化学四大滴定总结,欢迎查看。
一、酸碱滴定原理:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、碱和两性物质。
其基本反应为H﹢+OH﹣=H2O也称中和法,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
标定它们的基准物质是碳酸钠Na2CO3。
方法简介:最常用的碱标准溶液是氢氧化钠,有时也用氢氧化钾或氢氧化钡,标定它们的基准物质是邻苯二甲酸氢钾KHC8H4O6或草酸H2C2O·2H2O:OH+HC8H4O6ˉ→C8H4O6ˉ+H2O如果酸、碱不太弱,就可以在水溶液中用酸、碱标准溶液滴定。
离解常数 A和Kb是酸和碱的强度标志。
当酸或碱的浓度为0.1M,而且A或Kb大于10-7时,就可以准确地滴定,一般可准确至0.2%。
多元酸或多元碱是分步离解的,如果相邻的离解常数相差较大,即大于104,就可以进行分步滴定,这种情况下准精确度不高,误差约为1%。
盐酸滴定碳酸钠分两步进行:﹢ˉCO32-+H→HCO3HCO3ˉ+H﹢→CO2↑+H2O相应的滴定曲线上有两个等当点,因此可用盐酸来测定混合物中碳酸钠和碳酸氢钠的含量,先以酚酞(最好用甲酚红-百里酚蓝混合指示剂)为指示剂,用盐酸滴定碳酸钠至碳酸氢钠,再加入甲基橙指示剂,继续用盐酸滴定碳酸氢钠为二氧化碳,由前后消耗的盐酸的体积差可计算出碳酸氢钠的含量。
某些有机酸或有机碱太弱,或者它们在水中的溶解度小,因而无法确定终点时,可选择有机溶剂为介质,情况就大为改善。
这就是在非水介质中进行的酸碱滴定。
有的非酸或非碱物质经过适当处理可以转化为酸或碱。
然后也可以用酸碱滴定法测定之。
分析化学酸碱滴定公式整理
分析化学酸碱滴定公式整理
酸碱滴定公式整理如下:
1.酸碱滴定终点公式:滴定过程中,当滴加的酸和碱的摩尔比满足滴
定反应的化学方程式时,滴定终点达到。
酸碱滴定终点公式的一般形式为:n(A)/V(A)=n(B)/V(B)
其中,n(A)和n(B)分别表示酸和碱的摩尔数,V(A)和V(B)分别表示
滴加的酸和碱的体积。
2.酸碱滴定的标准溶液浓度计算公式:标准溶液是使用称量准确浓度
已知的物质溶解在溶剂中得到的溶液。
标准溶液的浓度可以使用以下公式
计算:
C(B)=(n(B)×M(B))/V(B)
其中,C(B)表示基准溶液浓度,n(B)表示溶液中物质的摩尔数,M(B)
表示物质的摩尔质量,V(B)表示溶液的体积。
3.酸碱滴定中的滴定反应计算公式:酸碱滴定反应可以通过平衡反应
方程式表示。
一般而言,酸碱滴定反应是一种酸和碱发生中和反应的过程,其一般形式为:
HA+BOH→H2O+BA
其中,HA表示酸,BOH表示碱,H2O表示水,BA表示盐。
4.酸碱滴定指示剂选择公式:在酸碱滴定中,往往会使用指示剂来标
定滴定终点。
指示剂的选择通常依赖于溶液的pH值。
常用的指示剂有酚酞、溴酚蓝、甲基橙等。
酸碱指示剂选择的公式如下:
pH = pKa + log ([A-]/[HA])
其中,pH表示溶液的酸度或碱度,pKa表示指示剂的酸性常数,[A-]和[HA]分别表示酸性和无色形式的指示剂浓度。
总之,酸碱滴定涉及到了一系列的公式和计算,这些公式帮助我们理解滴定过程、测定物质浓度和选择指示剂。
掌握这些公式,可以更加准确和方便地进行酸碱滴定分析。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析化学 酸碱滴定法 公式
2010级化学一班 李海波 2011-11-04
一、离子的活度和活度系数
活度:i i i c a γ= (i γ为活度系数,浓度很小的溶液近似等于1)
稀溶液中,离子强度:2
1
21i n i i z c I ∑==
二、分布分数δ ※一元(HA ,Ka )
[][]
+
+
+=
H Ka H HA δ []
+
+=
H
Ka Ka A
δ []HA C HA δ⋅= []
-⋅=-
A C A δ ※多元(H n A ,Ka 1、Ka 2、Ka n ) [][][][]n
n n n
n
A H Ka
Ka Ka Ka Ka H Ka H H H n ΛΛ2
1
2
1
2
1
1
++++=
-+-+++δ
[][][][]n
n n n
n A
H
Ka
Ka Ka Ka Ka H Ka H H Ka
H n ΛΛ2
1
2
1
2
1
1
1
1
1++++=-+-++-+-
-δ [][]
[]
n
n n n
n
A Ka Ka Ka Ka Ka H
Ka H H Ka Ka Ka n ΛΛΛ21212
11
21++++=
-+-++-
δ
三、溶液中PH 的计算
(1)强酸 强碱
(2)一元弱酸(碱)溶液PH 计算
1、计算时要先判断环境是酸性还是碱性。
2、像硫酸这种第一步解离完全,第二步不完全解离的不满足上式,但与上式的推导过程类似,应用质子守恒列方程,[OH -
]太小,忽略。
(3)多元弱酸(碱)溶液 一般都按二元酸处理,Ka 太小省略掉。
(4)两性物质溶液pH的计算
①酸式盐,eg:NaHA
②弱酸弱碱盐(1:1型),eg:CH2ClCOONH4(CH2ClCOOH→Ka,NH3→Ka')
(非1:1),eg:(NH4)2CO3 (1、溶液弱碱性,H2CO3、H+可忽略,只要是c不是很小,
Kw也可忽略) [][]3
3
NH
HCO≈
-→c
c
NH
HCO
2
3
3
⋅
=
⋅-δ
δ
(5)混合溶液
①两种弱酸:[]22
1
1
c
Ka
c
Ka
H⋅
+
⋅
=
+
②一种强酸和一种弱酸:类似硫酸的酸性计算,列出质子守恒,用分布分数求解。
③一种弱碱和一种弱酸:[]
碱
酸
c
c
Ka
Ka
H
2
1
⋅
=
+
(6)缓冲溶液(弱酸HA浓度c1,共轭碱A-浓度c2)※标准缓冲溶液要考虑离子强
度。
四、缓冲溶液的缓冲容量
五、酸碱滴定基本原理 强酸(碱)滴弱碱(酸)
多元弱酸(碱)和混合酸(碱)的滴定
六、终点误差公式(以NaOH 滴定酸为例)。
