2004年华东理工大学物理化学考研试题
物理化学__华东理工大学(9)--《物理化学》(上)考试试卷及答案(A)
四、(14 分) 20℃时,HCl 气体溶于苯中形成理想稀溶液。
(1)当达气液平衡时,若液相中 HCl 的摩尔分数为 0.0385,气相中苯的摩尔分数为 0.095。试求气相 总压。(7 分)
(2)当达气液平衡时,若液相中 HCl 的摩尔分数为 0.0278。试求气相中 HCl 气体的分压。(7 分) 已知 20℃时纯苯的饱和蒸气压为 10010Pa。
D.
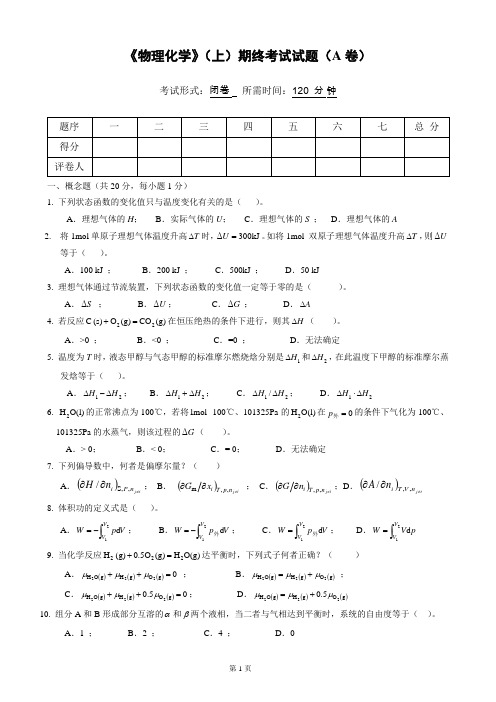
K 1
(K
2
)0.5
=1
二、(15 分) 以 25℃的 1mol CH4 (g) 和 4mol H2O(l) 为原料,在恒定压力下进行如下化学反应: CH4 (g) + H2O(g) → CO(g) + 3H2 (g)
第2页
若 CH4 的转化率为 50%,终态温度为 700℃,试求整个过程的热量。设气体服从理想气体状态方程,各物
相化合物之间彼此完全不互溶,则在 A 和 B 完整的液固平衡相图中最低共熔点有( )个。
A. 2 ; B. 3 ; C. 4;
D.5
17. 对于正偏差系统,下列正确的说法是( )。
A. pi < pi*xi ;
B.正偏差强烈时,可形成最高恒沸混合物 ;
C. pi = pi*xi ;
D.正偏差强烈时,可形成最低恒沸混合物
8. 体积功的定义式是( )。
∫ A.W
=−
V2
pdV
;
V1
∫ B.W = − V2 p外dV ; V1
∫ C.W = V2 p外dV ; V1
∫ D.W =
V2
Vd p
V1
9. 当化学反应 H2 (g) + 0.5O2 (g) = H2O(g) 达平衡时,下列式子何者正确?(
2004年华工考研物化试题及答案(理科)

华南理工大学2004年攻读硕士学位研究生入学考试试卷(329)参考答案科目名称:物理化学(化)适用专业:无机化学、分析化学、物理化学、环境科学说明:本答案由葛华才老师完成,试题做了规范化和少量处理,若有不恰当之处特别是错误之处,欢迎用电子邮件方式告知葛老师本人(邮箱:**************)。
一. 2 mol 乙醇在正常沸点(78.4℃)下,变为蒸汽,其摩尔汽化焓为41.50kJ . mol-1,乙醇蒸汽可视为理想气体。
(1)试求该相变过程的Q,W,△U,△S,△A,△G。
(2)若乙醇摩尔汽化焓可认为与温度无关时,那么50℃时乙醇的饱和蒸汽压应为多少?(3)当2mol乙醇蒸汽在101325Pa下,从78.4℃升温至100℃时,△H,△S各为多少?(已知C p,m(C2H5OH,g)=65.44 J . mol-1 . K-1)。
(本题15分)解:(1) Q p=∆H=n ∆vap H m= 2mol×41.50kJ . mol-1= 83.00 kJW= -p∆V= -pV g= -nRT= -[2×8.315×(273.15+78.4)] J =5846J∆U=Q+W= 83.00kJ+5.846kJ=88.85kJ∆S=Q/T= 83000J/(273.15+78.4)K=236.1J . K-1∆G=0 (可逆相变)∆A=∆U-T∆S=W= 5846J(2) 已知T=351.55K,p=101.325kPa,蒸发焓∆vap H m= 41.50kJ . mol-1,利用克-克方程可求T’=323.15K时的蒸气压p’:ln(p’/101.325kPa)=-(41500/8.315)[(1/323.15)-(1/351.55)]p’=28.10kPa(3) 乙醇蒸汽C p,m与温度无关,△H=nC p,m△T=(2×65.44×21.6)J = 2827J△S = nC p,m ln(T2/T1)=[2×65.44×ln(373.15/351.55)]J . K-1 = 7.804J . K-1二. 已知在298K,100 kPa下,反应:C2H4 (g)+H2O (l)==C2H5OH (l)数据如下:(C2H4(g)视为理想气体)C2H4 (g) H2O (l) C2H5OH (l) △f H mθ/kJ . mol-152.26 -285.83 -277.7S m θ/J . mol -1 . K -1219.6 69.91 161 C p ,m /J . mol -1 . K -1 43.56 75.291 111.5(1) 试求在298K 下,反应的标准平衡常数K θ。
华东理工大学(已有10试题)

华东理工大学化工学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999网络与数据库2003——2006自动控制原理1998控制原理2000——2007运筹学2000——2006高分子化学和物理1998——2007有机化学(含实验)1996——2007硅酸盐物理化学(含实验)1998——2007细胞生物学(含细胞遗传学)2000——2005化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007催化原理2000高分子材料成型加工2004工业水处理2000计算主意2000,2003化学与分子工程学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)综合化学1998——2006有机化学(含实验)1996——2007化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999普通生物化学1996——2004第1 页/共9 页生物化学1996——2002,2005——2007,2010(2010为回忆版)化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007无机化学1998——2004,2007催化原理2000高分子材料成型加工2004工业水处理2000计算主意2000,2003生物工程学院微生物学1996——2007普通生物化学1996——2004生物化学1996——2002,2005——2007,2010(2010为回忆版)综合化学1998——2006化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999食品工艺学2000——2006化学与生物综合2007化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998,2000——2002,2006食品工程2000——2002药物化学2000——2002催化原理2000高分子材料成型加工2004工程经济学2000工业水处理2000计算主意2000,2003机械与动力工程学院机械原理1998——2006机械设计2002——2006机械零件2000——2002机械发明基础2001——2002,2004金属机械性能2002材料力学1998——2007,2010(2010为回忆版)微机技术1997,2000——2004,2006——2007微机原理1998——2007微机原理及接口2002——2006化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999物理化学1991——1992,1994,1996——2007(1997——2003有答案)高分子化学和物理1998——2007理论力学1999——2002自动控制原理1998控制原理2000——2007数据结构与操作系统2007系统软件(含操作系统)1998——2006数据结构与程序设计1996——2002网络与数据库2003——2006计算机应用基础2000——2002泵与压缩机2000——2002工程材料2002——2004工程热力学1996——2004,2007化工容器设计2000——2002金属学2000——2002流体力学(2)2002普通物理2002第3 页/共9 页物理2000宝石学2000催化原理2000高分子材料成型加工2004工程经济学2000工业水处理2000计算主意2000,2003材料科学与工程学院高分子化学和物理1998——2007综合化学1998——2006硅酸盐物理化学(含实验)1998——2007化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999材料科学基础2002——2007物理化学1991——1992,1994,1996——2007(1997——2003有答案)普通生物化学1996——2004生物化学1996——2002,2005——2007,2010(2010为回忆版)化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007宝石学2000高分子材料成型加工2004工程经济学2000工业水处理2000计算主意2000,2003信息科学与工程学院信号与系统(含数字信号处理)2002——2007微机技术1997,2000——2004,2006——2007微机原理1998——2007微机原理及接口2002——2006自动控制原理1998控制原理2000——2007数据结构与操作系统2007系统软件(含操作系统)1998——2006数据结构与程序设计1996——2002网络与数据库2003——2006计算机应用基础2000——2002测量及调节仪表2000——2002模拟电子技术和数字电子技术2000——2002工程经济学2000计算主意2000,2003资源与环境工程学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)环境化学2002——2006化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007传热学2002——2005环境分析与监测2002环境工程(含环境检测)1999——2002煤化学及工艺学2000,2002宝石学2000催化原理2000第5 页/共9 页工程经济学2000工业水处理2000计算主意2000,2003药学院物理化学1991——1992,1994,1996——2007(1997——2003有答案)有机化学(含实验)1996——2007普通生物化学1996——2004生物化学1996——2002,2005——2007,2010(2010为回忆版)药理学1999化学制药与工艺学1999精细化学品化学及精细有机单元反应2000——2002分析化学1998--2002,2007药物化学2000——2002植物保护2004——2006化学与生物综合2007催化原理2000理学院高等代数1996——2002,2004——2007数学分析1996——2007量子力学1998——2001,2003——2006普通物理2002物理2000艺术设计与传媒学院设计基础2002——2007设计史论2004——2007设计史概(含设计史、设计原理)2002——2003命题设计2002商学院经济学及经济学说史2003——2006(2005有答案)经济学说史(含当代经济学流派)1998——2002(2000——2002有答案)西方经济学1998——2002(2000——2002有答案)国际经济学2002——2006管理学原理2000——2007(2000——2005有答案)企业管理1998,2002国际经济学2006运筹学2000——2006会计学2001——2002财务与会计基础2004——2006管理信息系统2000——2001经济管理基础理论2003——2005(2003——2004有答案)化工原理1993——2007,2010(2010为回忆版)化工原理(综)1999数据结构与操作系统2007系统软件(含操作系统)1998——2006数据结构与程序设计1996——2002网络与数据库2003——2006计算机应用基础2000——2002高等代数1996——2002,2004——2007工程经济学2000社会与公共管理学院环境法学2004——2006法学理论综合2005——2006社会学理论与主意2005——2007第7 页/共9 页社会调查研究主意1998,2000——2002社会研究主意2004——2005社会学概论1998——2004西方社会学史1998——2007政治学原理2004——2007政治学概论2005西方政治制度2004——2005西方社会思想史2000公共管理学2007行政管理学2004——2006(2004有答案)公共政策分析2004——2005社会保障与社会学理论2004——2005社会保障理论2006——2007外国语学院二外德语1998——2007二外日语1998——2007二外法语2004,2006——2007基础英语1999——2007(2004有答案)翻译实践(汉英互译)1998——2007汉语(古,现代汉语)和语言学基础(英)2001——2002人文科学研究院马克思主义哲学原理1999——2001,2003——2007哲学综合2007西方哲学史2005——2006政治学原理2004——2007政治学概论2005马克思主义经典原著选读2007马克思主义基本原理2007西方政治思想史2004——2005,2007西方政治制度2004——2005西方社会思想史2000马克思主义发展史1999伦理学原理2005——2006当代社会发展理论2006马克思主义发展史2003马克思主义社会发展理论2001——2002世界近现代史2005世界近代史2004,2006中国近代史2004,2006中国近现代史2005比较政治制度2006中国社会主义建设2002——2003体育系体育经济学2004——2006体育社会学2004——2006高等教诲研究所教诲学专业基础(全国统考试卷)2007教诲学2004——2006(2004有答案)教诲管理学2006教诲哲学2004科技信息研究所信息管理基础2004——2006第9 页/共9 页。
物理化学__华东理工大学(2)--单元测试卷

第二章 热力学定律和热力学基本方程单元测试卷一、选择题(每小题1分,共30分)1. 下列叙述不正确的是 。
A :不可逆过程发生的实质都归结于能量品位的降低;B :凡是不违背能量守恒原理的过程都能发生;C :一个不可能进行的过程假设已经进行,必将使能量的品位升高2. 在800K 的高温热源和300K 的低温热源之间运转的热机,当其从高温热源吸收800kJ 的热量并对外做功时,则热机至少需将 kJ 的热量传给低温热源。
A :300;B :400;C :5003. 从熵的统计意义可判断下列过程的熵变S ∆大于零的是 。
A :苯乙烯聚合成聚苯乙烯;B :气体在催化剂上吸附;C :液态苯汽化成气态苯4. 下列说法中不正确的是 。
A :可逆绝热过程的ΔS 总是等于零;B :不可逆绝热过程的ΔS 总是大于零;C :不可逆绝热过程的ΔS 总是小于零5.绝热不可逆过程中,系统(Sys )与环境(Sur )的熵变,正确的是 。
A :Sys Sur Δ0,Δ0S S ==;B :Sys Sur Δ0,Δ0S S >=;C :Sys Sur Δ0,Δ0S S =< 6. 在一绝热恒容的系统中发生了一个爆炸反应,系统的温度和压力都升高了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>=;B :Δ0,Δ0,Δ0U H S =>>;C :Δ0,Δ0,Δ0U H S ==>7. 一化学反应在恒压绝热的条件下发生(W /=0),反应系统的温度升高且体积增加了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>>;B :Δ0,Δ0,Δ0U H S >=>;C :Δ0,Δ0,Δ0U H S <=>8. 恒温恒容条件下进行某化学反应,其1135kJ mol A −∆=−⋅,以下不正确的是 。
A :理论上最多可对外做135kJ 的非体积功;B :要使化学反应逆向进行,则外界至少需提供135kJ 的非体积功;C :理论上至少可对外做135kJ 的非体积功9. 关于吉布斯函数G ,下列说法中正确的是 。
物理化学__华东理工大学(1)--单元测试卷

。
A:临界温度;B:沸点;C:摩尔体积
10. 为使纯物质气体经恒温压缩而液化,其温度必须低于它的
温度。
A:冰点; B:三相点; C:临界
11. 在一定温度和压力下求解范德华方程,得到三个摩尔体积的值:0.0523、0.2534 和 2.9523
m3 ⋅ mol−1 ,其中饱和液体的摩尔体积为
。
A: 0.0523 m3 ⋅ mol−1 ;B: 0.2534 m3 ⋅ mol−1 ;C: 2.9523 m3 ⋅ mol−1
5. 压力趋近于零时,物质在任何温度下的压缩因子都趋近于
。
A: 1; B:0; C:无法确定
6. 对于实际气体的压缩因子,以下错误的说法是
。
A:压缩因子是温度和压力的函数;
B:压缩因子仅是压力的函数;
C:压力一定时,压缩因子是温度的函数
7. 考察压力接近于零时 Z 随 p 变化的斜率(∂Z/∂p)T,p→0,发现低温时<0,高温时>0,其间必有
一温度使(∂Z/∂p)T,p→0=0,这一温度称为
。
A:波义耳温度;B:临界温度;C:沸点
8. 某气体的状态方程为 pVm=A+Bp+Cp2+…,其中 A, B,C 等均是温度的函数,则在 400K
时,A 的值等于
。
A:3325.6;B:4325.6;C:无法确定
9. 当压力发生变化时,物质的性质不发生变化的是
试求反应 0.5H2 (g) + 0.5I2 (g) → HI (g) 在 225 °C 时的恒压热效应 Qp 和恒容热效应
QV
。已知
25
°C
时
∆f
H
m
华东理工大学华东理工大学年考研真题考研试题

华东理工大学
说明:以下2007年试卷单科每年10元,其他年份的试卷单科每年5元。
化工学院
物理化学1991——1992,1996——2007(1998——2003有答案)
化工原理1993——2007
化工原理(综)1999
网络与数据库2003——2006
自动控制原理1998
控制原理2000——2007
运筹学2001——2006
高分子化学和物理1998——2007
有机化学(含试验)1998——2006
硅酸盐物理化学(含试验)1998——2007
细胞生物学(含细胞遗传学)2000——2005
化学制药与工艺学1999
精细化学品化学及精细有机单元反应2000——2002
分析化学1998,2000——2002,2007
化学与分子工程学院
物理化学1991——1992,1996——2007(1998——2003有答案)
综合化学1998——2006
有机化学(含试验)1998——2007
化工原理1993——2007
化工原理(综)1999
普通生物化学1999——2004
生物化学1998——2002,2005——2007
化学制药与工艺学1999
精细化学品化学及精细有机单元反应2000——2002
分析化学1998,2000——2002,2007
无机化学2000——2002,2007
生物工程学院
微生物学1998——2007
普通生物化学1999——2004
生物化学1998——2002,2005——2007
综合化学1998——2006
化工原理1993——2007
化工原理(综)1999。
物理化学__华东理工大学(10)--《物理化学》(上)考试试卷及答案(B)

五、(12 分)
温度 T 时纯物质 A 和 B 的饱和蒸气压分别为 100kPa 和 200kPa。现有 A 与 B 组成的二元溶液在该温 度下达到气液平衡,平衡液相浓度 xB = 0.1,气相可视为理想气体。
(1)设 A 与 B 的二元溶液为理想溶液,试求平衡时的气相组成 yB 及蒸气总压 p 。(6 分) (2)若实验测得平衡时的气相总压为 123kPa,B 在气相的分压为 24 kPa,试按照选取参考状态的惯例 I,求 A 和 B 的活度因子。(6 分)
6. 理想气体经过节流装置后,其 ∆U = 0 , ∆H = 0 。
(对、错)
7. 实际气体经过节流装置后,哪个热力学函数的变化值为零?
8. 封闭系统在
条件下进行一个过程,其 ∆U = QV 。
9. 将 25 ℃100g 液态水变为 25 ℃100g 饱和水蒸气,其 ∆G =
。
10. 写出克劳修斯不等式
yB
=
pB p
=
200 × 0.1 = 0.182 110
(2) aB
=
pB pB*
=
24 200
= 0.12
aA
=
pA pA*
= 123 − 24 100
= 0.99
γB
=
aB xB
=
0.12 0.1
= 1.2
γA
=
aA xA
= 0.99 1 − 0.1
= 1.1
六、解:
(1) 1.L; 2.L1+L2; 3.SA+L 4.SC+L; 5.SC+L; 6.SC+ SA; 7.SC+ SB;8.L + SB (2)
2004考研物化试卷2 华南理工

华南理工大学2004年攻读硕士学位研究生入学考试试卷(452)参考答案科目名称:物理化学适用专业:材料物理与化学、化学工程、化学工艺、生物化工、工业催化、生物医学工程、应用化学、环境工程说明:本答案由葛华才老师完成,试题做了规范化和少量处理,若有不恰当之处特别是错误之处,欢迎用电子邮件方式告知葛老师本人(邮箱:ge1963@)。
1. 始态为25℃常压下的10克固体萘(C10H8)置于含足够氧的弹式量热计中燃烧,最终产物为25℃的CO2及液体水,过程放热400.911kJ。
试求此过程的焓变ΔH.(10分) 解:弹式量热计燃烧过程C10H8(s)+ 12O2(g) = 10CO2(g) + 4H2O(l)是恒容过程,故∆U=Q V= -400.911kJ∆H= ∆U+∆pV= ∆U+∆n(g)RT= -400.911kJ+[(-2)×(10g/128g)×8.315×298.15]×10-3kJ=-404.785kJ2. 在绝热系统中将273K、1mol的水和373K、lmol的水混合,试计算此过程的熵变ΔS。
设在此温度范围水的等压摩尔热容量为75J . K-1 . mol-1。
(10分)解:整个系统过程为恒压绝热过程,设终态温度为T,则Q p=∆H=1mol×C p(T-273K)+ 1mol×C p(T-373K)=0解得T=323K过程熵变∆S=∆S(冷水)+∆S(热水)=1mol×75J . K-1 . mol-1×ln(323/273)+ 1mol×75J . K-1 . mol-1×ln(323/373)=1.819 J . K-13. 已知反应A (g) = 2B(g) 在298K时△r G mθ=4.75kJ•mol-1, 试求:(1) 反应开始只有A,在298K 、100kPa下A (g)的离解度?(2) 当温度不变,总压增至1000kPa,A (g)的离解度?(3) 反应开始时原料气中A (g) 与惰性气体的摩尔比为1:2,在298K 、100kPa下A (g)的离解度?(4) 解释(2)、(3)的计算结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华东理工大学2004年硕士研究生入学考试试题
一、(24分)
1、气体A 的临界温度高于气体B 的临界温度,则气体A 比气体B __液化。
(难、易)
2、某实际气体的温度低于其玻义耳温度,在压力较小时pV __n RT .(>,=,<)
3、对于封闭系统,在恒压和只做体积功的条件下Q p =H ∆,由于焓是状态函数,所以Q p 也是状态函数,__(对,错)
4、如图所示,一过程沿路径(1)由a 膨胀到b ,然后沿路径(2)由b 压缩到c ,试在图上用阴影表示出整个过程所做的功. 图
5、系统经一个绝热不可逆过程从初态到达终态,其ΔS ____0(>,=,<)
6、理想稀溶液中溶剂A 的化学势表达式为μA =_______________________.
7、在式r m G ∆ = -RT ln K 中,r m G ∆ 是化学反应达到平衡时的摩尔吉氏函数的变
化值,_______________(对、错)
8、在水中加入少量肥皂,所得溶液的表面张力___________同温度下纯水的表面张力.(>,=,<)
9、表面张力在数值上等于恒温恒压条件下系统增加单位表面积时环境对系统所做的可逆非体积功._________(对、错)
10、当温度趋于0K 时,子配分函数q 0的值趋于___________。
11、随着粒子数增大,ln Ωmax 与ln Ω的差别越来越_________。
(大,小)
12、某化合物能与水作用,若它的初浓度为1mol ⋅dm 3-,1小时后降为0.8 mol ⋅dm 3-,2小时后降为0.6 mol/dm 3-,则此反应的反应级数为__________。
13、反应A+3B→2Y 的速率方程为2A A A B
dc k c c dt -=,当,0,0A B c c =1/3时可简化为 3A A dc k c dt
'-=,则
k '=_____k A 。
14、电解质溶液是靠离子的定向迁移和电极反应导电。
________(对、错)
15、电池Pt | H 2(g ,p 1)| HCl(aq )| Cl 2(g ,p 2)|Pt 的电池反应可写成: H 2( g ,p 1)+ Cl 2(g ,p 2)→2 HCl(aq )、E 1或1/2 H 2( g,p 1)+1/2 Cl 2(g,p 2)→ HCl(aq )、E 2 则电池反应的电势E 1与E 2的关系为_________.
16、一原电池的电池反应为2Br -+ Cl 2(p )===Br 2(l)+2Cl -,则此原电池的表示式为_____________。
二、(15分)
(1) 25℃时C 2H 4(g)的
c m
H ∆ =-1411.0kJ ⋅mol -1;2CO (g)的f m H ∆ =-393.5 kJ ⋅mol -1,H 2O(l)的
f m
H ∆ =-285.8 kJ ⋅mol -1,试求C 2H 4(g)的f m H ∆ . (2)已知25℃时乙醇C 2H 5OH(l )的标准摩尔生成焓f m H ∆ (C 2H 5OH ,l )=-277.69
kJ ⋅mol -1,标准摩尔燃烧焓c m H ∆ (C 2H 5OH ,l )=-1366.8 kJ ⋅mol -1,二甲醚(CH 3)2O(g)的标准摩尔生成焓f m H ∆ [(CH 3)2O ,g ]=-184.1kJ/mol 。
求25℃二
甲醚的标准摩尔燃烧焓c m H ∆ [(CH 3)2O,g ]
三、(13分)
由4mol A 和2mol B 形成的理想气体混合物。
从300K 、600kPa 的初态,经绝热可逆膨胀至100kPa 的终态.试求终态温度及总的熵变ΔS 。
已知A 和B 气体的定容摩尔热容分别为1.5R 和2.5R
四、(12分 )
根据图(a)和图(b)回答下列问题
图A 图B
(1).指出图(a)中,K 点所代表的系统的总组成______、平衡液相的组成________、平衡气相的组成________。
(2).将组成x (CH 3OH)=0.33的溶液进行一次简单蒸馏(即加热到85℃停止蒸馏),则馏出液的组成为______、残液的组成为______、通过这样一次简单蒸馏能否将甲醇与水完全分开?____
(3).将(2)所得的馏出液再重新加热到78℃,问所得的馏出液的组成是多少?_______与(2)中所得的馏出液相比甲醇含量是高了还是低了?_______
(4).将(2)所得的残液再次加热到91℃,则所得的残液的组成为_________,与
(2)中所得的残液相比甲醇含量是高了还是低了?_______
(5).欲将甲醇水溶液的组分完全分离,应采取什么分离操作?____________
五、(16分)
对于Sn-Mg 固相完全不互溶并且生成化合物的系统,由冷却曲线得到下表中的实验数据(x 为摩尔分数)
(2).写出生成的化合物的分子式:
(3).在相图上标明各相区的相态。
六、(13分)
催化反应 A(g )=== Y(g )+Z(g )在633K 进行时,已知f m H ∆ ,m S 和298K 至633K
之间的平均,,p m B C
(2).随温度升高该反应的K 是增大还是减小?
七、(24分)
1、已知反应A+B+C −→−M Y+2Z, M 为催化剂,其反应机理为:
① A + B 11
k k -−−→←−− F (快) ② F + M 2k −−
→G + Z (慢) ③ G + C 3k −−
→Y + Z + M (快) 试求:(1)Y 的生成速率d c Y /d t ;
(2)复合反应的活化能E 与各步反应活化能E 1, E 2, E 3的关系
2、乙醛在518℃时的分解反应CH 3CHO(g )→CH 4(g )+CO(g )为二级反应,已知反应时间t 与恒容条件下系统总压的关系如下:
试求该反应的速率系数与半衰期,t =0时只有CH 3CHO(g )。
八(9分)
雾的粒子质量约为1×1012-g ,试求20℃时其饱和蒸气压与平面水的饱和蒸气压之比。
已知20℃时H 2O(l )的表面张力为72.75×103-N ⋅m 1-,密度为0.9982g ⋅cm -3,摩尔质量为18.02g ⋅mol -1。
九、(24分)
1、计算下列浓差电池反应的电势E (298K)及浓差电池(2)的电池反应的电势
E (350K)
(1)Na-Hg(a 1=0.1)|NaCl(b=0.1mol ⋅kg -1)|Na-Hg(a 2=0.01);
(2)Pt ,H 2(p 1=0.1p )|HCl(b=0.1 mol ⋅kg -1)|H 2(p 2=0.01 p ),Pt
2、德拜-休克尔极限公式 ln ±γ=Az +z_I 的适用条件是什么?试用该公式计算25℃时0.001mol ⋅kg -1的K 3Fe(CN)6水溶液的离子平均活度因子。
溶剂为水,25℃时A=1.1709 mol -1/2kg 1/2。
