材料科学基础——晶体结构2
上海交大-材料科学基础-第二章-2

体心立方八面体间隙
体心立方四面体间隙
八面体间隙: 由一个面上四个角和相邻两个晶胞体心共6个原子围成, 位置: 位于晶胞每个面中心和每个棱边的中点;
➢数目:12/4 + 6/2 = 6 ➢大小rB:
4R 3a a 4 R
3
rB 2a/2 - R 0.633R 110
a / 2 - R 0.154R 001
n个。
4)空隙大小 四面体间隙大小:r=0.225R 八面体间隙大小:r=0.414R
n个球作体心立方堆积时,存在3n个八 面体空隙、6n个四面体空隙,空隙较多。
2.2.2 多晶型性
多晶型性指某些金属在不同温度和压力下具有 不同的晶体结构。
多晶型性转变指金属在外部条件 (如 T 和 P) 改变时,其内部从一种晶体结构向另一种晶体结构 的转变,又称同素异构(同素异性)转变,转变的 产物称为同素异构体 例如纯铁:
2R a
rB
3 4
a2 ( 2 a(sin60o ))2 -R 0.225R 3
密排六方晶格八面体间隙
密排六方晶格四面体间隙
空隙分布
每个球周围有8个 四面体空隙;
每个球周围有6个 八面体空隙
空隙数量
n个等径球最紧密堆积时,整个系统四面体空
隙数为
8n 4
2n个,八面体空隙数为
6n 6
✓ 晶粒:组成晶体的结晶颗粒。 ✓ 多晶体:凡由两颗以上晶粒组成的晶体一般金属都
是多晶体。。
晶粒
多相合金
本节的基本要求
需掌握如下的概念和术语: ▪ 各向异性、多晶型性,配位数、致密度 ▪ 三种典型晶体结构的特征(包括:原子的排
列方式、点阵参数、晶胞原子数、原子半径、 配位数、致密度、各类间隙尺寸与个数,最 密排面(滑移面)和最密排方向的指数,堆 垛)。 ▪ 多晶体与单晶体、晶粒、晶界;
材料科学基础第2章
可编辑ppt
10
2.3.1 固溶体
固溶体(solid solution) :
合金组元通过溶解形成一种成分和性能均匀的、 且结构与组元之一相同的固相称为固溶体。
➢ 固溶体的最大特点是保持溶剂的晶体结构。
➢ 与固溶体晶格相同的组元为溶剂,一般在合金中 含量较多;另一组元为溶质,含量较少。
✓ 各向异性:由于在不同方向上的原子排列的紧密程 度不同使晶体在不同方向上的物理、化学和力学性 能不同。而一般整个晶体不显示各向异性,称为伪 等向性。
✓ 晶粒:组成晶体的结晶颗粒。 ✓ 多晶体:凡由两颗以上晶粒组成的晶体一般金属都
是多晶体。。
可编辑ppt
4
晶粒
可编辑ppt
5
Байду номын сангаас
多相合金
可编辑ppt
6
可编辑ppt
12
(3)按溶质原子在溶剂中的分布特点分类 无序固溶体:溶质原子在溶剂中任意分布, 无规律性。
有序固溶体:溶质原子按一定比例和有规 律分布在溶剂晶格的点阵或间隙里。
(4)按基体类型分类: 一次固溶体:以纯金属为基形成的固溶体。
二次固溶体:以化合物为基形成的固溶体。
可编辑ppt
13
固溶体的两种类型(置换和间隙)
中间相可以用分子式来大致表示其组成。
合金相的性质由以下三个因素控制: (1)电化学因素(电负性或化学亲和力因素)
电负性—化学亲和力越大越容易形成化合物,电负性 相近的元素容易形成固溶体。
(2)原子尺寸因素 △r=(rA-rB)/rA △r越大,越易形 成中间相。 △r越小,越易形成固溶体
(3)原子价因素(电子浓度因素): C电子=[A(100-x) +Bx]/100 C越大,越易形成
无机材料科学基础___第二章晶体结构

第 2 章结晶结构一、名词解释1.晶体:晶体是内部质点在三维空间内周期性重复排列,具有格子构造的固体2.空间点阵与晶胞:空间点阵是几何点在三维空间内周期性的重复排列晶胞:反应晶体周期性和对称性的最小单元3.配位数与配位多面体:化合物中中心原子周围的配位原子个数成配位关系的原子或离子连线所构成的几何多面体4.离子极化:在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象5.同质多晶与类质同晶:同一物质在不同的热力学条件下具有不同的晶体结构化学成分相类似物质的在相同的热力学条件下具有相同的晶体结构6.正尖晶石与反尖晶石:正尖晶石是指2价阳离子全部填充于四面体空隙中,3价阳离子全部填充于八面体空隙中。
反尖晶石是指2价阳离子全部填充于八面体空隙中,3价阳离子一半填充于八面体空隙中,一半填充于四面体空隙。
二、填空与选择1.晶体的基本性质有五种:对称性,异相性,均一性,自限性和稳定性(最小内能性)。
2.空间点阵是由 C 在空间作有规律的重复排列。
( A 原子 B离子 C几何点 D分子)3.在等大球体的最紧密堆积中有面心立方密堆积和六方密堆积二种排列方式,前者的堆积方式是以(111)面进行堆积,后者的堆积方式是以(001)面进行堆积。
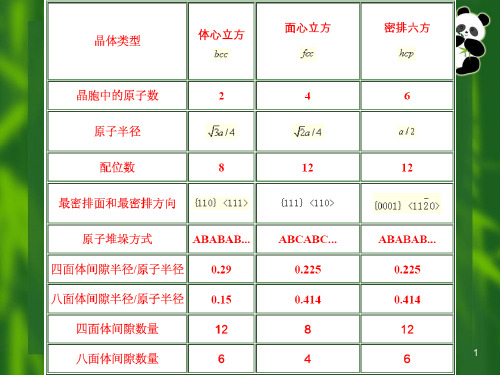
4.如晶体按立方紧密堆积,单位晶胞中原子的个数为 4 ,八面体空隙数为 4 ,四面体空隙数为 8 ;如按六方紧密堆积,单位晶胞中原子的个数为 6 ,八面体空隙数为6 ,四面体空隙数为 12 ;如按体心立方近似密堆积,单位晶胞中原子的个数为 2 ,八面体空隙数为 12 ,四面体空隙数为 6 。
5.等径球体最紧密堆积的空隙有两种:四面体空隙和八面体空隙。
一个球的周围有 8个四面体空隙、 6 个八面体空隙;n个等径球体做最紧密堆积时可形成 2n 个四面体空隙、 n 个八面体空隙。
不等径球体进行堆积时,大球做最紧密堆积或近似密堆积,小球填充于空隙中。
6.在离子晶体中,配置于正离子周围的负离子数(即负离子配位数),决定于正、负离子半径比(r +/r -)。
材料科学基础第二章

y
[111]
x
[111]
例:画出晶向
[112 ]
2.立方晶系晶面指数
晶面指数的确定方法
(a)建立坐标系,结点为原点, 三棱为方向,点阵常数为单位 (原点在标定面以外,可以采 用平移法); (b)晶面在三个坐标上的截距a1 a2 a3 ; (c)计算其倒数 b1 b2 b3 ; (d)化成最小、整数比h:k:l ; 放在圆方括号(hkl),不加逗号, 负号记在上方 。
3.六方晶系晶面和晶向指数
三指数表示六方晶系晶面和晶向的缺点:晶体学上等价的 晶面和晶向不具有类似的指数。 例:
晶面指数
(11 0)
(100)
[010] [100]
从晶面指数上不能明确表示等同晶面,为了克服这一缺点, 采用a1、a2、a3及c四个晶轴, a1、a2、a3之间的夹角均 为120º ,晶面指数以(hkil)表示。 根据立体几何,在三维空间中独立的坐标轴不会超过三 个可证明 : i= - (h+k) 或 h+k+i=0
六方晶系
d hkl
h k l a b c
2 2 2
d hkl
a h2 k 2 l 2
1 l c
2
4 h 2 hk k 2 3 a2
注:以上公式是针对简单晶胞而言的,如为复杂晶胞, 例如体心、面心,在计算时应考虑晶面层数增加的影 响,如体心立方、面心立方、上下底(001)之间还有 一层同类型晶面,实际
[1 00 ]
[0 1 0]
[010]
[1 00]
y
[100]
x
[00 1]
材料科学基础,第2章,材料中的晶体结构

晶面间距与晶面指数的关系: 晶面间距是现代测试中一个重要的
参数。在简单点阵中,通过晶面指数 (hkl)可以方便地计算出相互平行的一 组晶面之间的距离d。
晶系 晶面间距
立方
1 h2 k 2 l2
d2
a2
正方
1
h2 k2
l2
d2
a2
c2
六方
( ) 1
4 h2 hk k 2
l2
d2
3
a2
c2
1.晶面、晶向及其表征
1)晶面 (1)定义:晶体点阵在任何方向上可分
解为相互平行的结点平面,称为晶面。 (2)特征: 晶面上的结点在空间构成一个二维点阵。 同一取向上的晶面,不仅相互平行、间
距相等,而且结点的分布也相同。 不同取向的结点平面其特征各异。
(3)晶面指数:
结晶学中经常用(hkl)来表示一组平 行晶面,称为晶面指数。
不同方向的直线组,其质点分布不尽相同。
(3)晶向指数: 用[uvw]来表示。 其 中 u 、 v 、 w 三 个 数 字 是 晶 向 矢 量
在参考坐标系X、Y、Z轴上的矢量 分量经等比例化简而得出。
晶向指数求法:
①确定坐标系; ②过坐标原点,作直线与待求晶向
平行; ③在该直线上任取一点,并确定该
{110}晶面族
Z
(011)
(110) (011) (101)
(101)
Y (110)
X
2)晶向:
(1)定义:
点阵可在任何方向上分解为相互平行的直线组, 结点等距离地分布在直线上。位于一条直线上 的结点构成一个晶向。
(2)特征:
同一直线组中的各直线,其结点分布完全相同, 故其中任何一直线,可作为直线组的代表。
陆佩文材料科学基础 名词解释 -课后

第二章晶体结构2.1名词解释晶体由原子(或离子分子等)在空间作周期性排列所构成的固态物质晶胞是能够反应晶体结构特征的最小单位, 晶体可看成晶胞的无间隙堆垛而成。
晶体结构中的平行六面体单位点阵(空间点阵) 一系列在三维空间按周期性排列的几何点.对称:物体相同部分作有规律的重复。
对称型:晶体结构中所有点对称要素(对称面、对称中心、对称轴和旋转反伸轴)的集合,又叫点群.空间群:是指一个晶体结构中所有对称要素的集合布拉菲格子把基元以相同的方式放置在每个格点上,就得到实际的晶体结构。
基元只有一个原子的晶格称为布拉菲格子。
范德华健分子间由于色散、诱导、取向作用而产生的吸引力的总和配位数:晶体结构中任一原子周围最近邻且等距离的原子数.2.2试从晶体结构的周期性论述晶体点阵结构不可能有5次和大于6次的旋转对称?2.3金属Ni具有立方最紧密堆积的结构试问: I一个晶胞中有几个Ni原子? II 若已知Ni原子的半径为0.125nm,其晶胞边长为多少?2.4金属铝属立方晶系,其边长为0.405nm,假定其质量密度为2.7g/m3试确定其晶胞的布拉维格子类型2.5某晶体具有四方结构,其晶胞参数为a=b,c=a/2,若一晶面在x y z轴上的截距分别为2a 3b 6c,试着给出该晶面的密勒指数。
2.6试着画出立方晶体结构中的下列晶面(001)(110)(111)并分别标出下列晶向[210] [111] [101].2.14氯化铯(CsCl)晶体属于简立方结构,假设Cs+和Cl-沿立方对角线接触,且Cs+的半径为0.170nm Cl-的半径为0.181nm,试计算氯化铯晶体结构中离子的堆积密度,并结合紧密堆积结构的堆积密度对其堆积特点进行讨论。
2.15氧化锂(Li2O)的晶体结构可看成由O2-按照面心立方密堆,Li+占据其四面体空隙中,若Li+半径为0.074nm,O2-半径为0.140nm试计算I Li2O的晶胞常数 II O2-密堆积所形成的空隙能容纳阳正离子的最大半径是多少。
大学材料科学基础第二章材料中的晶体结构
4.晶面间距(Interplanar crystal spacing)
两相邻近平行晶面间的垂直距离—晶面间 距,用dhkl表示,面间距计算公式见(1-6)。 通常,低指数的面间 距较大,而高指数的 晶面间距则较小 晶面间距愈大,该晶 面上的原子排列愈密 集;晶面间距愈小, 该晶面上的原子排列 愈稀疏。
晶体结构 = 空间点阵 + 结构单元
如:Cu, NaCl, CaF2有不同的晶体结构, 但都属于面心立方点阵。 思考题:空间点阵与布拉菲点阵。
三、 晶向指数与晶面指数
(Miller Indices of Crystallographic Directions and Planes) 在晶体中,由一系列原子所组成的平面称 为晶面,原子在空间排列的方向称为晶向。 晶体的许多性能都与晶体中的特定晶面和晶 向有密切关系。为区分不同的晶面和晶向, 采用晶面和晶向指数来标定。
5.晶带 (Crystal zone) 所有平行或相交于同一直线的晶面构 成一个晶带,此直线称为晶带轴。
晶带轴[u v w]与该晶带的晶面(h k l) 之间存在以下关系: hu + kv + lw = 0 凡满足此关系的晶面都属于以[u v w]为 晶带轴的晶带,律应用举例
1 晶胞中原子数 (Number of Atoms in Unit Cell)
一个晶胞内所包含的原子数目。 体心立方晶胞:2个。 面心立方晶胞:4个。 密排六方晶胞:6个。
2 原子半径 r 与点阵常数 a 的关系
严格的说,原子半径并不是一个常数,它 随外界条件(温度)、原子结合键、配位数而 变,在理论上还不能精确地计算原子半径。 定义为晶胞中原子密排方向上相邻两原子 之间平衡距离的一半,用点阵常数表示。
材料科学基础2
3) 异类原子 在一种类型的原子组成 的晶格中,不同种类的原子替换原 有的原子占有其应有的位置。
第7页/共32页
二、点缺陷的形成
弗仑克耳缺陷:原子离开平衡位置进入间隙,形成等量的空 位和间隙原子。 肖特基缺陷:只形成空位不形成间隙原子。(构成新的晶面)
3. 面缺陷 在三维空间的两个方向上的尺寸很大(晶 粒数量级),另外一个方向上的尺寸很小(原子尺 寸大小)的晶体缺陷。
第6页/共32页
第二节 点缺陷
点缺陷:在三维空间各方向上尺寸都很小,在原子尺寸大小
的晶体缺陷。
一、点缺陷的类型 :
1) 空位 在晶格结点位置应有原子的 地方空缺,这种缺陷称为“空位”。
第15页/共32页
第一节 材料的实际晶体结构
一、多晶体结构
单晶体: 一块晶体材料,其内部
的晶体位向完全一致时,即 整个材料是一个晶体,这块 晶体就称之为“单晶体”, 实用材料中如半导体集成电 路用的单晶硅、专门制造的 金须和其他一些供研究用的 材料。
第1页/共32页
第一节 材料的实际晶体结构
一、多晶体结构
多晶体:
实际应用的工程材料 中,那怕是一块尺寸很小 材料,绝大多数包含着许 许多多的小晶体,每个小 晶体的内部,晶格位向是 均匀一致的,而各个小晶 体之间,彼此的位向却不 相同。称这种由多个小晶 体组成的晶体结构称之为 “多晶体”。
过饱和空位 晶体中含点缺陷的数目明显超过平衡 值。如高温下停留平衡时晶体中存在一平衡空位, 快速冷却到一较低的温度,晶体中的空位来不及移 出晶体,就会造成晶体中的空位浓度超过这时的平 衡值。过饱和空位的存在是一非平衡状态,有恢复 到平衡态的热力学趋势,在动力学上要到达平衡态 还要一时间过程。
第二章 晶体结构02概要
和晶核剂,在水泥工业中常用作矿化剂;
TiO2——集成光学棱镜材料; SiO2——光学材料和压电材料。
此外还有层状CdI2和CdCl2型结构,可作固体润滑剂。
AX2型晶体也具有按r+/r-选取结构类型的倾向。 32/107
材料科学基础
第二章 晶体结构
AX2型结构类型与
结构类型
r r
的关系
r r
金红石(TiO2)型
0.414~0.732
TeO2 0.67 MnF2 0.66 PbO2 0.64 FeF2 0.62 CoF2 0.62 ZnF2 0.62 NiF2 0.59 MgF2 0.58 SnO2 0.56 NbO2 0.52 MoO2 0.52 WO2 0.52 OsO2 0.51 IrO2 0.50 RuO2 0.49 TiO2 0.48 VO2 0.46 MnO2 0.39 GeO2 0.36 SiO2 0.29 BeF2 0.27
比值)
r r
0.732
实 例(右边数据为
萤石(CaF2)型
BaF2 PbF2 CaF2 CdF2 HfF2
1.05 0.99 0.80 0.74 0.67
SrF2 0.95 HgF2 0.84 ThO2 0.84 UO2 0.79 CeO2 0.77 PrO2 0.76 ZrO2 0.71 ZrF2 0.67
第五节 无机化合物晶体结构
Crystal Structure of Inorganic Compounds
材料科学基础
1/107
第二章 晶体结构
一、内在因素对晶体结构的影响——化学组成
1、原子和离子半径 质点间相 对距离
•原子半径或离子半径的实质是什么? •原子半径或离子半径是定值吗? •原子半径或离子半径的大小与哪些因素有关? 温度? 压力? 离子的极化? 2/107
材料科学基础第一章晶体结构(二决定离子晶体结构的基本因素)
图1-5 球体在平面上的最紧密堆积
面心立方最紧密堆积和六方最紧密堆积
球体在空间的堆积是按照ABAB……的层序来堆积。 这样的堆积中可以取出一个六方晶胞,称为六方最紧密堆 积,见图1-6 (a) 。
另一种堆积方式是按照ABCABC……的堆积方式。 这样的堆积中可以取出一个面心立方晶胞,称为面心立方 最紧密堆积。面心立方堆积中,ABCABC……重复层面 平行于(111)晶面,见图1-6(b)。
两种最紧密堆积中,每个球体周围同种球体的个数均 为12。
图1-6 (a)ABCABC…层序堆积 (b)ABAB……的层序堆积
—面心立方密堆积
—六方密堆积
两种三层堆叠方式
ABA: 第三层位于第一层 正上方
ABC: 第三层位于一二层间隙
(c) 2003 Brooks/Cole Publishing / Thomson Learning™
晶体结构中正、负离子的配位数的大小由结构中正、 负离子半径的比值来决定,根据几何关系可以计算出正 离子配位数与正、负离子半径比之间的关系,其值列于 表1-3。因此,如果知道了晶体结构是由何种离子构成的, 则从r+/r-比值就可以确定正离子的配位数及其配位多面 体的结构。
anion polyhedron
自身被极化和极化周围其它离子两个作用同时存在,一般只 考虑正离子对负离子的极化作用。
(1)正离子半径较小,电价较高,极化力表现明显,不易 被极化。
(2)负离子则相反,经常表现出被极化的现象,电价小而 半径较大的负离子(如I-,Br-等)尤为显著。
(3)当正离子为18电子构型时,如 Cu+、Ag+,必须考虑 负离子对正离子的极化作用,以及由此产生的诱导偶极矩所引起的 附加极化效应。
极化上升
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
晶体缺陷与晶体强度
缺陷在影响晶体的什么?-重要性
晶体缺陷对结构敏感性能,强度、塑性、电 阻等具有很大的影响,而且与相变、扩散、 塑性变形、再结晶及氧化、烧结等许多物理 冶金问题密切相关。
尽管结构缺陷占的分额很少,但对性能产生 根本的影响,起着关键作用。
牵一发而动全身!敏感因素!-----缺陷
x a
C
2x
b
C
b 2a
2
理论切变强度的估算:
因原子间斥力的短程性, 能量曲线不是正弦形的, 所以上面的估计是过高的, 更合理的值约为G/30。理 论切变强度和切变模量相 差约1个数量级。
晶体力学性能——晶体的非完整性是主要 的,完整性处于次要地位。
位错概念的引入
理论切变强度的估算:
假设能量曲线是正弦形式。 这样,要使原n
2x
b
在弹性变形范围,应力和应 变服从胡克定律:
理论切变强度的估算:
μ是拉梅系数,对各向同 性弹性体,它等于切变模 量G,γ是切应变,可以 近似为x/a,因此:
3.点缺陷对性能的影响
主要影响材料的物理性能
比体积 比热容 电阻率
1.3.3 位错(dislocations)
位错概念引入及位错观察
30年代,在研究晶体滑移时,发现理论屈 服强度和实际强度间有巨大差异,为了解 释这种差异,人们设想晶体中存在某种缺 陷。形变就在这局部缺陷处发生。
晶体结构——规则的完整排列是主要的, 非完整的是次要的。
线缺陷:在两个方向上尺寸很小,而另一个方 向上尺寸较大的缺陷。主要是位错。
面缺陷:在一个方向上尺寸很小,在另外两个 方向上尺寸较大的缺陷。晶界、相界、表面
1.3.2 点缺陷(Point Defect)
1 点缺陷的类型及形成
晶体中的点缺陷包括空位、间隙原子、杂质 或溶质原子以及它们组成的复杂缺陷。
空位
(a) Schottky空位
(b)Frenkel空位
a空位,b空位对,c三空位及空位四面体
b
c
a e
空位邻近原子群向空位所在地移动,形成一个由 几个原子组成的松驰集团,好象局部的熔化区
间隙原子:在点阵间隙位置挤进一个同类原 子,该原子称为间隙原子。
球对称畸变
沿密排方向,n+1原子占据n个原子位置
点缺陷周围的畸变:
往晶体中引入一个空位或一个间隙原子,它们周 围原子离开它们的平衡位置,造成晶格畸变,使 晶体总自由能降低。在无表面应力的均匀的各向 同性弹性体中引入一个强度为C的膨胀中心时, 体积变化△υ为
4cr r 3(1 ) /(1 )
式中σ为泊松(Poisson)比,r为常数,大多数金 属r=1.5
晶体中的原子偏离规则排列的不完整区域, 称为晶体缺陷。
尽管从整个晶体来看,原子(离子,原子团)是规 则排列的,但在微观区域却存在不规则性(缺陷), 这些不规则性对晶体很多物理化学过程以及性能起 着重要作用,它们在这些过程中常常扮演主要角色, 而晶体的规则性只退居为舞台的背景。
概念
点缺陷:在三维空间各方向上尺寸都很小的缺 陷。如空位、间隙原子、异类原子等。
空位在点缺陷中有极重要地位,一方面普遍 存在,另一方面浓度较高,对材料性质有重 大影响。如扩散、蠕变等过程。
间隙原子:在高能辐照条件下有可察觉的数 量。
空位(Vacancy)
从晶体正常点阵位置上抽去一个原子,失去了原 子的位置就是空位。 a. 肖脱基空位(Schottky),离位原子迁移到表面或 晶界而留下空位 b. 弗兰克尔空位(Френкель),离位原子挤入晶体 的间隙位置后而留下空位
引入可观浓度点缺陷的方法
➢ 激冷(从高温淬火) ➢ 多种条件下的范性形变 ➢ 以核粒子辐照损伤晶体 ➢ 冶金过程中的应力迫使原
子偏离结构位置
点缺陷的热力学
﹡点缺陷热力学:晶体中 点缺陷的存在一方面造成 点阵畸变,使晶体内能升 高;另一方面增大了原子 排列的混乱程度,改变了 周围原子的振动频率。使 熵值增大晶体稳定。
点缺陷的形成能:
形成一个点缺陷内能的增加。 ☻空位形成能:从晶体内部取出一个原子 (离子)放到晶体表面所需要的能量。 ☻间隙原子形成能:从晶体表面取出一个 原子,挤进间隙位置所需要的能量。
点缺陷的迁移能:
定义:点缺陷往晶体中运动时必须经过能量的最 高点(即鞍点),超过鞍点所需能量为点缺陷的迁 移能。 迁移方式:空位为直接式,间隙原子有直接式、 间隙式和对分间隙式 热跃迁几率:将点缺陷看作微观粒子,处在热能 谷中,从热涨落获得足够的能量越过势垒进入B。 在势阱A中有n个无交互作用的粒子。 P=B处粒子的流量/A中粒子的总数
a. 体心组态
b. 挤列组态
置换原子:占据在原来基体原子平衡位置上的异类 原子称为置换原子。
➢每种点缺陷都会造成晶格畸变,从而对性能产生影 响,屈服强度升高、电阻增大、体积膨胀等。 ➢与扩散相关的过程。
2. 点缺陷的运动及平衡浓度
点缺陷的运动
点缺陷的平衡浓度
空位是一种热平衡缺陷,一定温度下有一定的平 衡浓度。温度越高,平衡浓度越大。 金属中的空位平衡浓度是很低的,即使在接近熔 点温度也只有约10-4。 例如铝在靠近熔点的温度(933K)时的平衡空 位浓度Nv=8.7×10-4。 间隙原子的形成焓比空位约大一个数量级,所以 它的平衡浓度更低,接近熔点时一般为10-15。
点缺陷的迁移能
金属的空位迁移能略低于空位形成能;间隙原 子的迁移能比间隙原子的形成能小很多,且比 空位迁移能大。
晶体中的自扩散是不依赖于浓度梯度的,它是 由扩散原子的热运动而引起的原子迁移,实质 上是空位在晶体中的迁移,因此,自扩散的激 活能就等于空位的形成能加上空位的迁移能。
退火时,空位向空位壑迁移,引起空位的 湮没,位错、晶界、相界、自由表面均是 空位壑。
点缺陷的浓度
C=Aexp(-NoEo/KN0T) =Aexp(-Qf/RT)
Qf=N0E0——形成空位的激活能,即形成1mol空位 所需要的功,单位为J/mol
R=kN0——气体常数 ,为8.31J/mol.K A=exp(S0/k)由振动熵决定的系数,1~10
点缺陷产生后,其周围产生弹性畸变,而且间隙 原子的畸变比空位要大得多
