物质的转化规律(学生练习)
第二节 物质转化的规律(3)--有关纯度的计算

40吨 40吨
练习3: 铁矿石中Fe 的质量为40 40吨 练习3: 铁矿石中Fe2O3的质量为40吨, 80%,问铁矿石的 其中Fe 的质量分数是80%, 其中Fe2O3的质量分数是80%,问铁矿石的 质量是多少? 质量是多少? 50吨 50吨
二、有关物质含杂质时的化学方程式的计算
例1 : 2000吨含氧化铁75%的赤铁矿石 吨含氧化铁75% 用2000吨含氧化铁75%的赤铁矿石 炼铁, 炼铁,问: 吨 (1)可炼出多少吨纯铁 ( 可炼出多少吨纯铁? (1)可炼出多少吨纯铁? 1050吨) (2)可炼出含杂质8%的生铁多少吨 可炼出含杂质8%的生铁多少吨? (2)可炼出含杂质8%的生铁多少吨?
高温
160 = 1500吨 1500吨 2×56 x
X=1050吨 X=1050吨
生铁质量: (2)可炼含杂质 生铁质量: )可炼含杂质8%生铁质量 1050吨÷(1-8%)=1141.3吨 吨 ) 吨
生铁1141.3吨 答:可炼出1050吨纯铁,可炼含杂质8%生铁 可炼出1050吨纯铁,可炼含杂质 生铁 1050吨纯铁 吨
解法2 解法
(1)2000吨赤铁矿石中含氧化铁的质量为 2000吨赤铁矿石中含氧化铁的质量为 2000吨 75%=1500吨 2000吨×75%=1500吨 1500吨氧化铁中铁元素的质量为 1500吨氧化铁中铁元素的质量为 56 ×2 1500吨 1500吨× =1050吨 ×100% =1050吨 160 生铁质量: (2)可炼含杂质 生铁质量: )可炼含杂质8%生铁质量 1050吨÷(1-8%)=1141.3吨 吨 ) 吨
某物质的质量 某物质的质量分数
练习1: 50吨铁矿石中含 吨铁矿石中含Fe 质量为40 练习1: 50吨铁矿石中含Fe2O3质量为40 问该铁矿石中Fe 的质量分数是多少? 吨,问该铁矿石中Fe2O3的质量分数是多少?
第3讲 物质的转化(练习)-2022年暑假新高一化学衔接班课程(原卷版)

课时同步练习(3)A组1.下列变化,能通过加盐酸一步反应实现的是()①AgNO3→HNO3②Fe2O3→FeCl2③Cu→CuCl2④Cu(OH)2→CuCl2⑤Fe→FeCl3A.①②B.②④C.①④D.③⑤2.下列变化,不能通过一步反应实现的是()A.Na2CO3―→CO2B.BaCl2―→Ba(OH)2C.FeCl3―→Fe(OH)3D.CaCO3―→CaCl23.X、Y、Z、W各代表一种物质,若X+Y===Z+W,则X和Y之间不可能是() A.盐和盐的反应B.碱性氧化物和水的反应C.酸与碱的反应D.酸性氧化物和碱的反应4.甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去)。
下列各组物质按照甲、乙、丙的顺序不符合要求的是()A.C、CO、CO2B.H2O2、H2O、O2C.KOH、K2CO3、KNO3D.Fe2O3、FeCl3、Fe(OH)35.下列关于物质的分类及反应均正确的是()A.碳酸钙属于盐,可用于实验室制CO2:CaCO3+H2SO4===CaSO4+H2O+CO2↑B.铁属于较活泼金属,可用于实验室制H2:6HCl+2Fe===2FeCl3+3H2↑C.纯碱属于碱,可与稀盐酸发生反应:2HCl+Na2CO3===2NaCl+H2O+CO2↑D.烧碱属于碱,可与稀硫酸反应:H2SO4+2NaOH===Na2SO4+2H2O6.氢氧化钾是我国古代纺织业常用于漂洗的洗涤剂。
古代制取氢氧化钾的流程如下:上述流程中没有涉及的化学反应类型是()A.化合反应B.分解反应C.置换反应D.复分解反应7.下列关于氧化物的叙述中正确的是( )①酸性氧化物均可与水反应生成相应的酸 ②非金属氧化物肯定是酸性氧化物 ③碱性氧化物肯定是金属氧化物 ④金属氧化物都是碱性氧化物 ⑤不能跟酸反应的氧化物一定能跟碱反应 A .①②④⑤ B .①②③ C .③④ D .③ 8.下列物质在给定条件下的转化均能一步实现的是( )A .Fe 3O 4――――→CO 高温Fe ――→盐酸FeCl 3 B .H 2O 2――→△H 2――――→O 2点燃H 2O C .CaCl 2溶液――→CO 2CaCO 3――→盐酸CO 2 D .CuSO 4溶液――→Fe Cu ――――→O 2加热CuO9.下列各组物质之间可以按下图所示关系直接转化的是( )物质A ―→物质B ―→物质C ―→物质AA .Fe ―→Fe 2O 3―→FeSO 4―→FeB .CO ―→CO 2―→H 2CO 3―→COC .NaOH ―→NaCl―→Na 2CO 3―→NaOHD .HCl ―→CuCl 2―→BaCl 2―→HCl10.下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是( )甲乙丙A CuO CO 2 H 2OBC CO CO 2 C CaCO 3 CaO Ca(OH)2 DH 2SO 4H 2OH 211(1)以Na 、K 、H 、O 、C、S 、N 中任两种或三种元素组成合适的物质,分别填在下表中。
物质转化的规律-1

一、非金属单质 与其化合物的转化
自然界中的所有物质都在不停地发生变化, 科学家也常利用物质与物质之间的反应,制 造出新的物质、使物质世界更加丰富。 但不是所有物质之间都能发生化学反应, 物质之间的反应是有条件、也有规律的。
1、非金属+氧气
非金属
火山喷射的产物-硫黄
硫黄
(1)、硫黄:淡黄色粉末
生成了铁的化合物
上述变化的化学方程式:
Fe + S == FeS
结论:金属与非金属(不包括氧)可以 相互反应,生成相应的盐。
点燃
2 Fe + 3 Cl2 == 2 FeCl3
点燃
Cu + Cl2 == CuCl2
点燃
2 Na + Cl2 == 2 NaCl
点燃
Mg+Cl2
MgCl2
金属+非金属(除氧气)
碳能将氧化铜中的铜变成游离态的铜。
先移去盛有
石灰水的烧杯, 再移去酒精灯。
实验结束时, 应注意什么?
想一想
为什么?
防止,水的倒吸引起试破裂。
(2)、一氧化碳与氧化铜 炭也可以在高温下与二氧化碳反应:
高温
C + CO2 == 2 CO
一氧化碳也可以在高温下与氧化 铜反应:
CO + CuO == Cu + CO2
非金属单质及其化合物转化的一般规律: 非金属
O2
非金属氧化物
H2O
酸的通性
酸
盐
碱
注意: 1、大部分非金属氧化物和水反应生成酸 (二氧化硅除外) 2、不稳定的酸受热易分解为非金属氧化物和水 4、非金属氧化物和可溶性碱反应生成盐和水
九年级科学物质的转化规律2(精)
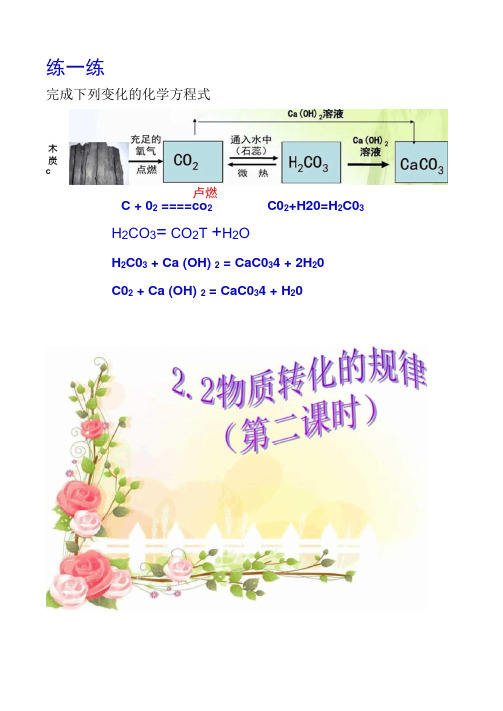
练一练完成下列变化的化学方程式卢燃C + 02 ====co 2C02+H20=H 2C03H 2CO 3= CO 2T +H 2OH 2C03 + Ca (OH) 2 = CaC034 + 2H 20 C02 + Ca (OH) 2 = CaC034 + H 20木 炭C金属单质与其化合物的转化1、金属+氧气一-金属氧化物(1) 3Fe+202 Fe 304 (2) 2Mg+02 曲 2MgO(3) 2C U +02 4 2CuO化学方程式:Fe +S~= FeS结论:2、金属+非金属一(无氧酸)盐(除氧气)P48实验1实验前后物质比较实验前硫磺:黄色铁粉:能被吸铁石吸引物质:黑色 不被吸铁石吸引 铁粉硫黄硫黄铁粉混合物1实验后讨论:你还知道 其他的金属转化2Fe + 3CI 2 皱2FeC13 Cu + Cl 2 些 CuCI 2 实实验现象:发生剧烈反应,放出大量的热 予 化学方程式;Ca0+H 20= Ca (OH) 23、某些金属氧化物+水—碱诽音 只有可溶性碱才能由相应的金属氧化物和水 圧忌反应生成。
还有哪些金属氧化物可以转化为相应的碱?Na 2O+H 2O^ 2NaOH K 2O+H 2O 2KOH aO+H 2O=Ba (OH) 2用化学方程式表示以 1.镁和硫混合燃烧Mg + S 樂 MgS2Na + Cl 2 理 2NaCI2. 铁在氯气中燃烧3. 铜在氯气中燃烧实验(3):在蒸发皿中放入新制的Cu(OH) 2粉末加热。
现象=蓝色固体变黑化学方程式:Cu (OH) 2 === CuO + H 20 结论^ 4、碱A 某些金属氧化物+水注意不溶性碱受热能分解,可溶性碱加热不能分解。
回顾实验(4):取NaOH 溶液倒入试管中,向试管内滴入 CuSO 4溶液。
化学方程式: 结论:5、碱2NaOH + CuS04碱的通览赴■fTfl金属单质与其化合物的转化归纳 金属单质与其化合物的转化思考 如何完成下列转变?写出相应的化学方程式。
物质的转化规律

3.(2014· 杭州)无标签试剂瓶中的一种黑色不溶于水的固体可能是硫化铜或者是硫化亚 铜。查资料可知:硫化铜(CuS)和硫化亚铜(Cu2S)在空气中灼烧分别发生下列化学反应: 灼烧 2CuO+2SO 2CuS+3O2===== 2 灼烧 CuO+SO (没配平) Cu2S+O2===== 2 (1)请写出配平后的 Cu2S 在空气中灼烧的化学方程式 定灼烧的 Cu2S 是否完全反应,依据的实验现象是 。如要确 。
5.(2014·沈阳)A是镁、铝、铜三种单质中的一种,在化合物中A元素常显 +2价,物质A、C、E、H都含有相同的某种元素,C、G都是氧化物,J是由 三种元素组成的盐。各物质间能发生如下反应(反应条件未标出): ①A+B→C ②A+D→E+F↑ ③C+D→E+G ④H+D→E+G ⑤E+I→H↓+J↓ 请推断: (1)写出下列物质的化学式:A__Mg__,F__H2__。 (2)D所属的物质类型是__B__(填字母) A.氧化物 B.酸 C.碱 D.盐
4.(2014· 临沂)已知 A、B、C 三种物质含有同种金属元素,其中 A 是大理石 的主要成分,B 为氧化物;D、E、F 三种物质含有同种非金属元素,其中 F 是单 质,E 是易与血液中血红蛋白结合的有毒气体。它们之间的转化关系如图所示(有 些转换关系反应条件等略去),试回答: (1)写出 E、F 的化学式:E__ __;F__ _; (2)用化学方程式表示以下转换关系: A→D__ C→A_ __; __。
CO M__ O2 ; N__ __2 ;P__CO __;Q__H __ 2; CH4+2O2 ===(点燃) CO2+2H O_ (2)CH4 与 M 反应的化学方程式__ _2 ; 该反应属
于__放热 __(填“放热”或“吸热”)反应。
物质转化的规律(自制版)

MgO + H2O = Mg(OH)2
2.难溶性碱加热能分解 (可溶性碱加热不分解)
2 Fe(OH)3 Cu(OH)2 NaOH
Fe2O3 + 3 H2O CuO + H2O Na2O + H2O
还原剂 H2O
盐
金
属
与
盐和水
盐
盐和氢气
三、常见无机物转化规律图(八圈图)
盐和氢气
盐
两条纵线
金
属
盐和水
本
反 应
化合反应
类
型 分解反应
可能同时也是氧化还原反应
一、非金属单质与其化合物的转化:
1.碳:
木 炭
C
充足的 氧气
点燃 CO2
通入水中 (石蕊)
Ca(OH)2 溶液
微 热 H2CO3
CaCO3
一、非金属单质与其化合物的转化:
2、硫
酸雨的形成与硫的一系列转变有关
SO2与水的反应
+O2
S
SO2
H2SO3
目的2
反应前通一会H2的目的:
排净试管内的空气,防止H2不纯而引起爆炸
反应结束后继续通一会H2的目的:
防止刚生成灼热பைடு நூலகம்Cu再次被氧化
第2节 物质转化的规律
一.金属的冶炼: (金属氧化物
1.用H2作还原剂:
金属 )
①原理:
H2 + CuO
Cu + H2O (置换反应)
②现象: 黑色固体变红色,试管口有水珠生成
高温
CaCO3
CaO
+ CO2
加热
MgCO3
CuO
+ CO2
人教版高中化学必修第一册习题练习之 物质的转化

物质的转化[基础达标]1.小明知道蛋壳的主要成分是碳酸钙,愚人节这天决定送妈妈一个“无壳鸡蛋”。
他从厨房中取来一个鸡蛋及一杯物质,将蛋泡在其中,只见蛋的表面冒出大量气泡,两天后就得到了一个没有壳的蛋。
他应取下列哪一种物质()A.醋B.高粱酒C.酱油D.食盐水A[同类别的物质具有相似的性质。
碳酸钙能与酸反应生成钙盐和二氧化碳气体。
小明的实验中产生大量的气泡,选用的应该是酸,醋的主要成分为醋酸。
]2.(2021·聊城高一检测)在一定条件下,跟酸、碱、盐都能反应的物质是()A.CaO B.Na2CO3C.CaCO3D.CO2B[CaO是碱性氧化物,与碱不发生反应;CO2是酸性氧化物,与酸不发生反应;Na2CO3和CaCO3都是盐,但后者难溶于水,不与碱、盐发生反应,前者可以,分别与盐酸、氢氧化钙、氯化钙等发生反应。
]3.(2021·南京十三中月考)下列性质中,不属于碱的通性的是()A.能与酸反应生成盐和水B.能与酸性氧化物反应生成盐和水C.能与某些盐反应生成新碱和新盐D.能与金属反应放出氢气D[A.能与酸反应生成盐和水,属于碱的通性,故A不符合;B.能与酸性氧化物反应生成盐和水,属于碱的通性,故B不符合;C.能与某些盐反应生成新碱和新盐,属于碱的通性,故C不符合;D.能与金属反应放出氢气,不属于碱的通性,故D符合。
] 4.(2021·沙坪坝区重庆八中统考)下列物质转化不能通过一步反应实现的是()A.CaO→CaCl2B.CuO→Cu(OH)2C.CaO→Ca(OH)2D.Mg(OH)2→MgCl2B[A.CaO与HCl反应生成CaCl2和水,可以通过一步反应实现,故A不选;B.CuO 与水不反应,CuO→Cu(OH)2转化不能通过一步反应实现,故B选;C.CaO与水反应生成Ca(OH)2,可以通过一步反应实现,故C不选;D.Mg(OH)2与HCl反应生成MgCl2和水,可以通过一步反应实现,故D不选。
第5课物质的转化-2023-2024学年九年级科学上册学练测(浙教版)(原卷版)

第5课 物质的转化【学与练】一、非金属单质与其化合物的转化(1)非金属在一定条件下可以转化为相应的化合物。
如: S+O 2===点燃SO 2 C+O 2===点燃CO 2注意:硫在空气中燃烧产生淡蓝色火焰,在氧气中燃烧产生明亮的蓝紫色火焰。
(2)某些非金属氧化物可以跟水反应生成相应的酸。
如:CO 2+H 2O==H 2CO 3 (生成的碳酸不稳定,受热易分解)。
H 2CO 3===H 2O+CO 2↑(3)规律:二、金属与其化合物的转化(1)金属单质和非金属单质在一定条件下可以相互反应,生成相应的盐或金属氧化物。
如:S +Fe===ΔFeS 3Fe+2O 2===点燃Fe 3O 4.(2)某些金属氧化物和水反应可以生成相应的碱。
如:CaO +H 2O===Ca(OH)2、Na 2O+H 2O===2NaOH 三、金属的冶炼金属冶炼就是要把金属从化合态变成游离态。
(1)氢气还原氧化铜实验中应该注意几个做法:①先通入氢气,再给氧化铜加热。
用氢气赶走试管内的空气,防止空气和氢气的混合物在加热的条件下发生爆炸。
②反应结束后,黑色的氧化铜变成红色的铜,此时应该先撤酒精灯,继续通入氢气至试管冷却,防止反应生成的灼热的铜再次被氧化成氧化铜。
③反应的化学方程式为H 2+CuO===△Cu+H 2O 。
(2)铁矿石炼铁的反应原理:C+O 2===点燃CO 2 C +CO 2=====高温2CO Fe 2O 3+3CO===高温2Fe +3CO四、还原反应(1)还原反应:碳、氢气等会夺取金属氧化物中的氧,从而得到金属单质,这种含氧化合物里的氧被夺取的反应,叫作还原反应。
碳、氢气和一氧化碳能从氧化铜、氧化铁中夺取氧的性质叫作还原性,具有还原性的物质叫作还原剂。
(2)碳、氢气和一氧化碳都是常用的还原剂。
五、单质、氧化物、酸、碱和盐之间的转化规律六、常见的物质鉴别方法(1)用一种试剂鉴别多种物质的方法。
选用适当的指示剂或用pH 试纸可区别有明显酸碱性差异的物质;用加水使其溶解的方法可检验有较明显溶解性差异的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的分类和转化规律 一. 物质的分类: 基本概念: 1.元素:是具有相同 的同一类原子的总称。
质子数量相同,中子数量不同的原子或离子也属于相同的元素;质子数相同,中子数量不同的原子或离子被称为 .元素的化学性质是由其 决定的,元素的种类是由 决定的。
2.纯净物: 称为纯净物, 纯净物又分为 和 。
3.混合物: 称为混合物。
4.单质: 称为单质。
元素在单质中存在时称为元素的游离态。
同一种元素的不同种单质叫做同素异形体(如:石墨和 )。
5.化合物: 叫做化合物。
自然界中的物质大多数为化合物。
6.无机化合物:通常指不含 元素的化合物(但包括碳的氧化物、碳酸盐等),简称无机物。
7.有机化合物: 通常指含 元素的化合物,有机化合物主要由 、 、 、 等元素组成。
但一些简单的含碳化合物,如一氧化碳、二氧化碳、碳酸盐、金属碳化物、碳酸等除外。
8.氧化物: 称为氧化物。
另一种元素若为金属元素,则为 ;若为非金属元素,则为 。
9: 酸:电离时生成 的化合物。
10.碱:电离时生成 的化合物。
11.盐:是指一类 或 与 结合的化合物。
二. 物质的转化规律:物质 纯净物 单质 化合物 __________,例:Cl 2、 、稀有气体 _____氧化物,例:SO 2、 _____氧化物,例:Na 2O 、 氧化物 酸 例: 碱 例: 盐 例:无机化合物 有机化合物,例:__________,例:Na 、 混合物 例:盐酸、空气、1.金属+氧==金属氧化物①钠放置在空气中。
现象:银白色逐渐退去。
反应:4Na+O2 ==②镁条燃烧。
现象:,反应:2Mg+O2③加热金属铝片。
现象:铝箔熔化,失去光泽,熔化的铝并不滴落,产生这一现象的原因是:铝表面生成了氧化铝薄膜,构成薄膜的氧化铝的熔点高于金属铝的熔点,包在铝的外面,所以熔化的液态铝不会落下来。
反应:4Al+3O2④铝在空气中生锈:4Al+3O2 == Al2O3是一层极薄的物,可阻碍反应的进行。
⑤铁丝在氧气中燃烧。
现象:,反应:3Fe+2O2。
铁钉在空气中生锈。
现象:,反应:4Fe+3O2= 。
相关知识点:(1)铁生锈的条件:、(2)Fe可做中的抗氧化剂(去除)。
⑥加热金属铜丝。
现象:。
反应:2Cu+O2== .2.金属氧化物+还原剂=金属+非金属氧化物①CuO+H2== 现象:,H2还原优点是反应生成物之一是,且产物较纯净。
②CuO+CO== (CO有剧毒,实验时一定)③2CuO+C;现象:(虽然C的还原能力强于H2,但固体还原剂与氧化物的充分接触程度没有固体与气体还原剂充分,自然反应温度就比H2要高,最好使用酒精喷灯或加罩的酒精灯。
C要稍微过量。
)④2Fe2O3+3C;⑤Fe2O3+3CO;(加热时一定要持续高温)⑥Fe2O3+3H2 ;现象:总结:金属与金属氧化物之间的转换①活泼金属在空气中易与氧气反应,表面生成一层氧化物。
有的氧化膜疏松,不能保护内层金属,如:;有的氧化膜致密,可以保护内层金属不被继续氧化,如:表面的氧化层。
在点燃镁条或铝片前,常用砂纸镁条或铝片。
②除Ag、Pt、Au外的金属, 一般都可与氧气发生化合反应, 金属越活泼与氧化合就越容易, 反应就越剧烈。
生成氧化物的特点是绝大部分反应的结果多为热量,的热量愈大,则生成的氧化物愈稳定。
金属氧化物大多数是性氧化物。
③金属氧化物热还原反应指的是金属氧化物(如Fe2O3、CuO等)在加热或者更高的温度条件下,用一些还原剂(如:)将氧化物中的金属元素以单质形式还原出来的反应。
越活泼的金属,其金属氧化物被还原时所需温度越高。
K→Al的冶炼只能在矿石熔化状态(不是水溶液)下电解,用H2、CO 还原。
④用气体做还原剂时,气体“”,酒精灯“”。
实验开始时,应先通入一段时间CO(或H2),目的是,实验结束后,应先拿走酒精灯,后撤走CO(或H2)导管,目的是.⑤CO有剧毒,实验时一定要进行。
3.金属氧化物+水==碱①生石灰溶于水:CaO+H2O== 现象:。
相关知识点: (1)最终所获得的溶液名称为氢氧化钙溶液,俗称;(2)在其中滴入无色酚酞,酚酞会变成色; (3)生石灰可做干燥剂.②氧化钠溶于水:Na2O+H2O==③氧化钾溶于水:K2O+H2O==补充:④K、Ca、Na可以直接与水反应。
如:Ca+2H2O==Ca(OH)2+H2↑4.碱==金属氧化物+水①Mg→Fe对应的氢氧化物加热可分解。
如:2Fe(OH)3== 。
②Sn→Cu对应的氢氧化物微热即分解。
如:Cu(OH)2== 。
现象:。
③Hg→Ag对应的氢氧化物常温即易分解。
如:2AgOH==Ag2O+H2O。
(常温下不存在)④特例:NH4OH== 。
现象:。
总结:金属氧化物与碱之间的转换①金属氧化物与水反应生成的碱一定要溶于水,生成的碱都是碱。
反应时都大量的热。
②弱碱(一般不溶于水的碱)加热可分解,活泼性越强的金属所生成的碱,加热分解需温度越。
③可溶性碱加热一般不分解。
K→Na对应的氢氧化物分解。
5.非金属+氧==非金属氧化物①氢气在空气中燃烧:2H2+O2现象:相关知识点: (1)氢气是一种常见的还原剂; (2)点燃前,一定要检验它的纯度否则会爆炸。
②红磷在空气中燃烧:4P+5O2现象:相关知识点: (1)烟是固体小颗粒;雾是液体小颗粒. (2)测量氧气在空气中的体积分数。
(3)可做烟雾弹。
③硫粉在空气中燃烧: S+O2现象:在空气中是发出微弱的火焰,在氧气中是发出明亮的火焰. 有强烈气味。
相关知识点:(1)反应后的产物可用紫色的石蕊试液来检验(紫色变成红色);(2)SO2污染空气,要用溶液进行尾气处理。
(3)SO2是气体,所以测量氧气在空气中的体积分数,若将水改为溶液,也可以测量氧气在空气中的体积分数。
④碳在氧气中充分燃烧:C+O2现象:在空气中是发出,在氧气中是发出。
相关知识点:反应后的产物可用来进行检验.⑤碳在氧气中不充分燃烧:2C+O26.非金属氧化物 + 活泼金属 == 非金属+金属氧化物①金属钠与水反应:2Na+2H2O== ,现象:浮(钠块浮在水面上)、游(钠块在水面上无规则游动)、熔(钠块熔化为小球)、响(发出嘶嘶的响声)、红(使滴入酚酞试液的溶液变红)②金属镁与CO2反应:2Mg+CO22MgO+C现象:发出白光,有白色粉末(MgO)生成,有黑色固体(C)生成,同时放出大量的热。
相关知识点: 非常活泼的金属能在二氧化碳中“燃烧”。
③金属铝与水的反应:2Al+6H2O==2Al(OH)3↓+3H2↑总结:非金属与非金属氧化物之间的转换①在非金属元素与氧形成的化合物里,氧显价,另一种非金属元素显价。
②经点燃,许多非金属都能在空气里燃烧;如是气体燃烧,在燃烧前一定要先。
③活泼金属可以将非金属氧化物中的非金属(不是氧)置换出来。
溶液中或气体之间发生的置换反应在常温下进行,气体与固体或两种固体之间发生的置换反应一般需在高温下进行。
④活泼金属火灾,不能使用和灭火。
⑤K、Ca、Na、Mg不能置换出盐溶液中的不活泼金属的离子。
就是因为活泼金属先与先反应。
H2SO3 == SO2↑+ H2OH2SO4 SO3↑+H2O光或4HNO== == 4NO↑+O↑+2H O (硝酸要用色瓶密封保存)9.金属+非金属==无氧盐①氯气与金属钠反应,现象:,反应: 2Na+Cl2②铁粉与硫粉混合加热。
现象:反应: Fe+S③铁丝在氯气中燃烧。
现象:产生棕黄色烟,反应:2Fe+3Cl22FeCl3总结:此处的非金属H2、O2除外。
当金属越活泼, 非金属也越活泼时, 反应就越容易进行。
10.金属氧化物+非金属氧化物==含氧盐①Na2O + SO3 = Na2SO4(较快),CaO + SO3 == CaSO4(较慢)②Na2O + CO2 = Na2CO3(缓慢吸收),CaO + CO2 = CaCO3(非常缓慢,如有水参与反应更快)③Na2O + SiO2高温Na2SiO3(熔融时),CaO + SiO2高温CaSiO3 (炼铁时加石灰石去杂的方法)11.含氧酸盐金属氧化物+非金属氧化物①CaCO3高温+ (二氧化碳工业制法)②2CuSO4高温2CuO + 2SO2↑+ O2↑③Cu2(OH)2CO3高温现象:④2Cu(NO3)22CuO + 4NO2↑ + O2↑总结:金属氧化物+非金属氧化物与含氧盐之间的转换①SO3与活泼金属的氧化物在常温下即可反应, 其余的需在加热或高温条件下才能发生反应。
Na2O、K2O比CaO反应速度要快一些(其它常见金属氧化物一般不反应)。
②、的碳酸盐稳定、易溶于水。
Ca、Mg、Cu等的碳酸盐微溶或难溶、受热易。
③Na2SO4, K2SO4等不易分解.其它硫酸盐的分解温度各不相同,Fe2(SO4)3在700℃左右就可以分解为:SO3和Fe2O3;CaSO4在1400℃左右分解:SO3和CaO;BaSO4在1580℃左右分解:SO3和BaO。
④硝酸盐加热易分解.K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气; Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2; Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
补充:其它盐的分解反应①2NaHCO3(侯氏制碱法中的一步)②Ca(HCO3)2CaCO3+CO2↑+H2O (水垢、钟笋石产生的原因)③2KMnO4(实验室制氧气方法之一)相关知识点: (1)紫色变为黑色;(2)生成使带火星木条的气体④2KClO3(实验室制氧气方法之一)相关知识点:(1)二氧化锰在其中作为催化剂,加快氯酸钾的分解速度或氧气的生成速度;(2)二氧化锰的和在化学反应前后没有改变;(3)反应完全后,试管中的残余固体是氯化钾和二氧化锰的混合物,进行分离的方法是:,,.⑤CuSO4·5H2O 现象:12.非金属氧化物+碱=盐+水①Ca(OH)2+CO2=现象:相关知识点: (1)这个反应可用来检验气体的存在.(2)石灰浆糊上墙后变硬的原因。
(3)继续通过量CO2的则溶液又由浑浊变澄清:CaCO3+CO2+H2O==Ca(HCO3)2②2NaOH+CO2=现象没有,可加酸或Ca(OH)2来验证是否反应。
相关知识点:(1)NaOH可用来吸收等气体.(2)NaOH晶体易吸收空气中的和而变质。
补充:检测CO2用,而吸收用。
原因:Ca(OH)2有沉淀;NaOH极易溶于水,吸收的也多。
检测H2O用,而吸收用H2SO4(浓)。
原因:有颜色变化。
H2SO4(浓)吸水多而快。
同时有CO2和H2O要检测时,先后。
同时要吸收CO2和H2O,先后。
③Ca(OH)2+SO2==(有白色沉淀生成)④NaOH+SO2=(工业去废气的方法)⑤2NaOH+SO3=⑥2NaOH+SiO2==Na2SiO3+ H2O (强碱不能用长期盛放)。
