华南理工大学物理化学2002研究生入学考试试卷及答案详解
华南理工大学2003研究生入学考试试卷及答案详解

K “= (p”/ p )2/4 =(101325Pa/100000Pa)2/4=0.2567
1
利用等压方程 ln (K ”/ K ) = (rHm / R )(1/T 1/T”)
即
ln(0.2567/0.0003901)=(128100kJ . mol1/8.3145J . K1 . mol1)(1/323.15K1/T”)
5
华南理工大学
2003 攻读硕士学位研究生入学考试试卷
科目名称:化工原理 适用专业:纸浆造纸工程、制糖工程、环境工程
一.填空(在括号内填入适当的文字)(40 分)
1. 流量计安装时,孔板流量计可以在(
安装,流体流动方向应取(
)。
)方向安装,转子流量计(
)方向
2. 图示,流体在园管中自上而下流动,通过 l 段的摩擦阻力损失为 h∫ab,
H
20
40
C60
%( )
D 80 E
100 H2SO4 (B)
别为 98、18。
H2O-H2SO4 系统的相图
(2) 指出各区和三相线的相态和自由度。
(3) 生产过程中用管道输送液态硫酸,若是 98%的浓硫酸,会不会出现问题?若是 93%的
浓硫酸,又会如何? (15 分)
答:(1) 组成分别为 H2SO4 . 4H2O(C)、H2SO4 . 2H2O(D)、H2SO4 . H2O(E)。 (2) 在常压下,硫酸与水的相图看起来似乎复杂,实际上很简单,是 H2O—H2SO4 . 4H2O、 H2SO4 . 4H2O—H2SO4 . 2H2O、H2SO4 . 2H2O—H2SO4 . H2O、H2SO4 . H2O—H2SO4 固相完全不互溶 的相图的组合,因此各区和三相线的相态很容易确定,自由度为 F=C-P+1=3-P,具体相态
华南理工大学 攻读硕士学位研究生入学考试试卷 物理化学(一)
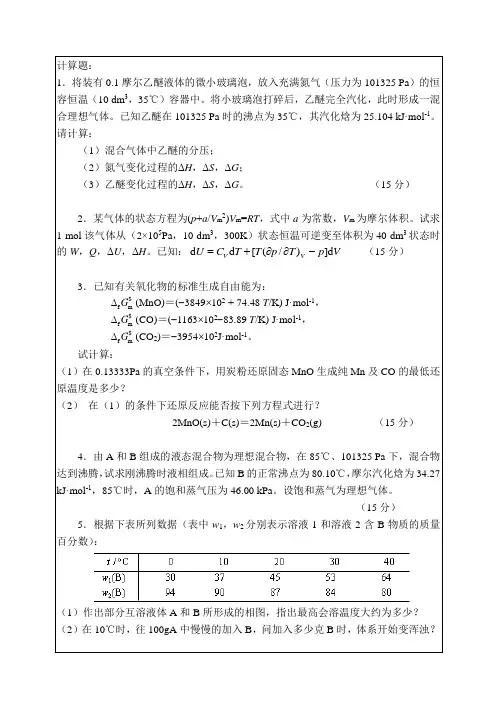
(3)异戊二烯被释放到大气中后会迁移。计算风速10 km·h-1时,异戊二烯在空气中的平均迁移距离。(15分)
简答题:
9.对于一定量的理想气体,分析下列过程是否可能?
(1)恒温下绝热膨胀。
(2)恒压(压力不为0)下绝热膨胀。
(3)热完全转化为功。(7分)
10.在25℃时,某液体物质A可在水中溶解xA(摩尔分数),设水在此液体中不溶解,若以该物质纯液体为标准态,如何求25℃该液体在水的饱和溶液中的活度系数?(7分)
计算题:
1.将装有0.1摩尔乙醚液体的微小玻璃泡,放入充满氮气(压力为101325 Pa)的恒容恒温(10 dm3,35℃)容器中。将小玻璃泡打碎后,乙醚完全汽化,此时形成一混合理想气体。已知乙醚在101325 Pa时的沸点为35℃,其汽化焓为25.104 kJ·mol-1。请计算:
(1)混合气体中乙醚的分压;
(2)在(1)的条件下还原反应能否按下列方程式进行?
2MnO(s)+C(s)=2Mn(s)+CO2(g)(15分)
4.由A和B组成的液态混合物为理想混合物,在85℃、101325 Pa下,混合物达到沸腾,试求刚沸腾时液相组成。已知B的正常沸点为80.10℃,摩尔汽化焓为34.27 kJ·mol-1,85℃时,A的饱和蒸气压为46.00 kPa。设饱和蒸气为理想气体。
(4)在10℃时,至少应在100gA中加入多少克B,才能使A层消失?
(5)将100gA和150gB的混合液加热至30℃时,计算此时两共轭溶液的组成和质量之比[m(A层):m(B层)]各为多少?
(6)若将(5)中的混合液在恒定压力下继续加热,问大约加热到什么温度时体系由浑浊变清?(15分)
6.由固态铝、铝-锌合金及熔化物AlCl3-NaCl为电解质组成原电池,653K时,当合金中Al的质量分数为0.38时,测得电池电动势为7.4310-3V,电动势的温度系数=2.910-5V·K-1。
华南理工大学2000-2003年攻读硕士学位研究生入学考试题

华南理工大学2000年攻读硕士学位研究生入学考试题一、填空选择题1.流体在半径为R 的圆形之管中作层流流动,则平均速度发生在距管中心 r= R。
2.在长为L(m),高为H(m)的降尘室中,颗粒的沉降速度为,气体通过降沉室的水平速度为,则颗粒能在降尘是分离的必要条件为。
3.空气在内径一定的圆管中稳定流动,当气体质量流量一定,气体温度升高时,Re值将。
4.流量一定,当吸入管径增加,离心泵的安装高度将。
5.有一板框过滤机,以恒压过滤一种悬浮液,滤饼为不可压缩,过滤介质阻力忽略不计。
当其他条件不变时,过滤时间缩短一半,所得的滤液是原来滤液的倍。
6.某水平管式换热器,管间为饱和水蒸气冷凝,若饱和水蒸气与壁温之差增加一倍时,冷凝传热速率将增加为原来的。
A. B. C. D.7.判断下列命题是否正确,正确的是。
A.上升的气速过大会引起漏液`;B.上升的气速过小会引起液泛;C.上升的气速过大会造成过量的液沫夹带;D.上升的气速过大会造成过量的气泡夹带;E.上升气速过大会使板效率降低。
8.在以下几个吸收过程中,那个改为化学吸收将会最显著的提高吸收速率。
A. 水吸收氨;B.水吸收HCl气体;C. 水吸收SO2; D. 水吸收CO29.在精镏操作中,两组分的相对挥发度越大,则表示分离该体系越。
A. 困难;B.完全;C. 容易;D. 不完全10.减压(真空)干燥器主要用于的物料,但它的设备费和能量消耗费都。
二、某常压连续干燥器,已知操作条件如下:干燥气的生产能力为200kg/h(按干燥产品计),空气的状况为:进预热器前的温度为20℃,相对湿度为60%,湿含量为0.01kg水/kg干空气,离开干燥气的温度为40℃,相对湿度为60%,湿含量为0.03 kg水/kg干空气,进干燥器前的温度为90℃,物料的状况:进干燥器前的温度为20℃,干基含水量为0.25kg水/kg 干料,出干燥器式的温度为35℃,干基含水量为0.01kg/kg干料。
华工物化试题精解

T=J(J+1)h2/82kR02
=1*2*(6.6*10-34)2/{8*3.1422*1.38×10-23*(35*10-3/6.022*1023)*(1.988×10-10)2}
=0.3480K
4.某化学反应在恒压、绝热和只做膨胀功的条件下进行,系统的温度由T1升高至T2,则此过程的焓变_______零;如果这一反应在恒温T1、恒压和只做膨胀功的条件下进行,则其焓变______零。
华南理工大学《物理化学》试卷(80学时)
专业班级________姓名________学号_________分数_______
华南理工大学化学学院葛华才老师解答,有错请留言,谢谢!
一、选择题(共10题,每题2分,20分)
1.含有非挥发性溶质B的水溶液,在101.325kPa和270.15K时开始析出冰,已知水的Kf=1.86K.kg.mol-1,Kb=0.52K.kg.mol-1,该溶液的正常沸点是:()
相图和冷却曲线见下图。
(3)可得到MgCu2。根据杠杆规则有
m(MgCu2)(0.25-0.1606)=(1kg-m(MgCu2))(0.33-0.25)
得m(MgCu2)=0.472kg
2.气态正戊烷和异戊烷的fGm(298.15K)分别为–194.4 kJ.mol-1,-200.8 kJ.mol-1;液体的饱和蒸气压分别为:
(C)反应级数由二级变为一级(D)反应级数由一级变为二级,k由小变大
[答]C
r=k1k2cA2/(k-1cA+k2)=kcA,k=k1k2cA/(k-1cA+k2)
cA→∞,k=k1k2/k-1;cA→0,k=k1cA
8.下列系统中为非胶体的是( )
华南理工大学物理化学2002年852物理化学考研真题

华南理工大学2002年攻读硕士学位研究生入学考试试卷1.在绝热的条件下,将0.4mol某理想气体从200kPa 压缩到1000kPa 时,温度从300K上升到900K,求该过程的W、△H、△S、△U、△G,判断过程的性质并指出判据,已知:该理想气体在300K和200kPa时的摩尔熵为S m=205J∙K-1∙mol-1,定压摩尔热容为C p,m=3.5R (12 分)2.298K时,反应N2O4(g)=2NO2(g)的平衡常数Kϴ=0.155,标准摩尔焓为57.24kJ∙mol-1(假定温度对反应焓的影响可以忽略不计)。
(共10 分)求(1) 373K 时反应的平衡常数Kϴ。
(2) 298K,总压为pϴ时N2O4的离解度。
(3) 298K,总压为pϴ,离解前N2O4和N2(惰性气体)物质的量为1:1时N2O4的离解度。
3.水的蒸汽压与温度之间可用如下关系式表示:lg(p/Pa) =-A/T+B若已知水在77℃时的饱和蒸汽压为41.847kPa,求:(1) 常数A,B 的值以及水的摩尔蒸发焓;(2) 在多大外压下水的沸点可以改变为101℃;(共8 分)4.(NH4)2SO4-H2O 所组成的二组分系统,在-19.1℃时有一个低共熔点,此时冰、(NH4)2SO4和浓度为38.4%(质量分数,下同)的(NH4)2SO4水溶液平衡共存。
在108.9℃时(NH4)2SO4饱和溶液(浓度为51.8%)沸腾。
(1) 试绘出相图示意图。
(2) 分析各组分存在的相平衡。
(3) 含30%的(NH4)2SO4水溶液冷却能否得到纯固体(NH4)2SO4?若不能,如何得到纯固体(NH4)2SO4?(4) 1kg 含51.8%的(NH4)2SO4水溶液在何温度下能得到最多的纯固体(NH4)2SO4,计算出最多能得到的(NH4)2SO4的量。
(共12 分)5. 25℃时,电池Zn(s)|ZnCl2(b=0.555mol∙kg-1)|AgCl(s)|Ag(s)的电动势E=1.015V,(∂E/∂T)p=-4.02×10-4V∙K-1。
华工考研试题材料物理化学

,考试作弊将带来严重后果!华南理工大学硕士研究生入学考试《材料物理化学》试卷1. 考前请将密封线内各项信息填写清楚;所有答案请直接答在试卷上(或答题纸上);.考试形式:闭卷;选择题(40分)(1)体心立方堆积的的空间利用率为( C )(A)74% (B)52%(C)68% (D)46%(2)面心立方晶体中具有最小面间距的晶面是( C):(A)(100)(B)(110)(C)(111)(D)(001)(3)尖晶石(MgAl2O4)型晶体中,O2-做面心立方最紧密堆积,Mg2+填入( B )(A)四面体空隙的半数(B)四面体空隙的八分之一(C)八面体空隙的半数(D)八面体空隙的八分之一(4)今有AX、BX和CY三种离子化合物,离子半径分别为:r X =0.181nm,rY=0.130nm,rA=0.095nm,rB=0.169nm,rC=0.034nm。
这三种化合物的阳离子配位数大小顺序排列是( A ):(A)BX>AX>CY (B)AX>CY>BX(C)BX>CY>AX (D)CY>BX>AX(5)下列硅酸盐矿物,属于链状结构的是( D )(A)顽火辉石Mg2[Si2O8] (B)绿柱石 Be3Al2[Si6O13](C)镁橄榄石Mg2[SiO4] (D)叶腊石Al2[Si4O10](OH)2(6)一个片状晶体,其化学式为KF·AlF3·BaO·MgO·Al2O3·5MgSiO3,这一结构与哪类晶体有关:B(A)滑石(B)白云母(C)叶蜡石 (D) 高岭石(7) 非化学计量化合物Cd 1+x O ,由于在化学组成上偏离化学计量而产生的晶格缺陷类型为( B )(A )负离子空位 (B )间隙正离子 (C )正离子空位 (D )间隙负离子 (8)、对于螺位错,其位错线方向、伯氏矢量方向与位错运动方向是( D ) (A )平行,平行 (B )垂直,平行 (C )平行,垂直 (D )垂直,垂直(9)若有一个变价金属氧化物XO ,在还原气氛下形成阴离子缺位型非化学计量化合物,金属元素X 和氧原子数之比为X :O=1.1:1,则其化学式应为( C )(A )X 1.1O (B )XO 0.90 (C )XO 0.91 (D )XO 1.(10)一种玻璃的化学组成为24mol%Na 2O12%mol%Al 2O 364mol%SiO 2,桥氧分数为( B )(A )2.12 (B )3.73 (C )2.94 (D )0.27(11)下列性能哪个不是玻璃的特性( B ) (A )各向同性 (B )熔点确定(C )介稳性 (D )物理、化学性质随成分连续变化(12)当液体(L )与固体(S )相接触,固相不被液体所润湿,则两相的表面张力关系为 ( D )(A )γSV -γSL >γLV (B )γSV -γSL <γLV (C )γSV >γSL (D )γSV <γSL(13)凸表面、平表面和凹表面的饱和蒸汽压存在以下关系( A ) (A )凸表面最高 (B )凹表面最高 (C )平表面最高 (D )三者一样高(14)晶界扩散系数D g ,体积扩散系数D b ,表面扩散系数D s 间的关系是:( D )(A )D g >D b >D s ; (B) D S >D b >D g ; (C) D b > D g >D s ; (D) D s >D g >D b(15)杨德(Jander )方程式1/32[1(1)]J G k t --=是固相反应( B )阶段的动力学方程。
物化下学期试题及答案华南理工考研真题
物化下学期试题及答案华南理⼯考研真题物化下学期⼀、选择题(共20题,每题1分。
需简要说明选择的理由,否则不给分):1.下列各系统中属于独⽴粒⼦系统的是:A. 绝对零度的晶体B. 理想液体混合物C. 纯⽓体D. 理想⽓体的混合物答案:()原因:2. 双原⼦分⼦振动的零点能等于:A. kTB. (1/2)kTC. hvD. (1/2)hv答案:()原因:3. ⼀个体积为V,粒⼦质量为m 的离域⼦系统,其最低平动能级和其相邻能级的间隔是:A. h2/ 8mV2/3B. 3h2/ 8mV2/3C. 5h2/ 8mV2/3D. 8h2/ 8mV2/3答案:()原因:4. CO2分⼦的转动运动对内能的贡献是A. U r=RT/2B. U r=RTC. U r=3RT/2D. U r=5RT /2答案:()原因:5. 独⽴⼦系统的分⼦全配分函数,可分解为彼此独⽴的各种运动形式的配分函数的乘积,各配分函数中与压⼒有关的是A. 平动配分函数B. 转动配分函数C. 振动配分函数D. 电⼦配分函数答案:()原因:6. 已知CO和N2的质量,转动特征温度皆基本相同,若电⼦均处于⾮简并的最低能级且振动对熵的贡献可忽略,则A. S(CO)=S(N2)B. S(CO)C. S(CO)与S(N2)⽆法⽐较D. S(CO)>S(N2)答案:()原因:7. 有两根半径相同的玻璃⽑细管插⼊⽔中,⽔⾯上升⾼度为h,其中⼀根在 1/3 h 处使其弯曲向下,试问⽔在此⽑细管端的⾏为是A ⽔从⽑细管端滴下;B ⽑细管端⽔⾯呈凸形弯⽉⾯;C ⽑细管端⽔⾯呈凹形弯⽉⾯;D ⽑细管端⽔⾯呈⽔平⾯。
答案:()原因:8. 讨论固体对⽓体的等温吸附的兰格缪尔(Langmuir)理论其最重要的基本假设为A. ⽓体是处在低压下B. 固体表⾯的不均匀性C. 吸附是单分⼦层的D. 吸附是多分⼦层的答案:()原因:9. 同时具有亲⽔和亲油基团的分⼦作为表⾯活性剂是因为 A. 在界⾯上产⽣负吸附 B. 能形成胶囊C. 在界⾯上定向排列降低了表⾯能D. 使溶液的表⾯张⼒增⼤答案:()原因:10. 温度T 时某⼀级反应A--→B,为了使A 的浓度改变1/5, 需时4s, 则反应的半衰期为 A. 12.42s B. 15.53s C. 4.14s D. 6.21s 答案:()原因:11. 对⾏反应当温度⼀定时由纯A 开始反应,下列说法中哪⼀点是不对的? A.起始时A 的消耗速率最快B.反应进⾏的净速率是正逆两向反应速率之差C.k 1/k -1的值是恒定的D.达到平衡时正逆两向的速率常数相同。
华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题
华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题〔适用专业:应化类材料物理与化学、化学工程、化学工艺、生物化工、工业催化、生物医学工程、应用化学、环境工程,未注明的为两类共用题〕•mol -1,现将353K ,标准压力下的1摩尔液态苯向真空等温蒸发为同温同压的苯蒸汽〔设为理想气体〕。
A .计算该过程苯吸收的热量和做的功;B .求过程的 G 和 S ;C .求环境的熵变;D .可以使用何中判据判断过程的性质。
〔12分〕解A .因真空蒸发, p 环=0⎰=-=∴0dV p W 环Q = U = H - (pV )压力变化不大时,压力对凝聚系统的焓、熵影响不大,所以 H 1=0、 S 1=0。
又理想气体恒温 H 3=0 ,所以H = H 1+ H 2+ H 3= H 2= n vap H m则 Q =n vap H m - p (V g -V l )= n vap H m - p V g ≈ n vap H m - nRT= 1×30770 J - 1mol × J ·K -1·mol -1×353K = 27835JB. S = S 1+ S 2+ S 3= S 2+ S 2= ( H 2/T )+ nR ln(p /p )= (30770J/353K)+1×·K -1×ln(101.325kPa/100kPa)·K -1G = H - T S = 30770J - 353K ×·K -1C. 环境熵变 :设系T =环TS 环= -Q 系/T 环= -27835J/353K =-78.85 J ·K -1D . 可用熵判据判断过程的性质,此过程S 隔= S 系+ S 环·K -1·K -1·K -1> 0 故为不可逆过程。
2.已知288.15K 时纯水的饱和蒸汽压为1705Pa ,现将1mol NaOH 溶解在4.559mol 水中,测得该溶液的饱和蒸汽压596.5Pa ,求:真空等温蒸发 H 、 SH 3、 S 3 (3)(1) H 1、 S 1苯 (l)1 mol 353K ,p 苯 ( l ) 1 mol 353 Kp = 101.325 k Pa苯 ( g ) 1 mol 353 K ,p苯 (g ) 1 mol 353 Kp = 101.325 kPa(2) H 2、 S 2A. A. 溶液中水的活度;B. B. 在纯水中和在溶液中,水的化学势的差值。
2002年华南理工大学物理化学考研真题及参考答案
3. 已知反应: 4Na (g) + O2 = 2 Na2O(s)
r Gm / (J·mol-1 ) = -1276222 + 890.6T/K-32.34( T/K)ln( T/K)
(a)
而反应: 4Cr(s) + 3 O2(g) 在 298K 时
= 2Cr2O3(s)
(b)
=2256.85 kJ·mol -1 r H m
2. 已知 H2O(l) 和 H2O(g) 的 S m (298K) 分别为 69.940 和 188.83 J·K-1·mol -1 ; f H m (298K)分别为
285.838 kJ·mol -1
和 241.825 kJ·mol -1 ; 假设相变过程的热效应随温度的变化可忽略不计。
= 547.77 J·mol -1 ·K-1 r Sm
rCp, m = 56 假设rCp, m 与温度无关。 (1) (2)
J·mol -1·K-1
写出反应(b)的 r Gm 与温度 T 的关系式;
证明在 p、温度低于 1063K 时 Cr2O3(s) 能被 Na(g)还原,即发生如下反应: 2Cr2O3 + 12Na(g) = 4 Cr(s) + 6 Na2O(s) (12 分) (c)
H = nCp,m(T2-T1) = [1×(12.471+8.3145)×(109.25-273.15)] J =-3407 J T V 10V 109.25 S nCV ,m ln 2 nR ln 2 [1 12.471ln 1 8.315ln 1 ]J K1 7.72J K1 T1 V1 273.15 V1 A U TS U T2 S S1 (T2 T1 ) [ 2043.9 109.25 7.72 13 (109.25 273.15)]J 756.6J G H TS H T2 S S1 (T2 T1 ) 2120J 注意: TS=T2S2-T1 S1 = T2(S1 + S)-T1 S1 ≠T1S + S1T
2023年华南理工大学攻读硕士学位研究生入学考试物理化学试题新编
2023年攻读硕士学位硕士入学考试试卷(请在答题纸上做答,试后本卷与答题纸一同交回)科目名称:物理化学(含物理化学试验)合用专业:化学工程、化学工艺、工业催化、环境工程、材料物理与化学1. C6H6在100kPa时旳熔点为5℃,摩尔熔化焓为9916J·mol-1,C p,m(l)=126.8J·K-1·mol-1,C p,m(s)=122.6J·K-1·mol-1。
求100kPa、–5℃下1 mol过冷C6H6凝固成固态C6H6旳Q、△U、△H、△S、△A、△G,假设凝固过程旳体积功可以忽视不计。
(12分)解:波及过程如下:∆H= ∆H1+ ∆H2+ ∆H3= C p,m(l)(T’-T) +∆H2+C p,m(s)(T-T’)=9916 J·mol-1+(122.6-126.8)×(268-278) J·mol-1= 9958 J·mol-1恒压Q= ∆H= 9958 J·mol-1∆U= ∆H- ∆pV ≈∆H=9958 J·mol-1∆S= ∆S1+ ∆S2+ ∆S3= C p,m(l)ln(T’/T) +∆H2/T’+C p,m(s)ln(T/T’)= ∆H2/T’+[C p,m(s)-C p,m(s)]ln(T/T’)=9916 J·mol-1/278K+(122.6-126.8)ln(268/278) J·K-1·mol-1= 35.8 J·K-1·mol-1∆G≈∆A= ∆H- T∆S = 9958 J·mol-1-268K×35.8 J·K-1·mol-1 = 363.6 J·mol-12. 卫生部规定汞蒸气在1m3空气中旳最高容许含量为0.01mg。
已知汞在20℃旳饱和蒸气压为0.160Pa,摩尔蒸气发焓为60.7kJ·mol-1(设为常数)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华南理工大学2002年攻读硕士学位研究生入学考试试卷科目名称:物理化学(含物理化学实验)1.在绝热的条件下,将0.4mol某理想气体从200kPa压缩到1000kPa时,温度从300K 上升到900K,求该过程的W、△H、△S、△U、△G,判断过程的性质并指出判据,已知:该理想气体在300K和200kPa时的摩尔熵为S m=205J·K-1·mol-1,定压摩尔热容为C p,m =3.5R(12分)解:分析过程:(p1=200kPa,V1,T1=300K)→(p2=1000kPa,,V2,T2=900K)绝热Q=0理想气体△U=nC V,m△T=n(C p,m-R)△T△H=nC p,m△T故W=△U-Q过程熵△S=nC p,m ln(T2/T1)+nR ln(p1/p2)△G=△(H-TS)=△H-(T2S2-T1S1)=△H-(T2△S-S1△T)过程绝热,所以只能用△S判断过程的方向。
注意:本题非恒外压,功一般由热力学第一定律式计算W=△U-Q。
2.298K时,反应N2O4(g)=2NO2(g)的平衡常数Kθ=0.155,标准摩尔焓为57.24kJ·mol-1(假定温度对反应焓的影响可以忽略不计)。
(共10分)求(1)373K时反应的平衡常数Kθ。
(2)298K,总压为pθ时N2O4的离解度。
(3)298K,总压为pθ,离解前N2O4和N2(惰性气体)物质的量为1:1时N2O4的离解度。
解:本题主要利用等压方程求不同温度下的平衡常数,以及与组成关系。
(1)等压方程:ln(K2θ/K1θ)=(T2-T1)∆r H mθ/R(T2T1)(2)N2O4(g)=2NO2(g)t=01mol0molt=∞时n1-x2x n总=1+x分压(1-x)pθ/(1+x)2x pθ/(1+x)K1θ=[2x/(1+x)]2/[(1-x)/(1+x)]=4x2/(1-x2)可求出x=(3)N2O4(g)=2NO2(g)N2t=01mol1molt=∞时n1-x2x1mol n总=2+x分压(1-x)pθ/(2+x)2x pθ/(2+x)K1θ=[2x/(2+x)]2/[(1-x)/(2+x)]=4x2/(2-x-x2)可求出x=3.水的蒸汽压与温度之间可用如下关系式表示:lg (p /Pa)=-A /T +B若已知水在77℃时的饱和蒸汽压为41.847kPa ,求:(1)常数A ,B 的值以及水的摩尔蒸发焓;(2)在多大外压下水的沸点可以改变为101℃;(共8分)解:(1)给出的关系式实际上为克-克方程的不定积分式。
题目只给出一个温度下的蒸汽压,代入方程无法求解。
所以必须考虑其他条件或常识,即水在100℃时的饱和蒸汽压为101.325kPa ,代入自然就可得到A ,B 。
至于∆vap H m 可用与A 的关系计算:∆vap H m =-2.303×AR亦可用克-克方程的定积分式计算。
(2)外压压力即为101℃时的水的饱和蒸汽压。
4.(NH 4)2SO 4-H 2O 所组成的二组分系统,在-19.1℃时有一个低共熔点,此时冰、(NH 4)2SO 4(s)和浓度为38.4%(质量分数,下同)的(NH 4)2SO 4水溶液平衡共存。
在108.9℃时(NH 4)2SO 4饱和溶液(浓度为51.8%)沸腾。
(1)试绘出相图示意图。
(2)分析各组分存在的相平衡。
(3)含30%的(NH 4)2SO 4水溶液冷却能否得到纯固体(NH 4)2SO 4?若不能,如何得到纯固体(NH 4)2SO 4?(4)1kg 含51.8%的(NH 4)2SO 4水溶液在何温度下能得到最多的纯固体(NH 4)2SO 4,计算出最多能得到的(NH 4)2SO 4的量。
(共12分)解:(1)相图和各相组成如下H 2O (NH 4)2SO 4t / %(质量)(3)不能。
可通过加热蒸发使硫酸铵的浓度增大至超过38.4%(或51.8%)即可.(4)冷却到接近-19.1℃时能得到最多的纯固体。
设固体量为W s ,利用杠杆规则则有,(51.8-38.4)(1kg -W s)=(100-51.8)W sW s=0.218kg5.25℃时,电池Zn(s)|ZnCl 2(b =0.555mol ·kg -1)|AgCl(s)|Ag(s)的电动势E =1.015V ,(∂E /∂T )p =-4.02×10-4V ·K -1。
已知E θ(Zn 2+/Zn)=-0.7630V,E θ(AgCl/Ag,Cl -)=0.2220V 。
(1)写出电池反应。
(2)求上述反应的平衡常数K θ。
(3)求电解质溶液ZnCl 2的平均活度系数。
(4)求上述反应在定浓条件下,在恒压无其他功的反应器中进行或在电池中可逆地进行时吸放的热量各为多少?(共12分)解:(1)电极反应:Zn(s)→Zn 2++2e —AgCl(s)+e —→Ag(s)+Cl —电池反应:Zn(s)+2AgCl(s)→2Ag(s)+ZnCl 2(l)(2)K θ =exp(zFE θ/RT )=exp[2×96500×(0.2220+0.7630)/8.315/298.2]=1.983×1033(3)=E θ-(0.05916/2)lg[43(b /b θ)3]])(4ln[2ln 23θ3θZnCl θ2bb F RT E F RT E E ±-=-=γα±γ,而,3θ3Z n C l 2 ⎪⎭⎫ ⎝⎛==±±±b b a a γ b b b b b b 3/13/12/14])2([)(=⨯==-+-+±ννν代入 1.015=(0.2220+0.7630)-(0.05916/2)lg(4×3×0.5553)±γγ±=0.521(4)可逆电池Q r =zFT (∂E /∂T )p =2×96500×298.2×(-4.02×10-4)J ·mol -1=-23136J ·mol -1非电池反应:Q p =∆r H =∆r G +T ∆r S =∆r G +Q r =-zFE +Q r =[-2×96500×1.015+(-23136)]J ·mol -1=-219031J ·mol -16.25℃时乙醇水溶液的表面张力与溶液中乙醇的浓度c (单位mol ·dm -3)的关系为γ/(N ·m -1)=[72-0.5(c /mol ·dm -3)+0.2(c /mol ·dm -3)2]×10-3计算c =0.6mol ·dm -3时,(1)乙醇在液面的表面过剩;(2)将半径为10-3m 的玻璃毛细管垂直插入该溶液中(设乙醇水溶液完全润湿毛细管),溶液在毛细管中上升高度是多少?已知该溶液的密度为986kg ·m -3,重力加速度为9.8N ·kg -1。
(共8分)解:(1)Γ=-(c /RT )d γ/d c=-(c /RT )[0.4(c /mol ·dm -3)-0.5]×10-3N ·m -1/(mol ·dm -3)=-[0.6/(8.315×298.2)](0.4×0.6-0.5)×10-3mol ·m -2=6.29×10-8mol ·m -2注意单位的处理!(2)h =2γ/ρgr =2×(72-0.5×0.6+0.2×0.62)×10-3/(986×9.8×10-3m)=0.0149m7.乙醛热分解CH 3CHO →CH 4+CO 是不可逆反应,在518℃及恒容条件下,有数据:求(1)乙醛分解的反应级数;(2)计算518℃时的速率常数;(3)实验测得在538℃时的速率常数是518℃时的两倍,计算该反应的活化能。
(共12分)解:本题与天津大学《物理化学》第四版教材11.33题基本相同。
设甲醛为A ,因为是恒温恒容反应,可用压力代替浓度进行有关计算。
A →CH 4+COt =0p A000总压p =p A0t =t p A p A0-p A p A0-p A 总压p =2p A0-p A所以p A =2p A0-p(1)可用多种方法求解。
比较简单的是积分法。
假设为级数n =1,则k =ln(p A0/p A )/t =ln[p A0/(2p A0-p )]/t代入数据:k 1=ln[0.400/(2×0.400-0.500)]/100s=0.00288s -1k 2=ln[0.200/(2×0.200-0.229)]/100s=0.00157s -1速率常数相差太多,可否定为一级反应。
假设为二级反应,则k =(p A -1-p A0-1)t代入数据得:k 1=[(2×0.400-0.500)-1-0.400-1]kPa -1/100s =0.00833kPa -1·s -1k 2=[(2×0.200-0.229)-1-0.200-1]kPa -1/100s =0.00848kPa -1·s -1速率常数非常接近,所以可认为是二级反应。
用n 级反应的压力与时间式代入建立一个方程,用尝试法求n 亦可。
(2)速率常熟k =(k 1+k 2)/2=0.00841kPa -1·s -1。
(3)E a =RT 1T 2ln(k ’/k )/(T 2-T 1)=(8.315×793.15×813.15×ln2/20)J ·mol -1=186kJ ·mol -18.有一平行反应A BC 在500K 时,k 1、k 2分别为4.65s -1和3.74s -1。
求(1)A 转化90%所需要的时间;(2)求总反应的表观活化能。
已知两平行反应的活化能E 1、E 2分别为20kJ ·mol -1和26kJ ·mol -1。
(共10分)解:本题需掌握一级平行反应的规律才容易做。
若没掌握,需自己推导。
(1)A 的转化率x 与时间的关系如下:t =-ln(1-x )/(k 1+k 2)=-ln(1-0.90)/(4.65s -1+3.74s -1)=0.2744s(2)E =(k 1E 1+k 2E 2)/(k 1+k 2)=(4.65×20+3.74×26)kJ ·mol -1/(4.65+3.74)=22.67kJ ·mol -1初始压力(纯乙醛)0.400kPa 0.200kPa 100秒后系统总压0.500kPa 0.229kPa9.将稀KI和AgNO3(过量)溶液混合制成溶胶。
