碘标记血管紧张素Ⅰ放射免疫分析药盒说明书
血管紧张素Ⅱ(AⅡ)测定试剂盒(化学发光免疫分析法)产品技术要求mairui

2性能要求
2.1外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;
Ra:应为棕色含固体微粒的液体,无板结、无絮状物。
Rb:应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
Rc:应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓
度的相对偏差在±10%范围内。
2.4最低检测限
应不大于4pg/mL。
2.5线性
试剂盒在4pg/mL ~1000 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 8%。
2.7批间差
变异系数CV 应≤ 10%。
2.8稳定性
2~8℃避光保存,试剂盒有效期为365 天。
到效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6 的要求。
碘[125I]雌二醇放射免疫分析药盒说明书
![碘[125I]雌二醇放射免疫分析药盒说明书](https://uimg.taocdn.com/dbaa1fcb58f5f61fb7366648.webp)
批号:20121020碘[125I]雌二醇放射免疫分析药盒说明书【药品名称】通用名:碘[125I]雌二醇放射免疫分析药盒英文名:Iodine[125I] Estradiol Radioimmunoassay Kit汉语拼音:Dian[125I] Ci’erchun Fangshemianyifenxi Yaohe简称:碘[125I]-E2放免药盒【成分】1、125I-E2:1瓶,红色液体。
放射性活性<0.11MBq/瓶(100管)。
2、E2标准品:7瓶,淡黄色液体(去激素人血清配置。
浓度分别为:0;10;50;100;250;500;1000pg/ml)。
3、兔抗-E2抗体:1瓶,蓝色液体(兔抗)。
4、质量血清:2瓶,淡黄色液体。
参考值范围:质控血清Ⅰ56.5±12.8 pg/ml质控血清Ⅱ 248.6±58.6 pg/ml5、分离试剂:1瓶,悬浮液(含驴抗兔血清和PEG).【放射性核素半衰期】碘[125I]物理半衰期(T1/2)为59.7天。
【测定原理】本药盒采用竞争性放射免疫分析方法,将放射性标记抗原和非标记抗原和非标记待测抗原同时与限量特异抗体进行竞争结合反应,通过分离未结合的标记抗原,测定标记抗原-抗体复合物的放射性计数,利用标准曲线和RIA的数学模型计算样品中待测物质的含量。
【临床意义】人体内雌二醇是雌激素中生物活性最强的雌激素。
男性雌二醇由睾丸产生,女性则由卵巢分泌。
循环血液中的雌二醇绝大部分与性激素结合球蛋白结合,在肝脏代谢,变成水溶性硫酸酯或葡萄糖醛酸酯,经肾脏排出。
男性E2水平升高主要是由睾丸或肝脏肿瘤所致。
女性E2会促进生殖上皮、乳腺、长骨的生长发育和第二性征的发育。
测定E2对青春期前女性内分泌疾病的诊断,对闭经、月经紊乱、卵巢功能评估有重要意义,是研究生殖生理和诊断不孕症的重要手段。
【禁忌】受检者在试验期间不得接受内放射性核素检查或治疗。
【样品采集】取静脉血分离血清,无须加防腐剂及其他处理,溶血和脂血标本影响测定结果。
(医疗药品)放射免疫诊断药盒
注:药盒中均不含抗凝剂,需单独购买,具体价格见试剂与原料。
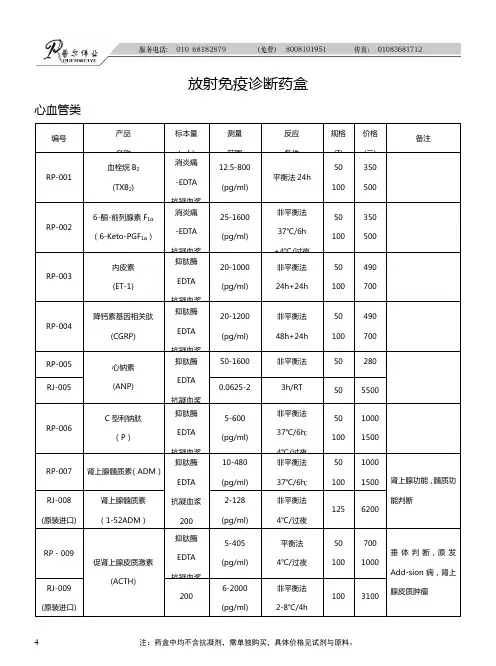
4放射免疫诊断药盒心血管类编号产品 名称标本量 (µl) 测量 范围 反应 条件 规格 (T) 价格 (元) 备注RP-001血栓烷B 2 (TXB 2)消炎痛-EDTA 抗凝血浆 12.5-800 (pg/ml)平衡法24h50 100350 500RP-0026-酮-前列腺素F 1α (6-Keto-PGF 1α)消炎痛-EDTA 抗凝血浆 25-1600 (pg/ml)非平衡法 37℃/6h +4℃/过夜50 100350 500RP-003内皮素 (ET-1)抑肽酶 EDTA 抗凝血浆 20-1000 (pg/ml)非平衡法 24h+24h50 100490 700RP-004降钙素基因相关肽(CGRP)抑肽酶 EDTA 抗凝血浆 20-1200 (pg/ml) 非平衡法 48h+24h 50 100 490 700RP-005 心钠素 (ANP)抑肽酶 EDTA 抗凝血浆50-1600 (pg/ml) 非平衡法 24h+24h 50 100 280 400RJ-005 (原装进口) 0.0625-2 (ng/ml) 3h/RT 2-8℃/20h 50 5500 RP-006C 型利钠肽 (P )抑肽酶 EDTA 抗凝血浆 5-600 (pg/ml) 非平衡法 37℃/6h; 4℃/过夜 50 100 1000 1500RP-007 肾上腺髓质素(ADM )抑肽酶 EDTA抗凝血浆 200 10-480 (pg/ml) 非平衡法 37℃/6h; 50 100 1000 1500 肾上腺功能,髓质功能判断RJ-008 (原装进口)肾上腺髓质素 (1-52ADM )2-128 (pg/ml) 非平衡法 4℃/过夜 1256200RP -009促肾上腺皮质激素(ACTH)抑肽酶EDTA 抗凝血浆 5-405 (pg/ml)平衡法 4℃/过夜50 100700 1000垂体判断,原发Add-sion 病,肾上腺皮质肿瘤RJ-009 (原装进口)2006-2000 (pg/ml)非平衡法 2-8℃/4h1003100注:药盒中均不含抗凝剂,需单独购买,具体价格见试剂与原料。
碘标记血管紧张素Ⅱ放射免疫分析药盒说明书
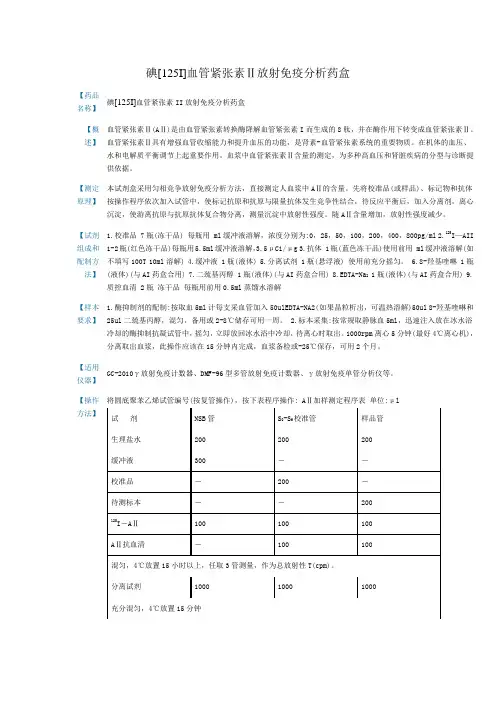
碘[125I]血管紧张素Ⅱ放射免疫分析药盒【药品名称】碘[125I]血管紧张素II放射免疫分析药盒【概述】血管紧张素Ⅱ(AⅡ)是由血管紧张素转换酶降解血管紧张素I而生成的8肽,并在酶作用下转变成血管紧张素Ⅱ。
血管紧张素Ⅱ具有增强血管收缩能力和提升血压的功能,是肾素-血管紧张素系统的重要物质。
在机体的血压、水和电解质平衡调节上起重要作用。
血浆中血管紧张素Ⅱ含量的测定,为多种高血压和肾脏疾病的分型与诊断提供依据。
【测定原理】本试剂盒采用匀相竞争放射免疫分析方法,直接测定人血浆中AⅡ的含量。
先将校准品(或样品)、标记物和抗体按操作程序依次加入试管中,使标记抗原和抗原与限量抗体发生竞争性结合,待反应平衡后,加入分离剂,离心沉淀,使游离抗原与抗原抗体复合物分离,测量沉淀中放射性强度。
随AⅡ含量增加,放射性强度减少。
【试剂组成和配制方法】1.校准品 7瓶(冻干品) 每瓶用 ml缓冲液溶解,浓度分别为:0,25,50,100,200,400,800pg/ml 2.125I—AII 1-2瓶(红色冻干品)每瓶用5.5ml缓冲液溶解,3.5μCi/μg 3.抗体 1瓶(蓝色冻干品)使用前用 ml缓冲液溶解(如不填写100T 10ml溶解) 4.缓冲液 1瓶(液体) 5.分离试剂 1瓶(悬浮液) 使用前充分摇匀。
6.8-羟基喹啉 1瓶(液体)(与AI药盒合用) 7.二巯基丙醇 1瓶(液体)(与AI药盒合用) 8.EDTA-Na2 1瓶(液体)(与AI药盒合用) 9.质控血清 2瓶冻干品每瓶用前用0.5ml蒸馏水溶解【样本要求】1.酶抑制剂的配制:按取血5ml计每支采血管加入50ulEDTA-NA2(如果晶粒析出,可温热溶解)50ul 8-羟基喹啉和25ul二巯基丙醇,混匀,备用或2-8℃储存可用一周。
2.标本采集:按常规取静脉血5ml,迅速注入放在冰水浴冷却的酶抑制抗凝试管中,摇匀,立即放回冰水浴中冷却,待离心时取出。
放射性免疫药盒

放射性免疫药盒引言放射性免疫药盒是一种用于存放和运输放射性免疫药物的设备。
放射性免疫疗法是一种基于辐射治疗和免疫疗法的结合技术,对肿瘤、自身免疫性疾病等疾病有着广泛的应用。
在放射性免疫疗法中,合适的药盒对于药物的稳定性和安全性至关重要。
本文将介绍放射性免疫药盒的特点、材料、设计和使用注意事项。
特点放射性免疫药盒具有以下几个特点:1.辐射防护:放射性免疫药盒采用特殊的材料,能够有效阻挡辐射波,避免对人员和环境造成伤害。
2.稳定性:放射性免疫药盒能够保持药物的稳定性,避免药物在运输过程中发生变化。
3.密封性:放射性免疫药盒具有良好的密封性,能够防止药物泄漏或外部污染物进入药盒。
4.标识明确:放射性免疫药盒上有明确的标识,包括药物名称、剂量、有效期等信息,方便使用和管理。
材料放射性免疫药盒的材料选择十分重要,需要满足以下几个要求:1.辐射防护:材料应具有较高的辐射防护能力,能够有效吸收和隔离辐射波。
2.耐腐蚀性:材料应具有良好的耐腐蚀性,能够抵抗药物的腐蚀和氧化。
3.密封性:材料应具有良好的密封性,能够防止药物泄漏或外部污染物进入药盒。
4.轻便耐用:材料应轻便、耐用,方便携带和使用。
常见的放射性免疫药盒材料包括铅、钴、铀等具有较高密度的金属,以及塑料、玻璃等具有较好耐腐蚀性和密封性的材料。
设计放射性免疫药盒的设计需要考虑以下几个因素:1.尺寸合适:药盒的尺寸应根据药物的容量和使用需求进行调整,既要满足药物的存放要求,又要方便携带和使用。
2.密封性:药盒应具有良好的密封性,能够有效防止药物泄漏或外部污染物进入药盒。
3.标识清晰:药盒上的标识应清晰可见,包括药物名称、剂量、有效期等信息,方便使用和管理。
4.辐射防护:药盒应具有较高的辐射防护能力,能够有效吸收和隔离辐射波。
使用注意事项在使用放射性免疫药盒时,需要注意以下几个事项:1.严格遵守操作规程:使用者应严格按照操作规程进行操作,避免药物泄漏或误操作造成伤害。
放射性药品生产质量管理规范

放射性药品生产质量管理规范(草)第一章范围第一条放射性药品是指用于临床诊断或者治疗的放射性核素制剂或者其标记药物。
本附录所指放射性药品包括:体内诊断用放射性药品(即时标记药品,尿素[14C]胶囊和呼气试验药盒、氯化亚铊[201Tl]注射液) 、体内治疗用放射性药品(体内植入制品、正电子类、碘[131I]化钠口服溶液和胶囊、氯化锶[89Sr]注射液) 、产生放射性核素的装置(发生器、反应堆、加速器) 、放射免疫分析药盒、配套药盒、放射化学品等。
第二条本附录适用于放射性药品生产企业、核研究院或中心、PET 中心等。
第二章原则第三条放射性药品具有如下特点:(1)放射性核素遵循特定规律衰变;(2)化学量少;(3)个性化给药。
因此其生产管理的关键点是辐射防护、防止核素的污染和交叉污染;其质量控制关键点是放射性活度、放射性核素纯度、放射化学纯度。
对于短半衰期放射性药品,应特别关注产品召回管理。
第三章机构人员第四条生产管理负责人、质量管理负责人、质量受权人应具有核医学、核药学专业知识及放射性药品生产和质量管理经验。
生产和质量管理负责人不得互相兼任。
第五条应设置辐射防护管理机构,其主要职责为:(1)(2)(3) 组织辐射防护法规的实施,开展辐射防护知识的宣传、教育和培训;负责对辐射防护工作进行监督检查;及时向有关部门报告放射性事故,并协助调查处理。
第六条从事放射性药品生产的人员应经专业技术及辐射防护知识培训,并取得岗位操作证书。
第七条从事质量检验的人员应经放射性药品检验技术及辐射防护知识培训,并取得岗位操作证书。
第八条放射性操作人员必须配带个人剂量计,并定期监测。
个人所受的剂量当量不应超过规定的限值。
生产碘[I]制品的人员应定期检查甲状腺中碘[I]量,至少每月一次。
125125第四章设施设备第九条厂房应符合国家关于辐射防护的有关规定,并获得辐射安全许可证。
第十条不同核素的放射性药品生产区应严格分开。
放射性工作区与非放射性工作区应有效隔离。
碘[25i]雌二醇放射免疫分析药盒说明书
批号:碘[125I]雌二醇放射免疫分析药盒说明书【药品名称】通用名:碘[125I]雌二醇放射免疫分析药盒英文名:Iodine[125I] Estradiol Radioimmunoassay Kit汉语拼音:Dian[125I] Ci’erchun Fangshemianyifenxi Yaohe简称:碘[125I]-E2放免药盒【成分】1、125I-E2:1瓶,红色液体。
放射性活性<0.11MBq/瓶(100管)。
2、E2标准品:7瓶,淡黄色液体(去激素人血清配置。
浓度分别为:0;10;50;100;250;500;1000pg/ml)。
3、兔抗-E2抗体:1瓶,蓝色液体(兔抗)。
4、质量血清:2瓶,淡黄色液体。
参考值范围:质控血清Ⅰ56.5±12.8pg/ml质控血清Ⅱ 248.6±58.6 pg/ml5、分离试剂:1瓶,悬浮液(含驴抗兔血清和PEG).【放射性核素半衰期】碘[125I]物理半衰期(T1/2)为59.7天。
【测定原理】本药盒采用竞争性放射免疫分析方法,将放射性标记抗原和非标记抗原和非标记待测抗原同时与限量特异抗体进行竞争结合反应,通过分离未结合的标记抗原,测定标记抗原-抗体复合物的放射性计数,利用标准曲线和RIA的数学模型计算样品中待测物质的含量。
【临床意义】人体内雌二醇是雌激素中生物活性最强的雌激素。
男性雌二醇由睾丸产生,女性则由卵巢分泌。
循环血液中的雌二醇绝大部分与性激素结合球蛋白结合,在肝脏代谢,变成水溶性硫酸酯或葡萄糖醛酸酯,经肾脏排出。
男性E2水平升高主要是由睾丸或肝脏肿瘤所致。
女性E2会促进生殖上皮、乳腺、长骨的生长发育和第二性征的发育。
测定E2对青春期前女性内分泌疾病的诊断,对闭经、月经紊乱、卵巢功能评估有重要意义,是研究生殖生理和诊断不孕症的重要手段。
【禁忌】受检者在试验期间不得接受内放射性核素检查或治疗。
【样品采集】取静脉血分离血清,无须加防腐剂及其他处理,溶血和脂血标本影响测定结果。
放射免疫诊断药盒
放射免疫诊断药盒放射免疫诊断药盒是临床上常用的一种检验试剂盒,主要用于检测身体内某些物质的含量,以帮助诊断疾病。
下面将结合临床应用和科学理解,从多个方面介绍放射免疫诊断药盒。
一、放射免疫诊断药盒的基本概念放射免疫诊断药盒(radioimmunoassay, RIA)是一种采用标记物与待分析物竞争或结合技术的免疫学检测方法。
放射免疫诊断药盒常用于测定血、尿、唾液、汗液、脑脊液等生物体内含量很低的某些物质,例如肾上腺素、胰岛素、生长激素、甲状腺激素、雌激素等。
放射免疫诊断药盒的核心技术是放射性同位素示踪和抗体结合技术。
放射性同位素示踪法是利用放射性同位素标记待检测物质,使之成为标记物。
最常用的同位素是放射性碘(如125I、131I),由于该方法具有灵敏度高、特异性强、标记容易、检测结果稳定等优点,被广泛应用于临床检验中。
抗体结合技术是指将含有待检测物质的标本与标记有抗体的同位素混合,形成一个“抗原-抗体”复合物,经过洗涤去除未结合的标本,以测定复合物中的同位素含量,从而确定待检测物质的浓度。
二、放射免疫诊断药盒的优势1. 高灵敏度:放射免疫诊断药盒可以检测生物体内含量非常少的物质,灵敏度常在picomole级别,相对于一些常规检测方法,其灵敏度较高。
2. 高特异性:采用抗体结合技术,不仅可以确保检测物质是目标物质,而且也能够精确地区分相似结构的物质。
3. 操作简单:放射免疫诊断药盒方法无需多步操作,操作简单易行,检测速度快。
4. 数据稳定:放射免疫诊断药盒通过放射性贴标示追踪物质,跟踪检测物质,保证检测方法的准确性和可靠性。
同时,该方法的测定结果可以通过放射手段进行永久保存。
三、放射免疫诊断药盒的局限性1.运输和使用过程中的辐射安全问题:由于放射免疫诊断药盒使用放射性同位素进行标记,因此在运输和使用过程中危及到实验室工作人员的辐射安全问题亟待解决。
2.消耗品成本高:由于放射免疫诊断药盒所需的材料成本较高,以及分析过程中同位素的使用量较大,这导致了该方法在大规模应用上存在一定的局限性。
碘[125I]癌胚抗原放射免疫分析药盒
碘[125I]癌胚抗原放射免疫分析药盒Dian[125I]Aipeikangyuan Fangshemianyifenxi YaoheIodine[125I]Carcinoembryonic Antigen Radioimmunoassay Kit说明书本药盒是碘[125I]标记的癌胚抗原放射免疫分析药盒,药盒简称:碘[125I]-癌胚抗原放免药盒。
用于血清中癌胚抗原含量的测定。
[临床意义]癌胚抗原(Carcino-embrgonic antigen) 是一种分子量约为20万的糖蛋白,正常人体内含量甚微,当某些器官发生恶变时,这种蛋白的合成会增加。
癌胚抗原作为重要的肿瘤相关抗原,主要用于消化器官腺体肿瘤的检测,如胃癌、肠癌、胆管癌、胰腺癌等。
此外,对肺癌,乳腺癌、卵巢癌、宫颈癌以及肝癌转移也有一定意义。
[原理与方法]采用放免竞争抑制顺序饱和分析原理,并用第二抗体加PEG作分离剂的方法,实现对血清、血浆、胸水、腹水及其它体液中CEA浓度的直接测定。
[药盒组成及贮存条件]1、碘[125I]—癌胚抗原:(一瓶)红色溶液。
2℃-8℃遮光保存有效期内稳定。
100管/瓶放射性活度≤0.185MBq(≤5μCi)。
125I物理半衰期(T1/2)为59.7天。
2、癌胚抗原标准品:(六瓶)用去激素人血清配制,其浓度分别为0、2、5、10、20、40、80ng/ml。
2℃-8℃遮光保存至少40天稳定,-20℃保存至有效期内稳定。
3、癌胚抗原抗体:(一瓶)蓝色溶液(兔抗)。
2℃-8℃遮光保存有效期内稳定。
4、质量控制样品:(二瓶)。
2℃-8℃遮光保存有效期内稳定。
-20℃保存至有效期内稳定。
5、分离剂:(一瓶)。
悬浮液(含驴抗兔血清和PEG)。
2℃-8℃遮光保存有效期内稳定。
以上各组份均应在使用前配制且摇匀使用。
[标本采集]取晨空腹静脉血,分离血清。
2—8。
C放置可保存一周,若冰冻保存,可放置四周。
溶血和脂血标本不能使用,高浓度血清标本(癌胚抗原>80ng/ml),应先用生理盐水稀释,计算结果时,要注意标本稀释倍数。
放射免疫分析的原理
放射免疫分析的原理放射免疫分析(Radioimmunoassay,RIA)是一种利用放射性同位素标记抗原或抗体来检测物质浓度的技术。
该技术广泛应用于临床诊断、生物化学研究以及药物筛选等领域,具有高灵敏度和高特异性的特点。
放射免疫分析的原理是基于抗原与抗体之间的特异性结合。
抗原是一种能够诱导免疫系统产生抗体的物质,而抗体是一种能够特异性结合抗原的免疫蛋白。
在放射免疫分析中,通常选择特异性结合抗原的抗体,并利用放射性同位素标记抗原或抗体,以便测定样品中抗原或抗体的浓度。
放射免疫分析的步骤一般包括抗原标记、抗体固定、分离和计数等几个关键步骤。
首先,将抗原标记上放射性同位素,通常使用的同位素有碘-125(125I)、碘-131(131I)、氘-3(3H)等。
标记后的放射性抗原具有相对稳定的放射性,可用于测定抗原的浓度。
然后,将已标记的抗原与待测样品中的抗原进行特异性结合,并通过添加抗体来固定放射标记的抗原。
接着,利用分离技术(如沉淀法、凝胶层析法等)将游离的抗体或抗原分离出来。
最后,通过放射计数器测定标记抗原或抗体的放射性强度,从而计算出待测样品中抗原或抗体的浓度。
放射免疫分析的原理基于放射性同位素的高灵敏度和稳定性,使得其具有极高的检测灵敏度和特异性。
相对于传统的免疫分析方法,如酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)等,放射免疫分析能够在极低的抗原浓度下进行检测,且能够检测复杂样品中的微量物质。
因此,放射免疫分析广泛用于检测激素、生物分子、药物和疾病标志物等各种生物样品中的微量物质。
然而,放射免疫分析也存在一些局限性,主要是由于放射性同位素的使用带来的放射性污染和辐射风险。
为了克服这一局限性,人们提出了许多新的代替技术,如免疫荧光分析(immunofluorescence assay,IFA)、化学发光免疫分析(chemiluminescence immunoassay,CLIA)等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【药品
名称】
碘标记血管紧张素I放射免疫分析药盒
【概述】肾素-血管紧张素系统在机体的血压、水、电解质平衡的调节上起着重要作用。
因此血浆肾素活性(PRA)和血管紧张素Ⅱ(AⅡ)浓度的测定已经成为原发性和继发性高血压的诊断及研究的重要指标。
血浆肾素活性(PRA)的测定是以血管紧张素I(AI)产生的速率来表示的,血管紧张素I(AI)是由肾素作用于血管紧张素原而生成的10肽,它被血管紧张素转换酶降解成血管紧张素Ⅱ。
血管紧张素I正常生理浓度下无生物活性。
PRA、AⅡ二者测定均采用酶抑制剂来阻断转换酶和血管紧张素酶的活性,以达到准确测定PRA和AⅡ的目的。
该项指标的测定,可作为判断肾素活性和对多种高血压及肾脏疾病诊断、分型的依据。
【测定原理】本试剂盒采用匀相竞争放射免疫分析方法,测定人血浆中AI的含量。
先将校准品(或样品)、标记物和抗体按操作程序依次加入试管中,使标记抗原和抗原与限量抗体发生竞争性结合,待反映平衡后,加入分离剂,离心沉淀,使游离抗原与抗原抗体复合物分离,测量沉淀中放射性强度。
随AI含量增加,放射性强度减少。
【试剂组成和配制方法】1.校准品 7瓶(冻干品) 每瓶用 ml缓冲液溶解,浓度分别为:0,0.19,0.38,0.75,1.5,3.0,6.0ng/ml 2.125I —AI 1-2瓶(红色冻干品) 每瓶用5.5ml缓冲液溶解,3.5μCi/μg 3.抗体 1瓶(蓝色冻干品) 使用前用 ml缓冲液溶解(如不填写100T 10ml溶解) 4.缓冲液 1瓶(液体) 5.分离试剂 1瓶(悬浮液) 使用前充分摇匀。
6.8-羟基喹啉 1瓶(液体) 7.二巯基丙醇 1瓶(液体) 8.EDTA-Na21瓶(液体) 9.保温液 1瓶(液体) 10.质控血清 2瓶(冻干品) 使用前用0.5ml缓冲液溶解
【样本要求】1.酶抑制剂的配制:按取血5ml计每支采血管加入50ulEDTA-NA2(如果晶粒析出,可温热溶解)50ul8-羟基喹啉和25ul二巯基丙醇,混匀,备用或2-8℃储存可用一周。
2.标本采集:按常规取静脉血5ml,迅速注入放在冰水浴冷却的酶抑制抗凝试管中,摇匀,立即放回冰水浴中冷却,待离心时取出。
1000rpm离心5分钟(最好4℃离心机),分离取出血浆,此操作应该在15分钟内完成,血浆备检或-25℃保存,可用2个月。
3.标本处理:测定前将冰冻的血浆标本在流动的冰水浴中快速融化,快速取双份标本,每份分别加入10ul保温液。
作对照管的一份标本放在冰水浴中,作为测定管的一份标本放在37℃水浴中温育1小时,取样后放入冰水浴中。
【适用
仪器】
GC-2010γ放射免疫计数器、DMF-96型多管放射免疫计数器、γ放射免疫单管分析仪等。
【操作方法】将圆底聚苯乙烯试管编号(按复管操作),按下表程序操作: AI加样测定程序表单位:μl 试剂NSB管S0-S6校准管对照管样品管生理盐水100 100 100 100
缓冲液200 ―――
校准品―100 ――
待测血浆标本――100 100
125I―AI 100 100 100 100
AI抗血清―100 100 100
混匀,4℃放置15小时以上,任取3管测量,作为总放射性T(cpm)。
分离试剂1000 1000 1000 1000
充分混匀,4℃放置15分钟
3500 rpm离心(离心力1500g)15分钟,立即吸去上清液,测各管沉淀的放射性计数(cpm)。
【数据
处理】以B/B0%为纵坐标,以校准品浓度为横坐标,在Logit-Log坐标纸上绘制校准曲线,根据样品B/B0%,从校准曲线上查出样品的含量,目前多用于自动γ计数仪预先编制的程序直接给出有关参数、校准曲线及样品浓度。
【质量
控制】
对质控血清的测定结果在允许范围内。
【方法
的局限
性】
本药盒仅用于血浆样本的测定,对其它体液样本测定的可靠性尚未得到充分的实验确认。
【对实
验结果
的解
释】
本药盒的检测结果不是临床适应症的唯一确认指标,其临床意义需结合其它检测指标及临床表现具体分析判断。
【有效
期】
2-8℃避光保存效期30天。
【注意事项】1.使用本药盒的实验室应具有“放射性同位素使用许可证”,使用过程中产生的放射性废物应按国家有关规定处理。
2.本药盒内不同批号的试剂不能混用,同一批号的试剂可混合均匀后使用。
3.各试剂必须摇匀后使用,使用前应平衡到室温(15-28℃)。
4.离心后吸弃上清液时注意不要损失沉淀。
5.标记物和校准品溶解使用后应该冰冻保存。
【包装
规格】
100T/盒。
