第六章习题解答
第六章-化学反应动力学习题解答

第六章 化学反应动力学思考题解答一、是非题(判断下列说法是否正确,并说明理由)1. 错2. 对3. 错4. 错5. 错6. 错7. 对8. 对9.错 10. 对 二、选择题1. B2. A.3. B.4. D. 5 .C 6.D. 7. A. 8. B 9. B. 10. C.习题解答1.请根据质量作用定律,写出下列各基元反应或复合反应中Ad d c t与各物质浓度的关系。
(1)2A + B 2P k−−→ (2)A + 2B P + 2S k−−→ (3)22A + M A M k−−→+ (4)2A B (5)2A 2B+D B+A 2D(6)解:(1)2A A B d 2d c kc c t -= (2)2A A Bd d c kc c t -=(3)2A A M d 2d c kc c t -= (4)2A 2B 1A d 2+2d c k c k c t -=- (5)222A 1B D 1A 2A B 2D d 2+2+d c k c c k c k c c k c t ---=--(6)A 1A 2A 3C d d ck c k c k c t-=+-2.某人工放射性元素放出α粒子,半衰期为15min 。
试问多长时间后该试样能分解掉80%。
解:由题意得该反应为一级反应,符合一级反应的条件,则112ln 2t k =得 1k = ln 215=0.0462mol -1 由积分定义式 1ln ak t a x=- 令0.8xy a==得 11ln 1k t y =- 则 t=34.84mink 1 k-1 k 1 k-1 k k3.反应25222N O (g)4NO (g)O (g)−−→+,在318K 下测得N 2O 5的浓度如下: t /min 0 20 40 60 80 100 120 140 160 c /mol·m -317.69.735.462.951.670.940.500.280.16求该反应的级数和速率常数及半衰期。
基础化学习题解答(第六章)

第六章沉淀溶解平衡与沉淀滴定思考题与习题一、填空题1.同离子效应使难溶电解质的溶解度降低。
2.根据待测组分与其他组分分离方法的不同,称量分析法一般分为沉淀法、气化法和电解法。
3. 称量分析法的主要操作过程包括溶解、沉淀、过滤和洗涤、烘干和灼烧、称量4. 根据滴定方式、滴定条件和选用指示剂的不同,银量法划分为莫尔法、佛尔哈德法、法杨司法。
5.莫尔法是在中性或弱碱性介质中,以K2CrO4_作指示剂的一种银量法;而佛尔哈德法是在酸性介质中,以AgNO3作指示剂的一种银量法。
二、选择题1.AgCl和Ag2CrO4的溶度积分别为1.8×10-10和2.0×10-12,则下面叙述中正确的是( C )A. AgCl与Ag2CrO4的溶解度相等;B. AgCl的溶解度大于Ag2CrO4;C.二者类型不同,不能由K大小直接判断溶解度大小;spD.都是难溶盐,溶解度无意义。
2.下面的叙述中,正确的是( B )A.溶度积大的化合物溶解度肯定大;B.向含AgCl固体的溶液中加适量的水使AgCl溶解又达平衡时,AgCl溶度积不变,其溶解度也不变;C.将难溶电解质放入纯水中,溶解达平衡时,电解质离子浓度的乘积就是该物质的溶度积;D. AgCl水溶液的导电性很弱,所以AgCl为弱电解质。
3.CaF2沉淀在pH=3的溶液中的溶解度较pH=5溶液中的溶解度( B )A.小;B.大;C.相等;D.可能大可能小。
4.已知Mg(OH)2的K=1.8×10-11,则Mg(OH)2饱和溶液中的pH是( A )spA. 3.59;B. 10.43;C. 4.5;D. 9.41。
5.指出下列条件适于佛尔哈德法的是( C )113A. pH6.5~10;B.以K2CrO4为指示剂;C.滴定酸度为0.1~1mol/L;D.以荧光黄为指示剂。
三、是非题(下列叙述中对的打“√”,错的打“×”)K越小,则其溶解度也越小。
习题解答6

第六章氧化还原反应习题解答:1.配平下列离子反应方程式(酸性介质)解:(1)IO3- + I-→ I2IO3- + 5I- + 6H+ =3I2 +3H2O(2)Mn2+ + NaBiO3 → MnO4- + Bi3+2Mn2+ + 5NaBiO3 +14H+= 2MnO4- + 5Bi3+ +7H2O+ 5Na+(3)Cr3+ + PbO2→ Cr2O72- + Pb2+2Cr3+ +3 PbO2+ H2O = Cr2O72- +3 Pb2+ + 2H+(4)HClO + P4→ Cl- + H3PO410HClO + P4+ 6H2O = 10Cl- +4 PO43-+ 22H+2. 配平下列离子反应方程式(碱性介质)(1)CrO42- + HSnO2- → CrO2- + HSnO3-2H2O+CrO42-+3e- = CrO2-+4OH-+)2OH-+HSnO2- = HSnO3-+H2O+2e-x32CrO42-+3HSnO2-+H2O = 2CrO2-+3HSnO3-+2OH-(2)H2O2 + CrO2-→ CrO42-3H2O2 + 2CrO2- + 2OH- = 2CrO42-+ 4H2O(3)I2 + H2AsO3- → AsO43- + I-I2 + H2AsO3- + 4OH- = AsO43- + 2I-+ 3H2O(4)Si + OH- → SiO32- + H2Si + 2OH- + H2O=SiO32- + 2H2(5)Br2 + OH- → BrO3- + Br-3Br2 + 6OH- = BrO3- + 5Br-+ 3H2O3. 某原电池中的一个半电池是有金属钴(Co) 浸在1.0 mol∙L-1 Co2+ 溶液中组成的;另一半电池则由铂(Pt) 片浸入1.0 mol∙L-1 Cl- 的溶液中,并不断通入Cl2 (p(Cl2)为101.325 kPa) 组成。
第六章 醇、酚、醚习题解答

第六章醇、酚、醚一、学习要求1.掌握醇、酚、醚的结构和命名。
2.掌握醇、酚、醚的主要化学性质和醇的重要的物理性质。
3.了解硫醇、硫醚和冠醚的结构、命名、性质及其重要用途。
二、本章要点醇、酚、醚是三类重要的有机化合物,有的在医药上用作消毒剂、麻醉剂、溶剂,有的是有机合成的常用原料。
(一)醇1.结构醇分子中的羟基氧为不等性sp3杂化,其中2个杂化轨道被2对未成键电子占据,另2个杂化轨道分别与α- C的sp3杂化轨道和氢原子的S轨道形成σ键。
由于氧的电负性大,故羟基氧电子云密度大,氢电子云密度小,因此氢氧键极性较大。
2. 命名醇的普通命名是在“醇”前加上烃基名称,并省去“基”字。
醇的系统命名原则是:(1)选择含有羟基的最长碳链作为主链,称为“某醇”,并使羟基相连的碳原子编号最小,将羟基位次写在“某醇”之前,其余的原则与烷烃相同。
(2)多元醇,应选择含羟基数目最多的最长碳链作主链,按羟基数目的多少称为“某二醇”、“某三醇”等。
(3)不饱和一元醇:选择既含羟基又含不饱和键数目最多的最长碳链作主链,编号时应使羟基位次最小,根据主链碳原子数称为“某烯(炔)醇”,并在“烯(炔)”、“醇”前面标明不饱和键和羟基的位次。
(4)命名芳香醇时,将芳环作为取代基,以侧链脂肪醇为母体。
(5)脂环醇,根据脂环烃基的名称,称为“环某醇”,从羟基所连接的碳原子开始,按“取代基位次之和最小”的原则给环碳原子编号,将取代基的位次、数目、名称依次写在“环某醇”的名称之前。
3. 性质(1)重要物理性质:由于醇可形成分子间氢键,故低级醇的沸点通常比相对分子质量相近的烷烃高得多。
随着醇中烷基的增大,醇羟基与水形成氢键的能力逐渐减弱,因此低级醇易溶于水,中级醇部分溶于水,高级醇则不溶于水。
(2)主要化学性质:①醇与活泼金属(如Na、K、Mg、Al等)反应,生成相应的醇盐,并放出氢气。
醇与活泼金属的反应速率顺序为:1)低级醇>中级醇>高级醇;2)甲醇>伯醇>仲醇>叔醇②醇可以与氢卤酸、卤化磷及氯化亚砜等发生亲核取代反应。
第六章金属电子论习题
电导率
q2 m*
n (EF0 )
弛豫时间
( E F0
)
m*
nq 2
平均自由程
v (EF0 )
m*v
nq 2
kF
nq2
0 K到室温之间的费密半径变化很小
9
固体物理
固体物理学
或近自由电子近似情况下
EF
EF0
1
2
12
kBT EF0
2
kF m
1.055
10 34 1.20 9.1110 31
0
10
1.39 106 m / s
固体物理
固体物理学
(4) 费密球面的横截面积
S (kF sin )2 4.52 sin 2m2
是 与 轴之间的夹角
kF
(3n
2
)
1 3
8
固体物理
固体物理学
(5) 在室温以及低温时电子的平均自由程
3
固体物理
固体物理学
N
N(
( E F0
E
)
)
4V
(
2m h2
3N / 2EF0
)3/2 E1/2
N(E)
(
EF EF0
)1/
2
N
(
EF0
)
TF
EF0 kB
3N 2kB N (EF0 )
3 6.0221023 21.3811023 3.321042
19624K
N
固体物理
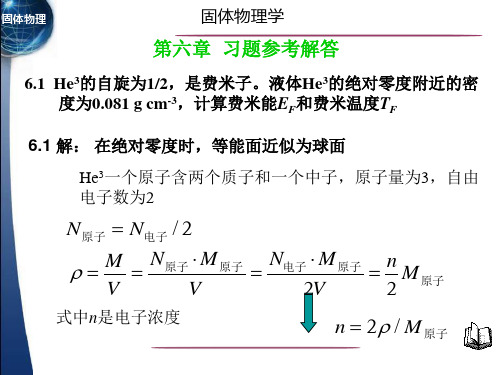
第六章习题参考答案

第六章 MCS-51的定时/计数器1. 如果采用晶振的频率为3MHz ,定时器/计数器工作方式0、1、2下,其最大的定时时间为多少? 解答:因为机器周期)(410312126s f T OSC cy μ=⨯==, 所以定时器/计数器工作方式0下,其最大定时时间为)(768.321042261313ms T T C MAX =⨯⨯=⨯=-;同样可以求得方式1下的最大定时时间为262.144ms ;方式2下的最大定时时间为1.024ms 。
2. 定时/计数器用作定时器时,其计数脉冲由谁提供?定时时间与哪些因素有关?答:定时/计数器作定时时,其计数脉冲由系统振荡器产生的内部时钟信号12分频后提供。
定时时间与时钟频率和定时初值有关。
3. 定时/计数器用作定时器时,对外界计数频率有何限制?答:由于确认1次负跳变要花2个机器周期,即24个振荡周期,因此外部输入的计数脉冲的最高频率为系统振荡器频率的1/24。
4.采用定时器/计数器T0对外部脉冲进行计数,每计数100个脉冲后,T0转为定时工作方式。
定时1ms 后,又转为计数方式,如此循环不止。
假定MCS-51单片机的晶体振荡器的频率为6MHz ,请使用方式1实现,要求编写出程序。
解:定时器/计数器T0在计数和定时工作完成后,均采用中断方式工作。
除了第一次计数工作方式设置在主程序完成外,后面的定时或计数工作方式分别在中断程序完成,用一标志位识别下一轮定时器/计数器T0的工作方式。
编写程序如下:ORG 0000HLJMP MAINORG 000BHLJMP IT0PMAIN: M OV TMOD,#06H ;定时器/计数器T0为计数方式2 MOV TL0,#156 ;计数100个脉冲的初值赋值MOV TH0,#156SETB GATE ;打开计数门SETB TR0 ;启动T0,开始计数SETB ET0 ;允许T0中断SETB EA ;CPU开中断CLR F0 ;设置下一轮为定时方式的标志位W AIT: AJMP W AITIT0P: CLR EA ;关中断JB F0,COUNT ;F0=1,转计数方式设置MOV TMOD,#00H ;定时器/计数器T0为定时方式0MOV TH0,#0FEH ;定时1ms初值赋值MOV TL0,#0CHSETB EA RETICOUNT: MOV TMOD,#06HMOV TL0,#156SETB EARETI5. 定时器/计数器的工作方式2有什么特点?适用于哪些应用场合? 答:定时器/计数器的工作方式2具有自动恢复初值的特点,适用于精确定时,比如波特率的产生。
第六章 习题解答
2
Λm =
κ
c
=(
0.944 )Ω −1 ⋅ m 2 ⋅ mol−1 = 9.44 × 10−3 Ω −1 ⋅ m 2 ⋅ mol−1 3 0.1 × 10
6-6 用银电极电解 AgNO3 溶液。通电一段时间后,测得在阴极上析出 1.15g 银,并知 + + 阴极区溶液中 Ag 的总量减少了 0.605g。试计算 AgNO3 溶液中离子的迁移数 t(Ag )和 t(NO3-) 。 解:在电解池的阴极上:Ag +e →Ag(s),每还原 1molAg 则需 96500C 的电量,所以通 过电解池的总电量: Q 总 =
-
x-
(2) t (K + ) = 0.6 /1 = 0.6; t ([Ag(CN) 2 ]− ) = 1 − 0.6 = 0.4
6-9 用铜电极电解 CuSO4 溶液。电解前每 100g 溶液中含 10.06g CuSO4,通电一段时 间后,测得在银电量计中沉积了 0.5008g 银,并测知阳极区溶液重 54.565g,其中含 CuSO4 2- 2+ 5.726g。试计算 CuSO4 溶液中离子的迁移数 t(Cu )和 t(SO4 ) 。
第六章 电化学
6-1 用铂电极电解 CuCl2 溶液,通过的电流为 20A,经过 15min 后,问在阴极上能析 出多少铜?在阳极上能析出多少 27℃、100kPa 下的 Cl2? 解: (1)在电解池的阴极上 Cu +2e →Cu(s) 析出 Cu 的质量:
2+ -
m=
M Cu It 63.546 × 10−3 × 20 × 15 × 60 =( )kg = 5.927 × 10−3 kg ZF 2 × 96500
-3 -1
第6章习题解答
根据题意,可知:平面波的角频率ω = 18π ×106 rad s ;波数 k = 1π rad m 3
由此得出
频率: f = ω = 9×106 Hz ; 2π
相速: vp = f λ = 54 ×106 m s
波长: λ = 2π = 6m k
能流密度矢量为
S
=
E
×
H
=
ex
1 η
sin2 (18π
e
z
A/m
(3)当t = 10−8 s 时,为使电场强度为最大正值,应有
PDF 文件使用 "pdfFactory Pro" 试用版本创建
2π ×108 t − 4π x + π = 2π ×108×10−8 − 4π x + π = ±2nπ
36
36
解之得的电场强度最大正值的位置在
(V/m)
f = c = 3×108 = 45 ×108 = 1.43×109 (Hz) λ π /15 π
于是可知
H = −e y 3π cos(9 ×109 t + 30z) (A/m)
E = e x 360π 2 cos(9 ×109 t + 30z) (V/m)
6-4 在自由空间中,某电磁波的波长为 0.2m。当该波进入到理想电介质后,波长变为 0.09m。
x = 13 m 3 n = 13 m nλ 82 8
(n = 0,1,2L)
6-9 某电台发射 600KHz 的电磁波,在离电台足够远处可以认为是平面波。设在某一点 a, 某瞬间的电场强度为10−4 V/m,求该点瞬间的磁场强度。若沿电磁波的传播方向前行 100 m,到达另一点 b,问该点要迟多少时间,才具有10−4 V/m 电场。
高等数学课后答案第六章习题详细解答
高等数学课后答案第六章习题详细解答-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN习 题 6—11、在平行四边形ABCD 中设−→−ABa −→−ADb 试用a 和b 表示向量−→−MA 、−→−MB 、−→−MC 、−→−MD其中M 是平行四边形对角线的交点解: 由于平行四边形的对角线互相平分 所以ab −→−−→−==AMAC 2 即 (ab )−→−=MA2 于是 21-=−→−MA (ab )因为−→−−→−-=MAMC 所以21=−→−MC (ab ) 又因a b −→−−→−==MDBD 2 所以21=−→−MD (ba )由于−→−−→−-=MD MB 所以21=−→−MB (ab )2、若四边形的对角线互相平分,用向量方法证明它是平行四边形. 证: AM =,=,∴=+=+=AD 与 BC 平行且相等,结论得证.3、 求起点为)1,2,1(A ,终点为)1,18,19(--B 的向量→AB 与12AB −−→-的坐标表达式.解:→AB =j i k j i 2020)11()218()119(--=-+--+--={20,20,0}--, 12AB −−→-={10,10,0}4、 求平行于a ={1,1,1}的单位向量. 解:与a 平行的单位向量为{}1,1,131±=±a a .5、在空间直角坐标系中,指出下列各点在哪个卦限?(1,1,1),A - (1,1,1),B -(1,1,1),C -- (1,1,1).D -- 解: A:Ⅳ; B:Ⅴ; C:Ⅷ; D:Ⅲ.6、 求点),,(z y x M 与x 轴,xOy 平面及原点的对称点坐标.解:),,(z y x M 关于x 轴的对称点为),,(1z y x M --,关于xOy 平面的对称点为),,(2z y x M -,关于原点的对称点为),,(3z y x M ---.7、已知点A(a, b, c), 求它在各坐标平面上及各坐标轴上的垂足的坐标(即投影点的坐标). 解:分别为),0,0(),0,,0(),0,0,(),,0,(),,,0(),0,,(c b a c a c b b a .8、过点(,,)P a b c 分别作平行于z 轴的直线和平行于xOy 面的平面,问它们上面的点的坐标各有什么特点?解:平行于z 轴的直线上面的点的坐标:x a,y b,z R ==∈;平行于xOy 面的平面上的点的坐标为 z c,x,y R =∈.9、求点P (2,-5,4)到原点、各坐标轴和各坐标面的距离.解:到原点的距离为x y 轴的距离为到z10、 求证以)1,3,4(1M 、)2,1,7(2M 、)3,2,5(3M 三点为顶点的三角形是一个等腰三角形. 解:222212(74)(13)(21)14M M =-+-+-=,222223(57)(21)(32)6M M =-+-+-=222213(45)(32)(13)6M M =-+-+-=,即1323M M M M =,因此结论成立.11、 在yoz 坐标面上,求与三个点A(3, 1, 2), B(4, -2, -2), C(0, 5, 1)等距离的点的坐标. 解:设yoz 坐标面所求点为),,0(z y M ,依题意有||||||MC MB MA ==,从而222)2()1()30(-+-+-z y 222)2()2()40(++++-=z y222)2()1()30(-+-+-z y联立解得2,1-==z y ,故所求点的坐标为)2,1,0(-.12、 z 轴上,求与点A(-4, 1, 7), 点B(3, 5,-2)等距离的点. 解:设所求z 轴上的点为),0,0(z ,依题意:222)7()10()40(-+-++z 222)2()50()30(++-+-=z ,两边平方得914=z ,故所求点为)914,0,0(.13、 求λ使向量}5,1,{λ=a 与向量}50,10,2{=b 平行. 解:由b a //得5051012==λ得51=λ.14、 求与y 轴反向,模为10的向量a 的坐标表达式.解:a =j j 10)(10-=-⋅={0,10,0}-.15、求与向量a ={1,5,6}平行,模为10的向量b 的坐标表达式. 解:}6,5,1{6210==a a a ,故 {}6,5,16210100±=±=a b .16、 已知向量6410=-+a i j k ,349=+-b i j k ,试求: (1)2+a b ; (2)32-a b .解:(1) 264102(349)1248i a b i j k i j k j k +=-+++-=+-; (2)323(6410)2(349)=122048a b =i j k i j k i j k --+-+--+.17、已知两点A 和(3,0,4)B ,求向量AB 的模、方向余弦和方向角.解: 因为(1,1)AB =-, 所以2AB =,11cos ,cos 22αβγ===-,从而 π3α=,3π4β=,2π3γ=.18、设向量的方向角为α、β、γ.若已知其中的两个角为π3α=,2π3β=.求第三个角γ.解: π3α=,2π3β=,由222cos cos cos 1αβγ++=得21cos 2γ=.故π4γ=或3π4.19、 已知三点(1,0,0)=A ,(3,1,1)B ,(2,0,1)C ,求:(1)BC 与CA 及其模; (2)BC 的方向余弦、方向角;(3)与BC 同向的单位向量.解:(1)由题意知{}{}23,01,111,1,0,BC =---=--{}{}12,00,011,0,1,CA =---=-- 故 2,2==BC CA .(2)因为{}1,1,0,=--BC 所以,由向量的方向余弦的坐标表示式得:cos 0αβγ===,方向角为:3,42ππαβγ===.(3)与BC 同向的单位向量为:o a =⎧⎫=⎨⎬⎩⎭BCBC .20、 设23,23,34,m i j k n i j k p i j k =++=+-=-+和23a m n p =+-求向量在x 轴上的投影和在y 轴上的分向量.解:2(23)3(23)(34)5114a i j k i j k i j k i j k =++++---+=+-.故向量a 在x 轴上的投影5=x a ,在y 轴上的投影分量为11y a j =.21、一向量的终点为点B(-2,1,-4),它在x 轴,y 轴和z 轴上的投影依次为3,-3和8,求这向量起点A 的坐标.解:设点A 为(x, y, z ),依题意有:84,31,32=---=-=--z y x , 故12,4,5-==-=z y x ,即所求的点A (-5, 4,-12).22、 已知向量a 的两个方向余弦为cos α=72 ,cos β=73, 且a 与z 轴的方向角是钝角.求cos γ. 解:因222cos cos cos 1,αβγ++=22223366cos 1cos 77497γγ=-==±故()—(),,又γ是钝角,所以76cos -=γ.23、设三力1232234F ,F ,F i j i j k j k =-=-+=+作用于同一质点,求合力的大小和方向角. 解: 合力123(2)(234)()F F F F i k i j k j k =++=-+-+++323i j k =-+,因此,合力的大小为|F |=合力的方向余弦为,222cos ,cos 223cos -===βγα因此παγβ===-习 题 6—21、 {}0,0,1=a ,{}0,1,0=b ,)1,0,0(=c ,求⋅a b ,c a ⋅,c b ⋅,及a a ⨯,b a ⨯,c a ⨯,c b ⨯. 解:依题意,i a =,j b =,k c =,故0=⋅=⋅j i b a ,0=⋅=⋅k i c a ,0=⋅=⋅k j c b .0=⨯=⨯i i a a ,k j i b a =⨯=⨯,j k i c a -=⨯=⨯,i k j c b =⨯=⨯.2、 }}{{1,2,2,21,1==b a ,,求b a ⋅及b a ⨯ .a 与b的夹角余弦.解:(1)121221⋅=⨯+⨯+⨯=a b 6, 112221⨯==i j ka b }{3,3,0-.(2)cos a b a b a b θ++==3、 已知 π5,2,,3∧⎛⎫=== ⎪⎝⎭a b a b ,求23a b -解:()()2232323-=-⋅-a b a b a b 22412976=-⋅+=a a b b ,∴ 23-=ab4、 证明下列问题:1)证明向量}{1,0,1=a 与向量}{1,1,1-=b 垂直. 2) 证明向量c 与向量()()a c b b c a ⋅-⋅垂直. 证:1)01110)1(1=⨯+⨯+-⨯=⋅b a ,^π(,)2a b ∴=,即a 与b 垂直. 2) [()()]⋅-⋅⋅a c b b c a c [()()]=⋅⋅-⋅⋅a c b c b c a c ()[]=⋅⋅-⋅c b a c a c 0=[()()]∴⋅-⋅⊥a c b b c a c .5、 求点)1,2,1(M 的向径OM 与坐标轴之间的夹角.解:设OM 与x 、y 、z 轴之间的夹角分别为γβα,,,则211)2(11cos 22=++==α, 22cos ==β, 21cos ==γ. 3π=∴α, 4π=β, 3π=γ.6、 求与k j i a ++=平行且满足1=⋅x a 的向量x .解:因x a //, 故可设{}λλλλ,,==a x ,再由1=⋅x a 得1=++λλλ,即31=λ,从而⎭⎬⎫⎩⎨⎧=31,31,31x .7、求与向量324=-+a i j k ,2=+-b i j k 都垂直的单位向量.解:=⨯=xy z xy zij kc a b a a a b b b 324112=--i j k =105+j k,||10==c0||∴=c c c=.⎫±⎪⎭j8、 在顶点为)2,1,1(-A 、)2,6,5(-B 和)1,3,1(-C 的三角形中,求三角形ABC 的面积以及AC 边上的高BD .解:{0,4,3},{4,5,0}AC AB =-=-,三角形ABC 的面积为,22516121521||21222=++=⨯=A S ||||21,5)3(4||22BD S ==-+= ||521225BD ⋅⋅= .5||=∴BD9、 已知向量≠0a ,≠0b ,证明2222||||||()⨯=-⋅a b a b a b .解 2222||||||sin ()∧⨯=⋅a b a b ab 222||||[1cos ()]∧=⋅-a b ab 22||||=⋅a b 222||||cos ()∧-⋅a b ab 22||||=⋅a b 2().-⋅a b10、 证明:如果++=0a b c ,那么⨯=⨯=⨯b c c a a b ,并说明它的几何意义.证: 由++=0a b c , 有()++⨯=⨯=00a b c c c , 但⨯=0c c ,于是⨯+⨯=0a c b c ,所以⨯=-⨯=⨯b c a c c a . 同理 由()++⨯=0a b c a , 有 ⨯=⨯c a a b ,从而 ⨯=⨯=⨯b c c a a b . 其几何意义是以三角形的任二边为邻边构成的平行四边形的面积相等.11、 已知向量23,3=-+=-+a i j k b i j k 和2=-c i j ,计算下列各式: (1)()()⋅-⋅a b c a c b (2)()()+⨯+a b b c (3)()⨯⋅a b c (4)⨯⨯a b c 解: (1)()()8(2)8(3)⋅-⋅=---+=a b c a c b i j i j k 824--j k .(2) 344,233+=-++=-+a b i j k b c i j k ,故()()+⨯+a b b c 344233=-=-i jk--j k . (3)231()231(2)(85)(2)11311312-⨯⋅=-⋅-=--+⋅-=-=--i jk a b c i j i j k i j 2.(4)由(3)知85,()851120⨯=--+⨯⨯=--=-i jka b i j k a b c 221++i j k .习 题 6—31、已知)3,2,1(A ,)4,1,2(-B ,求线段AB 的垂直平分面的方程. 解:设),,(z y x M 是所求平面上任一点,据题意有|,|||MB MA =()()()222321-+-+-z y x ()()(),412222-+++-=z y x化简得所求方程26270x y z -+-=.这就是所求平面上的点的坐标所满足的方程, 而不在此平面上的点的坐标都不满足这个方程,所以这个方程就是所求平面的方程.2、 一动点移动时,与)0,0,4(A 及xOy 平面等距离,求该动点的轨迹方程.解:设在给定的坐标系下,动点),,(z y x M ,所求的轨迹为C ,则(,,)M x y z C MA z ∈⇔= 亦即 z z y x =++-222)4( 0)4(22=+-∴y x 从而所求的轨迹方程为0)4(22=+-y x .3、 求下列各球面的方程:(1)圆心)3,1,2(-,半径为6=R ; (2)圆心在原点,且经过点)3,2,6(-;(3)一条直径的两端点是)3,1,4()5,32(--与;(4)通过原点与)4,0,0(),0,3,1(),0,0,4(- 解:(1)所求的球面方程为:36)3()1()2(222=-+++-z y x(2)由已知,半径73)2(6222=+-+=R ,所以球面方程为49222=++z y x (3)由已知,球面的球心坐标1235,1213,3242=-=-=+-==+=c b a , 球的半径21)35()31()24(21222=++++-=R ,所以球面方程为: 21)1()1()3(222=-+++-z y x(4)设所求的球面方程为:0222222=++++++l kz hy gx z y x因该球面经过点)4,0,0(),0,3,1(),0,0,4(),0,0,0(-,所以⎪⎪⎩⎪⎪⎨⎧=-=++=+=08160621008160k h g g l 解之得⎪⎪⎩⎪⎪⎨⎧=-=-==2210k g h l∴所求的球面方程为0424222=+--++z y x z y x .4、将yOz 坐标面上的抛物线22y z =绕z 旋转一周,求所生成的旋转曲面的方程. 解:222x y z +=(旋转抛物面) .5、将zOx 坐标面上的双曲线12222=-cz a x 分别绕x 轴和z 轴旋转一周,求所生成的旋转曲面的方程.解: 绕x 轴旋转得122222=+-c z y a x 绕z 轴旋转得122222=-+cz a y x .6、指出下列曲面的名称,并作图:(1)22149x z +=;(2)22y z =;(3)221x z += ;(4)22220x y z x ++-=;(5)222y x z +=;(6)22441x y z -+=;(7)221916x y z ++=; (8)222149x y z -+=-;(9)1334222=++z y x ;(10)2223122z y x +=+. 解: (1)椭圆柱面;(2) 抛物柱面;(3) 圆柱面;(4)球面;(5)圆锥面;(6)双曲抛物面;(7)椭圆抛物面;(8)双叶双曲面;(9)为旋转椭球面;(10)单叶双曲面.7、指出下列方程在平面解析几何和空间解析几何中分别表示什么图形?(1)1+=x y;(2)422=+y x ;(3)122=-y x ;(4)22x y =.解:(1)1+=x y 在平面解析几何中表示直线,在空间解析几何中表示平面; (2)422=+y x 在平面解析几何中表示圆周,在空间解析几何中表示圆柱面; (3)122=-y x 在平面解析几何中表示双曲线,在空间解析几何中表示双曲柱面; (4)y x 22=在平面解析几何中表示抛物线,在空间解析几何中表示抛物柱面.8、 说明下列旋转曲面是怎样形成的?(1)1994222=++z y x ;(2)14222=+-z y x (3)1222=--z y x ;(4)222)(y x a z +=-解:(1)xOy 平面上椭圆19422=+y x 绕x 轴旋转而成;或者 xOz 平面上椭圆22149+=x z 绕x 轴旋转而成(2)xOy 平面上的双曲线1422=-y x 绕y 轴旋转而成;或者 yOz 平面上的双曲线2214-=y z 绕y 轴旋转而成(3)xOy 平面上的双曲线122=-y x 绕x 轴旋转而成;或者 xOz 平面上的双曲线221x z -=绕x 轴旋转而成(4)yOz 平面上的直线a y z +=绕z 轴旋转而成或者 xOz 平面上的直线z x a =+绕z 轴旋转而成.9、 画出下列各曲面所围立体的图形:(1)012243=-++z y x 与三个坐标平面所围成;(2)42,42=+-=y x x z 及三坐标平面所围成;(3)22=0,(0)=1z z =a a >,y =x,x +y 及0x =在第一卦限所围成;(4)2222,8z x y z x y =+=--所围.解:(1)平面012243=-++z y x 与三个坐标平面围成一个在第一卦限的四面体; (2)抛物柱面24z x =-与平面24x y +=及三坐标平面所围成;(3)坐标面=0z 、0x =及平面(0)z =a a >、y=x 和圆柱面22=1x +y 在第一卦限所围成; (4)开口向上的旋转抛物面22z x y =+与开口向下的抛物面228z x y =--所围.作图略.习 题 6—41、画出下列曲线在第一卦限内的图形(1)⎩⎨⎧==21y x ;(2)⎪⎩⎪⎨⎧=---=0422y x y x z ;(3)⎪⎩⎪⎨⎧=+=+222222a z x ay x解:(1)是平面1x =与2y =相交所得的一条直线; (2)上半球面z 与平面0x y -=的交线为14圆弧; (3)圆柱面222x y a +=与222x z a +=的交线.图形略.2、分别求母线平行于x 轴及y 轴而且通过曲线⎪⎩⎪⎨⎧=-+=++0162222222y z x z y x 的柱面方程.解:消去x 坐标得16322=-z y ,为母线平行于x 轴的柱面;消去y 坐标得:162322=+z x ,为母线平行于y 轴的柱面.3、求在yOz 平面内以坐标原点为圆心的单位圆的方程(任写出三种不同形式的方程).解:⎩⎨⎧==+0122x z y ;⎩⎨⎧==++01222x z y x ; ⎪⎩⎪⎨⎧=+=++1122222z y z y x .4、试求平面20x -=与椭球面222116124x y z ++=相交所得椭圆的半轴与顶点.解:将椭圆方程22211612420x y z x ⎧++=⎪⎨⎪-=⎩化简为:221932y z x ⎧+=⎪⎨⎪=⎩,可知其为平面2=x 上的椭圆,半轴分别为3,3,顶点分别为)3,0,2(),3,0,2(),0,3,2(),0,3,2(--.5 、将下面曲线的一般方程化为参数方程(1)2229x y z y x ⎧++=⎨=⎩; (2)⎩⎨⎧==+++-04)1()1(22z z y x解:(1)原曲线方程即:⎪⎩⎪⎨⎧=+=199222z x xy ,化为⎪⎪⎪⎩⎪⎪⎪⎨⎧=≤≤==tz t t y t x sin 3)20(cos 23cos 23π;(2))20(0sin 3cos 31πθθθ≤≤⎪⎪⎩⎪⎪⎨⎧==+=z y x .6、求螺旋线⎪⎩⎪⎨⎧===θθθb z a y a x sin cos 在三个坐标面上的投影曲线的直角坐标方程.解:⎩⎨⎧==+0222z a y x ;⎪⎩⎪⎨⎧==0sin x b z a y ;⎪⎩⎪⎨⎧==0cosy b z a x .7、指出下列方程所表示的曲线(1)222253⎧++=⎨=⎩x y z x (2)⎩⎨⎧==++13094222z z y x ;(3)⎩⎨⎧-==+-3254222x z y x ; (4)⎩⎨⎧==+-+408422y x z y ; (5)⎪⎩⎪⎨⎧=-=-0214922x z y . 解:(1)圆; (2)椭圆; (3)双曲线; (4)抛物线; (5)双曲线.8、 求曲线⎩⎨⎧==-+30222z x z y 在xOy 面上的投影曲线方程,并指出原曲线是何种曲线.解:原曲线即:⎩⎨⎧=-=3922z x y ,是位于平面3=z 上的抛物线,在xOy 面上的投影曲线为⎩⎨⎧=-=0922z x y 9、 求曲线 ⎪⎩⎪⎨⎧==++211222z z y x 在坐标面上的投影. 解:(1)消去变量z 后得,4322=+y x 在xOy 面上的投影为,04322⎪⎩⎪⎨⎧==+z y x 它是中心在原点,半径为23的圆周. (2)因为曲线在平面21=z 上,所以在xOz 面上的投影为线段.;23||,021≤⎪⎩⎪⎨⎧==x y z (3)同理在yOz 面上的投影也为线段..23||,021≤⎪⎩⎪⎨⎧==y x z10、 求抛物面x z y =+22与平面 02=-+z y x 的交线在三个坐标面上的投影曲线方程.解: 交线方程为⎩⎨⎧=-+=+0222z y x x z y ,(1)消去z 得投影,04522⎩⎨⎧==-++z x xy y x(2)消去y 得投影2252400x z xz x y ⎧+--=⎨=⎩,(3)消去x 得投影2220y z y z x ⎧++-=⎨=⎩.习 题 6—51、写出过点()3,2,10M 且以{}1,2,2=n 为法向量的平面方程. 解:平面的点法式方程为()()()032212=-+-+-z y x .2、求过三点()()()01,0,0,1,0,0,0,1C B A 的平面方程.解:设所求平面方程为0=+++d cz by ax ,将C B A ,,的坐标代入方程,可得d c b a -===,故所求平面方程为1=++z y x .3、求过点()1,0,0且与平面1243=++z y x 平行的平面方程. 解:依题意可取所求平面的法向量为}2,4,3{=n ,从而其方程为()()()0120403=-+-+-z y x 即 2243=++z y x .4、求通过x 轴和点(4, -3, -1)的平面的方程.解:平面通过x 轴, 一方面表明它的法线向量垂直于x 轴, 即A =0; 另一方面表明 它必通过原点, 即D =0. 因此可设这平面的方程为By +Cz =0.又因为这平面通过点(4, -3, -1), 所以有-3B -C =0, 或C =-3B . 将其代入所设方程并除以B (B ≠0), 便得所求的平面方程为y -3z =0.5、求过点)1,1,1(,且垂直于平面7=+-z y x 和051223=+-+z y x 的平面方程.解:},1,1,1{1-=n }12,2,3{2-=n 取法向量},5,15,10{21=⨯=n n n所求平面方程为化简得:.0632=-++z y x6、设平面过原点及点)1,1,1(,且与平面8x y z -+=垂直,求此平面方程.解: 设所求平面为,0=+++D Cz By Ax 由平面过点)1,1,1(知平0,A B C D +++=由平面过原点知0D =,{1,1,1},n ⊥- 0A B C ∴-+=,0A C B ⇒=-=,所求平面方程为0.x z -=7、写出下列平面方程:(1)xOy 平面;(2)过z 轴的平面;(3)平行于zOx 的平面;(4)在x ,y ,z 轴上的截距相等的平面.解:(1)0=z ,(2)0=+by ax (b a ,为不等于零的常数), (3)c y = (c 为常数), (4) a z y x =++ (0)a ≠.8、 求平行于0566=+++z y x 而与三个坐标面所围成的四面体体积为1的平面方程. 解: 设平面为,1=++cz b y a x ,1=V 111,32abc ∴⋅=由所求平面与已知平面平行得,611161c b a == 化简得,61161c b a ==令tc t b t a t c b a 61,1,6161161===⇒===代入体积式 11111666t t t ∴=⋅⋅⋅ 1,6t ⇒=±,1,6,1===∴c b a 或1,6,1,a b c =-=-=-所求平面方程为666x y z ++=或666x y z ++=-.9、分别在下列条件下确定n m l ,,的值:(1)使08)3()1()3(=+-+++-z n y m x l 和016)3()9()3(=--+-++z l y n x m 表示同一平面; (2)使0532=-++z my x 与0266=+--z y lx 表示二平行平面; (3)使013=+-+z y lx 与027=-+z y x 表示二互相垂直的平面.解:(1)欲使所给的二方程表示同一平面,则:168339133-=--=-+=+-l n n m m l 即: ⎪⎩⎪⎨⎧=-+=-+=-+092072032n l m n l m ,解之得 97=l ,913=m ,937=n . (2)欲使所给的二方程表示二平行平面,则:6362-=-=m l ,所以4-=l ,3=m . (3)欲使所给的二方程表示二垂直平面,则:7230l ++=所以: 57l =-.10 、求平面011=-+y x 与083=+x 的夹角;解:设011=-+y x 与083=+x 的夹角为θ,则cosθ==∴ 4πθ=.11、 求点(2,1,1)到平面2240x y z +-+=的距离.解:利用点到平面的距离公式可得933d ===.习 题 6—61、求下列各直线的方程:(1)通过点)1,0,3(-A 和点)1,5,2(-B 的直线; (2) 过点()1,1,1且与直线433221-=-=-z y x 平行的直线. (3)通过点)3,51(-M 且与z y x ,,三轴分别成︒︒︒120,45,60的直线; (4)一直线过点(2,3,4)-A ,且和y 轴垂直相交,求其方程. (5)通过点)2,0,1(-M 且与两直线11111-+==-z y x 和01111+=--=z y x 垂直的直线; (6)通过点)5,3,2(--M 且与平面02536=+--z y x 垂直的直线. 解:(1)所求的直线方程为:015323-=-=++z y x 即:01553-=-=+z y x ,亦即01113-=-=+z y x . (2)依题意,可取L 的方向向量为{}4,3,2=s ,则直线L 的方程为413121-=-=-z y x . (3)所求直线的方向向量为:{}⎭⎬⎫⎩⎨⎧-=︒︒︒21,22,21120cos ,45cos ,60cos ,故直线方程为: 132511--=+=-z y x . (4)因为直线和y 轴垂直相交,所以交点为),0,3,0(-B 取{2,0,4},BA s −−→==所求直线方程.440322-=+=-z y x (5)所求直线的方向向量为:{}{}{}2,1,10,1,11,1,1---=-⨯-,所以,直线方程为:22111+==-z y x .(6)所求直线的方向向量为:{}5,3,6--,所以直线方程为: 235635x y z -++==--.2、求直线1,234x y z x y z ++=-⎧⎨-+=-⎩的点向式方程与参数方程.解 在直线上任取一点),,(000z y x ,取10=x ,063020000⎩⎨⎧=--=++⇒z y z y 解2,000-==z y .所求点的坐标为)2,0,1(-,取直线的方向向量{}{}3,1,21,1,1-⨯=s k j i kji34312111--=-=,所以直线的点向式方程为:,321041-+=--=-z y x 令102,413x y z t --+===--则所求参数方程: .3241⎪⎩⎪⎨⎧--=-=+=tz ty tx3、判别下列各对直线的相互位置,如果是相交的或平行的直线求出它们所在的平面,如果相交时请求出夹角的余弦.(1)⎩⎨⎧=-+=+-0623022y x z y x 与⎩⎨⎧=-+=--+01420112z x z y x ;(2)⎪⎩⎪⎨⎧--=+==212t z t y tx 与142475x y z --+==-. 解:(1)将所给的直线方程化为标准式为:4343223z y x =-=--43227-=--=-z y x 234234-==-- ∴二直线平行.又点)0,43,23(与点(7,2,0)在二直线上,∴向量⎭⎬⎫⎩⎨⎧=⎭⎬⎫⎩⎨⎧--0,45,2110,432,237平行于二直线所确定的平面,该平面的法向量为:{}{}19,22,50,45,2114,3,2--=⎭⎬⎫⎩⎨⎧⨯-,从而平面方程为:0)0(19)2(22)7(5=-+---z y x ,即0919225=++-z y x .(2)因为121475-≠≠-,所以两直线不平行,又因为0574121031=--=∆,所以两直线相交,二直线所决定的平面的法向量为{}{}{}1,1,35,7,412,1--=-⨯-,∴二直线所决定的平面的方程为:330x y z -++=.设两直线的夹角为ϕ,则cos ϕ==.4、判别下列直线与平面的相关位置: (1)37423z y x =-+=--与3224=--z y x ;(2)723zy x =-=与8723=+-z y x ; (3)⎩⎨⎧=---=-+-01205235z y x z y x 与07734=-+-z y x ;(4)⎪⎩⎪⎨⎧-=+-==4992t z t y t x 与010743=-+-z y x .解(1) 0)2(3)2()7(4)2(=-⨯+-⨯-+⨯-,而017302)4(234≠=-⨯--⨯-⨯,所以,直线与平面平行.(2) 0717)2(233≠⨯+-⨯-⨯,所以,直线与平面相交,且因为772233=--=,∴直线与平面垂直. (3)直线的方向向量为:{}{}{}1,9,51,1,22,3,5=--⨯-, 0179354=⨯+⨯-⨯,所以直线与平面平行或者直线在平面上;取直线上的点)0,5,2(--M ,显然点在)0,5,2(--M 也在平面上(因为4(2)3(5)70⨯--⨯--=),所以,直线在平面上.(4)直线的方向向量为{}9,2,1-, 097)2(413≠⨯+-⨯-⨯∴直线与平面相交但不垂直.5、验证直线l :21111-=-=-z y x 与平面π:032=--+z y x 相交,并求出它的交点和交角. 解: 032111)1(2≠-=⨯-⨯+-⨯∴直线与平面相交.又直线的参数方程为:⎪⎩⎪⎨⎧+=+=-=t z t y tx 211设交点处对应的参数为0t ,∴03)21()1()(2000=-+-++-⨯t t t ∴10-=t ,从而交点为(1,0,-1). 又设直线l 与平面π的交角为θ,则:21662111)1(2sin =⨯⨯-⨯+-⨯=θ,∴6πθ=.6、确定m l ,的值,使: (1)直线13241zy x =+=-与平面0153=+-+z y lx 平行; (2)直线⎪⎩⎪⎨⎧-=--=+=135422t z t y t x 与平面076=-++z my lx 垂直.解:(1)欲使所给直线与平面平行,则须:015334=⨯-⨯+l 即1l =-. (2)欲使所给直线与平面垂直,则须:3642=-=m l ,所以:8,4-==m l .7、求下列各平面的方程: (1)通过点)1,0,2(-p ,且又通过直线32121-=-=+z y x 的平面; (2)通过直线115312-+=-+=-z y x 且与直线⎩⎨⎧=--+=---052032z y x z y x 平行的平面; (3)通过直线223221-=-+=-z y x 且与平面0523=--+z y x 垂直的平面; (4). 求过点(2,1,0)M 与直线2335x t y t z t =-⎧⎪=+⎨⎪=⎩垂直的平面方程.解:(1)因为所求的平面过点)1,0,2(-p 和)2,0,1(-'p ,且它平行于向量{}3,1,2-,所以要求的平面方程为:03331212=--+-z y x , 即015=-++z y x .(2)已知直线的方向向量为{}{}{}2,1,11,2,13,1,5--⨯-=,∴平面方程为:2311510315x y z -++--=,即3250x y z +--= (3)所求平面的法向量为{}{}{}13,8,11,2,32,3,2-=-⨯-,∴平面的方程为:0)2(13)2(8)1(=--+--z y x ,即09138=+--z y x .(4).所求平面的法向量为{}2,3,1,则平面的方程为:2(2)3(1)(0)0x y z -+-+-=, 即 2370x y z ++-=.8、求点(4,1,2)M 在平面1x y z ++=上的投影.解: 过点(4,1,2)M 作已知平面的垂线,垂线的方向向量就是已知平面的法向量(1,1,1),所以垂线方程为412111x y z ---==,此垂线与已知平面的交点即为所求投影.为了求投影,将垂线方程化为参数方程412x t y t z t =+⎧⎪=+⎨⎪=+⎩,代入平面方程求得2t =-,故投影为(2,1,0)-.9、求点)1,3,2(-p 到直线⎩⎨⎧=++-=++-0172230322z y x z y x 的距离.解:直线的标准方程为:2251211-+==-z y x 所以p 到直线的距离 1534532025)2(1212392292421243222222===-++-+--+-=d .10、设0M 是直线L 外一点,M 是直线L 上一点,且直线的方向向量为 ,试证:点0M 到直线L的距离为d =.证:设0M M 与L 的夹角为θ,一方面由于0sin d M M θ=;另一方面,00sin M M s M M s θ⨯=,所以d =.11、求通过平面0134=-+-z y x 和025=+-+z y x 的交线且满足下列条件之一的平面: (1)通过原点; (2)与y 轴平行;(3)与平面0352=-+-z y x 垂直. 解: (1)设所求的平面为:0)25()134(=+-++-+-z y x z y x λ 欲使平面通过原点,则须:021=+-λ,即21=λ,故所求的平面方程为 0)25()134(2=+-++-+-z y x z y x 即:0539=++z y x .(2)同(1)中所设,可求出51=λ.故所求的平面方程为 0)25()134(5=+-++-+-z y x z y x 即:031421=-+z x .(3)如(1)所设,欲使所求平面与平面0352=-+-z y x 垂直,则须:0)3(5)51()4(2=-++--+λλλ从而3=λ,所以所求平面方程为05147=++y x .12、求直线⎩⎨⎧=++-=--+0101z y x z y x 在平面0=++z y x 上的投影直线的方程.解:应用平面束的方法.设过直线⎩⎨⎧=++-=--+0101z y x z y x 的平面束方程为0)1()1(=++-+--+z y x z y x λ即01)1()1()1(=-++-+-++λλλλz y x这平面与已知平面0=++z y x 垂直的条件是01)1(1)1(1)1(=⋅+-+⋅-+⋅+λλλ,解之得1-=λ代入平面束方程中得投影平面方程为10y z --=,所以投影直线为⎩⎨⎧=++=--001z y x z y .13、请用异于本章第五节例7的方法来推导点到平面的距离公式.证:设),,(0000z y x P 是平面π:0+++=Ax By Cz D 外的一点,下面我们来求点0P 到平面π的距离.过0P 作平面π的垂线L :000x x y y z z A B C---==,设L 与平面π的交点为(,,)P x y z ,则P 与0P 之间的距离即为所求.因为点(,,)P x y z 在L 上,所以000x x Aty y Bt z z Ct-=-=-=⎧⎪⎨⎪⎩,而(,,)P x y z 在平面π上,则000()()()0A x At B y Bt C z Ct D ++++++=000222Ax By Cz A B t DC⇒=-+++++,故000222Ax By Cz Dd t A B C+++===++=习 题 6—7飞机的速度:假设空气以每小时32公里的速度沿平行y 轴正向的方向流动,一架飞机在xoy 平面沿与x 轴正向成π6的方向飞行,若飞机相对于空气的速度是每小时840公里,问飞机相对于地面的速度是多少?解:如下图所示,设OA 为飞机相对于空气的速度,AB 为空气的流动速度,那么OB 就是飞机相对于地面的速度.840cos 840sin 4203420,3266OA i j i j AB j ππ=⋅+⋅=+=所以, 24203452,(420856.45OB i j OB =+=≈千米/小时.复习题A一 、判断正误:1、 若c b b a ⋅=⋅且≠0b ,则c a =; ( ⨯ ) 解析 c b b a ⋅-⋅=)(c a b -⋅=0时,不能判定=b 0或c a =.例如i a =,j b =,k c =,有⋅=⋅=0a b b c ,但c a ≠.图6-1 空所流动与飞机飞行速度的关2、 若c b b a ⨯=⨯且≠0b ,则c a =; ( ⨯ ) 解析 此结论不一定成立.例如i a =,j b =,)(j i c +-=,则k j i b a =⨯=⨯,k j i j c b =+-⨯=⨯)]([,c b b a ⨯=⨯,但c a ≠.3 、若0=⋅c a ,则=0a 或=0c ; ( ⨯ ) 解析 两个相互垂直的非零向量点积也为零.4、 a b b a ⨯-=⨯. ( √ ) 解析 这是叉积运算规律中的反交换律.二、选择题:1 、 当a 与b 满足( D )时,有b a b a +=+;(A)⊥a b ; (B)λ=a b (λ为常数); (C)a ∥b ; (D)⋅=a b a b .解析 只有当a 与b 方向相同时,才有a +b =a +b .(A)中a ,b 夹角不为0,(B),(C)中a ,b 方向可以相同,也可以相反.2、下列平面方程中,方程( C )过y 轴;(A) 1=++z y x ; (B) 0=++z y x ; (C) 0=+z x ; (D) 1=+z x . 解析 平面方程0=+++D Cz By Ax 若过y 轴,则0==D B ,故选C .3 、在空间直角坐标系中,方程2221y x z --=所表示的曲面是( B );(A) 椭球面; (B) 椭圆抛物面; (C) 椭圆柱面; (D) 单叶双曲面. 解析 对于曲面2221y x z --=,垂直于z 轴的平面截曲面是椭圆,垂直于x 轴或y 轴的平面截曲面是开口向下的抛物线,根据曲面的截痕法,可以判断曲面是椭圆抛物面.4、空间曲线⎩⎨⎧=-+=5,222z y x z 在xOy 面上的投影方程为( C );(A)722=+y x ; (B)⎩⎨⎧==+5722z y x ; (C) ⎩⎨⎧==+0722z y x ;(D)⎩⎨⎧=-+=0222z y x z解析 曲线⎩⎨⎧==+5722z y x 与xOy 平面平行,在xOy 面上的投影方程为⎩⎨⎧==+0722z y x .5 、直线11121-+==-z y x 与平面1=+-z y x 的位置关系是( B ). (A) 垂直; (B) 平行; (C) 夹角为π4; (D) 夹角为π4-.解析 直线的方向向量s ={2,1,-1},平面的法向量n ={1,-1,1},n s ⋅=2-1-1=0,所以,s ⊥n ,直线与平面平行.三、填空题:1、若2=b a ,π()2=a,b ,则=⨯b a 2 ,=⋅b a 0 ; 解 =⨯b a b a sin()a,b π22=2,=⋅b a b a cos()a,b π22=0.2、与平面062=-+-z y x 垂直的单位向量为 }2,1,1{66-±; 解 平面的法向量 n ={1,-1,2}与平面垂直,其单位向量为0n =411++=6,所以,与平面垂直的单位向量为}2,1,1{66-±.3、过点)2,1,3(--和)5,0,3(且平行于x 轴的平面方程为 057=-+z y ;解 已知平面平行于x 轴,则平面方程可设为 0=++D Cz By ,将点 (-3,1,-2)和(3,0,5)代入方程,有{20,50,B C D C D -+=+= ⇒ 7,51,5B D C D ⎧=-⎪⎨⎪=-⎩得 05157=+--D Dz Dy ,即 057=-+z y .4、过原点且垂直于平面022=+-z y 的直线为z yx -==20;解 直线与平面垂直,则与平面的法向量 n ={0,2,-1}平行,取直线方向向量s =n ={0,2,-1},由于直线过原点,所以直线方程为z yx -==20 .5、曲线⎩⎨⎧=+=1,222z y x z 在xOy 平面上的投影曲线方程为 ⎩⎨⎧==+.0,1222z y x解: 投影柱面为 1222=+y x ,故 ⎩⎨⎧==+0,1222z y x 为空间曲线在xOy 平面上的投影曲线方程.四、解答题:1、 已知}1,2,1{-=a ,}2,1,1{=b ,计算(a) b a ⨯; (b) ()()-⋅+2a b a b ; (c) 2b a -;解: (a) b a ⨯=211121-kji1,3}5,{--=.(b) {2,4,2}{1,1,2}{1,5,0}2a b -=--=-,1,3}{2,{1,1,2}2,1}{1,-=+-=+b a , 所以()()-⋅+2a b a b 7}3,1,2{}0,5,1{=-⋅-=.(c) 1}3,{0,{1,1,2}2,1}{1,--=--=-b a ,所以2b a -10)19(2=+=.2、已知向量21P P 的始点为)5,2,2(1-P ,终点为)7,4,1(2-P ,试求:(1)向量21P P 的坐标表示; (2)向量21P P 的模;(3)向量21P P 的方向余弦; (4)与向量21P P 方向一致的单位向量.解: (1) }2,6,3{}57),2(4,21{21-=-----=P P ;74926)3(222==++-=; (3) 21P P 在z y x ,,三个坐标轴上的方向余弦分别为362cos ,cos ,cos 777αβγ=-==;(4)k j i k j i 7276737263)(21++-=++-==P P .3、设向量{}1,1,1=-a ,{}1,1,1=-b ,求与a 和b 都垂直的单位向量.解: 令{}1110,2,2111=⨯=-=-i j kc a b,01⎧==⎨⎩c c c ,故与a 、b 都垂直的单位向量为0⎧±=±⎨⎩c .4、向量d 垂直于向量]1,3,2[-=a 和]3,2,1[-=b ,且与]1,1,2[-=c的数量积为6-,求向量d解: d 垂直于a 与b,故d 平行于b a ⨯,存在数λ使()b a d ⨯=λ⨯-=]1,3,2[λ]3,2,1[-]7,7,7[λλλ--= 因6-=⋅c d,故6)7(1)7()1(72-=-⨯+-⨯-+⨯λλλ, 73-=λ]3,3,3[-=∴d .5、求满足下列条件的平面方程:(1)过三点)2,1,0(1P ,)1,2,1(2P 和)4,0,3(3P ;(2)过x 轴且与平面025=++z y x 的夹角为π3. 解 (1)解1: 用三点式.所求平面的方程为0241003211201210=---------z y x ,即01345=+--z y x .解2: }1,1,1{-=}2,1,3{-=,由题设知,所求平面的法向量为k j i kj in 452131113121--=--=⨯=P P P P , 又因为平面过点)2,1,0(1P ,所以所求平面方程为0)2(4)1(5)0(=-----z y x ,即01345=+--z y x .解3: 用下面的方法求出所求平面的法向量},,{C B A =n ,再根据点法式公式写出平面方程也可.因为3121,P P P P ⊥⊥n n ,所以{0,320,A B C A B C +-=-+=解得A C A B 4,5-=-=,于是所求平面方程为0)2(4)1(5)0(=-----z A y A x A ,即 01345=+--z y x .(2)因所求平面过x 轴,故该平面的法向量},,{C B A =n 垂直于x 轴,n 在x 轴上的投影0=A ,又平面过原点,所以可设它的方程为0=+Cz By ,由题设可知0≠B (因为0=B 时,所求平面方程为0=Cz 又0≠C ,即0=z .这样它与已知平面025=++z y x 所夹锐角的余弦为π1cos 32=≠=,所以0≠B ),令C B C'=,则有0='+z C y ,由题设得22222212)5(10121503cos ++'++⨯'+⨯+⨯=πC C , 解得3='C 或13C '=-,于是所求平面方程为03=+z y 或03=-z y .6、 一平面过直线⎩⎨⎧=+-=++04,05z x z y x 且与平面01284=+--z y x 垂直,求该平面方程;解法1: 直线⎩⎨⎧=+-=++04,05z x z y x 在平面上,令x =0,得 54-=y ,z =4,则(0,-54,4)为平面上的点.设所求平面的法向量为n =},,{C B A ,相交得到直线的两平面方程的法向量分别为 1n ={1,5,1},2n ={1,0,-1},则直线的方向向量s =1n ⨯2n =101151-kji ={-5,2,-5},由于所求平面经过直线,故平面的法向量与直线的方向向量垂直,即⋅n s ={-5,2,-5}•},,{C B A =C B A 525-+-=0,因为所求平面与平面01284=+--z y x 垂直,则}8,4,1{},,{--⋅C B A =C B A 84--=0,解方程组{5250,480,A B C A B C -+=--= ⇒ 2,5,2A CBC =-⎧⎪⎨=-⎪⎩ 所求平面方程为 0)4()54(25)0(2=-++---z C y C x C ,即012254=+-+z y x .解法2: 用平面束(略)7、求既与两平面1:43x z π-=和2:251x y z π--=的交线平行,又过点(3,2,5)-的直线方程.解法1:{}11,0,4=-n ,{}22,1,5=--n ,{}124,3,1s =⨯=---n n ,从而根据点向式方程,所求直线方程为325431x y z +--==---,即325431x y z +--==. 解法2:设{},,s m n p =,因为1⊥s n ,所以40m p -=;又2⊥s n ,则250m n p --=,可解4,3m p n p ==,从而0p ≠.根据点向式方程,所求直线方程为32543x y z p p p +--==,即325431x y z +--==. 解法3:设平面3π过点(3,2,5)-,且平行于平面1π,则{}311,0,4==-n n 为3π的法向量,从而3π的方程为1(3)0(2)4(5)0x y z ⋅++⋅--⋅-=,即4230x z -+=.同理,过已知点且平行于平面2π的平面4π的方程为25330x y z --+=.故所求直线的方程为423025330x z x y z -+=⎧⎨--+=⎩.8、 一直线通过点)1,2,1(A ,且垂直于直线11231:+==-z y x L ,又和直线z y x ==相交,求该直线方程;解: 设所求直线的方向向量为{,,}m n p =s ,因垂直于L ,所以320m n p ++=;又因为直线过点)1,2,1(A ,则所求直线方程为 p z n y m x 121-=-=-,联立121,①,②320,③x y z m n p x y z m n p ---⎧==⎪⎨==⎪++=⎩由①,令λ=-=-=-p z n y m x 121,则有⎪⎩⎪⎨⎧+=+=+=,1,2,1p z n y m x λλλ代入方程②有{12,11,m n m p λλλλ+=++=+ 可得p m =,代入③解得p n 2-=, 因此,所求直线方程为112211-=--=-z y x .9、 指出下列方程表示的图形名称:(a) 14222=++z y x ;(b) z y x 222=+;(c) 22y x z +=;(d) 022=-y x ;(e) 122=-y x ; (f) ⎩⎨⎧=+=222z y x z .解: (a) 绕y 轴旋转的旋转椭球面.(b) 绕z 轴旋转的旋转抛物面. (c) 绕z 轴旋转的锥面.(d) 母线平行于z 轴的两垂直平面:y x =,y x -=. (e) 母线平行于z 轴的双曲柱面. (f) 旋转抛物面被平行于XOY 面的平面所截得到的圆,半径为2,圆心在(0,0,2)处.10、求曲面22z x y =+与222()z x y =-+所围立体在xOy 平面上的投影并作其图形. 解: 将所给曲面方程联立消去z ,就得到两曲面交线C 的投影柱面的方程122=+y x ,所以柱面与xOy 平面的交线⎩⎨⎧==+'01:22z y x C 所围成的区域221+≤x y 即为曲面22z x y =+与222()z x y =-+所围立体在xOy 平面上的投影(图略).复习题B1、设4=a ,3=b ,()6π=a,b ,求以2+a b 和3-a b 为邻边的平行四边形的面积.解:(2)(3)326A =+⨯-=⨯-⨯+⨯-⨯a b a b a a a b b a b b325=-⨯-⨯=-⨯a b a b a b 15sin()543302=⋅=⨯⨯⨯=a b a,b .2、设(3)(75)+⊥-a b a b ,(4)(72)-⊥-a b a b ,求()a,b . 解: 由已知可得:(3)(75)0+⋅-=a b a b ,(4)(72)0-⋅-=a b a b 即 22715160-+⋅=a b a b ,2278300+-⋅=a b a b .这可看成是含三个变量a 、b 及⋅a b 的方程组,可将a 、b 都用⋅a b 表示,即=a b 1cos()22⋅⋅===⋅a b a b a,b a b a b ,()3π=a,b .3、求与}3,2,1{-=a 共线,且28=⋅b a 的向量b .解 由于b 与a 共线,所以可设}3,2,{λλλλ-==a b ,由28=⋅b a ,得28}3,2,{}3,2,1{=-⋅-λλλ,即2894=++λλλ,所以2=λ,从而}6,4,2{-=b .4、 已知}0,1,1{},2,0,1{=-=b a ,求c ,使b c a c ⊥⊥,且6=c .解法1: 待定系数法.设},,{z y x =c ,则由题设知0,0=⋅=⋅b c a c 及6=c ,所以有①20②③6x z ⎧-=⎪⎨⎪=⎩由①得2x z = ④,由②得x y -= ⑤,将④和⑤代入③得62)(222=⎪⎭⎫⎝⎛+-+x x x ,解得2,4,4±==±=z y x ,于是 }2,4,4{-=c 或}2,4,4{--=c .解法2: 利用向量的垂直平行条件,因为b c a c ⊥⊥,,所以c ∥b a ⨯.设λ是不为零的常数,则k j i k ji b a c λλλλλ+-=-=⨯=22011201)(,因为6=c ,所以6]1)2(2[2222=+-+λ,解得2±=λ,所以}2,4,4{-=c 或{4,4,2}=--c .解法3: 先求出与向量b a ⨯方向一致的单位向量,然后乘以6±.k j i kji b a +-=-=⨯22011201,31)2(2222=+-+=⨯b a ,故与b a ⨯方向一致的单位向量为}1,2,2{31-.于是}1,2,2{36-±=c ,即}2,4,4{-=c 或}2,4,4{--=c .5、求曲线222x y R x y z ⎧+=⎨++=⎩的参数式方程.解: 曲线参数式方程是把曲线上任一点(,,)P x y z 的坐标,,x y z 都用同一变量即参数表示出来,故可令cos ,sin x R t y R t ==,则(cos sin )z R t t =-+.6、求曲线22:2z L x y x⎧⎪=⎨+=⎪⎩xOy 面上及在zOx 面上的投影曲线的方程.解: 求L 在xOy 面上的投影的方程,即由L 的两个方程将z 消去,即得L 关于xOy 面的投影柱面的方程222x y x +=则L 在xOy 面上的投影曲线的方程为2220x y xz ⎧+=⎨=⎩.同理求L 在zOx 面上的投影的方程,即由L 的两个方程消去y ,得L 关于zOx 面的投影柱面的方程z =L 在zOx面上的投影曲线方程为0z y ⎧=⎪⎨=⎪⎩.7、已知平面π过点0(1,0,1)M -和直线1211:201x y z L ---==,求平面π的方程. 解法1: 设平面π的法向量为n ,直线1L 的方向向量1(2,0,1)=s ,由题意可知1⊥n s ,(2,1,1)M 是直线1L 上的一点,则0(1,1,2)M M =在π上,所以0MM ⊥n ,故可取10MM =⨯n s (1,3,2)=--.则所求平面的点法式方程为 1(1)3(0)2(1)0x y z ⋅-+⋅--⋅+=,即3230x y z +--=为所求平面方程.解法2: 设平面π的一般方程为0Ax By Cz D +++=,由题意可知,π过点0(1,0,1)M -,故有0A C D -+=, (1)在直线1L 上任取两点12(2,1,1),(4,1,2)M M ,将其代入平面方程,得20A B C D +++=, (2)420A B C D +++=, (3)由式(1)、(2)、(3)解得3,2,3B A C A D A ==-=-,故平面π的方程为3230x y z +--=.解法3: 设(),,M x y z 为π上任一点.由题意知向量0M M 、01M M 和1s 共面,其中()12,1,1M 为直线1L 上的点,1(2,0,1)=s 为直线1L 的方向向量.因此0011()0M M M M ⨯⋅=s ,故平面π的方程为1012110110201x y z --+--+=,即3230x y z +--=为所求平面方程.8、求一过原点的平面π,使它与平面0:π4830x y z -+-=成4π角,且垂直于平面1:π730x z ++=.解: 由题意可设π的方程为0Ax By Cz ++=,其法向量为(,,)A B C =n ,平面0π的法向量为0(1,4,8)=-n ,平面1π的法向量为1(7,0,1)=n ,由题意得00||cos4||||π⋅=⋅n n n n ,即=(1) 由10⋅=n n ,得70A C +=,将7C A =-代入(1=解得20,B A =或10049B A =-,则所求平面π的方程为2070x y z +-= 或 491003430x y z --=.9、求过直线1L :0230x y z x y z ++=⎧⎨-+=⎩且平行于直线2L :23x y z ==的平面π的方程.解法1: 直线1L 的方向向量为1=s 111(4,1,3)213==---i j k,直线2L 的对称式方程为632x y z==,方向向量为2(6,3,2)=s ,依题意所求平面π的法向量1⊥n s 且2⊥n s ,故可取12=⨯n s s ,则413(7,26,18)632=--=-i j kn ,又因为1L 过原点,且1L 在平面π上,从而π也过原点,故所求平面π的方程为726180x y z -+=.解法2: 设所求平面π为 (23)0x y z x y z λ+++-+=,即(12)(1)(13)0x y z λλλ++-++=, 其法向量为(12,1,13)λλλ=+-+n ,由题意知2⊥n s ,故26(12)3(1)2(13)0λλλ⋅=++-++=n s , 得1115λ=-,则所求平面π的方程为726180x y z -+=.另外,容易验证230x y z -+=不是所求的平面方程.10、求过直线L :⎩⎨⎧=+-+=+-+0185017228z y x z y x 且与球面1222=++z y x 相切的平面方程解: 设所求平面为 ()018517228=+-+++-+z y x z y x λ,即(15)(288)(2)170x y z λλλλ+++-+++=,由题意:球心)0,0,0(到它的距离为1,即1)2()828()51(17222=--+++++λλλλ解得:89250-=λ 或 2-=λ 所求平面为:42124164387=--z y x 或 543=-y x11、求直线L :11111--==-z y x 在平面π:012=-+-z y x 上投影直线0L 的方程,并求直线0L 绕y 轴旋转一周而成的曲面方程.解: 将直线L :11111--==-z y x 化为一般方程 ⎩⎨⎧=-+=--0101y z y x ,设过直线L 且与平面π垂直的平面方程为()011=-++--y z y x λ,则有02)1(1=+--λλ,即2λ=-,平面方程为。
习题答案(第六章)
1、R n 中分量满足下列条件的全体向量1(,,)n x x 的集合,是否构成R n的子空间?①10n x x ++=;②120n x x x ⋅⋅⋅=;③2211n x x ++=。
解:①是,设(){}111,,|0n n V x x x x =++=,显然V 1≠∅,1,,,a b F V ξη∀∈∀∈,设1212(,,),(,,)x x y y ξη==,则()()()1111,,,,,,n n n n a b a x x b y y ax by ax by ξη+=+=++,而1111()()()()000n n n n ax by ax by a x x b y y a b ++++=+++++=+=所以1a b V ξη+∈,所以V 1是R n 的子空间; ②不是,取(1,0,,0),(0,1,,1)αβ==,则(){}11,,,|0n n V x x x x αβ∈=⋅⋅=,但(1,1,,1)V αβ+=∉,所以V 不是R n 的子空间;③不是,取(1,0,,0),(0,1,0,,0)αβ==,则(){}2211,,,|1n n V x x x x αβ∈=++=,但(1,1,0,,0)V αβ+=∉,所以V 不是R n 的子空间。
2、子集{}1|,,V X AX XB A B n ==为已知的阶矩阵是否是()n M F 的子集?解:是()n M F 的子集;证:显然1V ≠∅,1,,,X Y V a b F ∀∈∈,有()()A aX bY aAX bAY aXB bYB aX bY B +=+=+=+,所以1aX bY V +∈,所以1V 是()n M F 的子集。
3、设12(1,0,1,0),(1,1,2,0)αα==-,求含12,αα的R 4的一组基。
解:因为101010101010112001100010⎛⎫⎛⎫⎛⎫→→⎪ ⎪ ⎪---⎝⎭⎝⎭⎝⎭,取34(0,0,1,0),(0,0,0,1)αα==,所以{}1234,,,αααα为R 4的一组基。
