中药饮片年度产品质量回顾分析报告.doc
中药饮片产品质量风险评估分析报告

北京同科远大科技有限公司中药饮片产品质量风险评估分析报告2.质量风险概述………3.质量风险识别………4.风险分析…………4.1风险失败模式建立…4.2风险分析………4.2.1人员风险……4.2.2设备、仪器风险……4.2.3用物料风险……4.2.4生产操作方法风险…4.2.5生产环境风险…4.2.6检验风险……5.评估总论与建议…6.本风险评估依据与文件资料……产品名称:产品阶段:生产全过程评估小组成员:评估日期:我公司中药饮片产品的工艺规程、质量标准以及包装标签上的信息均按上述信息执行,与注册信息相符合。
2、中药饮片产品的质量风险概述本报告中药饮片产品的质量风险进行系统的分析评估,对中药饮片产品涉及的生产过程所有可能出现的风险进行评估,确定重点控制的目标,制定纠正和预防措施,对于高风险和中等风险的没有管理措施的必须确定降低风险的措施,低风险加强生产过程控制,确保产品质量,降低风险发生的可能性,提高可识别性,将风险控制在可接受水平。
如果采用风险控制措施和预防措施后风险仍不可接受,应重新制定降低风险的措施和办法。
本风险评估资料来源于公司中药饮片产品质量档案,历年生产记录,各种涉及的偏差、变更、验证、工艺规程、质量标准涉及等中药饮片产品生产的全部记录资料。
3、中药饮片产品风险识别中药饮片产品质量风险详细见下表,并逐一展开分析和评价,找出风险点进行控制,把降低风险的措施落实到每个环节。
采用表格的形式针对中药饮片产品质量风险,从人、机、物、料、法、环、测量六大因素进行风险识别分析:4、风险分析4.1 中药饮片产品失败模式建立上述通过图表识别了中药饮片产品生产主要风险因素,对中药饮片产品生产质量风险有了初步的了解和识别,为了更深入了解中药饮片产品生产过程质量风险,下面通过建立风险失败模式(FMEA)进行详细分解分析中药饮片产品生产风险因素及风险严重程度,通过建立FMEA来减少,控制将来生产过程失败。
4.2风险评分:(1)采用ICHQ9推荐的方法FMEA(失败模式及效应分析)进行风险评估和管理。
中药饮片产品质量风险评估报告
中药饮片产品质量风险评估分析报告2.质量风险概述………3.质量风险识别………4.风险分析…………4.1风险失败模式建立…4.2风险分析………4.2.1人员风险……4.2.2设备、仪器风险……4.2.3用物料风险……4.2.4生产操作方法风险…4.2.5生产环境风险…4.2.6检验风险……5.评估总论与建议…6.本风险评估依据与文件资料……产品名称:产品阶段:生产全过程评估小组成员:评估日期:我公司中药饮片产品的工艺规程、质量标准以及包装标签上的信息均按上述信息执行,与注册信息相符合。
2、中药饮片产品的质量风险概述本报告中药饮片产品的质量风险进行系统的分析评估,对中药饮片产品涉及的生产过程所有可能出现的风险进行评估,确定重点控制的目标,制定纠正和预防措施,对于高风险和中等风险的没有管理措施的必须确定降低风险的措施,低风险加强生产过程控制,确保产品质量,降低风险发生的可能性,提高可识别性,将风险控制在可接受水平。
如果采用风险控制措施和预防措施后风险仍不可接受,应重新制定降低风险的措施和办法。
本风险评估资料来源于公司中药饮片产品质量档案,历年生产记录,各种涉及的偏差、变更、验证、工艺规程、质量标准涉及等中药饮片产品生产的全部记录资料。
3、中药饮片产品风险识别中药饮片产品质量风险详细见下表,并逐一展开分析和评价,找出风险点进行控制,把降低风险的措施落实到每个环节。
采用表格的形式针对中药饮片产品质量风险,从人、机、物、料、法、环、测量六大因素进行风险识别分析:4、风险分析4.1 中药饮片产品失败模式建立上述通过图表识别了中药饮片产品生产主要风险因素,对中药饮片产品生产质量风险有了初步的了解和识别,为了更深入了解中药饮片产品生产过程质量风险,下面通过建立风险失败模式(FMEA)进行详细分解分析中药饮片产品生产风险因素及风险严重程度,通过建立FMEA来减少,控制将来生产过程失败。
4.2风险评分:(1)采用ICHQ9推荐的方法FMEA(失败模式及效应分析)进行风险评估和管理。
中药饮片qa年度总结汇报

中药饮片QA年度总结汇报一、质量目标达成情况在过去的的一年中,我们公司设定并实现了如下的质量目标:1.确保中药饮片的生产过程符合国家及行业标准,达到100%合格率。
2.提高产品的稳定性,使客户投诉率降低30%。
3.提升产品质量水平,确保产品在98%以上的测试中合格。
通过全体员工的努力,我们在以下方面取得了显著成果:产品的合格率达到了100%,完全符合国家及行业标准。
客户投诉率降低了35%,表明我们的产品和服务得到了客户的认可。
产品在99%以上的测试中合格,表明我们的产品质量稳定且优良。
二、关键绩效指标完成情况我们设定的关键绩效指标(KPl)包括:1.产品合格率。
2.客户满意度。
3.内部过程效率。
以下是关键绩效指标的完成情况:产品合格率:如上所述,我们达到了100%的产品合格率。
客户满意度:通过优化客户服务流程和提升产品质量,我们的客户满意度达到了95机内部过程效率:通过实施精益生产和持续改进,我们的内部过程效率提高了20%。
三、产品质量回顾及分析在过去的一年中,我们对每批次的中药饮片都进行了严格的质量检测,涵盖了所有批次产品的化学成分、微生物限度、安全性等多个方面。
根据质量检测数据,我们发现以下几个问题:1.部分批次的产品在微生物限度方面存在超标现象。
这主要是由于生产环境的卫生条件和生产设备的清洁度不足所致。
2.部分批次的产品在化学成分含量方面存在波动。
这主要是由于原材料的质量不稳定所致。
针对以上问题,我们已经采取了以下措施进行改进:1.加强生产环境的卫生管理,增加清洁设备的频次和力度。
同时,加强设备的维护和保养,确保设备的清洁度。
2.对原材料进行严格的质量检测和控制,确保原材料的质量稳定。
同时,加强生产工艺的研究和改进,减少生产过程中可能出现的问题。
四、质量管理体系有效性评估我们对公司的质量管理体系进行了全面的评估,发现以下几个方面的优势和不足:优势:1.公司的质量管理体系健全,涵盖了从原材料采购到产品出厂的各个环节。
中药饮片质量管理影响因素分析及管理对策
中药饮片质量管理影响因素分析及管理对策发布时间:2022-11-27T06:55:54.604Z 来源:《中国医学人文》2022年21期作者:李婷婷丛培臣徐道亮王晶晶胡文豪[导读] 目的:探究中药饮片的质量管理因素以及管理对策李婷婷丛培臣徐道亮王晶晶胡文豪淄博岜山中药饮片有限公司255200摘要:目的:探究中药饮片的质量管理因素以及管理对策。
方法:通过在对市场上2021年1月至2022年6月的中药饮片进行抽查回顾,针对中药饮片管理质量抽查出现的问题进行分析分类,同时针对影响因素给出相对应的对策。
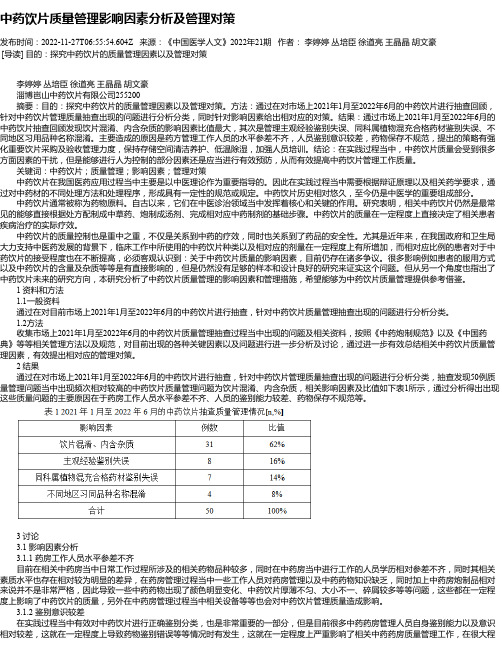
结果:通过市场上2021年1月至2022年6月的中药饮片抽查回顾发现饮片混淆、内含杂质的影响因素比值最大,其次是管理主观经验鉴别失误、同科属植物混充合格药材鉴别失误、不同地区习用品种名称混淆。
主要造成的原因是药方管理工作人员的水平参差不齐,人员鉴别意识较差,药物保存不规范,提出的策略有强化重要饮片采购及验收管理力度,保持存储空间清洁养护、低温除湿,加强人员培训。
结论:在实践过程当中,中药饮片质量会受到很多方面因素的干扰,但是能够进行人为控制的部分因素还是应当进行有效预防,从而有效提高中药饮片管理工作质量。
关键词:中药饮片;质量管理;影响因素;管理对策中药饮片在我国医药应用过程当中主要是以中医理论作为重要指导的。
因此在实践过程当中需要根据辩证原理以及相关药学要求,通过对中药材的不同处理方法和处理程序,形成具有一定性的规范或规定。
中药饮片历史相对悠久,至今仍是中医学的重要组成部分。
中药饮片通常被称为药物原料。
自古以来,它们在中医诊治领域当中发挥着核心和关键的作用。
研究表明,相关中药饮片仍然是最常见的能够直接根据处方配制成中草药、炮制成汤剂、完成相对应中药制剂的基础步骤。
中药饮片的质量在一定程度上直接决定了相关患者疾病治疗的实际疗效。
中药饮片的质量控制也是重中之重,不仅是关系到中药的疗效,同时也关系到了药品的安全性。
中药材、中药饮片供应商审计、评估报告

中药材(中药饮片)供应商现场审计、评估报告第一部分: 供应商基本资料供应商名称供应物料名称(详细信息见附表)供应商地址联系人联系电话质量负责人联系电话供应商性质GMP○ GSP○合作社○其他○()证件及资料名称营业执照○生产许可证○经营许可证○开户许可证○GMP证书合规性检查结果通知单○ GSP证书或合规性检查结果通知单○产品质量标准○供应商检验报告书○企业组织机构图○质量管理组织机构图○检验仪器清单○生产设备清单○产品生产工艺流程○人员配备情况清单○法人授权委托书○质量保证协议○是否清楚《中药材(中药饮片)质量保证协议书》条款非常清楚□不清楚□根本不清楚□首次审计□再次审计□符合规定□不符合规定□(以上资质真实、准确、符合要求方可进行下一步审计工作)第二部分: 供应商审核评估表评估项目考察方法评分标准评分结果机构与人员应建立与产品生产(经营)相适应的管理机构, 有组织机构图。
查公司组织机构图3有健全的质量管理体系, 并有组织机构图。
查质量管理体系机构3 配备足够数量并具有适当资质的管理和操作人员(有健全的人事档案)查人事档案 3 质量管理负责人和生产管理负责人不能互相兼任。
查人事档案 3应当指定部门或专人负责培训管理工作,培训的内容应包括中药专业知识、岗位技能和药品GMP相关法规知识,应当有培训方案或计划, 定期培训并评估培训的实际效果, 培训记录应当予以保存。
查培训记录 3质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力, 具备鉴别中药材和中药饮片真伪优劣的能力查培训记录 3中药材炮制操作人员应具有中药炮制专业知识和实际操作技能查培训记录 3 毒性中药材等有特殊要求的生产操作人员, 应具有相关专业知识和技能, 并熟知相关的劳动保护要求。
查培训记录 3中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力查培训记录 3 养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能查培训记录 3 人员进入生产区更衣洗手是否规范现场及指导更衣情况3 炮制毒性药材等专用工作服与其他操作人员的工作服应分别洗涤、整理, 并避免交叉污染。
中药饮片年度产品质量回顾分析报告

中药饮片年度产品质量回顾分析报告1. 引言中药饮片作为传统的中药剂型之一,一直以来在临床应用中扮演重要的角色。
随着人们对中药的认知不断提高,对中药饮片的质量要求也越来越高。
对中药饮片的年度产品质量进行回顾和分析,对于进一步提升中药饮片质量具有重要意义。
2. 数据采集与处理本次回顾分析报告基于2023年度收集的中药饮片质量数据进行分析。
数据来源包括中药饮片生产企业的质量报告、药品监管部门的检验报告等。
对采集到的数据进行整理和统计,得到可供分析的数据集。
3. 中药饮片质量概况根据数据分析结果,2023年度中药饮片质量总体良好。
其中,合格品种占比超过85%,不合格品种占比在5%以下。
表明中药饮片整体质量水平稳步提升。
4. 不合格原因分析通过对不合格品种的原因进行统计和分析,得出以下:不合格品种中,有一部分是由于生产工艺不规范导致的;另一部分不合格品种则与原材料质量问题有关;还有一些是在包装、存储和运输过程中引起的。
5. 中药饮片质量监管建议为进一步提升中药饮片的质量水平,以下建议被提出:在生产过程中,加强质量管理,加强生产工艺的规范性和可控性;严格把控原材料的质量,确保原材料符合标准;对包装、存储和运输过程进行严格监管,防止质量损失。
6.通过对2023年度中药饮片产品质量的回顾分析,可知中药饮片的质量整体呈现出良好的态势。
但仍有一些不合格品种存在,隐含着一些质量问题。
为进一步提升中药饮片的质量,需要加强生产工艺的规范性、控制原材料的质量,以及加强对包装、存储和运输环节的监管。
参考文献, . 中药饮片质量控制与评价[M]. 北京: 科学出版社, 2023., 赵六. 中药饮片生产工艺与管理[M]. 上海: 上海科学技术出版社, 2023.。
强化饮片质量整治工作总结
强化饮片质量整治工作总结
近年来,随着人们对健康的重视和对中药饮片的需求增加,饮片质量安全问题
备受关注。
为了确保饮片质量,各级相关部门积极开展强化饮片质量整治工作。
在这个过程中,取得了一定的成效,也积累了一些经验和教训。
首先,我们要充分认识到饮片质量问题的严重性和紧迫性。
饮片质量问题关乎
人民群众的身体健康,一旦发生质量安全事故,后果不堪设想。
因此,相关部门要高度重视,加大对饮片生产企业的监管力度,严格执行相关标准和规定,确保饮片质量安全。
其次,要加强对饮片生产企业的监督检查。
通过加强对饮片生产企业的日常监
督检查,及时发现和解决存在的质量安全问题,确保饮片质量符合标准要求。
同时,对于存在质量安全隐患的企业,要采取严厉的惩罚措施,以震慑其他企业,推动饮片质量整治工作向纵深发展。
再次,要加强对饮片质量监测和评估。
建立健全饮片质量监测和评估体系,对
饮片质量进行全面监测和评估,及时发现和解决存在的质量问题,保障饮片质量安全。
最后,要加强对从业人员的培训和教育。
饮片生产企业的从业人员是保障饮片
质量安全的重要环节,要加强对从业人员的培训和教育,提高其质量安全意识和技术水平,确保饮片生产过程中的质量安全。
总之,强化饮片质量整治工作是一项长期而艰巨的任务,需要各级相关部门的
共同努力和社会各界的支持。
只有不断加大力度,才能确保饮片质量安全,保障人民群众的身体健康。
国际制药项目管理协会(IPPM)
国际制药项目管理协会()中药饮片风险管理、偏差、变更、与实验室管理及质量控制关键技术高级培训班各有关单位:《中药饮片附录》已自年月日起实施,新版中药饮片附录对中药饮片生产质量管理的各个环节做出了许多新规定与技术要求,然而近年来随着高密度飞行检查结果数据证实,目前大部分生产企业均不符合新版中药饮片附录要求,皆存在生产管理不规范、质量管理混乱、物料管理混乱、生产记录缺失、非法生产等诸多问题,并受到了相关法律的严厉处罚。
为帮助中药饮片生产企业,全面掌握新版中药饮片附录知识,精确把握实施要点,提高生产管理与质量管理水平,并顺利完成认证工作,我单位定于年月日日在杭州市举办“中药饮片风险管理、偏差、变更、与实验室管理及质量控制关键技术高级培训班”本次培训特邀请参与编写、修订新版中药饮片附录并具有丰富一线工作经验的姜老师,结合中药饮片生产企业现存问题与需求精心设计了本课程,具有很强的提升与指导意义,坚信此次培训一定会让您受益匪浅,获益良多!有关培训事项通知如下;主办单位:国际制药项目管理协会()支持单位:(药学园地)公众号微谱医药食品伙伴网专助网一、时间地点:培训时间:年月日(日全天报到、日两天培训)培训地点:杭州市(详细培训地点、报名后再行通知)二、培训内容:第一天月日周五上午午休下午一、中药饮片质量风险管理:、质量风险管理的法规依据;、质量风险管理的来源;、如何理解质量风险管理;、质量风险管理;、如何选择质量风险管理工具;、如何利用工具进行风险评估;、关键生产工艺的风险管理;、关键公用系统与设备的风险管理;、变更控制中如何使用风险管理工具;、偏差管理中如何使用风险管理工具;、管理中如何使用风险管理工具;、验证与确认中如何使用风险管理工具;、培训总结;、风险分析流程的总结;二、偏差管理:、审计中关于偏差管理经常被挑战的问题;、偏差管理系统;、偏差类型举例;、偏差执行流程;、偏差管理程序与调查案例分析;、偏差管理的跟踪;、培训小结;三、预防与纠正措施:、审计中关于经常被挑战的问题;、的目的;、的发行;、的调查过程;、行动方案的制定;、行动的执行;、行动的关闭;、执行的有效性确认;、案例分析。
中药饮片产品质量风险评估分析报告
北京同科远大科技有限公司中药饮片产品质量风险评估分析报告2.质量风险概述………3.质量风险识别………4.风险分析…………4.1风险失败模式建立…4.2风险分析………4.2.1人员风险……4.2.2设备、仪器风险……4.2.3用物料风险……4.2.4生产操作方法风险…4.2.5生产环境风险…4.2.6检验风险……5.评估总论与建议…6.本风险评估依据与文件资料……产品名称:产品阶段:生产全过程评估小组成员:评估日期:我公司中药饮片产品的工艺规程、质量标准以及包装标签上的信息均按上述信息执行,与注册信息相符合。
2、中药饮片产品的质量风险概述本报告中药饮片产品的质量风险进行系统的分析评估,对中药饮片产品涉及的生产过程所有可能出现的风险进行评估,确定重点控制的目标,制定纠正和预防措施,对于高风险和中等风险的没有管理措施的必须确定降低风险的措施,低风险加强生产过程控制,确保产品质量,降低风险发生的可能性,提高可识别性,将风险控制在可接受水平。
如果采用风险控制措施和预防措施后风险仍不可接受,应重新制定降低风险的措施和办法。
本风险评估资料来源于公司中药饮片产品质量档案,历年生产记录,各种涉及的偏差、变更、验证、工艺规程、质量标准涉及等中药饮片产品生产的全部记录资料。
3、中药饮片产品风险识别中药饮片产品质量风险详细见下表,并逐一展开分析和评价,找出风险点进行控制,把降低风险的措施落实到每个环节。
采用表格的形式针对中药饮片产品质量风险,从人、机、物、料、法、环、测量六大因素进行风险识别分析:4、风险分析4.1 中药饮片产品失败模式建立上述通过图表识别了中药饮片产品生产主要风险因素,对中药饮片产品生产质量风险有了初步的了解和识别,为了更深入了解中药饮片产品生产过程质量风险,下面通过建立风险失败模式(FMEA)进行详细分解分析中药饮片产品生产风险因素及风险严重程度,通过建立FMEA来减少,控制将来生产过程失败。
4.2风险评分:(1)采用ICHQ9推荐的方法FMEA(失败模式及效应分析)进行风险评估和管理。
中药饮片厂年度总结(3篇)
第1篇一、工作回顾2021年,我厂在各级领导的关怀和支持下,全体员工的共同努力下,紧紧围绕“安全、质量、效益”三大目标,积极开展各项工作,现将2021年度工作总结如下:1. 安全生产一年来,我厂始终把安全生产放在首位,严格落实安全生产责任制,加强安全教育培训,提高员工安全意识。
通过开展安全隐患排查治理,及时消除安全隐患,确保了生产安全。
2. 质量管理我厂始终坚持“质量第一,用户至上”的原则,加强质量管理,严格执行国家标准和公司内部质量管理体系。
通过加强原辅料采购、生产过程控制、产品质量检验等环节的管理,确保了产品质量稳定可靠。
3. 生产经营2021年,我厂在市场竞争激烈的情况下,积极拓展市场,加强与上下游企业的合作,实现了生产经营的稳步增长。
全年营业收入达到XXX万元,同比增长XX%。
4. 技术创新我厂高度重视技术创新,积极引进先进设备和技术,提高生产效率。
通过开展技术改造,提高了产品质量和生产能力,降低了生产成本。
5. 人才培养我厂注重人才培养,加强员工培训,提高员工综合素质。
通过开展内部竞聘,选拔优秀人才担任重要岗位,为企业的可持续发展提供了人才保障。
二、存在问题1. 市场竞争加剧,产品销售压力增大。
2. 原辅料价格波动,成本控制压力加大。
3. 部分员工素质有待提高,影响企业整体形象。
三、2022年工作计划1. 优化产品结构,提高产品附加值,增强市场竞争力。
2. 加强成本控制,降低生产成本,提高企业盈利能力。
3. 深化内部改革,提高员工素质,打造一支高素质的员工队伍。
4. 加强与上下游企业的合作,拓展市场,提高市场份额。
5. 持续推进技术创新,提高生产效率和产品质量。
总之,2021年我厂在全体员工的共同努力下,取得了较好的成绩。
在新的一年里,我厂将继续努力,为实现企业可持续发展目标而努力奋斗。
第2篇一、前言2023年,我国中药饮片行业在政策扶持、市场需求和科技进步等多重因素推动下,取得了显著的发展成果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
年度产品质量回顾分析报告回顾日期:目录1. 概要2. 回顾期限3. 制造情况4. 产品描述5. 物料质量回顾5.1 原辅料、包装材料质量问题回顾5.2 主要原辅料购进情况回顾5.3 供应商管理情况回顾5.4工艺用水质量问题回顾6. 成品质量回顾6.1 成品质量标准6.2 成品质量指标统计及趋势分析7. 生产工艺回顾7.1 关键工艺参数控制情况7.2 中间产品控制情况7.3 工艺变更情况7.4 物料平衡7.5 收率7.6 返工与再加工7.7设施设备情况8. 偏差回顾9. 超常超标回顾10.质量事故回顾11. 产品留样观察12. 拒绝批次回顾12.1 拒绝的物料12.2 拒绝的中间产品及成品13. 变更控制回顾14. 验证回顾15. 人员情况16. 委托加工、委托检验情况回顾17. 不良反应回顾18. 产品召回、退货回顾18.1 产品召回18.2 退货19. 投诉20. 改进或预防措施21. 结论22. 建议年度质量回顾分析报告内容1、概要:根据GMP(2010修订)第十章质量控制与质量保证第八节产品质量回顾分析第二百六十六条的规定,按公司《产品年度质量回顾分析管理规程》的要求,2014年01月,对2013年生产的全部批次的中药饮片进行了年度质量回顾分析。
本报告对涉及该产品的物料及主要供应商、生产工艺(含主要工序控制参数验证情况及工艺变更、物料平衡及成品收率、返工与再加工、设施设备情况)、偏差(含生产过程及检验)、超常超标、质量事故、产品稳定性考察、拒绝批次(物料及产品)、变更控制、验证、环境监测、人员情况、投诉、不良反应、产品召回及退货等方面进行了年度回顾分析;对品种的成品、中间产品主要质量控制指标、关键工序控制参数进行了统计、趋势分析;对回顾中出现的偏差制定了改进与预防措施。
本回顾年度涉及产品的回顾分析项目均符合规定,主要质量控制指标及主要工艺控制参数趋势基本稳定。
从而确认产品工艺稳定可靠,以及原料、辅料、半成品、成品现行标准适用。
2、回顾期限:3、制造情况:本回顾年度共生产白术、党参、当归、黄芩、黄芪、远志、熟地黄、生地黄、决明子、红花、柴胡、炒白扁豆、太子参、天麻、姜厚朴、厚朴、蒲公英、麸炒白术、连翘、苍术、麸炒苍术、醋香附、煅瓦楞子、酒萸肉、蒲公英、桔梗、丹参、猪苓、金银花、菊花、秦艽、醋延胡索、麦冬、菟丝子、山萸肉、川芎、桑白皮等36个产品,共113批,总产量为17864.2kg。
4、产品描述:4.1产品工艺:【详细内容见各产品的工艺规程及各岗位标准操作规程、设备操作规程】。
4.2工艺流程图:原药材数量(岗位操作人员需熟悉常用中药材的经验鉴别干燥成品检验合格入库5. 物料质量回顾:主要物料供应商一览表5.1 原辅料、包装材料质量问题回顾评价:⑴本回顾年度涉及该产品的原料蒲公英、黄芪、金银花、丹参、白芍、菟丝子、百部、黄柏、牡丹皮、川芎、麦冬、厚朴、天麻、大腹皮、太子参、白扁豆、瓦楞子、香附、山茱萸、决明子、地黄、桔梗、猪苓、柴胡、菊花、黄精、黄芩、白术、苍术、秦艽、延胡索、当归、党参、远志、红花、赤芍、桑白皮、连翘、麦麸、生姜、黄酒、醋、复合袋、外箱、双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜、双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜(E)、双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜(F)、药用聚乙烯塑料袋C无质量缺陷。
⑵本回顾年度涉及该产品的包装材料无质量问题。
5.2 主要原辅料购进情况回顾评价:本回顾年度涉及的中药饮片共购进原料:蒲公英2批、姜厚朴1批、天麻1批、厚朴1批、太子参1批、炒白扁豆3批、麸炒白术3批、连翘3批、苍术3批、熟地黄13批、麸炒苍术1批、醋香附5批、煅瓦楞子7批、白术7批、酒萸肉1批、地黄5批、桔梗3批、丹参1批、猪苓1批、黄芩6批、金银花5批、菊花4批、秦艽3批、醋延胡索3批、党参3批、当归4批、黄芪4批、远志3批、决明子1批、红花1批、柴胡1批、麦冬3批、菟丝子3批、山萸肉3批、川芎1批、桑白皮3批;辅料:麦麸1批、生姜1批、黄酒1批、醋2批、复合袋2批、外箱1批、双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜2批、双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜(E)1批、双向拉伸聚丙烯/低密度聚乙烯药品包装用复合膜(F)1批、药用聚乙烯塑料袋C1批。
上述原料、辅料分别按《中国药典》2010年版一部、《中国药典》2010年版第一增补本及第二增补本、《河南省炮制规范》(2005年版)该产品项下的质量标准检验,均符合规定,全部放行使用。
5.3 供应商的管理情况回顾供应商审计情况:对上述供应商均已进行审计。
评价:本回顾年度供应商均按计划完成审计,审计过程未见偏差,结果均符合规定。
5.4 工艺用水质量问题回顾评价:本回顾年度工艺用水为饮用水,于6. 成品质量回顾:6.1 成品质量标准6.1.1蒲公英6.1.4 厚朴6.1.5 太子参6.1.6炒白扁豆6.1.11 麸炒苍术6.1.13 黄芩6.1.15 地黄6.1.17 白术6.1.18 酒萸肉6.1.19 桔梗6.1.20 丹参6.1.21 猪苓4 总灰分不得过5.0%不得过5.0%5 重金属及有害元素铅不得过百万分之五;镉不得过千万分之三;砷不得过百万分之二;汞不得过千万分之二;铜不得过百万分之二十。
铅不得过百万分之五;镉不得过千万分之三;砷不得过百万分之二;汞不得过千万分之二;铜不得过百万分之二十。
6 有机氯农药残留量六六六(总BHC)不得过千万分之二;滴滴涕(总DDT)不得过千万分之二;五氯硝基苯(PCNB)不得过千万分之一。
六六六(总BHC)不得过千万分之二;滴滴涕(总DDT)不得过千万分之二;五氯硝基苯(PCNB)不得过千万分之一。
7 浸出物不得少于17.0%不得少于17.0%8 含量测定含黄芪甲苷(C41H68O14)不得少于0.040%,含毛蕊异黄酮葡萄糖苷(C22H22O10)不得少于0.020%。
含黄芪甲苷(C41H68O14)不得少于0.040%,含毛蕊异黄酮葡萄糖苷(C22H22O10)不得少于0.020%。
序号项目名称内控标准法定标准1 性状本品应呈圆柱形的段。
外表皮灰黄色至灰棕色,有横皱纹。
切面棕黄色,中空。
气微,味苦、微辛,嚼之有刺喉感。
.本品应呈圆柱形的段。
外表皮灰黄色至灰棕色,有横皱纹。
切面棕黄色,中空。
气微,味苦、微辛,嚼之有刺喉感。
.2 薄层鉴别应显相同颜色的荧光斑点应显相同颜色的荧光斑点薄层鉴别应显相同颜色的斑点应显相同颜色的斑点3 水分不得过12.0%不得过12.0%4 总灰分不得过6.0%不得过6.0%5 浸出物不得少于30.0%不得少于30.0%6 含量测定含细叶远志皂苷(C36H56O12)不得少于2.0%,含远志酮Ⅲ(C25H28O15)不得少于0.15%,含3,6’二芥子酰基蔗糖(C36H46O17)不得少于0.50%。
含细叶远志皂苷(C36H56O12)不得少于2.0%,含远志酮Ⅲ(C25H28O15)不得少于0.15%,含3,6’二芥子酰基蔗糖(C36H46O17)不得少于0.50%。
6.1.29 决明子6.1.30 红花6.1.32 麦冬6.1.34 山萸肉6.1.36 桑白皮本年度回顾中生产成品蒲公英2批、姜厚朴1批、天麻1批、厚朴1批、太子参1批、炒白扁豆3批、麸炒白术3批、连翘3批、苍术3批、熟地黄13批、麸炒苍术1批、醋香附5批、煅瓦楞子7批、白术7批、酒萸肉1批、地黄5批、桔梗3批、丹参1批、猪苓1批、黄芩6批、菊花5批、金银花5批、醋延胡索3批、党参3批、当归4批、黄芪4批、远志3批、决明子1批、红花1批、柴胡1批、麦冬3批、菟丝子3批、山萸肉3批、川芎1批、桑白皮3批按照中国药典(2010年版)及内控标准检验,上述产品质量指标均符合质量标准要求。
6.2 对“6.1”项成品生产批次统计,只有熟地黄(厚片)生产批次超过10批,对熟地黄的定量质量指标如成品的水分、总灰分、酸不溶性灰分、浸出物、含量测定,中间产品的水分、杂质及成品收率进行统计、趋势分析。
6.3 各项质量指标用“单值-移动极差控制图”分析说明 6.3.1 参考文献:① 中华人民共和国国家标准 GBT 4091-2001常规控制图;② 《统计过程控制(SPC )体系实施指南》袁学成、胡湘洪编著,中国标准出版社出版。
6.3.2 样本移动极差(R S ):R Si = |χi+1 - χi |6.3.3 移动极差平均值(s R )s R = 1∕(K-1)×(R S1+ R S2+… …+R S288) 6.3.4 计算错误!未找到引用源。
值X 1+X 2+……+X KX = -------------K (单值个数)6.3.5 计算X 图的上、下控制限中心线(CL ): CL=错误!未找到引用源。
X 上控制线 (UCL): UCL =X +s R E 2 下控制线 (LCL ): LCL =X -s R E 26.3.6 计算R s 图的上、下控制限中心线 (CL ):CL =s R 上控制线(UCL): UCL =s R D 4下控制线(LCL ): LCL =s R D 3(不考虑)6.3.7 E 2 D 4 D 3 查控制图系数表(见附表) n 为2时 E 2=2.659 D 4=3.267D 3(*样本容量小于7时,没有稽查的下限)。
6.3.8 作图以项目和移动极差为纵坐标,样本号为横坐标,标上数值后,分别画出R S 图和X 图的控制线,画点连线,注上相关内容和数据。
(中心线为实直线,上下控制线为虚直线)。
6.3.9 附表: “单值-极差控制图”常用系数表*样本容量小于7时,没有稽查的下限。
6.3.10 对于生产过程中出现偏差的批次,其数据不能够列入样本,以免给统计数据造成误差,影响趋势分析的可靠性。
6.3.11 数据分析方法说明用“单值--移动极差控制图”进行趋势分析,确认各数据是否全部落在控制上限和控制下限之内。
若超出范围,则采取下列措施:(1)跟踪偏离范围的批次,查找记录;找出其偏离的原因,并讨论解决; (2)对照生产工艺操作程序、SOP 执行情况,对暴露问题必须及时纠正; (3)内控标准不合理必须立即修改,以符合实际工艺的需求; (4)寻找其他导致偏离的原因。
6.4 成品质量指标用“单值-极差控制图”进行统计、趋势分析 6.4.1 10批熟地黄饮片水分测定值X 汇总及R s 计算表标准规定: 水分不得过15.0%① 样本移动极差(R s ):R Si = |χi+1 -χi | (见上表R Si 值)② 移动极差平均值(s R )s R = 1∕(K-1)×(R S1+R S2+… …+R S288)= 0.256③ 计算错误!未找到引用源。
