【最新】一氧化碳与二氧化碳的比较
二氧化碳和一氧化碳的比较
二氧化碳和一氧化碳的比较
二氧化碳、一氧化碳是碳的两种氧化物。
组成上虽然相似但性质却相差很远。
下面我将从组成、结构、性质、用途及环境等角度进行比较:
一、从组成上比较:
二氧化碳和一氧化碳都是由氧元素和碳元素组成的。
二、从结构上比较:
一个二氧化碳分子是由一个碳原子和两个氧原子构成的;
一个一氧化碳分子是由一个碳原子和一个氧原子构成的。
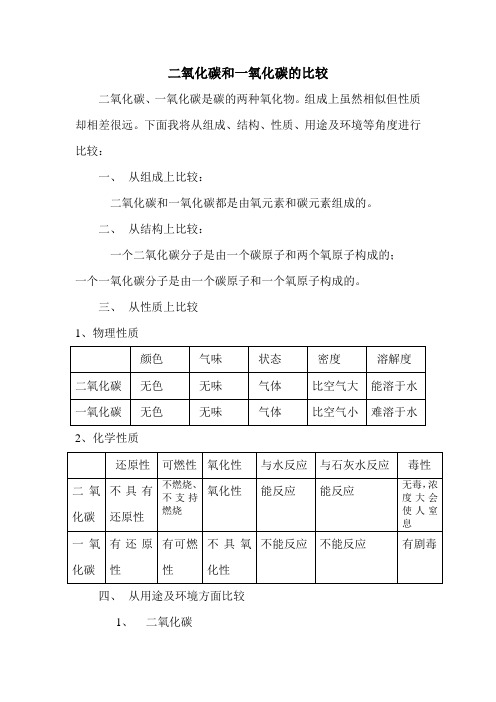
三、从性质上比较
1、物理性质
2、化学性质
四、从用途及环境方面比较
1、二氧化碳
(1)促进植物的光合作用
(2)由于其不燃烧,也不支持燃烧且密度比空气大,可用于灭火(3)生产化肥及作气体肥料
(4)固体二氧化碳叫干冰,升华时会吸收大量的热,可作人工降雨、制冷剂
(5)制作碳酸饮料
(6)对环境的影响——产生温室效应
2、一氧化碳
(1)燃烧能产生大量的热因此可作为能源。
(2)具有还原性,可用于冶炼工业。
以上就是二氧化碳和一氧化碳的比较。
二氧化碳和一氧化碳化学性质不同的原因

二氧化碳和一氧化碳化学性质不同的原因
二氧化碳和一氧化碳是我们经常接触到的两种物质,它们具有不同的化学性质,也是它们有不同的原因。
首先,二氧化碳和一氧化碳的原子结构不同。
二氧化碳有两个氧原子和一个碳原子,他们的原子结构是由四个共价键组成的,每个共价键使用一个氧原子和一个碳原子组成,形成一个多边形结构,碳原子每个都有四个共价键,而一氧化碳只有一个氧原子和一个碳原子,他们的原子结构是由两个共价键组成,一个氧原子和一个碳原子,形成一个双边形结构,碳原子只有两个共价键。
另外,二氧化碳和一氧化碳的电子结构也不同。
二氧化碳有四个电子层,其中最外层有八个电子,而一氧化碳只有两个电子层,最外层只有两个电子,电子层结构的不同导致了二氧化碳和一氧化碳的化学性质也不同。
此外,二氧化碳和一氧化碳的极性也不同。
二氧化碳的分子极性比一氧化碳的分子极性大,这是由于二氧化碳的分子结构比一氧化碳的分子结构大,共价键的个数也比一氧化碳的多,因此,二氧化碳的极性比一氧化碳的极性大。
最后,二氧化碳和一氧化碳的化学反应也不同。
因为二氧化碳的分子结构比一氧化碳的分子结构大,碳原子有四个共价
键,因此,它易于与其他物质反应,而一氧化碳只有两个共价键,所以它不容易与其他物质反应。
综上所述,二氧化碳和一氧化碳的化学性质不同,主要是由于它们的原子结构、电子结构、极性和化学反应都不同所致。
因此,我们可以根据不同的化学性质来选择不同的物质,以满足我们的需求。
一氧化碳与二氧化碳
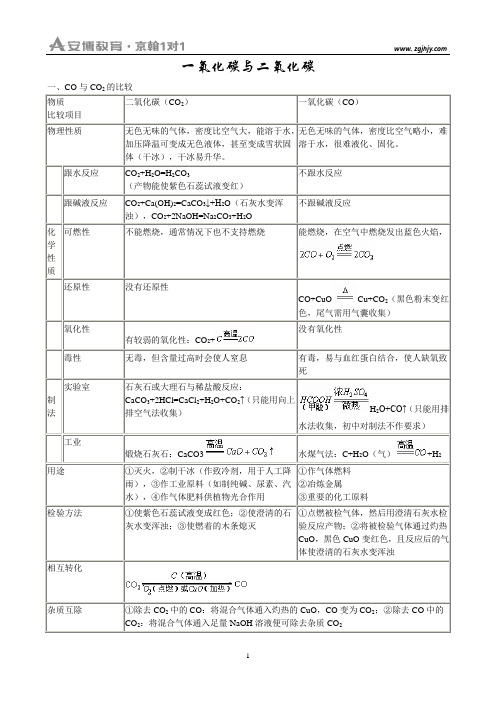
一氧化碳与二氧化碳一、CO与CO 的比较CO+CuO Cu+CO+H2O+CO↑(只能用排CaCO3(气)二、题型例析1. 计算型例1.现有CO和CO2的混合气体20g,其中氧元素的质量分数为64%,先使该混合气体通过足量灼热的氧化铁,再通入足量的澄清石灰水中,生成沉淀的质量为多少?(假设各步均完全反应)2. 性质型例2. 如图1所示的两瓶气体,若同时放在日光下,过一段时间可以观察到什么现象?这种现象说明了什么问题?例3. 点燃两支高低不同的蜡烛,然后在蜡烛上面倒扣一个大烧杯,请你叙述两支蜡烛熄灭的情况?解释其原因。
3. 设计型例4. 用一氧化碳还原氧化铜时,为防止一氧化碳对空气污染,课本中已介绍了两种对尾气的处理方法,即:(1)用气球收集;(2)将尾气点燃。
请你再设计出一种方法,并说明其特点。
4. 评价型例5. (2002年河南竞赛题)某学生设计了三种方案用于实验室制取二氧化碳。
(A)方案:(B)方案:(C)方案:你认为应选择哪种方案最好?为什么?5.信息型例7. 某化学活动小组的同学在实验室设计了如图4实验:向盛有少量固体甲的试管内持续通入气体乙,过一会儿在M处导管口点火(假设点着的火焰可以达到高温),一段时间后,试管中的固体变成光亮的红色,而澄清的石灰水变浑浊。
请回答下列问题:(1)若甲是CuO、Fe2O3、Cu2(OH)2CO3中的一种,而乙是H2、O2、CO中的一种,则甲、乙的组合可能有如下几种情况:①_________,②_________,③_________。
(2)若甲是C和CuO的混合物,乙是CO2,这种组合_________(填“可行”或“不行”),因为_________。
6. 综合型例8.乙醇是以高粱、玉米、薯类等为原料,经发酵、蒸馏而制得,属于可再生能源。
在汽油中加入适量乙醇作为汽油燃料,可节省石油资源,减少汽车尾气的污染。
2001年4月2日国家技术监督局发布《车用乙醇汽油》国家标准,并于同年4月15日开始实施。
一氧化碳和二氧化碳的区别

一氧化碳和二氧化碳的区别在物理性质上的区别:二氧化碳能溶于水,无毒无色,不能燃烧也不支持燃烧。
固体二氧化碳俗称干冰,常用于制冷剂。
一氧化碳难溶于水,有毒,无色无味。
容易和人体内的血红蛋白结合造成缺氧,形成一氧化碳中毒。
一氧化碳(CO)纯品为无色、无臭、无刺激性的气体。
分子量28.01,密度1.250g/l,冰点为-207℃,沸点-190℃。
在水中的溶解度甚低。
空气混合爆炸极限为12.5%~74%。
一氧化碳进入人体之后会和血液中的血红蛋白结合,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。
因此一氧化碳具有毒性。
在化学性质上的区别:一氧化碳化学性质较稳定。
可以燃烧,和氧气结合形成二氧化碳。
二氧化碳和水反应形成碳酸,同时碳酸不稳定,用以分解成水和二氧化碳。
碳酸为一种弱酸。
此外二氧化碳还可以和多种正离子反应形成沉淀。
常用的二氧化碳坚定方法就是将二氧化碳通入石灰水,石灰水变浑浊,加入足量硝酸后,石灰水变澄清,证明该气体为二氧化碳。
二氧化碳是空气中常见的化合物,其分子式为CO?,由两个氧原子与一个碳原子通过共价键连接而成,常温下是一种无色无味气体,密度比空气略大,能溶于水,与水反应生成碳酸。
二氧化碳与一氧化碳的鉴别方法:(1)澄清石灰水:将气体分别通入澄清石灰水中,能使澄清石灰水变浑浊的是二氧化碳,无明显现象的是一氧化碳。
(2)燃着的木条:将气体分别在空气中点燃,能燃烧的是一氧化碳,不能燃烧的是二氧化碳。
(3)紫色石蕊试液:将气体分别通入紫色石蕊试液中,能使石蕊试液变红的是二氧化碳,无明显现象的是一氧化碳。
(4)还原金属氧化物:将气体分别通过灼热的氧化铜,出现黑色粉末变红这一现象的是一氧化碳,没有明显现象的是二氧化碳。
二氧化碳与一氧化碳的除杂方法:1.CO(CO2)(括号内的物质为杂质):通常将气体通人过量的碱溶液(一般用氢氧化钠溶液而不用澄清石灰水)中,二氧化碳与碱溶液反应,从而达到除杂的目的。
二氧化碳和一氧化碳及其比较

二氧化碳和一氧化碳及其比较1.二氧化碳的物理性质在通常状况下,二氧化碳是一种无色气体,能溶于水,在标准状况下,二氧化碳的密度是 1.977 g/L,约是空气的 1.5 倍。
固体二氧化碳又叫做干冰,它可以升华。
2.二氧化碳的化学性质(1)本身不能燃烧,一般也不支持可燃物燃烧,不能供给呼吸。
在一般情况下,CO2既不能燃烧,也不能支持可燃物燃烧。
但在一定条件下,某些物质也可以在CO2中燃烧,如点燃的镁条,伸入盛有CO2的集气瓶中能继续燃烧:(2)跟水反应生成碳酸:CO2+H2O=H2CO3,生成的碳酸可使紫色的石蕊试液变红色。
①CO2能溶解于水,通常1体积的水可以溶解1体积的CO2,增大压强时,还会溶解得更多些。
CO2溶于水的同时还与水发生反应,但水中溶解的CO2只有1%跟水结合成H2CO3,其余仍以分子形式溶解在水中。
②能使紫色石蕊试液变红色的是H2CO3,而不是CO2。
(3)跟石灰水反应产生碳酸钙(白色)沉淀,此反应可用来检验二氧化碳。
CO2+Ca(OH)2=CaCO3↓+H2O3.二氧化碳对生活和环境的影响(1)用途①用于灭火;②用作制冷剂,用来保存食品和用于人工降雨;③作肥料,制纯碱、汽水等。
(2)影响近几十年来,由于人类消耗的能源急剧增加,森林遭到破坏,大气中二氧化碳的含量不断上升,造成“温室效应”。
4.一氧化碳的物理性质通常状况下,一氧化碳是一种无色、无味的气体,它的密度比空气的略小,难溶于水。
5.一氧化碳的化学性质(1)可燃性现象:燃烧时发出蓝色火焰,放出热量。
(2)还原性现象:黑色的氧化铜变红色,同时有使澄清的石灰水变浑浊的气体生成。
(3)毒性正常的血液呈深红色,当通入一氧化碳后,血液由深红色变成鲜红色,原因是一氧化碳能与血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,严重时会危及生命。
6.一氧化碳与二氧化碳的比较从CO和CO2的化学式可看出,CO比CO2少1个氧原子。
由于分子结构不同,就使得 CO和CO2的性质有很大差别。
一氧化碳与二氧化碳的异同点

一氧化碳与二氧化碳的异同点相同点:都是由碳、氧两种元素组成的氧化物,同属无机化合物。
不同点:一、结构:1、一氧化碳:碳的最外层有4个电子,氧的最外层有6个电子,碳的2个单电子进入到氧的p轨道和氧的2个单电子配对成键,形成两个键,然后氧的孤电子对进入到碳空的P轨道中形成一个配键,氧和碳之间就形成了三个键。
一氧化碳分子为极性分子,但分子的极性很弱。
分子形状为直线形。
2、二氧化碳:在二氧化碳分子中,碳原子采用sp杂化轨道与氧原子成键。
碳原子的2个sp杂化轨道分别与2个氧原子生成2个σ键。
碳原子上2个未参加杂化的p轨道与sp杂化轨道成直角,并且从侧面同氧原子的p轨道分别肩并肩地发生重叠,缩短了碳—氧原子间地距离,使二氧化碳中碳氧键具有一定程度的叁键特征。
决定分子形状的是sp杂化轨道,二氧化碳为非极性分子,分子形状为直线形。
二、物理性质:1、一氧化碳:在通常状况下,一氧化碳是无色、无臭、无味、难溶于水的气体,熔点-207℃,沸点-191.5℃。
标准状况下气体密度为1.25g/L,和空气密度(标准状况下 1.293g/L)相差很小,在水中的溶解度甚低,但易溶于氨水。
2、二氧化碳:在通常状况下是一种无色、无臭、无味的气体,能溶于水,溶解度为0.144g/100g水(25℃)。
在20℃时,将二氧化碳加压到5.73×106 Pa即可变成无色液体,常压缩在钢瓶中存,在-56.6℃、5.27×105 Pa时变为固体。
液态二氧化碳碱压迅速蒸发时,一部分气化吸热,二另一部分骤冷变成雪状固体,将雪状固体压缩,成为冰状固体,即俗你“干冰”。
“干冰”在1.013×105 Pa、-78.5℃时可直接升华变成气体。
二氧化碳比空气重,在标准状况下密度为1.977g/L,约是空气的1.5倍。
二氧化碳无毒,但不能供给动物呼吸,是一种窒息性气体。
三、化学性质:1、一氧化碳:a、可燃性:一氧化碳能够在空气中或氧气中燃烧,生成二氧化碳:2CO+O2=点燃=2CO2燃烧时发出蓝色的火焰,放出大量的热。
二氧化碳和一氧化碳及其比较

二氧化碳和一氧化碳及其比较1.二氧化碳的物理性质在通常状况下,二氧化碳是一种无色气体,能溶于水,在标准状况下,二氧化碳的密度是 1.977 g/L,约是空气的 1.5 倍。
固体二氧化碳又叫做干冰,它可以升华。
2.二氧化碳的化学性质(1)本身不能燃烧,一般也不支持可燃物燃烧,不能供给呼吸。
在一般情况下,CO2既不能燃烧,也不能支持可燃物燃烧。
但在一定条件下,某些物质也可以在CO2中燃烧,如点燃的镁条,伸入盛有CO2的集气瓶中能继续燃烧:(2)跟水反应生成碳酸:CO2+H2O=H2CO3,生成的碳酸可使紫色的石蕊试液变红色。
①CO2能溶解于水,通常1体积的水可以溶解1体积的CO2,增大压强时,还会溶解得更多些。
CO2溶于水的同时还与水发生反应,但水中溶解的CO2只有1%跟水结合成H2CO3,其余仍以分子形式溶解在水中。
②能使紫色石蕊试液变红色的是H2CO3,而不是CO2。
(3)跟石灰水反应产生碳酸钙(白色)沉淀,此反应可用来检验二氧化碳。
CO2+Ca(OH)2=CaCO3↓+H2O3.二氧化碳对生活和环境的影响(1)用途①用于灭火;②用作制冷剂,用来保存食品和用于人工降雨;③作肥料,制纯碱、汽水等。
(2)影响近几十年来,由于人类消耗的能源急剧增加,森林遭到破坏,大气中二氧化碳的含量不断上升,造成“温室效应”。
4.一氧化碳的物理性质通常状况下,一氧化碳是一种无色、无味的气体,它的密度比空气的略小,难溶于水。
5.一氧化碳的化学性质(1)可燃性现象:燃烧时发出蓝色火焰,放出热量。
(2)还原性现象:黑色的氧化铜变红色,同时有使澄清的石灰水变浑浊的气体生成。
(3)毒性正常的血液呈深红色,当通入一氧化碳后,血液由深红色变成鲜红色,原因是一氧化碳能与血液里的血红蛋白结合,使血红蛋白不能很好地跟氧气结合,严重时会危及生命。
6.一氧化碳与二氧化碳的比较从CO和CO2的化学式可看出,CO比CO2少1个氧原子。
由于分子结构不同,就使得 CO和CO2的性质有很大差别。
一氧化碳和二氧化碳的区别的原因

一氧化碳和二氧化碳的区别的原因二氧化碳是由一个氧原子和两个氧分子组成的,其化学式为CO2。
它是一种无色无味的气体。
两者的结构不同。
1、成分不同:一氧化碳是由一个氧原子和两个氧分子构成的,二氧化碳是由两个氧原子构成的。
2、用途不同:一氧化碳是一种非常重要的化工原料和化工产品,主要用于冶炼和钢铁工业;二氧化碳是一种温室气体,可以用作致冷剂、灭火剂、干冰、光气的原料、人造冰晶石等。
3、性质不同:①一氧化碳是一种无色无味的气体。
②二氧化碳有毒,易溶于水。
4、运输方式不同:一氧化碳是液态的,通常盛放在液态化石燃料的钢瓶里。
而二氧化碳是气体,通常储存在钢瓶中。
5、固态与液态不同:①一氧化碳在气态时会生成液态二氧化碳。
②二氧化碳只有在加压条件下才能从固态变成液态。
③一氧化碳的沸点很低,不到-191 ℃,在常温下可以支持燃烧。
④二氧化碳的沸点很高,常温下很难汽化。
2、性质不同:①两种物质的相对分子质量不同。
一氧化碳的相对分子质量为28,而二氧化碳的相对分子质量为44。
②两种物质的沸点不同。
一氧化碳的沸点为-191 ℃,比二氧化碳的沸点-56 ℃低。
③一氧化碳是一种无色无味的气体。
二氧化碳是一种常见的气体,我们经常将呼出的气体通过手帕、毛巾或其他东西去除其中的二氧化碳,然后再把这些带有二氧化碳的气体通过鼓风机吹入房间内,因此人们常常会感到鼻子和喉咙有刺激感。
④一氧化碳是有毒的,一旦接触到人体,就会使人窒息。
二氧化碳却没有毒,也不具有任何令人窒息的特性。
⑤一氧化碳是助燃剂,在常温下和二氧化碳一样会支持燃烧。
⑥二氧化碳也是一种中药,它有清热、镇静、降温的作用。
⑦二氧化碳还是碳水化合物、蛋白质、脂肪、甲醇、氨基酸、葡萄糖等的成分之一。
3、密度不同:一氧化碳密度比空气小,比空气轻。
二氧化碳密度比空气大,比空气重。
4、用途不同:①一氧化碳可以冶炼和钢铁工业,也是人造冰晶石、干冰、光气的原料。
②二氧化碳是一种温室气体,可以用作致冷剂、灭火剂、干冰、光气的原料、人造冰晶石等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021/2/2
1
从前偶一对双胞胎王子一氧化碳和 二氧化碳,他们都是无色无味的, 表面都一样,无法分开,他们同时 喜欢一位美丽的平凡女孩,她叫氢 氧化钙,开始时女孩无法分辨,但 是经过一段相处她就喜欢上了二氧 化碳,那你猜猜为什么?
2021/2/2
2
物理性质
性 质
化学性质
2021/2/2
3
CO与CO2的物理性质的比较:
气体 物理性质
CO2
CO
色、态、味 溶解性
无色无气味
气体 能溶于水 (1:1)
无色无气味
气体 难溶于水 (1: 0.02)
密度
比空气大
比空气略小
(1.977克/升) (1.250克/升)
2021/2/2
4
化学性质
CO2
不能燃烧,也不支持燃烧
CO
具有可燃性
2021/2/2
5
四、一氧化碳的用途 1.作气体燃料(可燃性) 2.冶炼金属(还原性)
2021/2/2
6
2021/2/2
7
干冰
大型冷库
贮存食品
人工降雨
2021/2/2
人造舞台云雾
8
2021/2/2
9
CuO CO
2021/2/2
澄清的幻灯片 5石灰水
10
加热前: 氧化铜
一氧化碳
+
2021/2/2
点燃
2CO + O2
CO2
溶于水,与水反应
难溶于水,也不与水反应
CO2 + H2O
石灰水变浑浊
CO2+Ca(OH)2 CaCO3 +H2O
具有氧化性 CO2 + C 点燃 2CO
具有还原性幻灯片 6
加热
CO + CuO Cu + CO2
没有毒性
具有毒性(与血红蛋白结合)
+
一氧化碳
氧化铜
11
加热幻灯 片氧5时化:铜 一氧化碳
+
+
2021/2/2
铜
二氧化碳 12
与石灰水幻灯片 5反应
鉴定二氧化碳
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O 碳酸钙
2021/2/2
13
