氧化镍的循环伏安曲线
循环伏安法
❖ 循环伏安法不仅可鉴定
电化学反应产物,还可鉴 定电化学—化学偶联反应 过程的产物。
❖ 例如,对—氨基苯酚的 电极反应过程,其循环伏
安图如图。开始由较负的 电位(图中起始点)沿箭头 方向作阳极扫描,得到一 个阳极峰1,而后作反向 阴极扫描,出现两个阴极 峰2和3,再作阳极扫描时 出现两个阳极峰4和5(图 中虚线表示)。其中峰5与 峰1的位置相同。
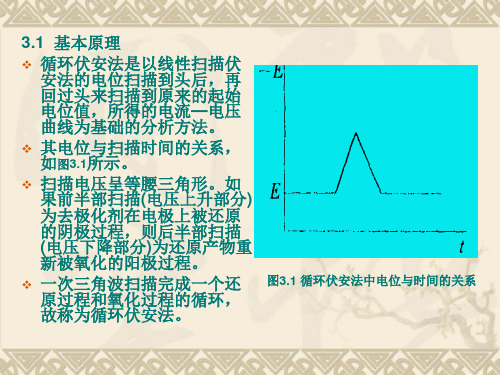
图3.1 循环伏安法中电位与时间的关系
❖ 其电流—电压曲线如图
图3.2 循环伏安图
❖ 阳、阴极峰电流之比值(设
)
❖ 严格地说,只有当电极反应产物可溶于溶液时, 上式的比值才为1。如电极产物形成汞齐,则由于 悬汞电极的体积很小,汞中还原形的浓度比溶液 中氧化形的浓度大得多,因而阳极峰电流比阴极 峰电流大。
极反应为
❖ 扫速越慢,阳极峰电流比阴极峰电流降低得更快,峰电流之 比ip,a/ip,c与v的关系如前图, ip,a/ip,c随v增加而增加,最后趋 于 发1生。水这化是反由应于电极还原产物Co(en)32+不稳定,在电极附近
❖ Co(en)32+可在阳极上氧化,而水化产物Co(en)2(OH)22+则不 能,因此,扫速越快,水化反应越来不及进行,生成的水化 物越少, ip,a/ip,c值越接近于1。反之,v越小,水化反应作用 越大,电流比值越小。
❖ 三种不同R1和R 2基的烯类比合物的反应是二聚化 反应的另一例子。其反应通式为
❖ 不同取代基的反应物的伏安图,如下图所示。
烯类化含物循环伏安图
c为
的循环伏安图,无阳极峰,表明二聚化反应很快,
循环伏安法原理及结果分析(图表相关)

循环伏安法原理及应用小结1 电化学原理1.1 电解池电解池是将电能转化为化学能的一个装置,由外加电源,电解质溶液,阴阳电极构成。
阴极:与电源负极相连的电极(得电子,发生还原反应)阳极:与电源正极相连的电极(失电子,发生氧化反应)电解池中,电流由阳极流向阴极。
1.2 循环伏安法1)若电极反应为O+e-→R,反应前溶液中只含有反应粒子O,且O、R在溶液均可溶,控制扫描起始电势从比体系标准平衡电势(φ平)正得多的起始电势(φi)处开始势作正向电扫描,电流响应曲线则如图0所示。
图0 CV扫描电流响应曲线2)当电极电势逐渐负移到(φ平)附近时,O开始在电极上还原,并有法拉第电流通过。
由于电势越来越负,电极表面反应物O的浓度逐渐下降,因此向电极表面的流量和电流就增加。
当O的表面浓度下降到近于零,电流也增加到最大值Ipc,然后电流逐渐下降。
当电势达到(φr)后,又改为反向扫描。
3)随着电极电势逐渐变正,电极附近可氧化的R粒子的浓度较大,在电势接近并通过(φ平)时,表面上的电化学平衡应当向着越来越有利于生成R的方向发展。
于是R开始被氧化,并且电流增大到峰值氧化电流Ipa,随后又由于R的显著消耗而引起电流衰降。
整个曲线称为“循环伏安曲线”1.3 经典三电极体系经典三电极体系由工作电极(WE)、对电极(CE)、参比电极(RE)组成。
在电化学测试过程中,始终以工作电极为研究电极。
其电路原理如图1,附CV图(图2):扫描范围-0.25-1V,扫描速度50mV/S,起始电位0V。
图1 原理图图2 CBZ的循环伏安扫描图图2所示CV扫描结果为研究电极上产生的电流随电位变化情况图。
1)横坐标Potential applied(电位)为图1中电压表所测,即Potential applied=P(WE)-P(RE)所有的电位数值都是相对于氢离子的电位值,规定在标准情况下,氢离子的电位为0。
当恒电位仪向工作电极提供负的电位时,其电源连接情况如图1所示,即工作电极与电源的负极相连,作为阴极工作发生还原反应;反之则作为阳极发生氧化反应。
循环伏安法细则

Originally posted by lzx9968 at 2010-04-14 20:41:21:
请教个问题,如果使用甘汞电极做参比,测试中发生反应的电位是0.4V,那么实际反应电位应该是多少呢,就是0.4V还是要加上或者减去参比电位?
我先问一个, 单电子过程扫循环伏安, 氧化还原电位差不在59mv , 那么主要影响电极的界面因素有哪些? 是什么扩大了电位差?
请问大家,做循环伏安曲线使用的工作电极和辅助电极都是铂电极,其中辅助电极要求面积较大一些,那工作电极的面积相对来说就要小一些,具体应小到什么程度,如果面积较大(但仍小于辅助电极)会对循环伏安曲线由什 ...
饱和甘汞电极电极电位为0.242V,相对于SHE的话,是0.4V加上0.242V,即0.642V vs SHE
看扫描方向,由正向负方向扫出的峰就是还原峰,由负往正方向扫就是氧化峰,也就是对应的负扫和正扫
我们用的是上海辰华的工作站,也是颠倒的,一般我们把数据导出再用ORIGIN75处理数据,把图形倒过来。
习惯上,将流入电极表面的电流,定义为负,流出电极表面的电流定义为正,前者为阴极,还原,后者为氧化。
仪器的cv图,可以根据扫描电位的方向,向负电位方向扫,肯定是先出现的还原电流峰,所以哪个先出来,就是还原峰,不用拘泥于坐标轴。
吸附可能会有物理吸附,化学吸附两种
循环伏安可以用于电沉积金属的,实际是就是在CV过程中,金属盐或者酸发生还原被还原成单质的。
Quote:
Originally posted by zlin at 2010-03-15 20:16:16:
你好,循环伏安法是一种测试方法,不是电镀的一种手段。
循环伏安一般是给电极施加恒定扫描速度的电压持续的观察电极表面电流和电位的关系,可以用来表征电极表面发生的反应以及探讨电极反应的机理。
镍_氧化镍_铜_氧化亚铜复合纳米粒子修饰玻碳电极测定过氧化氢

镍2氧化镍/铜2氧化亚铜复合纳米粒子修饰玻碳电极测定过氧化氢杨阿喜a 金根娣b 3(a 扬州环境资源职业技术学院 扬州;b 扬州教育学院 扬州225002)摘 要 在含镍离子和铜离子的溶液中用循环伏安法在玻碳电极(GCE )表面电化学沉积一层镍2氧化镍及铜2氧化亚铜纳米粒子(N i/N i O 、Cu /Cu 2O ),在-013V 电位条件下,该传感器能催化还原H 2O 2。
用安培法测定H 2O 2的响应电流与浓度在215×10-6~218×10-3mol/L 范围内呈线性关系,研究了各种实验条件对H 2O 2传感器性能的影响。
该传感器制作简单,在实际试样的回收率测定中,结果满意。
关键词 镍2氧化镍,铜2氧化亚铜,循环伏安法,安培法,电化学沉积中图分类号:O657.1 文献标识码:A 文章编号:100020518(2009)12214662052008211225收稿,2009203206修回通讯联系人:金根娣,女,硕士,副教授;E 2mail:jsyzjgd@sina .com;研究方向:电化学检测过氧化氢(H 2O 2)是工业生产、临床医学和环境科学等方面的重要物质,许多氧化还原酶催化反应的产物是H 2O 2,通过测定H 2O 2的浓度可以间接测定酶催化底物的浓度[1~3],H 2O 2的测定方法主要有容量分析法[4]、光谱法[5~7]、电化学方法[8,9]等。
目前,电化学生物传感器测定H 2O 2的方法主要是电流法即氧化H 2O 2产生电流。
镍和氧化镍是一种常见的电子传递介体[10,11],用于H 2O 2和葡萄糖的电化学检测。
也有纳米铜修饰电极测定H 2O 2的报道[12],还报道了用电化学方法在玻碳电极上修饰纳米钴2氧化钴用于砷的测定[13],但未见有将纳米镍2氧化镍/纳米铜2氧化亚铜同时修饰玻碳电极测定H 2O 2的报道。
由于镍比较活泼,使得纳米镍2氧化镍修饰的电极稳定性不好,而铜的金属性不如镍活泼,同时修饰纳米镍2氧化镍/铜2氧化亚铜后所得到电极的稳定性会增加,同时也增加了对H 2O 2的催化作用。
镍纳米线电极的电化学氧化还原行为及其对乙醇的电化学氧化催化作用_孔景临

镍纳米线电极的电化学氧化还原行为及其对乙醇的电化学氧化催化作用孔景临 薛宽宏* 何春建 邵 颖 陈巧玲姚建林 谢 泳 田中群(南京师范大学化学系 南京210097)(厦门大学固体表面物理化学国家重点实验室 厦门)摘 要 以铝在磷酸介质中形成的多孔氧化铝膜为模板,采用交流电沉积结合化学镀的方法制得镍纳米线电极.用原子力显微镜和透射电子显微镜表征了电极形貌.循环伏安实验表明,在碱性溶液中镍纳米线电极较之本体电极具有高得多的氧化还原峰电流密度和还原电量,而且前者对乙醇的电化学氧化具有高的催化活性,显示镍纳米线电极具有应用于镍的二次电池和有关有机电合成的良好前景.关键词 纳米线,镍电极,电池,乙醇,电催化中图分类号:O646 文献标识码:A 文章编号:1000-0518(2001)06-0462-042000-11-14收稿,2001-01-21修回国家自然科学基金(29973014)、江苏省自然科学基金(BK99062)和厦门大学固体表面物理化学国家重点实验室资助课题 镍在电化学工业中被广泛地用作镍镉电池和碱性介质中电解水的正极材料.近年来,高能量、无污染的M H /Ni 电池迅速发展,对镍电极的性能提出了更高要求,由于镍比贵金属催化剂来源广、价格便宜,用镍电极制得直接乙醇氧化燃料电池(DEFC )[1],将会使燃料电池的成本大大降低.关于镍电极的制备,目前研究主要集中在掺杂大比表面积球型Ni(O H)2粉体[2~5]方面.对于有机电合成所用的镍电极,研究者们尝试了电沉积于铜或石墨基底上的高比表面积镍电极[6]、抛光多晶镍电极[7]等.我们课题组近几年致力于多孔氧化铝模板合成纳米线的研究,利用这种纳米孔分布均匀有序,孔径大小可控的模板[8],制备了各种高度有序的纳米结构材料[9~11].本文报道以多孔氧化铝为模板制备的镍纳米线电极在碱性水溶液中的电化学氧化还原行为,及其对乙醇的电化学氧化催化作用.有助于进一步深入镍电极的理论研究,并具有实际的应用前景.1 实验部分1.1 镍纳米线电极的制备和表征电解液为质量分数4%的磷酸,直流电压45V ,温度25℃,氧化0.5h.制备好的模板按文献[9]方法进行交流电沉积,通过化学镀镍方法[12]沉积Ni .将镀覆好的样品剪去四周边缘,置于KO H 溶液中,溶解掉未氧化的基质铝及部分氧化铝,得到镍纳米线电极.制备好的电极用Dig tal Nanoscope Ⅲ型原子力显微镜(美国)以轻敲采集模式表征电极形貌.镍本体电极是表面经过抛光的多晶镍片(纯度为99.9%).测试的电极面积均为0.20cm 2.1.2 电化学性能的测试镍纳米线电极和本体电极在KO H 溶液中的氧化还原行为以及对乙醇氧化的电催化性能测试实验是在M 273恒电位仪(美国EG &G 公司)上进行,工作电极为镍纳米线电极或镍本体电极,对电极为螺旋状铂丝,参比电极为Ag /Ag Cl 电极(1m ol /L KCl ),电解液为1m ol /L KO H 溶液,实验温度25℃.实验中所用试剂均为分析纯,溶液用亚沸水配制.2 结果与讨论2.1 镍纳米线电极的形貌图1为镍纳米线电极的原子力显微镜照片.由图可见,该电极表面的纳米线尺寸均匀,直径在70~80nm.2.2 碱性溶液中镍纳米线电极和镍本体电极的电化学氧化还原行为关于碱性溶液中镍电极的阳极氧化过程已有许多报道[7,13],但由于镍的氧化物、氢氧化物种类多,晶型复杂,使得镍电极在高电位范围内的氧化过程仍不很清楚.已知镍与碱液接触后表面即会生成一层Ni (O H )2[13],起始生成的T -Ni (OH )2,会不可逆地转化为U -Ni(O H)2,后者不能被还原第18卷第6期应用化学V ol.18N o.62001年6月 C HIN ESE JO U RN AL O F A PP L IED CHEM IST RY Jun.2001图1 镍纳米线电极的AFM 照片Fig .1 An A FM imag e o f a Ni na no wire electro de 为镍[14].T -Ni (O H )2和U -Ni (O H )2在高电位下会进一步分别被氧化为V -和U -相的高价态镍的氧化物,其中V -相中可能含有四价镍[15].这些氧化物均具有复杂的结构,常简单地用V -NiOO H 和U -NiOO H [15]表示.为提高可重复性,在循环伏安实验之前先将工作电极在恒电位-0.7V (v s .Ag /Ag Cl,1mo l /L KCl)下预置一段时间.图2中曲线a 为镍纳米线电极在1mol /L KO H 溶液中浸过一段时间后的第1圈循环伏安曲线.图中可以看到2个氧化峰,在0.37和0.42V 电位下分别是T -Ni(O H)2和U -Ni (O H)2的氧化峰.存在U -Ni (O H )2的氧化是因镍纳米线电极在碱液中部分T -Ni (O H )2转化为U -Ni (O H )2.当该电极图2 镍纳米线电极在1mo l /L K O H 溶液中的循环伏安图Fig .2 Cyclic v oltammog r ams of a N i nanow ire electro de in 1mo l /L KO H so lutiona .th e 1st;b .the 55th cycle;scan rate 5mV /s经多次循环伏安实验达到稳定后,得到图2曲线b ,相对于T -Ni(O H)2的氧化峰基本消失,还原峰也不明显,表明这时镍纳米线电极表面组成主要为U -Ni (OH )2.表1比较了镍纳米线电极和镍本体电极在扫速为2mV /s 的循环伏安实验数据.表1 镍纳米线电极和镍本体电极循环伏安实验比较Tab .1 Results of cyclic voltammetry for Ninanowire and bulk electrodesNi electrode bulk nanow ire E p,a /V 0.436 0.423E p,c /V 0.3250.319ΔE a ,c /V 0.1110.10410-4j p,a /(m A ·m -2)0.248.8810-4j p,c /(mA ·m -2)0.097 6.2210-6Q red /(m A ·m -2)0.03651.89 E p,a :peak poten tial of oxidation ;E p,c :peak potential of red uction;j p,a :peak curren t density of oxidation;j p,c :peak cu rren t density of reduction;Q red :electric quantity of red uction.scan rate:2mV /s .表中可见,镍纳米线电极比本体电极具有高得多的表观氧化、还原峰电流密度和还原电量,同时前者较后者有更好的可逆性.两种镍电极的电活性有如此大的差异在于电极表面结构的不同.镍纳米线电极表面分布着直径为70~80nm 的纳米线,其具有传统固体材料所不具备的特殊性质,如小尺寸效应、表面效应、Kubo 效应[16]等.这些效应的存在使纳米线的比表面积、表面结合能增大,表面活性中心数目增多,而在电催化反应中电极材料表面原子的参与起重要作用,可能是镍纳米线电极较本体电极具有更高催化活性的原因.2.3 镍纳米线电极的质子扩散系数图3 镍纳米线电极在1mo l /L K O H 溶液中不同扫速下的循环伏安图Fig.3 Cyclic v oltammog r ams of a N i nano wireelectro de in 1mo l /L KO H so lutionscan rate /(mV ·s -1):a .5;b .10;c .20;d .30;e .50;f .80;g .100图3为镍纳米线电极在1mo l /L KOH 溶液中不同扫描速度下的循环伏安图.随扫描速度增463 第6期孔景临等:镍纳米线电极的电化学氧化还原行为及其对乙醇的电化学氧化催化作用 加,峰电流加大,氧化峰电位和还原峰电位分别向更正和更负方向移动.对电极反应U -Ni(O H)2→U-NiOO H +H ++e -.如图4所示,其峰电流密度j p,a 与扫描速度v 1/2成正比,这表明Ni(O H)2的氧化受扩散控制[2,15].研究发现,镍电极表面电化学反应能顺利进行时,质子在固相体相中的扩散就成为电极过程的控制步骤[15,17],因此质子扩散系数成为表征镍电极性能的重要参数,目前大多采用循环伏安法和电位阶跃法进行测定.由图4的直线斜率,按文献[2,15]方法,求得镍纳米线电极的质子扩散系数为1.4×10-9cm 2/s ,该值较镍本体电极的质子扩散系数 1.0×10-11cm 2/s [15]高出2个数量级,与表面化学镀Co 的Ni(O H)2球型粉体电极在高浓度KO H 溶液中的质子扩散系数1.2×10-9cm 2/s [2]相近.U -Ni (OH )2是一种导电性较差的p 型半导体,用常规方法制备的大比表面积U -Ni(O H)2粉体要进一步掺杂改性[2~5]以增强其导电性才能达到电池的使用要求.镍纳米线电极上的各根纳米线表面虽是Ni (O H )2,但中间仍是金属镍,故具有良好的导电性.图4 镍纳米线电极氧化峰电流与扫速平方根的关系图Fig.4 A plo t of a no dic peak curr ent vsv 1/2fo r a Ni nanowi re elect rode2.4 镍纳米线电极对乙醇氧化的电催化作用图5是镍纳米线电极在不同浓度的乙醇中的循环伏安曲线.在扫速和KO H 浓度相同的条件下,有乙醇和没有乙醇时相比,氧化峰电流明显加大,还原峰电流相应减小,说明U -NiOO H 对于乙醇的电化学氧化是一有效的催化剂.当乙醇浓度增加时,Ni(Ⅲ)通过化学反应转化为Ni(Ⅱ)的量越来越多,因而Ni(Ⅱ)的氧化电流越来越大,相应的Ni (Ⅲ)的还原峰电流越来越小.这与文献[6]报道的乙醇在镍电极上的氧化机理相符.在乙醇的浓度大于0.025mol /L 时(图5中曲线c ~e ),伏安曲线发生交叉,这是因为由正向扫描向负向扫描转变时,电极表面附近的乙醇及其氧化中间体未能被全部氧化,浓度仍相当大,因此在回扫的高电位区先继续出现Ni(Ⅱ)的氧化曲线并与正扫时的氧化曲线交叉,然后才出现Ni(Ⅲ)的还原曲线.图5 不同浓度的乙醇在镍纳米线电极上的循环伏安图Fig .5 Cyclic v oltammo g rams o f etha no l o n a Ni nano wire elec tro de in 1mol /L KO H so lutio nEtOH concentration(mol /L):a .0;b .0.025;c .0.05;d .0.10;e .0.20;scan rate 2mV /s图6 空白溶液校正后的乙醇在两种电极上的循环伏安图Fig.6 Cyclic v o ltam mog rams in 0.1mol /L EtO H +1mol /L KO H co rr ec ted by the blank so lutiono f 1mo l /L KO Ha .a bulk Ni electrod e ;b .a Ni nanowire electrod es can rate 10mV /s与文献中用于电催化氧化的各种镍电464应用化学 第18卷 极[6,7,15]相比,镍纳米线电极有很高的表观电流密度.我们在相同的实验条件下比较了镍纳米线电极和镍本体电极对乙醇的电催化氧化性能,图6是这两种电极在含有0.1mo l /L 乙醇和1mol /L KO H 溶液中的循环伏安曲线,其中已扣除了在1mo l /L KO H 空白溶液中的相应电流.镍本体电极在正向扫描时对乙醇的净氧化峰电流密度为1.35×104m A /m 2,而镍纳米线电极达到1.78×105m A /m 2,由此可见,其对乙醇氧化的催化活性明显地高于镍本体电极.关于镍纳米线电极对乙醇电催化氧化动力学实验结果拟另文发表.参 考 文 献 1 Pesselman R L ,M eshbeshe T M .Chem Eng Co -mun ,1985,38:265 2 W ang X Y ,Ya n J ,Zhang Y S,et al .J Appl Elec -trochem ,1998,28:1377 3 Z HAO Lin -Zhi (赵林治),Y AN G Shu -T ing (杨书廷),ZHAO Pei-Zheng (赵培正),et al .Yingyong Huax ue (应用化学),1998,15(2):112 4 Z HO U Zhen (周震),Y AN J ie (阎杰),ZHAN GYun -Shen (张允什),et al .Y ingyong Huax ue (应用化学),1998,15(2):40 5 C HEN W ei-Xia ng (陈卫祥),T AN G Zhi-Yuan (唐致远),L IU Zhao -Lin (刘昭林),et al .YingyongHuax ue (应用化学),1997,14(4):25 6 M anandhar K ,Pletcher D .J Appl Electrochem ,1979,9:707 7 Schr ebler Guzman R S,V ilche J R,Arvia A J .J Appl Electrochem ,1978,8:67 8 Dig gle J W ,Do wnie T C ,Goulding C W .ChemRev ,1989,69:365 9 P AN Gu-Ping (潘谷平),X U E K ua n-H o ng (薛宽宏),SU N Do ng -M ei (孙冬梅),et al .Huax ue W uli X uebao (化学物理学报),1999,12(6):675 10 X U Shi-M ing ,X U E K uan-Ho ng ,KO N G J ing-Lin,et al .Dianhuax ue (电化学),2000,6(2):151 11 SU N Do ng -M ei (孙冬梅),X U E Kuan -Ho ng (薛宽宏),C AI Cheng-Xin (蔡称心),et al .Fenxi Huax ue (分析化学),2000,28(10):1308 12 Dia ndusho ucebia nx ie zu(《电镀手册》编写组)Auths(著).Handboo k o f Elec tro plating (电镀手册).Beijing (北京):Na tio na l DefenseIndustria lPublishing Ho use(国防工业出版社),1986:511 13 Fleischmann M ,K orinek K ,Ple tcher D .Electro -anal Chem ,1971,31:39 14 Kim J W ,Park S M.J Electrochem Soc ,1999,146:1075 15 Zhang C ,Par k S M .J Electrochem Soc ,1987,134:2966 16 Kubo R.J Phys Soc Jap ,1962,17:975 17 M a cAr thur D M.J Electrochem Soc ,1970,117:422Electrochemical Redox Behavior of Ni NanowireElectrode and Its Application to Catalysis ofElectrooxidation of EthanolKONG Jing -Lin ,XU E Kuan -Ho ng *,HE Chun -Jian ,SHAO Ying ,CHEN Qiao -Ling(Department of Chemistry N anjing Normal University ,Nanjing 210097)YAO J ian-Lin,XIE Yo ng ,T IAN Zho ng-Qun(State Key Laboratory of Physical Chemistry for Solid Surf ace ,X iamen )Abstract The Ni nanowire electro des w ere fabrica ted by using po rous alumina a s a template.The electrodes possess high redox current density,hig h discharg e capacity a nd g ood redo x rev ersibility in 1mo l /L KOH solutio n ,sho wing its po tential application as a n ex cellent battery electrode .Ex perimental results also revealed its good cataly tic activ ities fo r electroox ida tion o f ethanol in an alkaline medium.Keywords na nowire,Ni electrode,ba ttery,ethanol,electrocatalysis465 第6期孔景临等:镍纳米线电极的电化学氧化还原行为及其对乙醇的电化学氧化催化作用 。
镍的cv氧化峰-详细解释说明

镍的cv氧化峰-概述说明以及解释1.引言1.1 概述镍是一种重要的过渡金属,具有良好的电化学性能和广泛的应用领域。
在电化学研究中,表征镍电极的氧化峰是一个重要的参数,可以提供关于电极表面氧化还原反应的信息。
CV测量方法是一种常用的技术,可以通过对电极施加不同的电压,观察电流的变化来研究氧化峰的形成机制。
本文将详细介绍镍的性质、CV测量方法以及氧化峰的形成机制。
通过对CV 氧化峰的特征进行分析,我们可以深入了解镍的电化学性质,从而为相关领域的研究和应用提供理论依据。
此外,还将探讨镍的氧化峰与电化学性质之间的关系,并展望未来可能的研究方向和应用前景。
通过本文的阐述,相信读者能够对镍的CV氧化峰有一个全面的了解,并对相关领域的研究和开发有所启发。
1.2 文章结构文章结构部分的内容可以进行如下编写:文章结构部分旨在介绍本文的组织安排和各个章节的主要内容。
通过清晰地规划文章的结构,读者可以更好地理解文章的脉络和逻辑关系。
首先,本文分为引言、正文和结论三个部分。
引言部分主要包括概述、文章结构和目的三个方面。
在概述中,将简要介绍镍的CV氧化峰的研究背景和重要性。
文章结构部分则是本节所在的章节,将对整篇文章的组织结构进行详细描述。
目的部分将阐明本文的研究目标和意义。
接下来,正文部分将详细介绍镍的性质、CV测量方法和氧化峰的形成机制三个方面的内容。
在镍的性质部分,将重点介绍镍的化学性质、物理性质和电化学性质等方面的内容。
CV测量方法部分将介绍常用的CV测量方法并简要说明其原理和应用。
氧化峰的形成机制部分将探讨CV氧化峰的形成机制及影响因素等内容。
最后,在结论部分将总结CV氧化峰的特征、镍的氧化峰与其电化学性质的关系,并对进一步的研究方向和意义进行展望。
CV氧化峰的特征部分将总结氧化峰的电流密度、峰值位置和形状等特征。
进一步探讨镍的氧化峰与其电化学性质的关系,可以揭示镍材料的催化活性、稳定性和电化学反应机理等方面的信息。
纳米氧化镍的低温固相合成及电容性能研究

中 图分 类 号 : Q 3 .3 T 181
文献 标 识 码 : A
文 章 编 号 :0 6 4 9 (0 20 — 0 3 0 10 — 9 02 1)2 0 2 — 4
S u i s n l w m p r t r o i . t t y t e i n a a i v e f r a c f a o. z d n c e x d t de o o t e e a u es l . a es n h ssa d c p c t e p r o m n eo n .ie i k l i e ds i n s o
Ha n a 1 igXio a W a gJ n , e g h n L e Go gJn xn nDa d n, Jn a y n , n u XuP n c e g , i i, n ig i 2 L
( .c ol厂 tr lSineadC e iaE gneigHariE gneigU i ri , ari 10 0 , hn ; 1Sh o DMa is cec n h mc nier , ebn n e r n esy H ebn 5 0 1 C ia e a l n i n v t 2S ho C e  ̄u n hr c ui n n ei , l stt C e c eh ooy . c ol h m t adP amaet a E g e r g Ji I tu hmi Tc nl ) c l i n in n i e l a g
tmp rtr f e trame t s l f E a dee to h mia s h w dta ihtmp rtr ( 4 0℃ )ma eamoe e eaueo a e t n. ut o M n lcrc e c le t s o e h t g h t Re s S t s h e eau e > 0 d r
循环伏安法cv曲线

循环伏安法cv曲线
循环伏安法(CV曲线),是一种非常重要的电化学研究方法,广泛应用于电化学分析和电极材料研究领域。
该方法通过对电流与电势之间关系的研究,可以获得有关电极反应特性的重要信息。
在循环伏安法实验中,首先需要准备一个工作电极、参比电极和计数电极组成的电解池。
工作电极是进行电化学反应的地方,参比电极则提供一个稳定的电势参考。
计数电极主要用于测量电流。
实验的流程如下:首先,在无电流的情况下,通过慢慢改变电势来扫描电极。
通常,电极的电势从较负的值开始升高,然后再降低,形成一个闭合的循环路径。
在扫描过程中,电流的变化将会被记录下来。
通过对得到的电流与电势之间的关系进行分析,我们可以得到CV 曲线。
CV曲线通常分为两部分:阳极扫描和阴极扫描。
在阳极扫描部分,随着电势的上升,电流逐渐增大,直至达到一个峰值。
这个峰值对应着物质的氧化反应,可用于确定氧化峰电位。
在阴极扫描部分,电势降低,电流逐渐减小,直到达到还原峰电位,对应物质的还原反应。
CV曲线中的峰形与电极反应动力学过程密切相关。
通常情况下,我们可以根据峰的形状、位置和大小,来判断电极反应的机理以及反应速率等信息。
此外,通过对CV曲线进行定量分析,我们还可以得到物质在电极上的吸附行为、电荷转移过程以及电化学反应的动力学参数等重要数据。
总之,循环伏安法(CV曲线)是一种重要的电化学研究方法,可以用于研究电极反应机理、电化学分析和电极材料性能评价等。
通过分析CV曲线,我们可以获得许多有关电化学反应的重要信息,为相关领域的研究提供了有力的支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化镍的循环伏安曲线
氧化镍(NiO)的循环伏安曲线是一种描述该材料在电化学循环过程中电流与电压之间关系的曲线。
循环伏安曲线通常在三电极体系中进行测量,其中包括工作电极(通常是氧化镍薄膜)、参比电极和对电极。
在测量循环伏安曲线时,首先将电压从初始值线性扫描到最终值,然后再反向扫描回初始值。
在此过程中,会记录下电流随时间的变化,并绘制成循环伏安曲线图。
氧化镍的循环伏安曲线通常显示出几个重要特征:
1. 起始峰:在正向扫描中,会出现一个峰,表示氧化镍的电极反应开始发生。
这个峰对应于氧化镍薄膜的氧化反应。
2. 峰电位:峰电位是循环伏安曲线上的峰处的电位值,可用于估计氧化镍的电化学活性。
3. 氧化还原峰:在反向扫描过程中,会出现一个峰,表示氧化镍的电极反应逆转,即氧化镍被还原为金属镍。
4. 氧化还原峰电位:氧化还原峰的电位值与电极反应的可逆性和反应速率有关,可用于表征氧化镍的电化学性质。
循环伏安曲线的形状和特征受到许多因素的影响,包括电解液成分、扫描速率和氧化镍样品的晶体结构等。
因此,在实际研
究中,可以通过调整这些实验参数来更深入地了解氧化镍的电化学特性。
