莱特莫韦合成工艺
恩替卡韦合成工艺

恩替卡韦合成工艺
恩替卡韦(Entecavir)是一种用于治疗乙型肝炎病毒(HBV)感染的核苷酸类似物。
它通过抑制病毒DNA的合成来阻止病毒的复制,从而减少病毒在体内的负荷。
恩替卡韦在临床上被广泛应用,并被认为是一种高效且安全的抗病毒药物。
恩替卡韦的合成工艺在化学工业中起着重要作用。
以下是恩替卡韦的合成工艺的主要步骤:
1. 阿德西韦(Adefovir)为恩替卡韦的前体化合物。
首先,通过反应将腺苷氨基乙醇酯与对应的醛缩合,得到腺苷异亲核试剂。
然后,与溴乙酸酯反应,生成腺苷酸异亲核试剂。
最后,通过酸水解来形成阿德西韦。
2. 阿德西韦与邻氨基苯甲酸反应,生成恩替卡韦的中间体。
这个反应通常需要在碱性条件下进行。
3. 最后一步是将中间体与碘乙基乙酸酯反应得到恩替卡韦产物。
在恩替卡韦合成工艺中,需要严格控制反应条件和反应物的纯度,以避免杂质的生成和产品质量的下降。
此外,反应过程中还需要考虑反应物的耗损、产率以及废物处理等因素,以确保工艺的经济性和环境
友好性。
近年来,随着药物合成领域的不断发展,人们通过改进合成方法和优化反应条件,不断提高恩替卡韦的合成效率和产量。
例如,引入催化剂、优化反应温度和时间、改进固相合成等方法都可以提高合成工艺的效果。
总的来说,恩替卡韦合成工艺是一个复杂的过程,需要高度专业化的技术和严密的操作。
然而,这个工艺的不断优化和改进为乙型肝炎患者提供了更好的治疗选择,并对乙型肝炎的防控做出了重要贡献。
药物Letermovir(莱特莫韦)合成检索总结报告
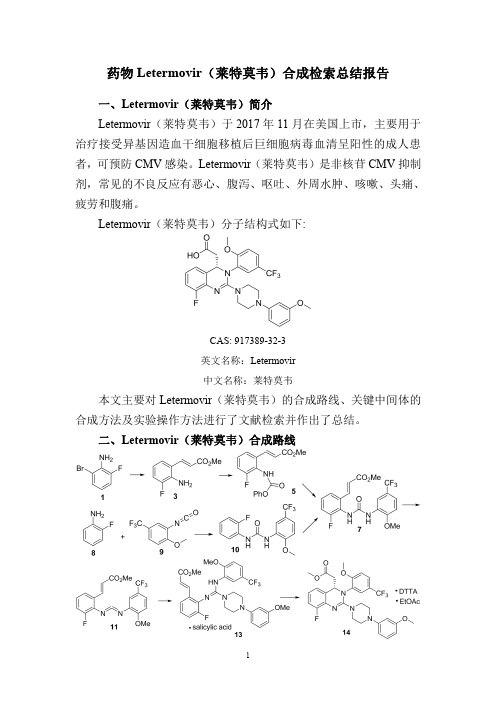
药物Letermovir(莱特莫韦)合成检索总结报告一、Letermovir(莱特莫韦)简介Letermovir(莱特莫韦)于2017年11月在美国上市,主要用于治疗接受异基因造血干细胞移植后巨细胞病毒血清呈阳性的成人患者,可预防CMV感染。
Letermovir(莱特莫韦)是非核苷CMV抑制剂,常见的不良反应有恶心、腹泻、呕吐、外周水肿、咳嗽、头痛、疲劳和腹痛。
Letermovir(莱特莫韦)分子结构式如下:CAS:917389-32-3英文名称:Letermovir中文名称:莱特莫韦本文主要对Letermovir(莱特莫韦)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、Letermovir(莱特莫韦)合成路线三、Letermovir (莱特莫韦)合成检索总结报告(一)Letermovir (莱特莫韦)中间体3的合成合成方法实验步骤参考文献操作方法一To adegassed solution of 2-bromo-6-fluoroaniline 1(1,99.5g,0.524mol),methyl acrylate 2(95.0mL,1.05mol),Chloro[(tri-tert-butylphosphine)-2-(2-aminobiphenyl)]palladium(II)(0.537g,1.05mmol)in isopropyl acetate (796mL),was added degassed N,N-dicyclohexylmethylamine (135mL,0.628mol).The resulting reaction was heated to 80°C and allowed to stir at this temperature for 5hours.The resulting slurry was cooled to 20°C and filtered.The filtrate was washed with 1M citric acid to provide a solution that contained compound 3(99.3g,97%assay yield)in isopropyl acrylate,which was used without further purification.WO2015/88931;(2015);(A1)English (二)Letermovir (莱特莫韦)中间体5的合成合成方法实验步骤参考文献操作方法一To a solution of compound 3(48.8g,0.250mol)in 683mL of isopropyl acetate was added 244mL of water,followed by di-sodium hydrogen phosphate (53.2g,0.375mol).To the resulting solution was added phenyl chloroformate 4(39.2mL,0.313mol)dropwise over 30minutes.The resulting reaction was heated to 30°C and allowed to stir at this temperature for 5hours for 4hours and then was heated to 60°C and allowed to stir at this temperature for 5hours for an additional 2hours to remove excess phenyl chloroformate.An additional 293mL of isopropyl acetate was then added and the reaction mixture was allowed to stirWO2015/88931;(2015);(A1)Englishat room temperature until the solids completely dissolvedinto solution.The resulting reaction mixture was transferred to a separatory funnel and the organic phase was washed with 98mL of water and collected to provide a solution of compound 5in isopropyl acetate,which was used without further purification.操作方法二To a stirred crude i -PrOAc solution of acrylate 3(15.9kg,8.2wt %15,6.66mol)was added H 2O (6.50L)and Na 2HPO 4(1.42kg,10.0mol)followed by phenyl chloroformate 4(1.04L,8.33mol)dropwise over 30min.The reaction mixture was stirred at RT for 12h before being heated to 60°C and stirred for a further 2h.The mixture was then diluted with i -PrOAc (7.00L)and held at 60°C until all solids were dissolved.The aqueous phase was then separated and the organics washed with H 2O (2.60L)before being cooled to RT to afford a crude i-PrOAc slurry of carbamate 5(ca.95%assay yield)which was used directly without further purifification.For the purposes of characterization,a sample of pure carbamate 5was isolated by crystallization from a sample of the crude solution diluted with heptane.Mp 154−158°anic Process Research and Development ;vol.20;nb.6;(2016);p.1097–1103.(三)Letermovir (莱特莫韦)中间体7的合成方法一合成方法实验步骤参考文献操作方法一A solution of compound 5(79.0g,0.250mol),2-methoxy-5-(trifluoromethyl)aniline 6(52.7g,0.276mol),and 4-dimethylaminopyridine (0.92g,0.0075mol)in isopropyl acetate (780mL)was heated to reflux and allowed to stir at this temperature for 5hours.The resulting slurry was cooled to 20°C,then allowed to stir at this temperature for for two hours at this temperature,then filtered.The collected filter cake was dried in vacuo to provide compound 7(95.0g,0.230mol)as a white solid,which was used without further purification.WO2015/88931;(2015);(A1)English 操作方法To a stirred crude i-PrOAc solution of carbamate 5(<6.66mol)was added 2-methoxy-5-(triflfluoromethyl)aniline 6(1.40kg,7.33mol).The slurry was diluted with i -PrOAc,heated to 40−45°C,and a constant volume distillation carried out to azeotropically dry the mixture (KF <400ppm).Organic Process Research and Development ;。
一种利托那韦的制备方法与流程

一种利托那韦的制备方法与流程利托那韦(Lopinavir)是一种抗逆转录病毒药物,广泛应用于治疗艾滋病病毒(HIV)感染。
它是一个蛋白酶抑制剂,通过抑制病毒的蛋白酶活性,阻断HIV复制和繁殖。
以下是利托那韦的制备方法与流程的详细介绍。
1.利托那韦的化学合成是通过多步法完成的。
首先,合成二苯甲酮(Phenylacetic Acid),这是制备利托那韦的起始原料。
二苯甲酮可以通过甲酸甲酯(Methyl Formate)和苯甲醛(Benzaldehyde)在碱性条件下反应而得到。
2.制备二苯甲酰胺(Phenylacetamide)作为二苯甲酮的衍生产物。
二苯甲酮在温和的氨气和甲醇反应条件下,经催化加氢反应生成二苯甲酰胺。
3.利用二苯甲酰胺合成二苯甲酰胺-4-(4-氟苯甲基)-N-甲基-苯甲酰胺(LOP-RENZA)。
在反应中,将二苯甲酰胺和氨气反应生成二苯甲酰胺酰胺,然后与4-(4-氟苯甲基)-N-甲基-苯甲醛反应,生成LOP-RENZA。
4. LOP-RENZA经氢化反应生成利托那韦的中间体。
在反应中,LOP-RENZA与氢气和Pd/C催化剂在碱性条件下反应,去除酮基得到利托那韦的中间体。
5.利用利托那韦中间体与N-α-苯基甲基丙氨酸左旋异构体晶体(L-isoleucyl-L-valyl-L-valine,LIV-JPN),反应生成利托那韦。
在反应中,利托那韦中间体与LIV-JPN在碱性条件下反应,生成利托那韦结构。
6.利托那韦结构通过结晶和纯化过程得到利托那韦药物。
制备利托那韦的流程如下:步骤1:合成二苯甲酮a.将甲酸甲酯和苯甲醛加入反应瓶中。
b.加入适量的碱性催化剂(如氢氧化钠)。
c.在适当的温度和反应时间下反应,生成二苯甲酮。
步骤2:合成二苯甲酰胺a.将二苯甲酮和氨气、甲醇加入反应瓶中。
b.加入催化剂(如Pd/C)。
c.在适当的温度和反应时间下反应,生成二苯甲酰胺。
步骤3:合成LOP-RENZAa.将二苯甲酰胺和氨气反应生成二苯甲酰胺酰胺。
甲磺酸艾瑞布林的合成工艺

甲磺酸艾瑞布林的合成工艺甲磺酸艾瑞布林的合成工艺主要涉及以下步骤:
1.片段1的合成:以D-葡萄醛酸-3,6-内脂为起始物料,首先用丙酮保护邻二羟基,然后用磺酰氯将羟基氯代,得到化合物2。
接着用钯碳/氢气将氯还原,再用DIBAL-H将内酯还原为半缩醛。
然后与格式试剂反应得到化合物4。
2.片段2的合成:以2,3-二氢呋喃为原料,水合得到半缩醛,然后与2,3-二溴丙烯反应开环,再进行选择性保护伯醇、手性拆分、保护仲醇等步骤,得到化合物12。
3.N-ERBL-02中间体的制备:在四口瓶中加入Sm和THF,搅拌下加入二碘甲烷,搅拌完毕后体系室温搅拌一定时间。
然后滴加前面制备好的SmI2溶液,搅拌一定时间后体系升温至室温,再加入TBME搅拌一定时间。
4.N-ERBL-03中间体的制备:在另一四口瓶中加入N-ERBL-02中间体、甲醇和THF,体系搅拌下降温至-85℃,然后滴加前面制备好的SmI2溶液。
滴加完毕后体系搅拌一定时间至TLC确认反应原料反应完毕。
体系升温至室温后加入TBME,搅拌一定时间,静置后分出有机相。
有机相低温减压脱除有机溶剂,残余物柱层析纯化得到目标产物。
请注意,以上步骤只是甲磺酸艾瑞布林合成工艺的一部分,具体合成过程可能需要更多的步骤和更复杂的操作。
此外,合成过程中涉及的试剂和条件都需要根据实际情况进行调整和优化。
在进行实际合成时,建议参考相关的专业文献和化学手册,并在专业人士的指导下进行操作。
1。
5_羟甲基噻唑的合成

化学试剂,2009,31(8),655~6575 羟甲基噻唑的合成叶翠层,肖红波,殷作虎,辛莎,孙汉洲*(中南林业科技大学应用化学研究所,湖南长沙 410004)摘要:标题化合物是合成第二代抗AIDS 药物利托那韦(Ritonavir )的中间体。
以2 氯 5 氯甲基噻唑为原料,经过乙醇 氢氧化钠溶液水解,锌粉/醋酸还原脱氯,氢氧化钠水解合成5 羟甲基噻唑。
在适宜的条件下,5 羟甲基噻唑总收率为66 2%。
关键词:5 羟甲基噻唑;2 氯 5 氯甲基噻唑;合成;锌粉/醋酸还原脱氯中图分类号:TQ252 5 文献标识码:A 文章编号:0258 3283(2009)08 0655 03收稿日期:2008 08 31作者简介:叶翠层(1955 ),男,湖北洪湖人,学士,副教授,主要从事有机合成方面的研究。
自发现5 羟甲基噻唑(1)可用于合成第二代抗AI DS 药物利托那韦(Ritonavir)以来[1,2],科学家对化合物1的合成工艺进行了广泛的研究。
化合物1的合成有多种工艺[3],Michael 等[4]、Leanna 等[5,6]和Gregory 等[7]分别以2 氯 5 氯甲基噻唑(2)为原料通过不同的工艺合成。
本文改进了以化合物2为原料合成化合物1的工艺。
此工艺的优点是水解反应在均相中温和进行、副反应少、反应时间短、容易控制、生成的NaCl 不溶解于乙醇而沉淀,促进了水解反应的进行;避免了Michael 等[4]所报道直接水解的非均相反应,容易产生低聚合和树脂类副产物的缺点;也避免了Leanna 等[5,6]和Gregory 等[7]所报道的甲酸钠酯化的非均相反应和反应时间长(8~10h)的缺点。
2 氯 5 羟甲基噻唑(3)用锌粉/乙酸还原脱氯,设备简单,容易转产,避免了催化氢化脱氯设备投资大,不容易转产的缺点。
化合物2在乙醇和碱作用有2 氯 5 噻唑甲基乙醚(5)副产物生成,可以通过加大碱的用量控制化合物5的含量<1%,并在减压蒸馏时除去。
一种莱特莫韦中间体的氯代方法与流程

一种莱特莫韦中间体的氯代方法与流程莱特莫韦(Laitmerwe)是一种重要的有机合成中间体,常用于制备具有抗病毒、抗癌活性的有机化合物。
莱特莫韦的合成常采用氯代反应,以下将介绍一种常用的莱特莫韦氯代方法与流程。
莱特莫韦的氯代方法可以采用两步反应完成。
第一步是将莱特莫韦前体化合物与氢氯酸反应,生成莱特莫韦的氯代中间体。
第二步是将氯代中间体经过脱氯反应,得到莱特莫韦。
首先,我们需要合成莱特莫韦的前体化合物。
根据文献报道,常用的方法是利用呋喃环与芳香醛反应,生成呋喃基醛化合物。
具体步骤如下:步骤1:将呋喃加入无水氯化亚铜(CuCl)的二甲苯溶液中,反应生成无机铜试剂。
步骤2:将芳香醛溶解在氢氧化钠(NaOH)醇溶液中,生成芳香基酚。
步骤3:将无机铜试剂和芳香基酚混合,反应生成呋喃基醛化合物。
接下来,我们将介绍莱特莫韦的氯代方法与流程。
步骤4:将上述合成的呋喃基醛化合物溶解在干燥的氯仿中,加入过量的氯化亚铁(FeCl2),并加入少量的无水盐酸(HCl)。
该步骤的目的是生成莱特莫韦的氯代中间体。
步骤5:反应混合物在低温条件下搅拌,并且保持氩气保护下,反应数小时。
步骤6:待反应完成后,用饱和盐水洗涤有机相,然后用饱和盐水再洗一次。
最后使用旋蒸仪去除有机溶剂,得到莱特莫韦的氯代中间体。
莱特莫韦的氯化反应是一种亲核取代反应,通过亲核试剂进攻芳基卤素原子可得到具有亲核酰基的芳香族化合物。
在反应过程中,氯化亚铁起到了催化剂的作用,无水盐酸则会促进反应的进行。
莱特莫韦的氯代中间体可以进一步地用于脱氯反应,得到莱特莫韦的最终产物。
脱氯反应常采用强鹼如氢氧化钠(NaOH)作为催化剂,使氯代中间体发生消旋和脱氯反应,生成莱特莫韦。
总结起来,莱特莫韦的氯代方法与流程主要包括合成莱特莫韦前体化合物、莱特莫韦的氯化反应以及脱氯反应。
其中,氯化反应是通过无水氯仿、氯化亚铁和无水盐酸催化进行的。
脱氯反应则是通过强鹼如氢氧化钠催化进行的。
法匹拉韦合成工艺路线的优点和缺点

法匹拉韦合成工艺路线的优点和缺点
法匹拉韦是一种广泛应用于医药领域的药物成分,其合成工艺路线具有以下优点和缺点:
优点:
1. 高效合成:法匹拉韦的合成工艺路线经过优化,反应条件适宜,反应效率高,可以高效地合成目标产品。
2. 原料易得:法匹拉韦的合成原料比较常见,易于获得,成本相对较低。
3. 产率高:经过工艺优化和反应条件控制,法匹拉韦的产率较高,可以有效降低生产成本。
4. 可操作性强:法匹拉韦的合成工艺路线步骤相对较少,操作简单,易于工业化生产和批量生产。
缺点:
1. 环保因素:法匹拉韦的合成工艺中可能涉及一些有机溶剂和化学试剂,对环境有一定的影响。
需要进行合理的废弃物处理和环保措施。
2. 工艺复杂性:尽管法匹拉韦的工艺路线相对较简单,但是其中一些反应步骤可能需要特殊条件和催化剂,对工艺控制要求较高。
3. 潜在副反应:在合成过程中,可能会产生一些副反应,导致杂质的产生,并对产品纯度和质量造成一定影响,需要进行后续的纯化和质量控制。
4. 原料成本:虽然法匹拉韦的合成原料相对常见,但是某些原料的成本可能较高,会对生产成本产生一定的影响。
维生素A的合成

维生素A的合成
1
2
维生素A衍生物的合成
C14+C6 路线 C15+C5 路线 Rhone-Poulenc公司的技术路线
C14+C6 路线:
它以Grignard 反应为其特征,以β - 紫罗兰酮为原料,完成了全反式维A 乙酸酯的全合成。这是世界各地最为广泛采用的合成维生素A方法 这条路线的主线由β - 紫罗兰酮开始,经Darzens 反应、Grignard反应、氢化、乙酰化、羟基溴化、脱溴化氢六步操作完成。 辅线则包括甲基乙烯酮、六碳醇的合成以及Grignard 试剂的制备 这种方法工艺成熟,收率稳定,反应中各中间体的立体异构比较清楚,易于精制成结晶或纯品;但本法所需原料达50 多种,反应步骤长,固定投资大,且为串联反应,不易于生产控制,另外六碳醇的安全生产上尚存在问题。
H2
Pd-CaCO3 喹啉
第五步:乙酰化
A
CH3COCl/
CH2Cl2
B
反应机理
PART 1
HBr/CH2Cl2
第六步:羟基溴化和脱溴化氢
CH3ONa
第一步:Darzens缩合反应
反应机理:
PART 1
第二步:脱羧反应
1)NaOH
添加标题
1
2)HOAc
添加标题
2
反应机理:
添加标题
3
水解
添加标题
4
脱羧
添加标题
5
OH-
添加标题
6
第三步:格式反应
EtMgBr
01
反应机理:
02
水解
03
NH4Cl
04
第四步:选择性氢化
反应机理:
利用炔键氢化活性大于烯键的性质,在钯催化剂中加入适量的喹啉作为抑制剂,减低其催化活性,并在低温下定量通入氢气,可以只还原炔烃不还原烯烃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
莱特莫韦合成工艺
莱特莫韦是一种由人工合成的药物,可用于治疗某些特定的感染和疾病。
以下是其合成工艺的一种可能方法:
首先,将4-氟苯甲醚或4-溴苯甲醚与1-叔丁氧羰基哌嗪及有机溶剂混合在一起。
然后,向反应瓶中加入强碱,如叔丁醇钾。
在氮气的保护下,将混合物加热至95-150℃,反应时间约为20小时。
在此过程中,可以通过高效液相色谱(HPLC)观察反应的进程。
反应完成后,通过柱层析分离和纯化产物。
然后进行质谱分析和核磁共振波谱分析,以确定产物的结构和纯度。
上述方法仅供参考,实际操作中可能还需要进行其他的反应和纯化步骤。
此外,该方法需要使用特殊的试剂和设备,因此在实验室条件下可能难以实现。
需要注意的是,莱特莫韦的合成涉及到有机合成和药物合成的知识,需要具备相应的专业知识和技能。
因此,建议在进行相关研究时寻求专业的指导和帮助。
同时,需要遵守相关的法律法规和伦理规范,确保实验的合法性和安全性。
另外,需要强调的是,合成新的药物或化合物需要进行充分的研究和测试,以确保其有效性和安全性。
因此,建议在进行相关研究时进行充分的前期调研和实验设计,以确保研究的科学性和可靠性。
