2020年中考试题汇编:计算题(word版,含解析)
2020年中考试题汇编:计算题(word版,含解析)

计算题1.(2020•铜仁)铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g 于烧杯中,然后等量分5次加入未知质量分数的某强酸(W )溶液,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
(1)写出你所选择酸(W )的化学式 。
(2)铜粉中混有铁粉的质量是 。
(3)计算你选择酸(W )的质量分数(写出计算过程)。
解析 (1)H 2SO 4(或HCl )(2)0.98g (3)9.8%或7.3%(详见解析)【解析】解:(1)铁的金属活动性排在氢的前面,会置换出硫酸或盐酸中的氢,所以所选择酸(W )的化学式是:H 2SO 4(或HCl );(2)根据图表信息,共生成氢气的质量为:0.01g+ 0.01g+0.01g+0.005g =0.035g 设参加反应的铁的质量为x , 2442Fe +H SO FeSO +H 5620.035gx↑═56=20.035g x x =0.98g(3)①假设该酸是硫酸,设5g 该硫酸溶液中含H 2SO 4的质量为y ,2442Fe +H SO FeSO +H 9820.01gy ↑═98=20.01gy y =0.49g 该硫酸溶液中溶质的质量分数为0.49g 5g×100%=9.8%; 答:该硫酸溶液中溶质的质量分数为9.8%。
②假设该酸是盐酸,设5g 该盐酸溶液中含HCl 的质量为z ,22Fe +2HCl FeCl +H 7320.01g z═73=20.01gz z =0.365g 该盐酸溶液中溶质的质量分数为0.365g 5g×100%=7.3%。
答:若选择的酸为硫酸,该硫酸溶液中溶质的质量分数为9.8%;若选择的酸为盐酸,则质量分数为7.3%。
2.(2020•河北)20.某小组用粗锌测定某稀硫酸中溶质的质量分数。
取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。
2020年深圳市中考数学试题及详解(WORD版)

2020年深圳市中考数学试题及详解(WORD版)1.2020的相反数是(-2020)。
2.图形C既是轴对称图形,也是中心对称图形。
3.150 000 000用科学记数法表示为1.5×10^8.4.正方体的主视图、左视图和俯视图相同。
5.平均数为253,中位数为253.6.运算(2/3)×(-9/10)的结果为(-3/5)。
7.三角形的一个外角等于两个内角的和。
8.BD的长度为4.9.平行四边形的对边相等,圆周角等于圆心角的一半,分式方程的解为x=2.10.河宽(PT的长)可以表示为200sin70°米。
11.3a+c>0是错误的结论。
12.点H、K分别是线段CD上的中点。
二、填空题13.m^3-m=(m-1)m(m+1)14.B.2个15.k=2x-516.∠XXX∠XXX,∠XXX∠DCA,∠ABC+∠ADC=180°三、解答题17.5/818.3/419.(1) m=100.n=30 (2) 人数/名:软件 30,硬件 40,总线15,测试 15 (3) 108° (4) 90人20.(1) 连接OB,∠XXX°,∠XXX∠OAD=90°,∴四边形OBCD是矩形,BC=OD=6,∵∠OAB=90°,∴AB=OA=OB=10,∵∠OAE=∠OAB+∠BAE=90°+∠BAE,∠OEA=∠OED+∠DEA=90°+∠BAE,∴∠OAE=∠OEA,AE=AB (2) ∵BC=6,CD=BD-BC=AB-BC=4,∴AD=√(AB^2-BD^2)=√(100-36)=8,∴CE=CD+DE=CD+AD=12,∵BE=2AB=20,∴AE=BE-AB=10,∵∠AEC=∠ABC=90°,∴三角形AEC与三角形ABC全等,∴AC=BC=6,∴CD/AC=4/6=2/321.(1) 设肉粽的进货单价为x元,蜜枣粽的进货单价为y 元,则50x+30y=620,且x=y+6,解得x=14,y=8 (2) 设肉粽的单价为p元,则p+6为蜜枣粽的单价,50p+30(p+6)=620,解得p=8,∴肉粽的单价为8元,蜜枣粽的单价为14元,进货总价为400元,∴肉粽的数量为50个,蜜枣粽的数量为20个,剩下的200元可以买16个肉粽或10个蜜枣粽,所以最终可以买到66个肉粽和30个蜜枣粽。
2020年广东省深圳市中考数学试题及参考答案(word解析版)
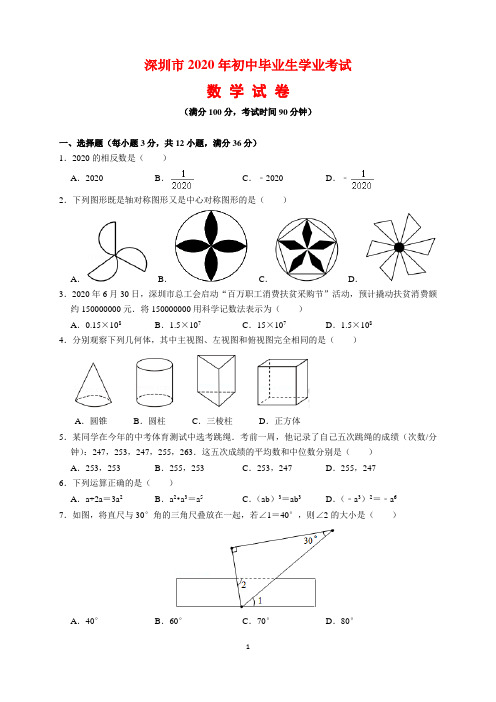
深圳市2020年初中毕业生学业考试数学试卷(满分100分,考试时间90分钟)一、选择题(每小题3分,共12小题,满分36分)1.2020的相反数是()A.2020 B.C.﹣2020 D.﹣2.下列图形既是轴对称图形又是中心对称图形的是()A.B.C.D.3.2020年6月30日,深圳市总工会启动“百万职工消费扶贫采购节”活动,预计撬动扶贫消费额约150000000元.将150000000用科学记数法表示为()A.0.15×108B.1.5×107C.15×107D.1.5×1084.分别观察下列几何体,其中主视图、左视图和俯视图完全相同的是()A.圆锥B.圆柱C.三棱柱D.正方体5.某同学在今年的中考体育测试中选考跳绳.考前一周,他记录了自己五次跳绳的成绩(次数/分钟):247,253,247,255,263.这五次成绩的平均数和中位数分别是()A.253,253 B.255,253 C.253,247 D.255,2476.下列运算正确的是()A.a+2a=3a2B.a2•a3=a5C.(ab)3=ab3D.(﹣a3)2=﹣a67.如图,将直尺与30°角的三角尺叠放在一起,若∠1=40°,则∠2的大小是()A.40°B.60°C.70°D.80°8.如图,在△ABC中,AB=AC.在AB、AC上分别截取AP,AQ,使AP=AQ.再分别以点P,Q为圆心,以大于PQ的长为半径作弧,两弧在∠BAC内交于点R,作射线AR,交BC于点D.若BC=6,则BD的长为()A.2 B.3 C.4 D.59.以下说法正确的是()A.平行四边形的对边相等B.圆周角等于圆心角的一半C.分式方程=﹣2的解为x=2 D.三角形的一个外角等于两个内角的和10.如图,为了测量一条河流的宽度,一测量员在河岸边相距200米的P、Q两点分别测定对岸一棵树T的位置,T在P的正北方向,且T在Q的北偏西70°方向,则河宽(PT的长)可以表示为()A.200tan70°米B.米C.200sin 70°米D.米11.二次函数y=ax2+bx+c(a≠0)的顶点坐标为(﹣1,n),其部分图象如图所示.以下结论错误的是()A.abc>0 B.4ac﹣b2<0 C.3a+c>0 D.关于x的方程ax2+bx+c=n+1无实数根12.如图,矩形纸片ABCD中,AB=6,BC=12.将纸片折叠,使点B落在边AD的延长线上的点G处,折痕为EF,点E、F分别在边AD和边BC上.连接BG,交CD于点K,FG交CD于点H.给出以下结论:①EF⊥BG;②GE=GF;③△GDK和△GKH的面积相等;④当点F与点C重合时,∠DEF=75°,其中正确的结论共有()A.1个B.2个C.3个D.4个二、填空题(本题共4小题,每小题3分,共12分)13.分解因式:m3﹣m=.14.一口袋内装有编号分别为1,2,3,4,5,6,7的七个球(除编号外都相同),从中随机摸出一个球,则摸出编号为偶数的球的概率是.15.如图,在平面直角坐标系中,O(0,0),A(3,1),B(1,2).反比例函数y=(k≠0)的图象经过▱OABC的顶点C,则k=.16.如图,在四边形ABCD中,AC与BD相交于点O,∠ABC=∠DAC=90°,tan∠ACB=,=,则=.三、解答题(本题共7小题,共52分)17.(5分)计算:()﹣1﹣2cos30°+|﹣|﹣(4﹣π)0.18.(6分)先化简,再求值:÷(2+),其中a=2.19.(7分)以人工智能、大数据、物联网为基础的技术创新促进了新业态蓬勃发展,新业态发展对人才的需求更加旺盛.某大型科技公司上半年新招聘软件、硬件、总线、测试四类专业的毕业生,现随机调查了m名新聘毕业生的专业情况,并将调查结果绘制成如图两幅不完整的统计图.请根据统计图提供的信息,解答下列问题.(1)m=,n=.(2)请补全条形统计图;(3)在扇形统计图中,“软件”所对应的扇形的圆心角是度;(4)若该公司新招聘600名毕业生,请你估计“总线”专业的毕业生有名.20.(8分)如图,AB为⊙O的直径,点C在⊙O上,AD与过点C的切线互相垂直,垂足为D.连接BC并延长,交AD的延长线于点E.(1)求证:AE=AB;(2)若AB=10,BC=6,求CD的长.21.(8分)端午节前夕,某商铺用620元购进50个肉粽和30个蜜枣粽,肉粽的进货单价比蜜枣粽的进货单价多6元.(1)肉粽和蜜枣粽的进货单价分别是多少元?(2)由于粽子畅销,商铺决定再购进这两种粽子共300个,其中肉粽数量不多于蜜枣粽数量的2倍,且每种粽子的进货单价保持不变,若肉粽的销售单价为14元,蜜枣粽的销售单价为6元,试问第二批购进肉粽多少个时,全部售完后,第二批粽子获得利润最大?第二批粽子的最大利润是多少元?22.(9分)背景:一次小组合作探究课上,小明将两个正方形按如图所示的位置摆放(点E、A、D 在同一条直线上),发现BE=DG且BE⊥DG.小组讨论后,提出了下列三个问题,请你帮助解答:(1)将正方形AEFG绕点A按逆时针方向旋转(如图1),还能得到BE=DG吗?若能,请给出证明;若不能,请说明理由;(2)把背景中的正方形分别改成菱形AEFG和菱形ABCD,将菱形AEFG绕点A按顺时针方向旋转(如图2),试问当∠EAG与∠BAD的大小满足怎样的关系时,背景中的结论BE=DG仍成立?请说明理由;(3)把背景中的正方形分别改写成矩形AEFG和矩形ABCD,且,AE=4,AB=8,将矩形AEFG绕点A按顺时针方向旋转(如图3),连接DE,BG.小组发现:在旋转过程中,DE2+BG2的值是定值,请求出这个定值.23.(9分)如图1,抛物线y=ax2+bx+3(a≠0)与x轴的交点A(﹣3,0)和B(1,0),与y轴交于点C,顶点为D.(1)求该抛物线的解析式;(2)连接AD,DC,CB,将△OBC沿x轴以每秒1个单位长度的速度向左平移,得到△O'B'C',点O、B、C的对应点分别为点O'、B'、C',设平移时间为t秒,当点O'与点A重合时停止移动.记△O'B'C'与四边形AOCD重合部分的面积为S,请直接写出S与t之间的函数关系式;(3)如图2,过该抛物线上任意一点M(m,n)向直线l:y=作垂线,垂足为E,试问在该抛物线的对称轴上是否存在一点F,使得ME﹣MF=?若存在,请求出F的坐标;若不存在,请说明理由.答案与解析一、选择题(每小题3分,共12小题,满分36分)1.2020的相反数是()A.2020 B.C.﹣2020 D.﹣【知识考点】相反数.【思路分析】直接利用相反数的定义得出答案.【解答过程】解:2020的相反数是:﹣2020.故选:C.【总结归纳】此题主要考查了相反数,正确把握相反数的定义是解题关键.2.下列图形既是轴对称图形又是中心对称图形的是()A.B.C.D.【知识考点】轴对称图形;中心对称图形.【思路分析】根据中心对称图形与轴对称图形的概念进行判断即可.【解答过程】解:A、不是中心对称图形,不是轴对称图形,故此选项不合题意;B、既是中心对称图形,又是轴对称图形,故此选项符合题意;C、不是中心对称图形,是轴对称图形,故此选项不合题意;D、是中心对称图形,不是轴对称图形,故此选项不合题意;故选:B.【总结归纳】本题考查的是中心对称图形与轴对称图形的概念.轴对称图形的关键是寻找对称轴,图形两部分折叠后可重合,中心对称图形是要寻找对称中心,旋转180度后两部分重合.3.2020年6月30日,深圳市总工会启动“百万职工消费扶贫采购节”活动,预计撬动扶贫消费额约150000000元.将150000000用科学记数法表示为()A.0.15×108B.1.5×107C.15×107D.1.5×108【知识考点】科学记数法—表示较大的数.【思路分析】科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数.【解答过程】解:将150000000用科学记数法表示为1.5×108.故选:D.【总结归纳】此题考查科学记数法的表示方法.科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数,表示时关键要正确确定a的值以及n的值.4.分别观察下列几何体,其中主视图、左视图和俯视图完全相同的是()A.圆锥B.圆柱C.三棱柱D.正方体【知识考点】简单几何体的三视图.【思路分析】分别得出圆锥体、圆柱体、三棱柱、正方体的三视图的形状,再判断即可.【解答过程】解:圆锥的主视图、左视图都是等腰三角形,而俯视图是圆,因此选项A不符合题意;圆柱体的主视图、左视图都是矩形,而俯视图是圆形,因此选项B不符合题意;三棱柱主视图、左视图都是矩形,而俯视图是三角形,因此选项C不符合题意;正方体的三视图都是形状、大小相同的正方形,因此选项D符合题意;故选:D.【总结归纳】本题考查简单几何体的三视图,明确圆锥、圆柱、三棱柱、正方体的三视图的形状和大小是正确判断的前提.5.某同学在今年的中考体育测试中选考跳绳.考前一周,他记录了自己五次跳绳的成绩(次数/分钟):247,253,247,255,263.这五次成绩的平均数和中位数分别是()A.253,253 B.255,253 C.253,247 D.255,247【知识考点】算术平均数;中位数.【思路分析】根据中位数、众数的计算方法,分别求出结果即可.【解答过程】解:=(247+253+247+255+263)÷5=253,这5个数从小到大,处在中间位置的一个数是253,因此中位数是253;故选:A.【总结归纳】本题考查中位数、众数的意义和计算方法,掌握中位数、众数的计算方法是正确计算的前提.6.下列运算正确的是()A.a+2a=3a2B.a2•a3=a5C.(ab)3=ab3D.(﹣a3)2=﹣a6【知识考点】合并同类项;同底数幂的乘法;幂的乘方与积的乘方.【思路分析】利用合并同类项、幂的乘方、积的乘方以及同底数幂的乘法的计算法则进行计算即可.【解答过程】解:a+2a=3a,因此选项A不符合题意;a2•a3=a2+3=a5,因此选项B符合题意;(ab)3=a3b3,因此选项C不符合题意;(﹣a3)2=a6,因此选项D不符合题意;故选:B.【总结归纳】本题考查合并同类项、幂的乘方、积的乘方以及同底数幂的乘法的计算法则,掌握计算法则是正确计算的前提.7.如图,将直尺与30°角的三角尺叠放在一起,若∠1=40°,则∠2的大小是()A.40°B.60°C.70°D.80°【知识考点】平行线的性质.【思路分析】根据平角的定义和平行线的性质即可得到结论.【解答过程】解:由题意得,∠4=60°,∵∠1=40°,∴∠3=180°﹣60°﹣40°=80°,∵AB∥CD,∴∠3=∠2=80°,故选:D.【总结归纳】本题考查了平行线的性质,平角的定义,熟练掌握平行线的性质是解题的关键.8.如图,在△ABC中,AB=AC.在AB、AC上分别截取AP,AQ,使AP=AQ.再分别以点P,Q为圆心,以大于PQ的长为半径作弧,两弧在∠BAC内交于点R,作射线AR,交BC于点D.若BC=6,则BD的长为()A.2 B.3 C.4 D.5【知识考点】等腰三角形的性质;作图—基本作图.【思路分析】依据等腰三角形的性质,即可得到BD=BC,进而得出结论.【解答过程】解:由题可得,AR平分∠BAC,又∵AB=AC,∴AD是三角形ABC的中线,∴BD=BC=×6=3,故选:B.【总结归纳】本题主要考查了基本作图以及等腰三角形的性质,等腰三角形的顶角平分线、底边上的中线、底边上的高相互重合.9.以下说法正确的是()A.平行四边形的对边相等B.圆周角等于圆心角的一半C.分式方程=﹣2的解为x=2 D.三角形的一个外角等于两个内角的和【知识考点】分式方程的解;平行四边形的性质;圆心角、弧、弦的关系;圆周角定理.【思路分析】根据平行四边形的性质对A进行判断;根据圆周角定理对B进行判断;利用分式方程有检验可对C进行判断;根据三角形外角性质对D进行判断.【解答过程】解:A、平行四边形的对边相等,所以A选项正确;B、一条弧所对的圆周角等于它所对的圆心角的一半,所以B选项错误;C、去分母得1=x﹣1﹣2(x﹣2),解得x=2,经检验原方程无解,所以C选项错误;D、三角形的一个外角等于与它不相邻的两个内角的和,所以D选项错误.故选:A.【总结归纳】本题考查了圆周角定理:在同圆或等圆中,同弧或等弧所对的圆周角相等,都等于这条弧所对的圆心角的一半.10.如图,为了测量一条河流的宽度,一测量员在河岸边相距200米的P、Q两点分别测定对岸一棵树T的位置,T在P的正北方向,且T在Q的北偏西70°方向,则河宽(PT的长)可以表示为()A.200tan70°米B.米C.200sin 70°米D.米【知识考点】解直角三角形的应用﹣方向角问题.【思路分析】在直角三角形PQT中,利用PQ的长,以及∠PQT的度数,进而得到∠PTQ的度数,根据三角函数即可求得PT的长.【解答过程】解:在Rt△PQT中,∵∠QPT=90°,∠PQT=90°﹣70°=20°,∴∠PTQ=70°,∴tan70°=,∴PT==,即河宽米,故选:B.【总结归纳】此题考查了解直角三角形的应用﹣方向角问题,掌握方向角与正切函数的定义是解题的关键.11.二次函数y=ax2+bx+c(a≠0)的顶点坐标为(﹣1,n),其部分图象如图所示.以下结论错误的是()A.abc>0 B.4ac﹣b2<0 C.3a+c>0 D.关于x的方程ax2+bx+c=n+1无实数根【知识考点】根的判别式;二次函数图象与系数的关系;抛物线与x轴的交点.【思路分析】根据抛物线开口方向,对称轴的位置以及与y轴的交点可以对A进行判断;根据抛物线与x轴的交点情况可对B进行判断;x=1时,y<0,可对C进行判断;根据抛物线y=ax2+bx+c 与直线y=n+1无交点,可对D进行判断.【解答过程】解:A.∵抛物线开口向下,∴a<0,∵对称轴为直线x=﹣=﹣1,∴b=2a<0,∵抛物线与y轴交于正半轴,∴c>0,∴abc>0,故A正确;B.∵抛物线与x轴有两个交点,∴b2﹣4ac>0,即4ac﹣b2<0,故B正确;C.∵抛物线的对称轴为直线x=﹣1,抛物线与x轴的一个交点在(﹣3,0)和(﹣2,0)之间,∴抛物线与x轴的另一个交点在(0,0)和(1,0)之间,∴x=1时,y<0,即a+b+c<0,∵b=2a,∴3a+c<0,故C错误;D.∵抛物线开口向下,顶点为(﹣1,n),∴函数有最大值n,∴抛物线y=ax2+bx+c与直线y=n+1无交点,∴一元二次方程ax2+bx+c=n+1无实数根,故D正确.故选:C.【总结归纳】本题考查了抛物线与x轴的交点:把求二次函数y=ax2+bx+c(a,b,c是常数,a ≠0)与x轴的交点坐标问题转化为解关于x的一元二次方程.也考查了二次函数的性质.12.如图,矩形纸片ABCD中,AB=6,BC=12.将纸片折叠,使点B落在边AD的延长线上的点G处,折痕为EF,点E、F分别在边AD和边BC上.连接BG,交CD于点K,FG交CD于点H.给出以下结论:①EF⊥BG;②GE=GF;③△GDK和△GKH的面积相等;④当点F与点C重合时,∠DEF=75°,其中正确的结论共有()A.1个B.2个C.3个D.4个【知识考点】三角形的面积;矩形的性质;翻折变换(折叠问题).【思路分析】连接BE,设EF与BG交于点O,由折叠的性质可得EF垂直平分BG,可判断①;由“ASA”可证△BOF≌△GOE,可得BF=EG=GF,可判断②;通过证明四边形BEGF是菱形,可得∠BEF=∠GEF,由锐角三角函数可求∠AEB=30°,可得∠DEF=75°,可判断④,由题意无法证明△GDK和△GKH的面积相等,即可求解.【解答过程】解:如图,连接BE,设EF与BG交于点O,∵将纸片折叠,使点B落在边AD的延长线上的点G处,∴EF垂直平分BG,∴EF⊥BG,BO=GO,BE=EG,BF=FG,故①正确,∵AD∥BC,∴∠EGO=∠FBO,又∵∠EOG=∠BOF,∴△BOF≌△GOE(ASA),∴BF=EG,∴BF=EG=GF,故②正确,∵BE=EG=BF=FG,∴四边形BEGF是菱形,∴∠BEF=∠GEF,当点F与点C重合时,则BF=BC=BE=12,∵sin∠AEB===,∴∠AEB=30°,∴∠DEF=75°,故④正确,由题意无法证明△GDK和△GKH的面积相等,故③错误;故选:C.【总结归纳】本题考查了翻折变换,全等三角形的判定和性质,菱形的判定和性质,锐角三角函数等知识,灵活运用这些性质进行推理是本题的关键.二、填空题(本题共4小题,每小题3分,共12分)13.分解因式:m3﹣m=.【知识考点】提公因式法与公式法的综合运用.【思路分析】先提取公因式m,再对余下的多项式利用平方差公式继续分解.【解答过程】解:m3﹣m=m(m2﹣1),=m(m+1)(m﹣1).【总结归纳】本题考查提公因式法分解因式和利用平方差公式分解因式,关键在于需要进行二次分解因式.14.一口袋内装有编号分别为1,2,3,4,5,6,7的七个球(除编号外都相同),从中随机摸出一个球,则摸出编号为偶数的球的概率是.【知识考点】概率公式.【思路分析】用袋子中编号为偶数的小球的数量除以球的总个数即可得.【解答过程】解:∵从袋子中随机摸出一个球共有7种等可能结果,其中摸出编号为偶数的球的结果数为3,∴摸出编号为偶数的球的概率为,故答案为:.【总结归纳】本题主要考查概率公式,解题的关键是掌握随机事件A的概率P(A)=事件A可能出现的结果数÷所有可能出现的结果数.15.如图,在平面直角坐标系中,O(0,0),A(3,1),B(1,2).反比例函数y=(k≠0)的图象经过▱OABC的顶点C,则k=.【知识考点】反比例函数图象上点的坐标特征;平行四边形的性质.【思路分析】连接OB,AC,根据O,B的坐标易求P的坐标,再根据平行四边形的性质:对角线互相平分即可求出则C点坐标,根据待定系数法即可求得k的值.【解答过程】解:连接OB,AC,交点为P,∵四边形OABC是平行四边形,∴AP=CP,OP=BP,∵O(0,0),B(1,2),∴P的坐标(,1),∵A(3,1),∴C的坐标为(﹣2,1),∵反比例函数y=(k≠0)的图象经过点C,∴k=﹣2×1=﹣2,故答案为﹣2.【总结归纳】本题考查的是反比例函数图象上点的坐标特点,平行四边形的性质,求得C点的坐标是解答此题的关键.16.如图,在四边形ABCD中,AC与BD相交于点O,∠ABC=∠DAC=90°,tan∠ACB=,=,则=.【知识考点】角平分线的性质;解直角三角形.【思路分析】通过作辅助线,得到△ABC∽△ANM,△OBC∽△ODM,△ABC∽△DAN,进而得出对应边成比例,再根据tan∠ACB=,=,得出对应边之间关系,设AB=a,DN=b,表示BC,NA,MN,进而表示三角形的面积,求出三角形的面积比即可.【解答过程】解:如图,过点D作DM∥BC,交CA的延长线于点M,延长BA交DM于点N,∵DM∥BC,∴△ABC∽△ANM,△OBC∽△ODM,∴==tan∠ACB=,==,又∵∠ABC=∠DAC=90°,∴∠BAC+∠NAD=90°,∵∠BAC+∠BCA=90°,∴∠NAD=∠BCA,∴△ABC∽△DAN,∴==,设AB=a,DN=b,则BC=2a,NA=2b,MN=4b,由==得,DM=a,∴4b+b=a,即,b=a,∴====.故答案为:.【总结归纳】本题考查相似三角形的性质和判定,根据对应边成比例,设常数表示三角形的面积是得出正确答案的关键.三、解答题(本题共7小题,共52分)17.(5分)计算:()﹣1﹣2cos30°+|﹣|﹣(4﹣π)0.【知识考点】实数的运算;零指数幂;负整数指数幂;特殊角的三角函数值.【思路分析】根据零指数幂、负整数指数幂、特殊角的三角函数值进行计算即可求解.【解答过程】解:原式=3﹣2×+3﹣13﹣+﹣1=2.【总结归纳】本题考查了实数的运算、零指数幂、负整数指数幂、特殊角的三角函数值,解决本题的关键是掌握特殊角的三角函数值.18.(6分)先化简,再求值:÷(2+),其中a=2.【知识考点】分式的化简求值.【思路分析】先将分式进行化简,然后代入值即可求解.【解答过程】解:原式=÷=÷=×=当a=2时,原式==1.【总结归纳】本题考查了分式的化简求值,解决本题的关键是进行分式的化简.19.(7分)以人工智能、大数据、物联网为基础的技术创新促进了新业态蓬勃发展,新业态发展对人才的需求更加旺盛.某大型科技公司上半年新招聘软件、硬件、总线、测试四类专业的毕业生,现随机调查了m名新聘毕业生的专业情况,并将调查结果绘制成如图两幅不完整的统计图.请根据统计图提供的信息,解答下列问题.(1)m=,n=.(2)请补全条形统计图;(3)在扇形统计图中,“软件”所对应的扇形的圆心角是度;(4)若该公司新招聘600名毕业生,请你估计“总线”专业的毕业生有名.【知识考点】用样本估计总体;扇形统计图;条形统计图.【思路分析】(1)根据总线的人数和所占的百分比,可以求得m的值,然后即可计算出n的值;(2)根据(1)中的结果和硬件所占的百分比,可以求得硬件专业的毕业生,从而可以将条形统计图补充完整;(3)根据条形统计图中的数据,可以计算出在扇形统计图中,“软件”所对应的扇形的圆心角的度数;(4)根据统计图中的数据,可以计算出“总线”专业的毕业生的人数.【解答过程】解:(1)m=15÷30%=50,n%=5÷50×100%=10%,故答案为:50,10;(2)硬件专业的毕业生有:50×40%=20(人),补全的条形统计图如右图所示;(3)在扇形统计图中,“软件”所对应的扇形的圆心角是360°×=72°,故答案为:72;(4)600×30%=180(名),即“总线”专业的毕业生有180名,故答案为:180.【总结归纳】本题考查条形统计图、扇形统计图、用样本估计总体,解答本题的关键是明确题意,利用数形结合的思想解答.20.(8分)如图,AB为⊙O的直径,点C在⊙O上,AD与过点C的切线互相垂直,垂足为D.连接BC并延长,交AD的延长线于点E.(1)求证:AE=AB;(2)若AB=10,BC=6,求CD的长.【知识考点】三角形中位线定理;切线的性质.【思路分析】(1)证明:连接AC、OC,如图,根据切线的性质得到OC⊥CD,则可判断OC∥AD,所以∠OCB=∠E,然后证明∠B=∠E,从而得到结论;(2)利用圆周角定理得到∠ACB=90°,则利用勾股定理可计算出AC=8,再根据等腰三角形的性质得到CE=BC=6,然后利用面积法求出CD的长.【解答过程】(1)证明:连接AC、OC,如图,∵CD为切线,∴OC⊥CD,∴CD⊥AD,∴OC∥AD,∴∠OCB=∠E,∵OB=OC,∴∠OCB=∠B,∴∠B=∠E,∴AE=AB;(2)解:∵AB为直径,∴∠ACB=90°,∴AC==8,∵AB=AE=10,AC⊥BE,∴CE=BC=6,∵CD•AE=AC•CE,∴CD==.【总结归纳】本题考查了切线的性质:圆的切线垂直于经过切点的半径;若出现圆的切线,必连过切点的半径,构造定理图,得出垂直关系.也考查了圆周角定理.21.(8分)端午节前夕,某商铺用620元购进50个肉粽和30个蜜枣粽,肉粽的进货单价比蜜枣粽的进货单价多6元.(1)肉粽和蜜枣粽的进货单价分别是多少元?(2)由于粽子畅销,商铺决定再购进这两种粽子共300个,其中肉粽数量不多于蜜枣粽数量的2倍,且每种粽子的进货单价保持不变,若肉粽的销售单价为14元,蜜枣粽的销售单价为6元,试问第二批购进肉粽多少个时,全部售完后,第二批粽子获得利润最大?第二批粽子的最大利润是多少元?【知识考点】一元一次方程的应用;一元一次不等式的应用;一次函数的应用.【思路分析】(1)设蜜枣粽的进货单价是x元,则肉粽的进货单价是(x+6)元,根据用620元购进50个肉粽和30个蜜枣粽,可得出方程,解出即可;(2)设第二批购进肉粽y个,则蜜枣粽购进(300﹣y)个,获得利润为w元,根据w=蜜枣粽的利润+肉粽的利润,得一次函数,根据一次函数的增减性,可解答.【解答过程】解:(1)设蜜枣粽的进货单价是x元,则肉粽的进货单价是(x+6)元,由题意得:50(x+6)+30x=620,解得:x=4,∴6+4=10,答:蜜枣粽的进货单价是4元,则肉粽的进货单价是10元;(2)设第二批购进肉粽y个,则蜜枣粽购进(300﹣y)个,获得利润为w元,由题意得:w=(14﹣10)y+(6﹣4)(300﹣y)=2y+600,∵2>0,∴w随y的增大而增大,∵y≤2(300﹣y),∴0<y≤200,∴当y=200时,w有最大值,w最大值=400+600=1000,答:第二批购进肉粽200个时,总利润最大,最大利润是1000元.【总结归纳】本题考查了一次函数,一元一次方程及一元一次不等式的知识,解答本题的关键是仔细审题,找到不等关系及等量关系,难度一般.22.(9分)背景:一次小组合作探究课上,小明将两个正方形按如图所示的位置摆放(点E、A、D 在同一条直线上),发现BE=DG且BE⊥DG.小组讨论后,提出了下列三个问题,请你帮助解答:(1)将正方形AEFG绕点A按逆时针方向旋转(如图1),还能得到BE=DG吗?若能,请给出证明;若不能,请说明理由;(2)把背景中的正方形分别改成菱形AEFG和菱形ABCD,将菱形AEFG绕点A按顺时针方向旋转(如图2),试问当∠EAG与∠BAD的大小满足怎样的关系时,背景中的结论BE=DG仍成立?请说明理由;(3)把背景中的正方形分别改写成矩形AEFG和矩形ABCD,且,AE=4,AB=8,将矩形AEFG绕点A按顺时针方向旋转(如图3),连接DE,BG.小组发现:在旋转过程中,DE2+BG2的值是定值,请求出这个定值.【知识考点】相似形综合题.【思路分析】(1)由正方形的性质得出AE=AF,∠EAG=90°,AB=AD,∠BAD=90°,得出∠EAB=∠GAD,证明△AEB≌△AGD(SAS),则可得出结论;(2)由菱形的性质得出AE=AG,AB=AD,证明△AEB≌△AGD(SAS),由全等三角形的性质可得出结论;(3)方法一:过点E作EM⊥DA,交DA的延长线于点M,过点G作GN⊥AB交AB于点N,求出AG=6,AD=12,证明△AME∽△ANG,设EM=2a,AM=2b,则GN=3a,AN=3b,则BN=8﹣3b,可得出答案;方法二:证明△EAB∽△GAD,得出∠BEA=∠AGD,则A,E,G,Q四点共圆,得出∠GQP =∠PAE=90°,连接EG,BD,由勾股定理可求出答案.【解答过程】(1)证明:∵四边形AEFG为正方形,∴AE=AF,∠EAG=90°,又∵四边形ABCD为正方形,∴AB=AD,∠BAD=90°,∴∠EAB=∠GAD,∴△AEB≌△AGD(SAS),∴BE=DG;(2)当∠EAG=∠BAD时,BE=DG,理由如下:∵∠EAG=∠BAD,∴∠EAB=∠GAD,又∵四边形AEFG和四边形ABCD为菱形,∴AE=AG,AB=AD,∴△AEB≌△AGD(SAS),∴BE=DG;(3)解:方法一:过点E作EM⊥DA,交DA的延长线于点M,过点G作GN⊥AB交AB于点N,由题意知,AE=4,AB=8,∵=,∴AG=6,AD=12,∵∠EMA=∠ANG,∠MAE=∠GAN,∴△AME∽△ANG,设EM=2a,AM=2b,则GN=3a,AN=3b,则BN=8﹣3b,∴ED2=(2a)2+(12+2b)2=4a2+144+48b+4b2,GB2=(3a)2+(8﹣3b)2=9a2+64﹣48b+9b2,∴ED2+GB2=13(a2+b2)+208=13×4+208=260.方法二:如图2,设BE与DG交于Q,∵,AE=4,AB=8∴AG=6,AD=12.∵四边形AEFG和四边形ABCD为矩形,∴∠EAG=∠BAD,∴∠EAB=∠GAD,∵,∴△EAB∽△GAD,∴∠BEA=∠AGD,∴A,E,G,Q四点共圆,∴∠GQP=∠PAE=90°,∴GD⊥EB,连接EG,BD,∴ED2+GB2=EQ2+QD2+GQ2+QB2=EG2+BD2,∴EG2+BD2=42+62+82+122=260.【总结归纳】本题是相似形综合题,考查了正方形的性质,菱形的性质,矩形的性质,全等三角形的判定与性质,相似三角形的判定与性质,勾股定理等知识,熟练掌握特殊平行四边形的性质是解题的关键.23.(9分)如图1,抛物线y=ax2+bx+3(a≠0)与x轴的交点A(﹣3,0)和B(1,0),与y轴交于点C,顶点为D.(1)求该抛物线的解析式;(2)连接AD,DC,CB,将△OBC沿x轴以每秒1个单位长度的速度向左平移,得到△O'B'C',点O、B、C的对应点分别为点O'、B'、C',设平移时间为t秒,当点O'与点A重合时停止移动.记△O'B'C'与四边形AOCD重合部分的面积为S,请直接写出S与t之间的函数关系式;(3)如图2,过该抛物线上任意一点M(m,n)向直线l:y=作垂线,垂足为E,试问在该抛物线的对称轴上是否存在一点F,使得ME﹣MF=?若存在,请求出F的坐标;若不存在,请说明理由.【知识考点】二次函数综合题.【思路分析】(1)将点A(﹣3,0)、B(1,0)代入抛物线的解析式得到关于a、b的方程组即可;(2)分三种情况:①0<t<1时,②1≤t<时,③≤t≤3时,可由面积公式得出答案;(3)令F(﹣1,t),则MF=,ME=﹣n,得出,可求出n=.则得出答案.【解答过程】解:(1)∵抛物线y=ax2+bx+3过点A(﹣3,0),B(1,0),∴,解得,∴抛物线的解析式为y=﹣x2﹣2x+3;(2)①0<t<1时,如图1,若B'C'与y轴交于点F,∵OO'=t,OB'=1﹣t,∴OF=3OB'=3﹣3t,∴S=×(C'O'+OF)×OO'=×(3+3﹣3t)×t=﹣+3t,②1≤t<时,S=;③≤t≤3时,如图2,C′O′与AD交于点Q,B′C′与AD交于点P,过点P作PH⊥C′O′于H,∵AO=3,O'O=t,∴AO'=3﹣t,O'Q=6﹣2t,∴C'Q=2t﹣3,∵QH=2PH,C'H=3PH,∴PH=C'Q=(2t﹣3),∴S=(2t﹣3),∴S=﹣,综合以上可得:S=.(3)令F(﹣1,t),则MF=,ME=﹣n,∵ME﹣MF=,∴MF=ME﹣,∴,∴m2+2m+1+t2﹣2nt=﹣.∵n=﹣m2﹣2m+3,∴+(2+4n﹣17)m+1+t2﹣6t+﹣=0.当t=时,上式对于任意m恒成立,∴存在F(﹣1,).【总结归纳】本题是二次函数的综合题,考查了待定系数法求二次函数的解析式,两点间的距离公式,平移的性质,三角形的面积等知识.熟练运用方程的思想方法,正确进行分类是解题的关键.。
2020年中考化学试题分类汇编:化学计算题(word版,含解析)

化学计算题1.(2020•宁波)某科学兴趣小组同学取8.5g 铁,放到含少量硫酸的硫酸铜溶液中,完全反应后,最终得到9.2g 固体。
为测定所得固体中各成分的含量,同学们将62.5g 稀盐酸分五次加入到该固体中,得到数据如下表:请分析计算:(1)表中a 的值是___________。
(2)9.2g 固体中铁的质量是____________g 。
(3)稀盐酸的溶质质量分数是多少________? (4)与硫酸铜反应的铁的质量是多少________? 【答案】7.1 2.8 7.3% 5.6g 【解析】(1)由表中的数据可知,每12.5g 的稀盐酸完全反应,反应掉的铁的质量为0.7g ,所以a =7.8g-0.7g=7.1g 。
(2)由表中的数据可知,第四次加入的稀盐酸反应的铁的质量是7.1g-6.4g=0.7g 。
第五次加入的稀盐酸没有反应,说明了铁已完全反应,所以,9.2g 固体中铁的质量是:9.2g=6.4g=2.8g ;(3)设12.5g 稀盐酸中含溶质的质量为x 。
222HCl+Fe=FeCl +H 73560.7g7356=0.7gxx ↑解得:x =0.9125g 稀盐酸的溶质质量分数0.9125g=100%=7.3%12.5g⨯答:稀盐酸的溶质质量分数为7.3%。
(4)跟硫酸铜反应的铁的质量为y44Fe CuSO Cu FeSO 56646.4g 5664 6.4gy y +=+=解得:y =5.6g 。
答:跟硫酸铜反应的铁的质量为5.6g 。
故答案为:(1)7.1;(2)2.8g ;(3)7.3%;(4)5.6g 。
2.(2020•永州)国家明令禁止在面粉生产中添加过氧化钙(CaO 2)等食品添加剂。
过氧化钙是一种安全无毒物质,常带有结晶水,广泛用于果蔬保鲜、空气净化、污水处理等方面。
某化学兴趣小组为测定某过氧化钙样品(CaO 2•xH 2O )中的结晶水,称取4.86g 过氧化钙样品,灼热时发生如下反应: 2[CaO 2•xH 2O]2CaO+O 2↑+2xH 2O完全反应冷却后称量,得到剩余固体的质量为3.36g 。
湖北省武汉市2020年中考数学试题(解析版)

湖北省武汉市2020年中考数学真题一、选择题1.2-的相反数是( ) A. 2- B. 2C.12D. 12-【答案】B 【解析】 分析】根据相反数的性质可得结果.【详解】因为-2+2=0,所以﹣2相反数是2, 故选B .【点睛】本题考查求相反数,熟记相反数的性质是解题的关键 .2.x 的取值范围是( ) A. 0x ≥ B. 2x ≥-C. 2x ≤D. 2x ≥【答案】D 【解析】 【分析】由二次根式有意义的条件列不等式可得答案.20,x ∴-≥2.x ∴≥故选D .【点睛】本题考查的是二次根式有意义的条件,掌握二次根式的被开方数为非负数是解题的关键. 3.两个不透明的口袋中各有三个相同的小球,将每个口袋中的小球分别标号为1,2,3.从这两个口袋中分别摸出一个小球,则下列事件为随机事件的是( ) A. 两个小球的标号之和等于1 B. 两个小球的标号之和等于6 C. 两个小球的标号之和大于1 D. 两个小球的标号之和大于6【答案】B 【解析】 【分析】随机事件是指在某个条件下有可能发生有可能不会发生的事件,根据此定义即可求解.【详解】解:从两个口袋中各摸一个球,其标号之和最大为6,最小为2,选项A:“两个小球的标号之和等于1”为不可能事件,故选项A错误;选项B:“两个小球的标号之和等于6”为随机事件,故选项B正确;选项C:“两个小球的标号之和大于1”为必然事件,故选项C错误;选项D:“两个小球的标号之和大于6”为不可能事件,故选项D错误.故选:B.【点睛】本题考查了随机事件、不可能事件、必然事件的概念,熟练掌握各事件的定义是解决本题的关键.4.现实世界中,对称现象无处不在,中国的方块字中有些也只有对称性,下列汉字是轴对称图形的是()A. B. C. D.【答案】C【解析】【分析】根据轴对称图形的定义“在平面内,一个图形沿着一条直线折叠,直线两旁的部分能够完全重合的图形叫做轴对称图形”逐项判断即可得.【详解】A、不是轴对称图形,此项不符题意B、不是轴对称图形,此项不符题意C、是轴对称图形,此项符合题意D、不是轴对称图形,此项不符题意故选:C.【点睛】本题考查了轴对称图形的定义,熟记定义是解题关键.5.下图是由4个相同的正方体组成的立体图形,它的左视图是()A. B. C. D.【答案】A【解析】分析】根据左视图的定义即可求解. 【详解】根据图形可知左视图为故选A .【点睛】此题主要考查三视图,解题的关键是熟知左视图的定义.6.某班从甲、乙、丙、丁四位选中随机选取两人参加校乒乓球比赛,恰好选中甲、乙两位选手概率是( ) A.13B.14C.16D.18【答案】C 【解析】 【分析】画出树状图展示所有12种等可能的结果数,再根据概率公式即可求解. 【详解】画树状图为:∴P (选中甲、乙两位)=21126= 故选C .【点睛】本题考查了列表法或树状图法:通过列表法或树状图法展示所有等可能的结果求出n ,再从中选出符合事件A 或B 的结果数目m ,然后根据概率公式求出事件A 或B 的概率. 7.若点()11,A a y -,()21,B a y +在反比例函数(0)ky k x=<的图象上,且12y y >,则a 的取值范围是( ) A. 1a <- B. 11a -<<C. 1a >D. 1a <-或1a >【答案】B 【解析】 【分析】 由反比例函数(0)ky k x=<,可知图象经过第二、四象限,在每个象限内,y 随x 的增大而增大,由此分三种情况①若点A 、点B 在同在第二或第四象限;②若点A 在第二象限且点B 在第四象限;③若点A在第四象限且点B 在第二象限讨论即可. 【详解】解:∵反比例函数(0)ky k x=<, ∴图象经过第二、四象限,在每个象限内,y 随x 的增大而增大, ①若点A 、点B 同在第二或第四象限, ∵12y y >, ∴a-1>a+1, 此不等式无解;②若点A 在第二象限且点B 在第四象限, ∵12y y >, ∴1010a a -⎧⎨+⎩<>,解得:11a -<<;③由y 1>y 2,可知点A 在第四象限且点B 在第二象限这种情况不可能. 综上,a 的取值范围是11a -<<. 故选:B .【点睛】本题考查反比例函数的图象和性质,熟练掌握反比例函数的图象和性质是解题的关键,注意要分情况讨论,不要遗漏.8.一个容器有进水管和出水管,每分钟的进水和出水是两个常数.从某时刻开始4min 内只进水不出水,从第4min 到第24min 内既进水又出水,从第24min 开始只出水不进水,容器内水量y (单位:L )与时间x (单位:min )之间的关系如图所示,则图中a 的值是( )A. 32B. 34C. 36D. 38【答案】C 【解析】 【分析】设每分钟的进水量为bL ,出水量为cL ,先根据函数图象分别求出b 、c 的值,再求出24x =时,y 的值,然后根据每分钟的出水量列出等式求解即可.【详解】设每分钟的进水量为bL ,出水量为cL 由第一段函数图象可知,205()4b L == 由第二段函数图象可知,20(164)(164)35b c +---= 即201251235c +⨯-= 解得15()4c L =则当24x =时,1520(244)5(244)454y =+-⨯--⨯= 因此,45452412154a c-=== 解得36(min)a = 故选:C .【点睛】本题考查了函数图象的应用,理解题意,从函数图象中正确获取信息,从而求出每分钟的进水量和出水量是解题关键.9.如图,在半径为3的⊙O 中,AB 是直径,AC 是弦,D 是AC 的中点,AC 与BD 交于点E .若E 是BD 的中点,则AC 的长是( )B.C.D.【答案】D 【解析】 【分析】连接DO 、DA 、DC ,设DO 与AC 交于点H ,证明△DHE ≌△BCE ,得到DH=CB ,同时OH 是三角形ABC 中位线,设OH=x ,则BC=2x=DH ,故半径DO=3x ,解出x ,最后在Rt △ACB 中由勾股定理即可求解.【详解】解:连接DO 、DA 、DC 、OC ,设DO 与AC 交于点H ,如下图所示,∵D是AC的中点,∴DA=DC,∴D在线段AC的垂直平分线上,∵OC=OA,∴O在线段AC的垂直平分线上,∴DO⊥AC,∠DHC=90°,∵AB是圆的直径,∴∠BCA=90°,∵E是BD的中点,∴DE=BE,且∠DEH=∠BEC,∴△DHE≌△BCE(AAS),∴DH=BC,又O是AB中点,H是AC中点,∴HO是△ABC的中位线,设OH=x,则BC=DH=2x,∴OD=3x=3,∴x=1,即BC=2x=2,在Rt△ABC中,==AC故选:D.【点睛】本题考查了圆周角定理、三角形全等、勾股定理等,属于综合题,熟练掌握其性质和定理是解决此题的关键10.下列图中所有小正方形都是全等的.图(1)是一张由4个小正方形组成的“L”形纸片,图(2)是一张⨯方格纸片.把“L”形纸片放置在图(2)中,使它恰好盖住其中的4个小正方由6个小正方形组成的32⨯方格纸片,将“L”形,共有如图(3)中的4种不同放置方法,图(4)是一张由36个小正方形组成的66形纸片放置在图(4)中,使它恰好盖住其中的4个小正方形,共有n种不同放置方法,则n的值是()A. 160B. 128C. 80D. 48【答案】A【解析】【分析】先计算出66⨯方格纸片中共含有多少个32⨯方格纸片,再乘以4即可得.【详解】由图可知,在66⨯方格纸片中,32⨯方格纸片个数为54240⨯⨯=(个)则404160n=⨯=故选:A.【点睛】本题考查了图形类规律探索,正确得出在66⨯方格纸片中,32⨯方格纸片的个数是解题关键.二、填空题11._______.【答案】3【解析】【分析】根据二次根式的性质进行求解即可.=3-=3,故答案为3.a=是解题的关键.12.热爱劳动,劳动最美!某合作学习小组6名同学一周居家劳动的时间(单位:h),分别为:4,3,3,5,5,6.这组数据的中位数是________.【答案】4.5【解析】【分析】根据中位数的定义即可得.【详解】将这组数据按从小到大进行排序为3,3,4,5,5,6 则这组数据的中位数是454.52+= 故答案为:4.5.【点睛】本题考查了中位数的定义,熟记定义是解题关键.13.计算2223m nm n m n --+-的结果是________. 【答案】1m n- 【解析】 【分析】根据分式的减法法则进行计算即可. 【详解】原式2()3()()()()m n m nm n m n m n m n ---+=+--223()()m n m nm n m n --=++-()()m nm n m n =++-1m n=- 故答案为:1m n-. 【点睛】本题考查了分式的减法运算,熟记运算法则是解题关键.14.在探索数学名题“尺规三等分角”的过程中,有下面的问题:如图,AC 是平行四边形ABCD 的对角线,点E 在AC 上,AD AE BE ==,102D ︒∠=,则BAC ∠的大小是________.【答案】26°. 【解析】 【分析】设∠BAC=x ,然后结合平行四边形的性质和已知条件用x 表示出∠EBA 、∠BEC 、 ∠BCE 、 ∠BEC 、 ∠DCA 、∠DCB ,最后根据两直线平行同旁内角互补,列方程求出x 即可.【详解】解:设∠BAC=x ∵平行四边形ABCD 的对角线 ∴DC//AB,AD=BC,AD//BC ∴∠DCA=∠BAC=x ∵AE=BE∴∠EBA =∠BAC=x ∴∠BEC =2x ∵AD AE BE == ∴BE=BC∴∠BCE=∠BEC =2x ∴∠DCB=∠BCE+∠DCA=3x ∵AD//BC ,102D ︒∠=∴∠D+∠DCB=180°,即102°+3x=180°,解得x=26°. 故答案为26°.【点睛】本题主要考查了平行四边形的性质、等腰三角形的判定和性质,运用平行四边形结合已知条件判定等腰三角形和掌握方程思想是解答本题的关键.15.抛物线2y ax bx c =++(a ,b ,c 为常数,0a <)经过(2,0)A ,(4,0)B -两点,下列四个结论: ①一元二次方程20ax bx c ++=的根为12x =,24x =-; ②若点()15,C y -,()2,D y π在该抛物线上,则12y y <; ③对于任意实数t ,总有2at bt a b +≤-;④对于a 的每一个确定值,若一元二次方程2ax bx c p ++=(p 为常数,0p >)的根为整数,则p 的值只有两个.其中正确的结论是________(填写序号). 【答案】①③ 【解析】 【分析】①根据二次函数与一元二次方程的联系即可得;②先点(2,0)A ,(4,0)B -得出二次函数的对称轴,再根据二次函数的对称性与增减性即可得;③先求出二次函数的顶点坐标,再根据二次函数图象的平移规律即可得;④先将抛物线2y ax bx c =++向下平移p 个单位长度得到的二次函数解析式为2y ax bx c p =++-,再根据二次函数与一元二次方程的联系即可得.【详解】抛物线2y ax bx c =++经过(2,0)A ,(4,0)B -两点∴一元二次方程20ax bx c ++=的根为12x =,24x =-,则结论①正确抛物线的对称轴为4212x -+==- ∴3x =时的函数值与5x =-时的函数值相等,即为1y 0a <∴当1x ≥-时,y 随x 的增大而减小又13π-<<12y y ∴>,则结论②错误当1x =-时,y a b c =-+则抛物线的顶点的纵坐标为a b c -+,且0a b c -+>将抛物线2y ax bx c =++向下平移a b c -+个单位长度得到的二次函数解析式为22()y ax bx c a b c ax bx a b =++--+=+-+由二次函数图象特征可知,2y ax bx a b =+-+的图象位于x 轴的下方,顶点恰好在x 轴上 即0y ≤恒成立则对于任意实数t ,总有20at bt a b +-+≤,即2at bt a b +≤-,结论③正确将抛物线2y ax bx c =++向下平移p 个单位长度得到的二次函数解析式为2y ax bx c p =++- 函数2y ax bx c p =++-对应的一元二次方程为20ax bx c p ++-=,即2ax bx c p ++=因此,若一元二次方程2ax bx c p ++=的根为整数,则其根只能是121,3x x ==-或120,2x x ==-或121x x ==-对应的p 的值只有三个,则结论④错误 综上,结论正确的是①③ 故答案为:①③.【点睛】本题考查了二次函数的图象与性质(对称性、增减性)、二次函数图象的平移问题、二次函数与一元二次方程的联系等知识点,熟练掌握并灵活运用二次函数的图象与性质是解题关键.16.如图,折叠矩形纸片ABCD ,使点D 落在AB 边的点M 处,EF 为折痕,1AB =,2AD =.设AM 的长为t ,用含有t 的式子表示四边形CDEF 的面积是________.【答案】211144t t -+ 【解析】 【分析】首先根据题意可以设DE =EM =x ,在三角形AEM 中用勾股定理进一步可以用t 表示出x ,再可以设CF =y ,连接MF ,所以BF =2−y ,在三角形MFN 与三角形MFB 中利用共用斜边,根据勾股定理可求出用t 表示出y ,进而根据四边形的面积公式可以求出答案. 【详解】设DE =EM =x , ∴222(2)x x t =-+,∴x =244t + ,设CF =y ,连接FM ,∴BF =2−y , 又∵FN = y ,NM =1,∴22221(2)(1)y y t +=-+-,∴y =2244t t -+,∴四边形CDEF 的面积为:1()2x y CD +=221424()244t t t +-++∙1,故答案为:211144t t -+. 【点睛】本题主要考查了勾股定理的综合运用,熟练掌握技巧性就可得出答案.三、解答题17.计算:()235423a a a a ⎡⎤⋅+÷⎢⎥⎣⎦.【答案】610a 【解析】 【分析】根据同底数幂相乘、乘积的幂、幂的乘方、同底数幂相除运算法则逐步求解即可. 【详解】解:原式35829()+÷+=a a a8829)(+÷=a a a8210=÷a a 610=a .【点睛】本题考查了整式的乘除中幂的运算法则,熟练掌握公式及其运算法则是解决此类题的关键. 18.如图,直线EF 分别与直线AB ,CD 交于点E ,F .EM 平分BEF ∠,FN 平分CFE ∠,且EM ∥FN .求证:AB ∥CD .【答案】证明见解析. 【解析】 【分析】先根据角平分线的定义可得11,22MEF BEF N CF FE E ∠=∠∠∠=,再根据平行线的性质可得MEF NFE ∠=∠,从而可得BEF CFE ∠=∠,然后根据平行线的判定即可得证.【详解】EM 平分BEF ∠,FN 平分CFE ∠11,22MEF BEF NF CFE E ∠=∠∠∠=∴ EM //FN MEF NFE ∠=∠∴1122BEF CFE ∴∠=∠,即BEF CFE ∠=∠ //AB CD ∴.【点睛】本题考查了平行线的判定与性质、角平分线的定义等知识点,熟记平行线的判定与性质是解题关键.19.为改善民生;提高城市活力,某市有序推行“地摊经济”政策.某社区志愿者随机抽取该社区部分居民,按四个类别:A 表示“非常支持”,B 表示“支持”,C 表示“不关心”,D 表示“不支持”,调查他们对该政策态度的情况,将结果绘制成如下两幅不完整的统计图.根据图中提供的信息,解决下列问题:(1)这次共抽取了________名居民进行调查统计,扇形统计图中,D 类所对应的扇形圆心角的大小是________;(2)将条形统计图补充完整;(2)该社区共有2000名居民,估计该社区表示“支持”的B 类居民大约有多少人?【答案】(1)60,18︒;(2)图见解析;(3)该社区表示“支持”的B 类居民大约有1200人. 【解析】 【分析】(1)根据C 类的条形统计图和扇形统计图的信息可得出总共抽取的人数,再求出D 类居民人数的占比,然后乘以360︒即可得;(2)根据(1)的结论,先求出A 类居民的人数,再补全条形统计图即可; (3)先求出表示“支持”的B 类居民的占比,再乘以2000即可得. 【详解】(1)总共抽取的居民人数为915%60÷=(名) D 类居民人数的占比为3100%5%60⨯= 则D 类所对应的扇形圆心角的大小是3605%18⨯︒=︒ 故答案为:60,18︒;(2)A 类居民的人数为60369312---=(名) 补全条形统计图如下所示:(3)表示“支持”的B 类居民的占比为36100%60%60⨯= 则200060%1200⨯=(名)答:该社区表示“支持”的B 类居民大约有1200人.【点睛】本题考查了条形统计图和扇形统计图的信息关联、画条形统计图等知识点,熟练掌握统计调查的相关知识是解题关键.20.在8×5的网格中建立如图的平面直角坐标系,四边形OABC 的顶点坐标分别为(0,0)O ,(3,4)A ,(8,4)B ,(5,0)C .仅用无刻度的直尺在给定网格中按下列步骤完成画图,并回答问题:(1)将线段CB 绕点C 逆时针旋转90︒,画出对应线段CD ; (2)在线段AB 上画点E ,使45BCE ︒∠=(保留画图过程的痕迹); (3)连接AC ,画点E 关于直线AC 的对称点F ,并简要说明画法. 【答案】(1)见解析;(2)见解析;(3)见解析 【解析】 【分析】(1)根据题意,将线段CD 是将线段CB 绕点C 逆时针旋转90︒即可; (2)连接BD ,并连接(4,2),(5,5)点,两线段的交点即为所求的点E. (3)连接(5,0)和(0,5)点,与AC 的交点为F,且F 为所求.【详解】解:(1)如图示,线段CD 是将线段CB 绕点C 逆时针旋转90︒得到的;(2)∠BCE 为所求的角,点E 为所求的点.(3)连接(5,0)和(0,5)点,与AC 的交点为F,且F 为所求.【点睛】本题考查了作图-旋转变换,正方形的性质,全等三角形的性质和轴对称的性质,熟悉相关性质是解题的关键.21.如图,在Rt ABC 中,90ABC ∠=︒,以AB 为直径的⊙O 交AC 于点D ,AE 与过点D 的切线互相垂直,垂足为E .(1)求证:AD 平分BAE ∠; (2)若CD DE =,求sin BAC ∠的值.【答案】(1)证明见解析;(2)sin BAC ∠. 【解析】【分析】(1)如图(见解析),先根据圆的切线的性质可得OD DE ⊥,再根据平行线的判定与性质可得DAE ADO ∠=∠,然后根据等腰三角形的性质可得DAO ADO ∠=∠,最后根据角平分线的定义即可得证;(2)如图(见解析),先根据角的和差、等量代换可得ADE C ∠=∠,再根据三角形全等的判定定理与性质可得AD BC =,设,AD BC a CD x ===,然后根据相似三角形的判定与性质可得AC BCBC CD=,从而可求出x 的值,最后根据正弦三角函数的定义即可得. 【详解】(1)如图,连接OD 由圆的切线的性质得:OD DE ⊥AE DE ⊥//OD AE ∴ DAE ADO ∴∠=∠又OA OD =DAO ADO ∴∠=∠ DAE DAO ∴∠=∠则AD 平分BAE ∠; (2)如图,连接BD由圆周角定理得:90ADB ∠=︒90BDC ∴∠=︒90ABC ∠=︒ 90DAO C ∴∠+∠=︒ 90DAE ADE ∠+∠=︒ADE C ∴∠=∠在ADE 和BCD 中,90E BDC DE CDADE C ∠=∠=︒⎧⎪=⎨⎪∠=∠⎩()ADE BCD ASA ∴≅AD BC ∴=设,AD BC a CD x ===,则AC AD CD a x =+=+,且0,0a x >>在ACB △和BCD 中,90C CABC BDC ∠=∠⎧⎨∠=∠=︒⎩ACB BCD ∴~AC BC BC CD ∴=,即a x aa x+=解得x =0x =<(不符题意,舍去)经检验,x =是所列分式方程的解AC a ∴=+=则在Rt ABC中,sin BC BAC AC ∠===故sin BAC ∠.【点睛】本题考查了圆周角定理、圆的切线的性质、正弦三角函数、相似三角形的判定与性质等知识点,较难的是题(2),通过作辅助线,构造全等三角形和相似三角形是解题关键.22.某公司分别在A ,B 两城生产同种产品,共100件.A 城生产品的总成本y (万元)与产品数量x (件)之间具有函数关系2y ax bx c =++,当10x =时,400y =;当20x 时,1000y =.B 城生产产品的每件成本为70万元. (1)求a ,b 的值;(2)当A ,B 两城生产这批产品的总成本的和最少时,求A ,B 两城各生产多少件?(3)从A 城把该产品运往C ,D 两地的费用分别为m 万元/件和3万元/件;从B 城把该产品运往C ,D 两地的费用分别为1万元/件和2万元/件,C 地需要90件,D 地需要10件,在(2)的条件下,直接写出A ,B 两城总运费的和的最小值(用含有m 的式子表示). 【答案】(1)1a =,30b =;(2)A 城生产20件,B 城生产80件;(3)当02m <≤时,A ,B 两城总运费的和的最小值为(2090)m +万元;当2m >时,A ,B 两城总运费的和的最小值为(10110)m +万元. 【解析】 【分析】(1)先根据题意得出产品数量为0时,总成本y 也为0,再利用待定系数法即可求出a 、b 的值; (2)先根据(1)的结论得出y 与x 的函数关系式,从而可得出A ,B 两城生产这批产品的总成本的和,再根据二次函数的性质即可得;(3)设从A 城运往C 地的产品数量为n 件,A ,B 两城总运费的和为P ,先列出从A 城运往D 地的产品数量、从B 城运往C 地的产品数量、从B 城运往D 地的产品数量,再求出n 的取值范围,然后根据题干运费信息列出P 与n 的函数关系式,最后根据一次函数的性质求解即可得. 【详解】(1)由题意得:当产品数量为0时,总成本也为0,即0x =时,0y =则010010400400201000c a b c a b c =⎧⎪++=⎨⎪++=⎩,解得1300a b c =⎧⎪=⎨⎪=⎩故1a =,30b =;(2)由(1)得:230y x x =+设A ,B 两城生产这批产品的总成本的和为W 则223070(100)700400x x x x x W ++-+==- 整理得:220)60(60x W -+= 由二次函数的性质可知,当20x 时,W 取得最小值,最小值为6600万元此时1001002080x -=-=答:A 城生产20件,B 城生产80件;(3)设从A 城运往C 地的产品数量为n 件,A ,B 两城总运费的和为P ,则从A 城运往D 地的产品数量为(20)n -件,从B 城运往C 地的产品数量为(90)n -件,从B 城运往D 地的产品数量为(1020)n -+件由题意得:20010200n n -≥⎧⎨-+≥⎩,解得1020n ≤≤3(20)(90)2(1020)P mn n n n =+-+-+-+整理得:(2)130P m n =-+根据一次函数的性质分以下两种情况:①当02m <≤时,在1020n ≤≤内,P 随n 的增大而减小 则20n =时,P 取得最小值,最小值为20(2)1302090m m -+=+ ②当2m >时,在1020n ≤≤内,P 随n 的增大而增大则10n =时,P 取得最小值,最小值为10(2)13010110m m -+=+答:当02m <≤时,A ,B 两城总运费的和的最小值为(2090)m +万元;当2m >时,A ,B 两城总运费的和的最小值为(10110)m +万元.【点睛】本题考查了利用待定系数法求二次函数的解析式、二次函数与一次函数的实际应用等知识点,较难的是题(3),正确设立未知数,建立函数关系式是解题关键.23.问题背景:如图(1),已知A ABC DE ∽△△,求证:ABD ACE ∽;尝试应用:如图(2),在ABC 和ADE 中,90BAC DAE ︒∠=∠=,30ABC ADE ︒∠=∠=,AC与DE 相交于点F .点D 在BC 边上,AD BD=,求DFCF 的值;拓展创新:如图(3),D 是ABC 内一点,30BAD CBD ︒∠=∠=,90BDC ︒∠=,4AB =,AC =AD 的长.【答案】问题背景:见详解;尝试应用:3;拓展创新:AD =【解析】 【分析】问题背景:通过A ABC DE ∽△△得到AB AC AD AE =,AB ACAD AE=,再找到相等的角,从而可证ABD ACE ∽;尝试应用:连接CE ,通过BAC DAE ∽可以证得ABD ACE ∽,得到BD ADCE AE=,然后去证AFE DFC ∽△△,ADF ECF ∽△△,通过对应边成比例即可得到答案;拓展创新:在AD 的右侧作∠DAE=∠BAC ,AE 交BD 延长线于E ,连接CE ,通过BAC DAE ∽,BAD CAE ∽,然后利用对应边成比例即可得到答案.【详解】问题背景:∵A ABC DE ∽△△, ∴∠BAC=∠DAE ,AB ACAD AE=, ∴∠BAD+∠DAC=CAE+∠DAC , ∴∠BAD=∠CAE , ∴ABD ACE ∽;尝试应用:连接CE ,∵90BAC DAE ︒∠=∠=,30ABC ADE ︒∠=∠=, ∴BAC DAE ∽,∴AB ADAC AE=, ∵∠BAD+∠DAC=CAE+∠DAC , ∴∠BAD=∠CAE , ∴ABD ACE ∽,∴BD ADCE AE=, 由于30ADE ︒∠=,90DAE ︒∠=,∴30AE tan AD ︒==即BD AD CE AE ==,∵ADBD =, ∴3ADCE=,∵90BAC DAE ︒∠=∠=,30ABC ADE ︒∠=∠=,∴60C E ︒∠=∠=,又∵AFE DFC ∠=∠,∴AFE DFC ∽△△, ∴AF EF DF CF =,即AF DF EF CF=, 又∵AFD EFC ∠=∠∴ADF ECF ∽△△, ∴3DF AD CF CE==;拓展创新:AD =如图,在AD 的右侧作∠DAE=∠BAC ,AE 交BD 延长线于E ,连接CE ,∵∠ADE=∠BAD+∠ABD ,∠ABC=∠ABD+∠CBD ,30BAD CBD ︒∠=∠=,∴∠ADE=∠ABC ,又∵∠DAE=∠BAC ,∴BAC DAE ∽, ∴AB AC BC AD AE DE==, 又∵∠DAE=∠BAC ,∴∠BAD=∠CAE ,∴BAD CAE ∽,∴=BD AB AD CE AC AE ===, 设CD=x ,在直角三角形BCD 中,由于∠CBD=30°, ∴BD =,2BC x =, ∴32CE x =,∴DE =, ∵AB BC AD DE=,∴4AD =,∴AD =【点睛】本题考查了相似三角形的综合问题,熟练掌握相似三角形的判定和性质是解题的关键. 24.将抛物线2:(2)C y x =-向下平移6个单位长度得到抛物线1C ,再将抛物线1C 向左平移2个单位长度得到抛物线2C .(1)直接写出抛物线1C ,2C 的解析式;(2)如图(1),点A 在抛物线1C 对称轴l 右侧上,点B 在对称轴l 上,OAB 是以OB 为斜边的等腰直角三角形,求点A 的坐标;(3)如图(2),直线y kx =(0k ≠,k 为常数)与抛物线2C 交于E ,F 两点,M 为线段EF 的中点;直线4y x k=-与抛物线2C 交于G ,H 两点,N 为线段GH 的中点.求证:直线MN 经过一个定点. 【答案】(1)抛物线1C 的解析式为: y=x 2-4x-2;抛物线2C 的解析式为:y=x 2-6;(2)点A 的坐标为(5,3)或(4,-2);(3)直线MN 经过定点(0,2)【解析】【分析】(1)根据函数图象上下平移:函数值上加下减;左右平移:自变量左加右减写出函数解析式并化简即可; (2)先判断出点A 、B 、O 、D 四点共圆,再根据同弧所对的圆周角相等得到∠BDA=∠BOA=45°,从而证出DAC △是等腰直角三角形.设点A 的坐标为(x ,x 2-4x-2),把DC 和AC 用含x 的代数式表示出来,利用DC=AC 列方程求解即可,注意有两种情况;(3)根据直线y kx =(0k ≠,k 为常数)与抛物线2C 交于E ,F 两点,联立两个解析式,得到关于x 的一元二次方程,根据根与系数的关系求出点M 的横坐标,进而求出纵坐标,同理求出点N 的坐标,再用待定系数法求出直线MN 的解析式,从而判断直线MN 经过的定点即可.【详解】解:(1)∵抛物线2:(2)C y x =-向下平移6个单位长度得到抛物线1C ,再将抛物线1C 向左平移2个单位长度得到抛物线2C ,∴抛物线1C 的解析式为:y=(x-2)2-6,即y=x 2-4x-2,抛物线2C 的解析式为:y=(x-2+2)2-6,即y=x 2-6.(2)如下图,过点A 作AC ⊥x 轴于点C ,连接AD ,∵OAB 是等腰直角三角形,∴∠BOA =45°,又∵∠BDO=∠BAO=90°,∴点A 、B 、O 、D 四点共圆,∴∠BDA=∠BOA=45°,∴∠ADC=90°-∠BDA=45°,∴DAC △是等腰直角三角形,∴DC=AC .∵点A 在抛物线1C 对称轴l 右侧上,点B 在对称轴l 上,∴抛物线1C 的对称轴为x=2,设点A 的坐标为(x ,x 2-4x-2),∴DC=x-2,AC= x 2-4x-2,∴x-2= x 2-4x-2,解得:x=5或x=0(舍去),∴点A 的坐标为(5,3);同理,当点B 、点A 在x 轴的下方时,x-2= -(x 2-4x-2),x=4或x=-1(舍去),∴点A 的坐标为(4,-2),综上,点A 的坐标为(5,3)或(4,-2).(3)∵直线y kx =(0k ≠,k 为常数)与抛物线2C 交于E ,F 两点,∴26y kx y x =⎧⎨=-⎩, ∴x 2-kx-6=0,设点E 的横坐标为x E ,点F 的横坐标为x F ,∴x E +x F =k ,∴中点M 的横坐标x M =2E F x x +=2k , 中点M 的纵坐标y M =kx=22k , ∴点M 的坐标为(2k ,22k ); 同理可得:点N 的坐标为(2k -,28k), 设直线MN 的解析式为y=ax+b (a ≠0),将M (2k ,22k )、N (2k -,28k )代入得: 222282k k a b a b k k ⎧=+⎪⎪⎨⎪=-+⎪⎩,解得:242k a k b ⎧-=⎪⎨⎪=⎩,∴直线MN 的解析式为y= 24k k-·x+2(0k ≠), 不论k 取何值时(0k ≠),当x=0时,y=2,∴直线MN 经过定点(0,2).【点睛】本题考查二次函数综合应用,熟练掌握图象平移的规律、判断点A 、B 、O 、D 四点共圆的方法、用待定系数法求函数解析式的步骤是解题的关键.。
2020年数学中考试题(含答案)

2020年数学中考试题(含答案)一、选择题1.如图,菱形ABCD 的一边中点M 到对角线交点O 的距离为5cm ,则菱形ABCD 的周长为( )A .5cmB .10cmC .20cmD .40cm2.下列关于矩形的说法中正确的是( )A .对角线相等的四边形是矩形B .矩形的对角线相等且互相平分C .对角线互相平分的四边形是矩形D .矩形的对角线互相垂直且平分3.小军旅行箱的密码是一个六位数,由于他忘记了密码的末位数字,则小军能一次打开该旅行箱的概率是( )A .110B .19C .16D .154.三张外观相同的卡片分别标有数字1,2,3,从中随机一次性抽出两张,则这两张卡片上的数字恰好都小于3的概率是( )A .19B .16C .13D .235.某球员参加一场篮球比赛,比赛分4节进行,该球员每节得分如折线统计图所示,则该球员平均每节得分为( )A .7分B .8分C .9分D .10分 6.下列运算正确的是( ) A .23a a a += B .()2236a a = C .623a a a ÷=D .34a a a ⋅= 7.10+1的值应在( )A .3和4之间B .4和5之间C .5和6之间D .6和7之间8.已知直线//m n ,将一块含30角的直角三角板ABC 按如图方式放置(30ABC ∠=︒),其中A ,B 两点分别落在直线m ,n 上,若140∠=︒,则2∠的度数为( )A .10︒B .20︒C .30D .40︒9.现定义一种变换:对于一个由有限个数组成的序列S 0,将其中的每个数换成该数在S 0中出现的次数,可得到一个新序列S 1,例如序列S 0:(4,2,3,4,2),通过变换可生成新序列S 1:(2,2,1,2,2),若S 0可以为任意序列,则下面的序列可作为S 1的是( )A .(1,2,1,2,2)B .(2,2,2,3,3)C .(1,1,2,2,3)D .(1,2,1,1,2)10.如图,已知////AB CD EF ,那么下列结论正确的是( )A .AD BC DF CE =B .BC DF CE AD = C .CD BC EF BE = D .CD AD EF AF= 11.下列分解因式正确的是( )A .24(4)x x x x -+=-+B .2()x xy x x x y ++=+C .2()()()x x y y y x x y -+-=-D .244(2)(2)x x x x -+=+-12.把一副三角板如图(1)放置,其中∠ACB =∠DEC =90°,∠A =45°,∠D =30°,斜边AB =4,CD =5.把三角板DCE 绕着点C 顺时针旋转15°得到△D 1CE 1(如图2),此时AB 与CD 1交于点O ,则线段AD 1的长度为( )A 13B 5C .22D .4二、填空题13.已知a ,b ,c 是△ABC 的三边长,a ,b 满足|a ﹣7|+(b ﹣1)2=0,c 为奇数,则c=_____.14.关于x 的一元二次方程2310ax x --=的两个不相等的实数根都在-1和0之间(不包括-1和0),则a 的取值范围是___________15.如图,直线a、b被直线l所截,a∥b,∠1=70°,则∠2= .16.如图是两块完全一样的含30°角的直角三角尺,分别记做△ABC与△A′B′C′,现将两块三角尺重叠在一起,设较长直角边的中点为M,绕中点M转动上面的三角尺ABC,使其直角顶点C恰好落在三角尺A′B′C′的斜边A′B′上.当∠A=30°,AC=10时,两直角顶点C,C′间的距离是_____.17.在函数3yx=-的图象上有三个点(﹣2,y1),(﹣1,y2),(12,y3),则y1,y2,y3的大小关系为_____.18.一批货物准备运往某地,有甲、乙、丙三辆卡车可雇用.已知甲、乙、丙三辆车每次运货量不变,且甲、乙两车单独运完这批货物分别用2,a a次;甲、丙两车合运相同次数,运完这批货物,甲车共运180吨;乙、丙两车合运相同次数,运完这批货物乙车共运270吨,现甲、乙、丙合运相同次数把这批货物运完,货主应付甲车主的运费为___________元.(按每吨运费20元计算)19.分解因式:2x2﹣18=_____.20.在学校组织的义务植树活动中,甲、乙两组各四名同学的植树棵数如下,甲组:9,9,11,10;乙组:9,8,9,10;分别从甲、乙两组中随机选取一名同学,则这两名同学的植树总棵数为19的概率______.三、解答题21.如图1,△ABC内接于⊙O,∠BAC的平分线交⊙O于点D,交BC于点E(BE>EC),且3D作DF∥BC,交AB的延长线于点F.(1)求证:DF为⊙O的切线;(2)若∠BAC=60°,7,求图中阴影部分的面积;(3)若43ABAC=,DF+BF=8,如图2,求BF的长.22.如图,在平面直角坐标系中,小正方形格子的边长为1,Rt △ABC 三个顶点都在格点上,请解答下列问题:(1)写出A ,C 两点的坐标;(2)画出△ABC 关于原点O 的中心对称图形△A 1B 1C 1;(3)画出△ABC 绕原点O 顺时针旋转90°后得到的△A 2B 2C 2,并直接写出点C 旋转至C 2经过的路径长.23.某烘焙店生产的蛋糕礼盒分为六个档次,第一档次(即最低档次)的产品每天生产76件,每件利润10元,调查表明:生产提高一个档次的蛋糕产品,该产品每件利润增加2元(1)若生产第五档次的蛋糕,该档次蛋糕每件利润为多少元?(2)由于生产工序不同,蛋糕产品每提高一个档次,一天产量会减少4件.若生产的某档次产品一天的总利润为1024元,该烘焙店生产的是第几档次的产品?24.如图,ABC ∆是边长为4cm 的等边三角形,边AB 在射线OM 上,且6OA cm =,点D 从点O 出发,沿OM 的方向以1cm/s 的速度运动,当D 不与点A 重合时,将ACD ∆绕点C 逆时针方向旋转60°得到BCE ∆,连接DE.(1)如图1,求证:CDE ∆是等边三角形;(2)如图2,当6<t<10时,DE 是否存在最小值?若存在,求出DE 的最小值;若不存在,请说明理由.(3)当点D 在射线OM 上运动时,是否存在以D ,E ,B 为顶点的三角形是直角三角形?若存在,求出此时t 的值;若不存在,请说明理由.25.修建隧道可以方便出行.如图:A ,B 两地被大山阻隔,由A 地到B 地需要爬坡到山顶C地,再下坡到B地.若打通穿山隧道,建成直达A,B两地的公路,可以缩短从A地i=,从B到C坡面的坡角到B地的路程.已知:从A到C坡面的坡度1:3∠=︒,4245CBABC=公里.(1)求隧道打通后从A到B的总路程是多少公里?(结果保留根号)(2)求隧道打通后与打通前相比,从A地到B地的路程约缩短多少公里?(结果精确到0.012 1.414≈3 1.732)【参考答案】***试卷处理标记,请不要删除一、选择题1.D解析:D【解析】【分析】根据菱形的性质得出AB=BC=CD=AD,AO=OC,根据三角形的中位线求出BC,即可得出答案.【详解】∵四边形ABCD是菱形,∴AB=BC=CD=AD,AO=OC,∵AM=BM,∴BC=2MO=2×5cm=10cm,即AB=BC=CD=AD=10cm,即菱形ABCD的周长为40cm,故选D.【点睛】本题考查了菱形的性质和三角形的中位线定理,能根据菱形的性质得出AO=OC是解此题的关键.2.B解析:B【解析】试题分析:A.对角线相等的平行四边形才是矩形,故本选项错误;B.矩形的对角线相等且互相平分,故本选项正确;C.对角线互相平分的四边形是平行四边形,不一定是矩形,故本选项错误;D.矩形的对角线互相平分且相等,不一定垂直,故本选项错误;故选B.考点:矩形的判定与性质.3.A解析:A【解析】∵密码的末位数字共有10种可能(0、1、 2、 3、4、 5、 6、 7、 8、 9、 0都有可能),∴当他忘记了末位数字时,要一次能打开的概率是1 10.故选A.4.C解析:C【解析】【分析】画出树状图即可求解.【详解】解:画树状图得:∵共有6种等可能的结果,而两张卡片上的数字恰好都小于3有2种情况,∴两张卡片上的数字恰好都小于3概率=13;故选:C.【点睛】本题考查的是概率,熟练掌握树状图是解题的关键.5.B解析:B【解析】【分析】根据平均数的定义进行求解即可得.【详解】根据折线图可知该球员4节的得分分别为:12、4、10、6,所以该球员平均每节得分=1241064+++=8,故选B.【点睛】本题考查了折线统计图、平均数的定义等知识,解题的关键是理解题意,掌握平均数的求解方法.6.D解析:D【解析】【分析】【详解】解:A 、a+a 2不能再进行计算,故错误;B 、(3a )2=9a 2,故错误;C 、a 6÷a 2=a 4,故错误;D 、a·a 3=a 4,正确;故选:D .【点睛】本题考查整式的加减法;积的乘方;同底数幂的乘法;同底数幂的除法.7.B解析:B【解析】解:∵34<<,∴415<<.故选B .的取值范围是解题关键.8.B解析:B【解析】【分析】根据平行线的性质判断即可得出结论.【详解】 解:直线//m n ,21180ABC BAC ∴∠+∠∠+∠=+︒,30ABC =︒∠,90BAC ∠=︒,140∠=︒,218030904020∴∠=---︒︒=︒︒︒,故选:B .【点睛】本题考查的是平行线的性质,熟练掌握平行线的性质是解题的关键.9.D解析:D【解析】【分析】根据已知中有限个数组成的序列S0,将其中的每个数换成该数在S0中出现的次数,可得到一个新序列S1,可得S1中2的个数应为偶数个,由此可排除A ,B 答案,而3的个数应为3个,由此可排除C ,进而得到答案.【详解】解:由已知中序列S 0,将其中的每个数换成该数在S 0中出现的次数,可得到一个新序列S 1,A 、2有三个,即序列S 0:该位置的三个数相等,按照变换规则,应为三个3,故A 不满足条件;B 、2有三个,即序列S 0:该位置的三个数相等,按照变换规则,应为三个3,故B 不满足条件;C 、3有一个,即序列S 0:该位置的数出现了三次,按照变换规则,应为三个3,故C 不满足条件;D 、2有两个,即序列S 0:该位置的两个数相等,1有三个,即这三个位置的数互不相等,满足条件,故选D .【点睛】本题考查规律型:数字的变化类.10.A解析:A【解析】【分析】已知AB ∥CD ∥EF ,根据平行线分线段成比例定理,对各项进行分析即可.【详解】∵AB ∥CD ∥EF , ∴AD BC DF CE=. 故选A .【点睛】 本题考查平行线分线段成比例定理,找准对应关系,避免错选其他答案.11.C解析:C【解析】【分析】根据因式分解的步骤:先提公因式,再用公式法分解即可求得答案.注意分解要彻底.【详解】A. ()244x x x x -+=-- ,故A 选项错误; B. ()21x xy x x x y ++=++,故B 选项错误; C. ()()()2x x y y y x x y -+-=- ,故C 选项正确;D. 244x x -+=(x-2)2,故D 选项错误,故选C.【点睛】本题考查了提公因式法,公式法分解因式.注意因式分解的步骤:先提公因式,再用公式法分解.注意分解要彻底.12.A解析:A【解析】试题分析:由题意易知:∠CAB=45°,∠ACD=30°.若旋转角度为15°,则∠ACO=30°+15°=45°.∴∠AOC=180°-∠ACO-∠CAO=90°.在等腰Rt △ABC 中,AB=4,则AO=OC=2.在Rt △AOD 1中,OD 1=CD 1-OC=3,由勾股定理得:AD 1故选A.考点: 1.旋转;2.勾股定理.二、填空题13.7【解析】【分析】根据非负数的性质列式求出ab 的值再根据三角形的任意两边之和大于第三边两边之差小于第三边求出c 的取值范围再根据c 是奇数求出c 的值【详解】∵ab 满足|a ﹣7|+(b ﹣1)2=0∴a ﹣7解析:7【解析】【分析】根据非负数的性质列式求出a 、b 的值,再根据三角形的任意两边之和大于第三边,两边之差小于第三边求出c 的取值范围,再根据c 是奇数求出c 的值.【详解】∵a ,b 满足|a ﹣7|+(b ﹣1)2=0,∴a ﹣7=0,b ﹣1=0,解得a=7,b=1,∵7﹣1=6,7+1=8,∴68c <<,又∵c 为奇数,∴c=7,故答案为7.【点睛】本题考查非负数的性质:偶次方,解题的关键是明确题意,明确三角形三边的关系.14.<a<-2【解析】【分析】【详解】解:∵关于x 的一元二次方程ax2-3x-1=0的两个不相等的实数根∴△=(-3)2-4×a×(-1)>0解得:a >−设f (x )=ax2-3x-1如图∵实数根都在-1解析:94-<a<-2【解析】【分析】【详解】解:∵关于x的一元二次方程ax2-3x-1=0的两个不相等的实数根∴△=(-3)2-4×a×(-1)>0,解得:a>−9 4设f(x)=ax2-3x-1,如图,∵实数根都在-1和0之间,∴-1<−32a-<0,∴a<−32,且有f(-1)<0,f(0)<0,即f(-1)=a×(-1)2-3×(-1)-1<0,f(0)=-1<0,解得:a<-2,∴−94<a<-2,故答案为−94<a<-2.15.110°【解析】∵a∥b∴∠3=∠1=70°∵∠2+∠3=180°∴∠2=110°解析:110°【解析】∵a∥b,∴∠3=∠1=70°,∵∠2+∠3=180°,∴∠2=110°16.5【解析】【分析】连接CC1根据M是ACA1C1的中点AC=A1C1得出CM=A1M=C1M=AC=5再根据∠A1=∠A1CM=30°得出∠CMC1=60°△MCC1为等边三角形从而证出CC1=CM解析:5【解析】【分析】连接CC1,根据M是AC、A1C1的中点,AC=A1C1,得出CM=A1M=C1M=12AC=5,再根据∠A1=∠A1CM=30°,得出∠CMC1=60°,△MCC1为等边三角形,从而证出CC1=CM,即可得出答案.【详解】解:如图,连接CC1,∵两块三角板重叠在一起,较长直角边的中点为M,∴M是AC、A1C1的中点,AC=A1C1,∴CM=A1M=C1M=12AC=5,∴∠A1=∠A1CM=30°,∴∠CMC1=60°,∴△CMC1为等边三角形,∴CC1=CM=5,∴CC1长为5.故答案为5.考点:等边三角形的判定与性质.17.y2>y1>y3【解析】【分析】根据图象上的点(xy)的横纵坐标的积是定值k可得xy=k据此解答即可【详解】解:∵函数y=-的图象上有三个点(-2y1)(-1y2)(y3)∴-2y1=-y2=y3=解析:y2>y1>y3.【解析】【分析】根据图象上的点(x,y)的横纵坐标的积是定值k,可得xy=k,据此解答即可.【详解】解:∵函数y=-3x的图象上有三个点(-2,y1),(-1,y2),(12,y3),∴-2y1=-y2=12y3=-3,∴y1=1.5,y2=3,y3=-6,∴y2>y1>y3.故答案为y2>y1>y3.【点睛】本题考查了反比例函数的图象上点的坐标特征.解题时注意:图象上的点(x,y)的横纵坐标的积是定值k,即xy=k.18.【解析】【分析】根据甲乙两车单独运这批货物分别用2a次a次能运完甲的效率应该为乙的效率应该为那么可知乙车每次货运量是甲车的2倍根据若甲丙两车合运相同次数运完这批货物时甲车共运了180吨;若乙丙两车合解析:2160【解析】【分析】根据“甲、乙两车单独运这批货物分别用2a次、a次能运完”甲的效率应该为1 2a ,乙的效率应该为1a,那么可知乙车每次货运量是甲车的2倍根据“若甲、丙两车合运相同次数运完这批货物时,甲车共运了180吨;若乙、丙两车合运相同次数运完这批货物时,乙车共运了270吨.”这两个等量关系来列方程.【详解】设这批货物共有T吨,甲车每次运t甲吨,乙车每次运t乙吨,∵2a⋅t甲=T,a⋅t乙=T,∴t甲:t乙=1:2,由题意列方程:180270 180270T Tt t--=甲乙,t乙=2t甲,∴180270180135T T--=,解得T=540.∵甲车运180吨,丙车运540−180=360吨,∴丙车每次运货量也是甲车的2倍,∴甲车车主应得运费15402021605⨯⨯= (元),故答案为:2160.【点睛】考查分式方程的应用,读懂题目,找出题目中的等量关系是解题的关键.19.2(x+3)(x﹣3)【解析】【分析】原式提取2再利用平方差公式分解即可【详解】原式=2(x2﹣9)=2(x+3)(x﹣3)故答案为:2(x+3)(x﹣3)【点睛】此题考查了提公因式法与公式法的综合解析:2(x+3)(x﹣3)【解析】【分析】原式提取2,再利用平方差公式分解即可.【详解】原式=2(x2﹣9)=2(x+3)(x﹣3),故答案为:2(x+3)(x﹣3)【点睛】此题考查了提公因式法与公式法的综合运用,熟练掌握因式分解的方法是解本题的关键.20.【解析】【分析】【详解】画树状图如图:∵共有16种等可能结果两名同学的植树总棵数为19的结果有5种结果∴这两名同学的植树总棵数为19的概率为解析:5 16.【解析】【分析】【详解】画树状图如图:∵共有16种等可能结果,两名同学的植树总棵数为19的结果有5种结果,∴这两名同学的植树总棵数为19的概率为5 16.三、解答题21.(1)证明见解析(2)3﹣2π;(3)3【解析】【分析】(1)连结OD,如图1,由已知得到∠BAD=∠CAD,得到BD CD=,再由垂径定理得OD⊥BC,由于BC∥EF,则OD⊥DF,于是可得结论;(2)连结OB,OD交BC于P,作BH⊥DF于H,如图1,先证明△OBD为等边三角形得到∠ODB=60°,OB=BD=3BDF=∠DBP=30°,在Rt△DBP中得到3,PB=3,在Rt△DEP中利用勾股定理可算出PE=2,由于OP⊥BC,则BP=CP=3,得到CE=1,由△BDE∽△ACE,得到AE的长,再证明△ABE∽△AFD,可得DF=12,最后利用S阴影部分=S△BDF﹣S弓形BD=S△BDF﹣(S扇形BOD﹣S△BOD)进行计算;(3)连结CD,如图2,由43ABAC=可设AB=4x,AC=3x,设BF=y,由BD CD=得到CD=BD=23△BFD∽△CDA,得到xy=4,再由△FDB∽△FAD,得到16﹣4y=xy,则16﹣4y=4,然后解方程即可得到BF=3.【详解】(1)连结OD,如图1,∵AD平分∠BAC交⊙O于D,∴∠BAD=∠CAD,∴BD CD=,∴OD⊥BC,∵BC∥EF,∴OD⊥DF,∴DF为⊙O的切线;(2)连结OB,连结OD交BC于P,作BH⊥DF于H,如图1,∵∠BAC=60°,AD平分∠BAC,∴∠BAD=30°,∴∠BOD=2∠BAD=60°,∴△OBD为等边三角形,∴∠ODB=60°,OB=BD=∴∠BDF=30°,∵BC∥DF,∴∠DBP=30°,在Rt△DBP中,PD=12,在Rt△DEP中,∵,,∴=2,∵OP⊥BC,∴BP=CP=3,∴CE=3﹣2=1,易证得△BDE∽△ACE,∴AE:BE=CE:DE,即AE:5=1,∴,∵BE∥DF,∴△ABE∽△AFD,∴BE AEDF AD=,即5DF=,解得DF=12,在Rt△BDH中,BH=12S阴影部分=S△BDF﹣S弓形BD=S△BDF﹣(S扇形BOD﹣S△BOD)=2216023604π⨯⨯+⨯=2π;(3)连结CD,如图2,由43ABAC=可设AB=4x,AC=3x,设BF=y,∵BD CD=,∴CD=BD=∵∠F=∠ABC=∠ADC,∵∠FDB=∠DBC=∠DAC,∴△BFD∽△CDA,∴BD BFAC CD==xy=4,∵∠FDB=∠DBC=∠DAC=∠FAD,而∠DFB=∠AFD,∴△FDB∽△FAD,∴DF BFAF DF=,即848y yy x y-=+-,整理得16﹣4y=xy,∴16﹣4y=4,解得y=3,即BF的长为3.考点:1.圆的综合题;2.相似三角形的判定与性质;3.切线的判定与性质;4.综合题;5.压轴题.22.(1)A点坐标为(﹣4,1),C点坐标为(﹣1,1);(2)见解析;(3)102π.【解析】【分析】(1)利用第二象限点的坐标特征写出A,C两点的坐标;(2)利用关于原点对称的点的坐标特征写出A1、B1、C1的坐标,然后描点即可;(3)利用网格特点和旋转的性质画出点A、B、C的对应点A2、B2、C2,然后描点得到△A2B2C2,再利用弧长公式计算点C旋转至C2经过的路径长.【详解】解:(1)A点坐标为(﹣4,1),C点坐标为(﹣1,1);(2)如图,△A1B1C1为所作;(3)如图,△A2B2C2为所作,OC2213+10,点C旋转至C2经过的路径长=9010180π⋅=102π.【点睛】本题考查了作图﹣旋转变换:根据旋转的性质可知,对应角都相等都等于旋转角,对应线段也相等,由此可以通过作相等的角,在角的边上截取相等的线段的方法,找到对应点,顺次连接得出旋转后的图形.也考查了弧长公式.23.(1该档次蛋糕每件利润为18元;(2)该烘焙店生产的是四档次的产品.【解析】【分析】(1)依题意可求出产品质量在第五档次的每件的利润.(2)设烘焙店生产的是第x档次的产品,根据单件利润×销售数量=总利润,即可得出关于x的一元二次方程,解之即可得出结论.【详解】(1)10+2×(5-1)=18(元).答:该档次蛋糕每件利润为18元.(2)设烘焙店生产的是第x档次的产品,根据题意得:[10+2(x-1)]×[76-4(x-1)]=1024,整理得:x2﹣16x+48=0,解得:x1=4,x2=12(不合题意,舍去).答:该烘焙店生产的是四档次的产品.【点睛】本题考查了一元二次方程的应用,解题的关键是:(1)根据数量关系,列式计算;(2)根据单件利润×销售数量=总利润,列出关于x的一元二次方程.24.(1)详见解析;(2)存在,;(3)当t=2或14s时,以D、E、B为顶点的三角形是直角三角形.【解析】试题分析:(1)由旋转的性质结合△ABC是等边三角形可得∠DCB=60°,CD=CE,从而可得△CDE 是等边三角形;(2)由(1)可知△CDE是等边三角形,由此可得DE=CD,因此当CD⊥AB时,CD最短,则DE最短,结合△ABC是等边三角形,AC=4即可求得此时DE=CD=(3)由题意需分0≤t<6,6<t<10和t>10三种情况讨论,①当0≤t<6时,由旋转可知,∠ABE=60°,∠BDE<60°,由此可知:此时若△DBE是直角三角形,则∠BED=90°;②当6<t<10s时,由性质的性质可知∠DBE=120°>90°,由此可知:此时△DBE不可能是直角三角形;③当t>10s时,由旋转的性质可知,∠DBE=60°,结合∠CDE=60°可得∠BDE=∠CDE+∠BDC=60°+∠BDC>60°,由此可得∠BED<60°,由此可知此时若△BDE 是直角三角形,则只能是∠BDE=90°;这样结合已知条件即可分情况求出对应的t的值了.试题解析:(1)∵将△ACD绕点C逆时针方向旋转60°得到△BCE,∴∠DCE=60°,DC=EC,∴△CDE是等边三角形;(2)存在,当6<t<10时,由(1)知,△CDE是等边三角形,∴DE=CD,由垂线段最短可知,当CD⊥AB时,CD最小,此时∠ADC=90°,又∵∠ACD=60°,∴∠ACD=30°,∴ AD=12AC=2,∴ CD=22224223AC AD-=-=,∴ DE=23(cm);(3)存在,理由如下:①当0s≤t<6s时,由旋转可知,∠ABE=60°,∠BDE<60°,∴此时若△DBE是直角三角形,则∠BED=90°,由(1)可知,△CDE是等边三角形,∴∠DEC=60°,∴∠CEB=∠BED-∠DEC=30°,∴∠CDA=∠CEB=30°,∵∠CAB=60°,∴∠ACD=∠ADC=30°,∴DA=CA=4,∴OD=OA﹣DA=6﹣4=2,∴t=2÷1=2(s);②当6s<t<10s时,由性质的性质可知∠DBE=120°>90°,∴此时△DBE不可能是直角三角形;③当t>10s时,由旋转的性质可知,∠DBE=60°,又由(1)知∠CDE=60°,∴∠BDE=∠CDE+∠BDC=60°+∠BDC,而∠BDC>0°,∴∠BDE>60°,∴只能∠BDE=90°,从而∠BCD=30°,∴BD=BC=4,∴OD=14cm,∴t=14÷1=14(s);综上所述:当t=2s或14s时,以D、E、B为顶点的三角形是直角三角形.点睛:(1)解第2小题的关键是:抓住点D在运动过程中,△DBE是等边三角形这一点得到DE=CD,从而可知当CD⊥AB时,CD最短,则DE最短,由此即可由已知条件解得DE的最小值;(2)解第3小题的关键是:根据点D的不同位置分为三段时间,结合已知条件首先分析出在每个时间段内△BDE中哪个角能够是直角,然后再结合已知条件进行解答即可求得对应的t的值了.25.(1)隧道打通后从A 到B 的总路程是(434)+公里;(2)隧道打通后与打通前相比,从A 地到B 地的路程约缩短2.73公里.【解析】【分析】(1)过点C 作CD ⊥AB 于点D ,利用锐角三角函数的定义求出CD 及AD 的长,进而可得出结论.(2)由坡度可以得出A ∠的度数,从而得出AC 的长,根据AC CB AB +-即可得出缩短的距离.【详解】(1)作CD AB ⊥于点D ,在Rt BCD ∆中,∵45CBA ∠=︒,42BC =, ∴4CD BD ==.在Rt ACD ∆中,∵1:3CD i AD==, ∴343AD CD ==,∴()434AB =+公里.答:隧道打通后从A 到B 的总路程是()434+公里.(2)在Rt ACD ∆中,∵3CD i AD==, ∴30A ∠=︒,∴2248AC CD ==⨯=,∴842AC CB +=+∵434AB =,∴842434 2.73AC CB AB +-=+≈(公里).答:隧道打通后与打通前相比,从A 地到B 地的路程约缩短2.73公里.【点睛】本题考查的是解直角三角形的应用-坡度问题,解题的关键是学会添加常用辅助线,构造直角三角形解决问题,需要熟记坡度和锐角三角函数的定义.。
2020年河北省中考数学试题及参考答案(word解析版)
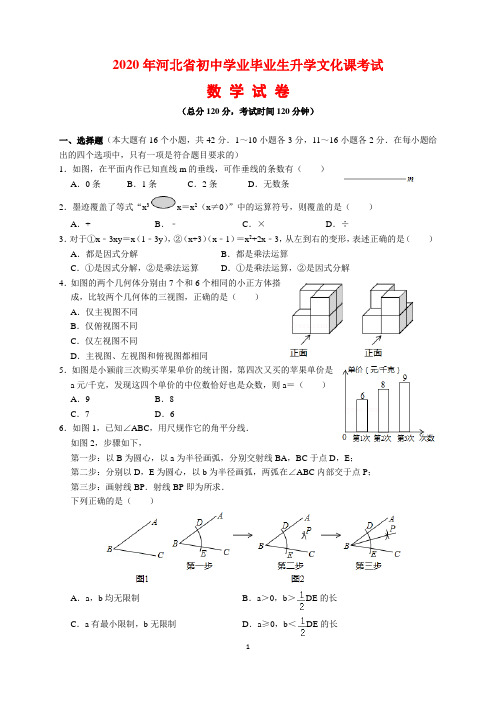
2020年河北省初中学业毕业生升学文化课考试数学试卷(总分120分,考试时间120分钟)一、选择题(本大题有16个小题,共42分.1~10小题各3分,11~16小题各2分.在每小题给出的四个选项中,只有一项是符合题目要求的)1.如图,在平面内作已知直线m的垂线,可作垂线的条数有()A.0条B.1条C.2条D.无数条2.墨迹覆盖了等式“x3x=x2(x≠0)”中的运算符号,则覆盖的是()A.+ B.﹣C.×D.÷3.对于①x﹣3xy=x(1﹣3y),②(x+3)(x﹣1)=x2+2x﹣3,从左到右的变形,表述正确的是()A.都是因式分解B.都是乘法运算C.①是因式分解,②是乘法运算D.①是乘法运算,②是因式分解4.如图的两个几何体分别由7个和6个相同的小正方体搭成,比较两个几何体的三视图,正确的是()A.仅主视图不同B.仅俯视图不同C.仅左视图不同D.主视图、左视图和俯视图都相同5.如图是小颖前三次购买苹果单价的统计图,第四次又买的苹果单价是a元/千克,发现这四个单价的中位数恰好也是众数,则a=()A.9 B.8C.7 D.66.如图1,已知∠ABC,用尺规作它的角平分线.如图2,步骤如下,第一步:以B为圆心,以a为半径画弧,分别交射线BA,BC于点D,E;第二步:分别以D,E为圆心,以b为半径画弧,两弧在∠ABC内部交于点P;第三步:画射线BP.射线BP即为所求.下列正确的是()A.a,b均无限制B.a>0,b>DE的长C.a有最小限制,b无限制D.a≥0,b<DE的长7.若a≠b,则下列分式化简正确的是()A.=B.=C.=D.=8.在如图所示的网格中,以点O为位似中心,四边形ABCD的位似图形是()A.四边形NPMQ B.四边形NPMRC.四边形NHMQ D.四边形NHMR9.若=8×10×12,则k=()A.12 B.10 C.8 D.610.如图,将△ABC绕边AC的中点O顺时针旋转180°.嘉淇发现,旋转后的△CDA与△ABC 构成平行四边形,并推理如下:小明为保证嘉淇的推理更严谨,想在方框中“∵CB=AD,”和“∴四边形…”之间作补充,下列正确的是()A.嘉淇推理严谨,不必补充B.应补充:且AB=CDC.应补充:且AB∥CD D.应补充:且OA=OC11.若k为正整数,则=()A.k2k B.k2k+1C.2k k D.k2+k12.如图,从笔直的公路l旁一点P出发,向西走6km到达l;从P出发向北走6km也到达l.下列说法错误的是()A.从点P向北偏西45°走3km到达lB.公路l的走向是南偏西45°C.公路l的走向是北偏东45°D.从点P向北走3km后,再向西走3km到达l13.已知光速为300000千米/秒,光经过t秒(1≤t≤10)传播的距离用科学记数法表示为a×10n 千米,则n可能为()A.5 B.6 C.5或6 D.5或6或714.有一题目:“已知:点O为△ABC的外心,∠BOC=130°,求∠A.”嘉嘉的解答为:画△ABC 以及它的外接圆O,连接OB,OC.如图,由∠BOC=2∠A=130°,得∠A=65°.而淇淇说:“嘉嘉考虑的不周全,∠A还应有另一个不同的值.”下列判断正确的是()A.淇淇说的对,且∠A的另一个值是115°B.淇淇说的不对,∠A就得65°C.嘉嘉求的结果不对,∠A应得50°D.两人都不对,∠A应有3个不同值15.如图,现要在抛物线y=x(4﹣x)上找点P(a,b),针对b的不同取值,所找点P的个数,三人的说法如下,甲:若b=5,则点P的个数为0;乙:若b=4,则点P的个数为1;丙:若b=3,则点P的个数为1.下列判断正确的是()A.乙错,丙对B.甲和乙都错C.乙对,丙错D.甲错,丙对16.如图是用三块正方形纸片以顶点相连的方式设计的“毕达哥拉斯”图案.现有五种正方形纸片,面积分别是1,2,3,4,5,选取其中三块(可重复选取)按图的方式组成图案,使所围成的三角形是面积最大的直角三角形,则选取的三块纸片的面积分别是()A.1,4,5 B.2,3,5C.3,4,5 D.2,2,4二、填空题(本大题有3个小题,共12分.17~18小题各3分;19小题有3个空,每空2分)17.已知:﹣=a﹣=b,则ab=.18.正六边形的一个内角是正n边形一个外角的4倍,则n=.19.如图是8个台阶的示意图,每个台阶的高和宽分别是1和2,每个台阶凸出的角的顶点记作T m(m为1~8的整数).函数y=(x<0)的图象为曲线L.(1)若L过点T1,则k=;(2)若L过点T4,则它必定还过另一点T m,则m=;(3)若曲线L使得T1~T8这些点分布在它的两侧,每侧各4个点,则k的整数值有个.三、解答题(本大题有7个小题,共66分.解答应写出文字说明、证明过程或演算步骤)20.(本小题满分8分)已知两个有理数:﹣9和5.(1)计算:;(2)若再添一个负整数m,且﹣9,5与m这三个数的平均数仍小于m,求m的值.21.(本小题满分8分)有一电脑程序:每按一次按键,屏幕的A 区就会自动加上a 2,同时B 区就会自动减去3a ,且均显示化简后的结果.已知A ,B 两区初始显示的分别是25和﹣16,如图.如,第一次按键后,A ,B 两区分别显示:(1)从初始状态按2次后,分别求A ,B 两区显示的结果;(2)从初始状态按4次后,计算A ,B 两区代数式的和,请判断这个和能为负数吗?说明理由. 22.(本小题满分9分)如图,点O 为AB 中点,分别延长OA 到点C ,OB 到点D ,使OC =OD .以点O 为圆心,分别以OA ,OC 为半径在CD 上方作两个半圆.点P 为小半圆上任一点(不与点A ,B 重合),连接OP 并延长交大半圆于点E ,连接AE ,CP . (1)①求证:△AOE ≌△POC ;②写出∠l ,∠2和∠C 三者间的数量关系,并说明理由.(2)若OC =2OA =2,当∠C 最大时,直接指出CP 与小半圆的位置关系,并求此时S 扇形EOD (答案保留π).23.(本小题满分9分)用承重指数w 衡量水平放置的长方体木板的最大承重量.实验室有一些同材质同长同宽而厚度不一的木板,实验发现:木板承重指数W 与木板厚度x (厘米)的平方成正比,当x =3时,W =3.(1)求W 与x 的函数关系式.(2)如图,选一块厚度为6厘米的木板,把它分割成与原来同长同宽但薄厚不同的两块板(不计分割损耗).设薄板的厚度为x (厘米),Q =W 厚﹣W 薄. ①求Q 与x 的函数关系式;②x 为何值时,Q 是W 薄的3倍?[注:(1)及(2)中的①不必写x 的取值范围] 24.(本小题满分10分)表格中的两组对应值满足一次函数y =kx+b ,现画出了它的图象为直线l ,如图.而某同学为观察k ,b 对图象的影响,将上面函数中的k 与b 交换位置后得另一个一次函数,设其图象为直线l'.x ﹣1 0 y﹣21(1)求直线l的解析式;(2)请在图上画出直线l'(不要求列表计算),并求直线l'被直线l和y轴所截线段的长;(3)设直线y=a与直线l,l′及y轴有三个不同的交点,且其中两点关于第三点对称,直接写出a的值.25.(本小题满分10分)如图,甲、乙两人(看成点)分别在数轴﹣3和5的位置上,沿数轴做移动游戏.每次移动游戏规则:裁判先捂住一枚硬币,再让两人猜向上一面是正是反,而后根据所猜结果进行移动.①若都对或都错,则甲向东移动1个单位,同时乙向西移动1个单位;②若甲对乙错,则甲向东移动4个单位,同时乙向东移动2个单位;③若甲错乙对,则甲向西移动2个单位,同时乙向西移动4个单位.(1)经过第一次移动游戏,求甲的位置停留在正半轴上的概率P;(2)从如图的位置开始,若完成了10次移动游戏,发现甲、乙每次所猜结果均为一对一错.设乙猜对n次,且他最终停留的位置对应的数为m,试用含n的代数式表示m,并求该位置距离原点O最近时n的值;(3)从如图的位置开始,若进行了k次移动游戏后,甲与乙的位置相距2个单位,直接写出k 的值.26.(本小题满分12分)如图1和图2,在△ABC中,AB=AC,BC=8,tanC=.点K在AC边上,点M,N分别在AB,BC上,且AM=CN=2.点P从点M出发沿折线MB﹣BN匀速移动,到达点N时停止;而点Q在AC边上随P移动,且始终保持∠APQ=∠B.(1)当点P在BC上时,求点P与点A的最短距离;(2)若点P在MB上,且PQ将△ABC的面积分成上下4:5两部分时,求MP的长;(3)设点P移动的路程为x,当0≤x≤3及3≤x≤9时,分别求点P到直线AC的距离(用含x 的式子表示);(4)在点P处设计并安装一扫描器,按定角∠APQ扫描△APQ区域(含边界),扫描器随点P 从M到B再到N共用时36秒.若AK=,请直接写出点K被扫描到的总时长.答案与解析一、选择题(本大题有16个小题,共42分.1~10小题各3分,11~16小题各2分.在每小题给出的四个选项中,只有一项是符合题目要求的)1.如图,在平面内作已知直线m的垂线,可作垂线的条数有()A.0条B.1条C.2条D.无数条【知识考点】垂线.【专题】线段、角、相交线与平行线;推理能力.【思路分析】根据垂直、垂线的定义,可直接得结论.【解答过程】解:在平面内,与已知直线垂直的直线有无数条,所以作已知直线的垂线,可作无数条.故选:D.【总结归纳】本题考查了垂直和垂线的定义.掌握垂线的定义是解决本题的关键.2.墨迹覆盖了等式“x3x=x2(x≠0)”中的运算符号,则覆盖的是()A.+ B.﹣C.×D.÷【知识考点】同底数幂的除法.【专题】整式;符号意识.【思路分析】直接利用同底数幂的除法运算法则计算得出答案.【解答过程】解:∵x3x=x2(x≠0),∴覆盖的是:÷.故选:D.【总结归纳】此题主要考查了同底数幂的除法运算,正确掌握相关运算法则是解题关键.3.对于①x﹣3xy=x(1﹣3y),②(x+3)(x﹣1)=x2+2x﹣3,从左到右的变形,表述正确的是()A.都是因式分解B.都是乘法运算C.①是因式分解,②是乘法运算D.①是乘法运算,②是因式分解【知识考点】多项式乘多项式;因式分解的意义;因式分解﹣提公因式法.【专题】整式;运算能力.【思路分析】根据因式分解的定义(把一个多项式化成几个整式积的形式,叫因式分解,也叫分解因式)判断即可.【解答过程】解:①x﹣3xy=x(1﹣3y),从左到右的变形是因式分解;②(x+3)(x﹣1)=x2+2x﹣3,从左到右的变形是整式的乘法,不是因式分解;所以①是因式分解,②是乘法运算.故选:C.【总结归纳】此题考查了因式分解.解题的关键是掌握因式分解的定义:把一个多项式化为几个整式的积的形式,这种变形叫做把这个多项式因式分解.4.如图的两个几何体分别由7个和6个相同的小正方体搭成,比较两个几何体的三视图,正确的是()A.仅主视图不同B.仅俯视图不同C.仅左视图不同D.主视图、左视图和俯视图都相同【知识考点】简单组合体的三视图.【专题】投影与视图;几何直观.【思路分析】根据主视图是从物体的正面看得到的视图,俯视图是从上面看得到的图形,左视图是左边看得到的图形,可得答案.【解答过程】解:从正面看,两个几何体均为第一层和第二层都是两个小正方形,故主视图相同;从左面看,两个几何体均为第一层和第二层都是两个小正方形,故左视图相同;从上面看,两个几何体均为第一层和第二层都是两个小正方形,故俯视图相同.故选:D.【总结归纳】本题考查了简单组合体的三视图,利用三视图的意义是解题关键.5.如图是小颖前三次购买苹果单价的统计图,第四次又买的苹果单价是a元/千克,发现这四个单价的中位数恰好也是众数,则a=()A.9 B.8C.7 D.6【知识考点】条形统计图;中位数;众数.【专题】统计与概率;数据分析观念.【思路分析】根据统计图中的数据和题意,可以得到a的值,本题得以解决.【解答过程】解:由统计图可知,前三次的中位数是8,∵第四次又买的苹果单价是a元/千克,这四个单价的中位数恰好也是众数,∴a=8,故选:B.【总结归纳】本题考查条形统计图、中位数、众数,解答本题的关键是明确题意,利用数形结合的思想解答.6.如图1,已知∠ABC,用尺规作它的角平分线.如图2,步骤如下,第一步:以B为圆心,以a为半径画弧,分别交射线BA,BC于点D,E;第二步:分别以D,E为圆心,以b为半径画弧,两弧在∠ABC内部交于点P;第三步:画射线BP.射线BP即为所求.下列正确的是()A.a,b均无限制B.a>0,b>DE的长C.a有最小限制,b无限制D.a≥0,b<DE的长【知识考点】作图—基本作图.【专题】作图题;应用意识.【思路分析】根据角平分线的画法判断即可.【解答过程】解:以B为圆心画弧时,半径a必须大于0,分别以D,E为圆心,以b为半径画弧时,b必须大于DE,否则没有交点,故选:B.【总结归纳】本题考查作图﹣基本作图,解题的关键是熟练掌握五种基本作图,属于中考常考题型.7.若a≠b,则下列分式化简正确的是()A.=B.=C.=D.=【知识考点】分式的基本性质.【专题】分式;运算能力.【思路分析】根据a≠b,可以判断各个选项中的式子是否正确,从而可以解答本题.【解答过程】解:∵a≠b,∴,故选项A错误;,故选项B错误;,故选项C错误;,故选项D正确;故选:D.【总结归纳】本题考查分式的基本性质:分式的分子与分母同乘(或除以)一个不等于0的整式,分式的值不变.熟练掌握分式的基本性质是解题的关键.8.在如图所示的网格中,以点O为位似中心,四边形ABCD的位似图形是()A.四边形NPMQ B.四边形NPMRC.四边形NHMQ D.四边形NHMR【知识考点】位似变换.【专题】平移、旋转与对称;推理能力.【思路分析】由以点O为位似中心,确定出点C对应点M,设网格中每个小方格的边长为1,则OC=,OM=2,OD=,OB=,OA=,OR=,OQ=2,OP=2,OH=3,ON=2,由=2,得点D对应点Q,点B对应点P,点A对应点N,即可得出结果.【解答过程】解:∵以点O为位似中心,∴点C对应点M,设网格中每个小方格的边长为1,则OC==,OM==2,OD=,OB==,OA==,OR==,OQ=2,OP==2,OH==3,ON==2,∵==2,∴点D对应点Q,点B对应点P,点A对应点N,∴以点O为位似中心,四边形ABCD的位似图形是四边形NPMQ,故选:A.【总结归纳】本题考查了位似变换、等腰直角三角形的性质、勾股定理等知识;熟练掌握位似中心,找出点C对应点M是解题的关键.9.若=8×10×12,则k=()A.12 B.10 C.8 D.6【知识考点】平方差公式;因式分解﹣运用公式法.【专题】整式;分式方程及应用;运算能力.【思路分析】根据平方差公式和分式方程的解法,即可得到k的值.【解答过程】解:方程两边都乘以k,得(92﹣1)(112﹣1)=8×10×12k,∴(9+1)(9﹣1)(11+1)(11﹣1)=8×10×12k,∴80×120=8×10×12k,∴k=10.经检验k=10是原方程的解.故选:B.【总结归纳】此题考查了平方差公式和解分式方程,熟练掌握平方差公式和解分式方程的方法是解本题的关键.10.如图,将△ABC绕边AC的中点O顺时针旋转180°.嘉淇发现,旋转后的△CDA与△ABC 构成平行四边形,并推理如下:小明为保证嘉淇的推理更严谨,想在方框中“∵CB=AD,”和“∴四边形…”之间作补充,下列正确的是()A.嘉淇推理严谨,不必补充B.应补充:且AB=CDC.应补充:且AB∥CD D.应补充:且OA=OC【知识考点】平行四边形的判定;旋转的性质.【专题】多边形与平行四边形;平移、旋转与对称;应用意识.【思路分析】根据两组对边分别相等的四边形是平行四边形判定即可.【解答过程】解:∵CB=AD,AB=CD,∴四边形ABCD是平行四边形,故选:B.【总结归纳】本题考查平行四边形的判定,旋转变换等知识,解题的关键是理解题意,灵活运用所学知识解决问题,属于中考常考题型.11.若k为正整数,则=()A.k2k B.k2k+1C.2k k D.k2+k【知识考点】幂的乘方与积的乘方.【专题】整式;运算能力.【思路分析】根据幂的乘方的运算法则:底数不变,指数相乘解答即可.【解答过程】解:=((k•k)k=(k2)k=k2k,故选:A.【总结归纳】本题考查了幂的乘方.解题的关键掌握幂的乘方的运算法则:底数不变,指数相乘.12.如图,从笔直的公路l旁一点P出发,向西走6km到达l;从P出发向北走6km也到达l.下列说法错误的是()A.从点P向北偏西45°走3km到达lB.公路l的走向是南偏西45°C.公路l的走向是北偏东45°D.从点P向北走3km后,再向西走3km到达l【知识考点】方向角;勾股定理的应用.【专题】等腰三角形与直角三角形;几何直观;应用意识.【思路分析】先作出图形,根据勾股定理和等腰直角三角形的性质即可求解.【解答过程】解:如图,由题意可得△PAB是腰长6km的等腰直角三角形,则AB=6km,则PC=3km,则从点P向北偏西45°走3km到达l,选项A错误;则公路l的走向是南偏西45°或北偏东45°,选项B,C正确;则从点P向北走3km后,再向西走3km到达l,选项D正确.故选:A.【总结归纳】本题考查的是勾股定理的应用,关键是从题中抽象出勾股定理这一数学模型,画出准确的示意图.领会数形结合的思想的应用.13.已知光速为300000千米/秒,光经过t秒(1≤t≤10)传播的距离用科学记数法表示为a×10n 千米,则n可能为()A.5 B.6 C.5或6 D.5或6或7【知识考点】科学记数法—表示较大的数.【专题】实数;数感.【思路分析】科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数.确定n的值时,要看把原数变成a时,小数点移动了多少位,n的绝对值与小数点移动的位数相同.【解答过程】解:当t=1时,光传播的距离为1×300000=300000=3×105(千米),则n=5;当t=10时,光传播的距离为10×300000=3000000=3×106(千米),则n=6.因为1≤t≤10,所以n可能为5或6,故选:C.【总结归纳】此题考查科学记数法的表示方法.科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数,表示时关键要正确确定a的值以及n的值.14.有一题目:“已知:点O为△ABC的外心,∠BOC=130°,求∠A.”嘉嘉的解答为:画△ABC 以及它的外接圆O,连接OB,OC.如图,由∠BOC=2∠A=130°,得∠A=65°.而淇淇说:“嘉嘉考虑的不周全,∠A还应有另一个不同的值.”下列判断正确的是()A.淇淇说的对,且∠A的另一个值是115°B.淇淇说的不对,∠A就得65°C.嘉嘉求的结果不对,∠A应得50°D.两人都不对,∠A应有3个不同值【知识考点】三角形的外接圆与外心.【专题】圆的有关概念及性质;几何直观.【思路分析】直接利用圆内接四边形的性质结合圆周角定理得出答案.【解答过程】解:如图所示:∠A还应有另一个不同的值∠A′与∠A互补.故∠A′=180°﹣65°=115°.故选:A.【总结归纳】此题主要考查了三角形的外接圆,正确分类讨论是解题关键.15.如图,现要在抛物线y=x(4﹣x)上找点P(a,b),针对b的不同取值,所找点P的个数,三人的说法如下,甲:若b=5,则点P的个数为0;乙:若b=4,则点P的个数为1;丙:若b=3,则点P的个数为1.下列判断正确的是()A.乙错,丙对B.甲和乙都错C.乙对,丙错D.甲错,丙对【知识考点】二次函数图象上点的坐标特征.【专题】二次函数图象及其性质;推理能力.【思路分析】求出抛物线的顶点坐标为(2,4),由二次函数的性质对甲、乙、丙三人的说法分别进行判断,即可得出结论.【解答过程】解:y=x(4﹣x)=﹣x2+4x=﹣(x﹣2)2+4,∴抛物线的顶点坐标为(2,4),∴在抛物线上的点P的纵坐标最大为4,∴甲、乙的说法正确;若b=3,则抛物线上纵坐标为3的点有2个,∴丙的说法不正确;故选:C.【总结归纳】本题考查了二次函数图象上点的坐标特征、抛物线的顶点坐标等知识;熟练掌握二次函数图象上点的坐标特征是解题的关键.16.如图是用三块正方形纸片以顶点相连的方式设计的“毕达哥拉斯”图案.现有五种正方形纸片,面积分别是1,2,3,4,5,选取其中三块(可重复选取)按图的方式组成图案,使所围成的三角形是面积最大的直角三角形,则选取的三块纸片的面积分别是()A.1,4,5 B.2,3,5C.3,4,5 D.2,2,4【知识考点】勾股定理的逆定理.【专题】等腰三角形与直角三角形;应用意识.【思路分析】根据题意可知,三块三角形的面积中,两个较小的面积之和等于最大的面积,再根据三角形的面积,分别计算出各个选项中围成的直角三角形的面积,比较大小,即可解答本题.【解答过程】解:当选取的三块纸片的面积分别是1,4,5时,围成的直角三角形的面积是=,当选取的三块纸片的面积分别是2,3,5时,围成的直角三角形的面积是=;当选取的三块纸片的面积分别是3,4,5时,围成的三角形不是直角三角形;当选取的三块纸片的面积分别是2,2,4时,围成的直角三角形的面积是=,∵,∴所围成的三角形是面积最大的直角三角形,则选取的三块纸片的面积分别是2,3,5,故选:B.【总结归纳】本题考查勾股定理的逆定理,解答本题的关键是明确题意,利用勾股定理的逆定理解答.二、填空题(本大题有3个小题,共12分.17~18小题各3分;19小题有3个空,每空2分)17.已知:﹣=a﹣=b,则ab=.【知识考点】二次根式的加减法.【专题】二次根式;运算能力.【思路分析】直接化简二次根式进而得出a,b的值求出答案.【解答过程】解:原式=3﹣=a﹣=b,故a=3,b=2,则ab=6.故答案为:6.【总结归纳】此题主要考查了二次根式的加减,正确化简二次根式是解题关键.18.正六边形的一个内角是正n边形一个外角的4倍,则n=.【知识考点】多边形内角与外角.【专题】多边形与平行四边形;正多边形与圆;运算能力.【思路分析】根据多边形的内角和公式求出正六边形的一个内角等于120°,再根据多边形的外角和是360°即可解答.【解答过程】解:正六边形的一个内角为:,∵正六边形的一个内角是正n边形一个外角的4倍,∴正n边形一个外角为:120°÷4=30°,∴n=360°÷30°=12.故答案为:12.【总结归纳】本题主要考查了多边形的外角和定理,理解多边形外角和中外角的个数,以及正多边形的边数之间的关系,是解题关键.19.如图是8个台阶的示意图,每个台阶的高和宽分别是1和2,每个台阶凸出的角的顶点记作T m(m为1~8的整数).函数y=(x<0)的图象为曲线L.(1)若L过点T1,则k=;(2)若L过点T4,则它必定还过另一点T m,则m=;(3)若曲线L使得T1~T8这些点分布在它的两侧,每侧各4个点,则k的整数值有个.【知识考点】反比例函数的应用.【专题】反比例函数及其应用;应用意识.【思路分析】(1)由题意可求T1~T8这些点的坐标,将点T1的坐标代入解析式可求解;(2)将点T4的坐标代入解析式可求k的值,将点T5代入,可求解;(3)由曲线L使得T1~T8这些点分布在它的两侧,每侧各4个点,可得T1,T2,T7,T8与T3,T4,T5,T6在曲线L的两侧,即可求解.【解答过程】解:(1)∵每个台阶的高和宽分别是1和2,∴T1(﹣16,1),T2(﹣14,2),T3(﹣12,3),T4(﹣10,4),T5(﹣8,5),T6(﹣6,6),T7(﹣4,7),T8(﹣2,8),∵L过点T1,∴k=﹣16×1=﹣16,故答案为:﹣16;(2)∵L过点T4,∴k=﹣10×4=﹣40,∴反比例函数解析式为:y=﹣,当x=﹣8时,y=5,∴T5在反比例函数图象上,∴m=5,故答案为:5;(3)若曲线L过点T1(﹣16,1),T8(﹣2,8)时,k=﹣16,若曲线L过点T2(﹣14,2),T7(﹣4,7)时,k=﹣14×2=﹣28,若曲线L过点T3(﹣12,3),T5(﹣8,5)时,k=﹣12×3=﹣36,若曲线L过点T4(﹣10,4),T5(﹣8,5)时,k=﹣40,∵曲线L使得T1~T8这些点分布在它的两侧,每侧各4个点,∴﹣36<k<﹣28,∴整数k=﹣35,﹣34,﹣33,﹣32,﹣31,﹣30,﹣29共7个,∴答案为:7.【总结归纳】本题考查了反比例函数的应用,求出各点的坐标是本题的关键.三、解答题(本大题有7个小题,共66分.解答应写出文字说明、证明过程或演算步骤)20.(本小题满分8分)已知两个有理数:﹣9和5.(1)计算:;(2)若再添一个负整数m,且﹣9,5与m这三个数的平均数仍小于m,求m的值.【知识考点】解一元一次不等式.【专题】实数;一元一次不等式(组)及应用;运算能力.【思路分析】(1)根据有理数的加法、除法法则计算即可;(2)根据题意列不等式,解不等式,由m是负整数即可求出m的值.【解答过程】解:(1)==﹣2;(2)根据题意得,<m,∴﹣4+m<3m,∴m﹣3m<4,∴﹣2m<4,∴m>﹣2,∵m是负整数,∴m=﹣1.【总结归纳】此题考查了有理数的运算,解不等式.熟练掌握有理数的运算法则,解不等式的方法是解本题的关键.21.(本小题满分8分)有一电脑程序:每按一次按键,屏幕的A区就会自动加上a2,同时B区就会自动减去3a,且均显示化简后的结果.已知A,B两区初始显示的分别是25和﹣16,如图.如,第一次按键后,A,B两区分别显示:(1)从初始状态按2次后,分别求A,B两区显示的结果;(2)从初始状态按4次后,计算A,B两区代数式的和,请判断这个和能为负数吗?说明理由.【知识考点】非负数的性质:偶次方;整式的加减;配方法的应用.【专题】整式;运算能力.【思路分析】(1)根据题意列出代数式即可;(2)根据题意得到25+4a2+(﹣16﹣12a),根据整式加减的法则计算,然后配方,根据非负数的性质即可得到结论.【解答过程】解:(1)A区显示的结果为:25+2a2,B区显示的结果为:﹣16﹣6a;(2)这个和不能为负数,理由:根据题意得,25+4a2+(﹣16﹣12a)=25+4a2﹣16﹣12a=4a2﹣12a+9;∵(2a﹣3)2≥0,∴这个和不能为负数.【总结归纳】本题考查了配方法的应用,非负数的性质,整式的加减,正确的理解题意是解题的关键.22.(本小题满分9分)如图,点O为AB中点,分别延长OA到点C,OB到点D,使OC=OD.以点O为圆心,分别以OA,OC为半径在CD上方作两个半圆.点P为小半圆上任一点(不与点A,B重合),连接OP并延长交大半圆于点E,连接AE,CP.(1)①求证:△AOE≌△POC;②写出∠l,∠2和∠C三者间的数量关系,并说明理由.(2)若OC=2OA=2,当∠C最大时,直接指出CP与小半圆的位置关系,并求此时S扇形EOD(答案保留π).【知识考点】全等三角形的判定与性质;直线与圆的位置关系;扇形面积的计算.【专题】图形的全等;圆的有关概念及性质;与圆有关的位置关系;与圆有关的计算.【思路分析】(1)①利用公共角相等,根据SAS证明三角形全等便可;②由全等三角形得∠C=∠E,再利用三角形外角性质得结论;(2)当CP与小半圆O相切时,∠C最大,求出∠DOE便可根据扇形的面积公式求得结果.【解答过程】解:(1)①在△AOE和△POC中,,∴△AOE≌△POC(SAS);②∵△AOE≌△POC,∴∠E=∠C,∵∠1+∠E=∠2,∴∠1+∠C=∠2;(2)当∠C最大时,CP与小半圆相切,如图,∵OC=2OA=2,∴OC=2OP,∵CP与小半圆相切,∴∠OPC=90°,∴∠OCP=30°,∴∠DOE=∠OPC+∠OCP=120°,∴.【总结归纳】本题主要考查了圆的切线的性质,全等三角形的判定与性质,三角形的外角性质,直角三角形的性质,扇形的面积计算,关键在于掌握各个定理,灵活运用这些性质解题.23.(本小题满分9分)用承重指数w衡量水平放置的长方体木板的最大承重量.实验室有一些同材质同长同宽而厚度不一的木板,实验发现:木板承重指数W与木板厚度x(厘米)的平方成正比,当x=3时,W=3.(1)求W与x的函数关系式.(2)如图,选一块厚度为6厘米的木板,把它分割成与原来同长同宽但薄厚不同的两块板(不计分割损耗).设薄板的厚度为x(厘米),Q=W厚﹣W薄.①求Q与x的函数关系式;②x为何值时,Q是W薄的3倍?[注:(1)及(2)中的①不必写x的取值范围]【知识考点】二次函数的应用.【专题】二次函数的应用;应用意识.【思路分析】(1)由木板承重指数W与木板厚度x(厘米)的平方成正比,可设W=kx2(k≠0).将x=3时,W=3代入,求出k=,即可得出W与x的函数关系式;(2)①设薄板的厚度为x厘米,则厚板的厚度为(6﹣x)厘米,将(1)中所求的解析式代入Q =W厚﹣W薄,化简即可得到Q与x的函数关系式;②根据Q是W薄的3倍,列出方程﹣4x+12=3×x2,求解即可.【解答过程】解:(1)设W=kx2(k≠0).∵当x=3时,W=3,∴3=9k,解得k=,∴W与x的函数关系式为W=x2;(2)①设薄板的厚度为x厘米,则厚板的厚度为(6﹣x)厘米,∴Q=W厚﹣W薄=(6﹣x)2﹣x2=﹣4x+12,即Q与x的函数关系式为Q=﹣4x+12;②∵Q是W薄的3倍,∴﹣4x+12=3×x2,。
2020年广东省中考数学试题及参考答案(word解析版)

2020年广东省初中学业水平考试数学(满分为120分,考试用时为90分钟)一、选择题(本大题10小题,每小题3分,共30分)在每小题列出的四个选项中,只有一个是正确的.1.9的相反数是()A.﹣9 B.9 C.D.﹣2.一组数据2,4,3,5,2的中位数是()A.5 B.3.5 C.3 D.2.53.在平面直角坐标系中,点(3,2)关于x轴对称的点的坐标为()A.(﹣3,2)B.(﹣2,3)C.(2,﹣3)D.(3,﹣2)4.若一个多边形的内角和是540°,则该多边形的边数为()A.4 B.5 C.6 D.75.若式子在实数范围内有意义,则x的取值范围是()A.x≠2 B.x≥2 C.x≤2 D.x≠﹣26.已知△ABC的周长为16,点D,E,F分别为△ABC三条边的中点,则△DEF的周长为()A.8 B.2C.16 D.47.把函数y=(x﹣1)2+2图象向右平移1个单位长度,平移后图象的函数解析式为()A.y=x2+2 B.y=(x﹣1)2+1 C.y=(x﹣2)2+2 D.y=(x﹣1)2﹣38.不等式组的解集为()A.无解B.x≤1 C.x≥﹣1 D.﹣1≤x≤19.如图,在正方形ABCD中,AB=3,点E,F分别在边AB,CD上,∠EFD=60°.若将四边形EBCF沿EF折叠,点B恰好落在AD边上,则BE的长度为()A.1 B.C.D.210.如图,抛物线y=ax2+bx+c的对称轴是x=1,下列结论:①abc>0;②b2﹣4ac>0;③8a+c<0;④5a+b+2c>0,正确的有()A.4个B.3个C.2个D.1个二、填空题(本大题7小题,每小题4分,共28分)11.分解因式:xy﹣x=.12.如果单项式3x m y与﹣5x3y n是同类项,那么m+n=.13.若+|b+1|=0,则(a+b)2020=.14.已知x=5﹣y,xy=2,计算3x+3y﹣4xy的值为.15.如图,在菱形ABCD中,∠A=30°,取大于AB的长为半径,分别以点A,B为圆心作弧相交于两点,过此两点的直线交AD边于点E(作图痕迹如图所示),连接BE,BD.则∠EBD的度数为.16.如图,从一块半径为1m的圆形铁皮上剪出一个圆周角为120°的扇形ABC,如果将剪下来的扇形围成一个圆锥,则该圆锥的底面圆的半径为m.17.有一架竖直靠在直角墙面的梯子正在下滑,一只猫紧紧盯住位于梯子正中间的老鼠,等待与老鼠距离最小时扑捉.把墙面、梯子、猫和老鼠都理想化为同一平面内的线或点,模型如图,∠ABC=90°,点M,N分别在射线BA,BC上,MN长度始终保持不变,MN=4,E为MN的中点,点D到BA,BC的距离分别为4和2.在此滑动过程中,猫与老鼠的距离DE的最小值为.三、解答题(一)(本大题3小题,每小题6分,共18分)18.(6分)先化简,再求值:(x+y)2+(x+y)(x﹣y)﹣2x2,其中x=,y=.19.(6分)某中学开展主题为“垃圾分类知多少”的调查活动,调查问卷设置了“非常了解”、“比较了解”、“基本了解”、“不太了解”四个等级,要求每名学生选且只能选其中一个等级,随机抽取了120名学生的有效问卷,数据整理如下:等级非常了解比较了解基本了解不太了解人数(人)24 72 18 x (1)求x的值;(2)若该校有学生1800人,请根据抽样调查结果估算该校“非常了解”和“比较了解”垃圾分类知识的学生共有多少人?20.(6分)如图,在△ABC中,点D,E分别是AB、AC边上的点,BD=CE,∠ABE=∠ACD,BE与CD相交于点F.求证:△ABC是等腰三角形.四、解答题(二)(本大题3小题,每小题8分,共24分)21.(8分)已知关于x,y的方程组与的解相同.(1)求a,b的值;(2)若一个三角形的一条边的长为2,另外两条边的长是关于x的方程x2+ax+b=0的解.试判断该三角形的形状,并说明理由.22.(8分)如图1,在四边形ABCD中,AD∥BC,∠DAB=90°,AB是⊙O的直径,CO平分∠BCD.(1)求证:直线CD与⊙O相切;(2)如图2,记(1)中的切点为E,P为优弧上一点,AD=1,BC=2.求tan∠APE的值.23.(8分)某社区拟建A,B两类摊位以搞活“地摊经济”,每个A类摊位的占地面积比每个B类摊位的占地面积多2平方米.建A类摊位每平方米的费用为40元,建B类摊位每平方米的费用为30元.用60平方米建A类摊位的个数恰好是用同样面积建B类摊位个数的.(1)求每个A,B类摊位占地面积各为多少平方米?(2)该社区拟建A,B两类摊位共90个,且B类摊位的数量不少于A类摊位数量的3倍.求建造这90个摊位的最大费用.五、解答题(三)(本大题2小题,每小题10分,共20分)24.(10分)如图,点B是反比例函数y=(x>0)图象上一点,过点B分别向坐标轴作垂线,垂足为A,C.反比例函数y=(x>0)的图象经过OB的中点M,与AB,BC分别相交于点D,E.连接DE并延长交x轴于点F,点G与点O关于点C对称,连接BF,BG.(1)填空:k=;(2)求△BDF的面积;(3)求证:四边形BDFG为平行四边形.25.(10分)如图,抛物线y=x2+bx+c与x轴交于A,B两点,点A,B分别位于原点的左、右两侧,BO=3AO=3,过点B的直线与y轴正半轴和抛物线的交点分别为C,D,BC=CD.(1)求b,c的值;(2)求直线BD的函数解析式;(3)点P在抛物线的对称轴上且在x轴下方,点Q在射线BA上.当△ABD与△BPQ相似时,请直接写出所有满足条件的点Q的坐标.答案与解析一、选择题(本大题10小题,每小题3分,共30分)在每小题列出的四个选项中,只有一个是正确的.1.9的相反数是()A.﹣9 B.9 C.D.﹣【知识考点】相反数.【思路分析】根据相反数的定义即可求解.【解题过程】解:9的相反数是﹣9,故选:A.【总结归纳】此题主要考查相反数的定义,比较简单.2.一组数据2,4,3,5,2的中位数是()A.5 B.3.5 C.3 D.2.5【知识考点】中位数.【思路分析】中位数是指一组数据从小到大排列之后,如果数据的总个数为奇数,则中间的数即为中位数;如果数据的总个数为偶数个,则中间两个数的平均数即为中位数.【解题过程】解:将数据由小到大排列得:2,2,3,4,5,∵数据个数为奇数,最中间的数是3,∴这组数据的中位数是3.故选:C.【总结归纳】本题考查了统计数据中的中位数,明确中位数的计算方法是解题的关键.本题属于基础知识的考查,比较简单.3.在平面直角坐标系中,点(3,2)关于x轴对称的点的坐标为()A.(﹣3,2)B.(﹣2,3)C.(2,﹣3)D.(3,﹣2)【知识考点】关于x轴、y轴对称的点的坐标.【思路分析】根据“关于x轴对称的点,横坐标相同,纵坐标互为相反数”解答即可.【解题过程】解:点(3,2)关于x轴对称的点的坐标为(3,﹣2).故选:D.【总结归纳】本题考查了关于x轴、y轴对称的点的坐标,解决本题的关键是掌握好对称点的坐标规律:(1)关于x轴对称的点,横坐标相同,纵坐标互为相反数;(2)关于y轴对称的点,纵坐标相同,横坐标互为相反数;(3)关于原点对称的点,横坐标与纵坐标都互为相反数.4.若一个多边形的内角和是540°,则该多边形的边数为()A.4 B.5 C.6 D.7【知识考点】多边形内角与外角.【思路分析】根据多边形的内角和公式(n﹣2)•180°列式进行计算即可求解.【解题过程】解:设多边形的边数是n,则(n﹣2)•180°=540°,解得n=5.故选:B.【总结归纳】本题主要考查了多边形的内角和公式,熟记公式是解题的关键.5.若式子在实数范围内有意义,则x的取值范围是()A.x≠2 B.x≥2 C.x≤2 D.x≠﹣2【知识考点】二次根式有意义的条件.【思路分析】根据二次根式中的被开方数是非负数,即可确定二次根式被开方数中字母的取值范围.【解题过程】解:∵在实数范围内有意义,∴2x﹣4≥0,解得:x≥2,∴x的取值范围是:x≥2.故选:B.【总结归纳】此题主要考查了二次根式有意义的条件,即二次根式中的被开方数是非负数.正确把握二次根式的定义是解题关键.6.已知△ABC的周长为16,点D,E,F分别为△ABC三条边的中点,则△DEF的周长为()A.8 B.2C.16 D.4【知识考点】三角形中位线定理.【思路分析】根据中位线定理可得DF=AC,DE=BC,EF=AC,继而结合△ABC的周长为16,可得出△DEF的周长.【解题过程】解:∵D、E、F分别为△ABC三边的中点,∴DE、DF、EF都是△ABC的中位线,∴DF=AC,DE=BC,EF=AC,故△DEF的周长=DE+DF+EF=(BC+AB+AC)=16=8.故选:A.【总结归纳】此题考查了三角形的中位线定理,解答本题的关键是掌握三角形的中位线平行于第三边,并且等于第三边的一半,难度一般.7.把函数y=(x﹣1)2+2图象向右平移1个单位长度,平移后图象的函数解析式为()A.y=x2+2 B.y=(x﹣1)2+1 C.y=(x﹣2)2+2 D.y=(x﹣1)2﹣3【知识考点】二次函数图象与几何变换.【思路分析】先求出y=(x﹣1)2+2的顶点坐标,再根据向右平移横坐标加,求出平移后的二次函数图象顶点坐标,然后利用顶点式解析式写出即可.【解题过程】解:二次函数y=(x﹣1)2+2的图象的顶点坐标为(1,2),∴向右平移1个单位长度后的函数图象的顶点坐标为(2,2),∴所得的图象解析式为y=(x﹣2)2+2.故选:C.【总结归纳】本题主要考查的是函数图象的平移,求出平移后的函数图象的顶点坐标直接代入函数解析式求得平移后的函数解析式.8.不等式组的解集为()A.无解B.x≤1 C.x≥﹣1 D.﹣1≤x≤1【知识考点】解一元一次不等式组.【思路分析】分别求出每一个不等式的解集,根据口诀:同大取大、同小取小、大小小大中间找、大大小小无解了确定不等式组的解集.【解题过程】解:解不等式2﹣3x≥﹣1,得:x≤1,解不等式x﹣1≥﹣2(x+2),得:x≥﹣1,则不等式组的解集为﹣1≤x≤1,故选:D.【总结归纳】本题考查的是解一元一次不等式组,正确求出每一个不等式解集是基础,熟知“同大取大;同小取小;大小小大中间找;大大小小找不到”的原则是解答此题的关键.9.如图,在正方形ABCD中,AB=3,点E,F分别在边AB,CD上,∠EFD=60°.若将四边形EBCF沿EF折叠,点B恰好落在AD边上,则BE的长度为()A.1 B.C.D.2【知识考点】正方形的性质;翻折变换(折叠问题).【思路分析】由正方形的性质得出∠EFD=∠BEF=60°,由折叠的性质得出∠BEF=∠FEB'=60°,BE=B'E,设BE=x,则B'E=x,AE=3﹣x,由直角三角形的性质可得:2(3﹣x)=x,解方程求出x即可得出答案.【解题过程】解:∵四边形ABCD是正方形,∴AB∥CD,∠A=90°,∴∠EFD=∠BEF=60°,∵将四边形EBCF沿EF折叠,点B恰好落在AD边上,∴∠BEF=∠FEB'=60°,BE=B'E,∴∠AEB'=180°﹣∠BEF﹣∠FEB'=60°,∴B'E=2AE,设BE=x,则B'E=x,AE=3﹣x,∴2(3﹣x)=x,解得x=2.故选:D.【总结归纳】本题考查了正方形的性质,折叠的性质,含30°角的直角三角形的性质等知识点,能综合性运用性质进行推理是解此题的关键.10.如图,抛物线y=ax2+bx+c的对称轴是x=1,下列结论:①abc>0;②b2﹣4ac>0;③8a+c<0;④5a+b+2c>0,正确的有()A.4个B.3个C.2个D.1个【知识考点】二次函数图象与系数的关系;抛物线与x轴的交点.【思路分析】根据抛物线的开口方向、对称轴、与坐标轴的交点判定系数符号及运用一些特殊点解答问题.【解题过程】解:由抛物线的开口向下可得:a<0,根据抛物线的对称轴在y轴右边可得:a,b异号,所以b>0,根据抛物线与y轴的交点在正半轴可得:c>0,∴abc<0,故①错误;∵抛物线与x轴有两个交点,∴b2﹣4ac>0,故②正确;∵直线x=1是抛物线y=ax2+bx+c(a≠0)的对称轴,所以﹣=1,可得b=﹣2a,由图象可知,当x=﹣2时,y<0,即4a﹣2b+c<0,∴4a﹣2×(﹣2a)+c<0,即8a+c<0,故③正确;由图象可知,当x=2时,y=4a+2b+c>0;当x=﹣1时,y=a﹣b+c>0,两式相加得,5a+b+2c>0,故④正确;∴结论正确的是②③④3个,故选:B.【总结归纳】本题考查的是二次函数图象与系数的关系,掌握二次函数的性质、灵活运用数形结合思想是解题的关键,解答时,要熟练运用抛物线上的点的坐标满足抛物线的解析式.二、填空题(本大题7小题,每小题4分,共28分)11.分解因式:xy﹣x=x(y﹣1).【知识考点】因式分解﹣提公因式法.【思路分析】直接提取公因式x,进而分解因式得出答案.【解题过程】解:xy﹣x=x(y﹣1).故答案为:x(y﹣1).【总结归纳】此题主要考查了提取公因式法分解因式,正确找出公因式是解题关键.12.如果单项式3x m y与﹣5x3y n是同类项,那么m+n=4.【知识考点】34:同类项.【思路分析】根据同类项的定义(所含字母相同,相同字母的指数相同)可得m=3,n=1,再代入代数式计算即可.【解题过程】解:∵单项式3x m y与﹣5x3y n是同类项,∴m=3,n=1,∴m+n=3+1=4.故答案为:4.【总结归纳】本题考查同类项的定义,正确根据同类项的定义得到m,n的值是解题的关键.13.若+|b+1|=0,则(a+b)2020=1.【知识考点】16:非负数的性质:绝对值;23:非负数的性质:算术平方根.【思路分析】根据非负数的意义,求出a、b的值,代入计算即可.【解题过程】解:∵+|b+1|=0,∴a﹣2=0且b+1=0,解得,a=2,b=﹣1,∴(a+b)2020=(2﹣1)2020=1,故答案为:1.【总结归纳】本题考查非负数的意义和有理数的乘方,掌握非负数的意义求出a、b的值是解决问题的关键.14.已知x=5﹣y,xy=2,计算3x+3y﹣4xy的值为7.【知识考点】33:代数式求值.【思路分析】由x=5﹣y得出x+y=5,再将x+y=5、xy=2代入原式=3(x+y)﹣4xy计算可得.【解题过程】解:∵x=5﹣y,∴x+y=5,当x+y=5,xy=2时,原式=3(x+y)﹣4xy=3×5﹣4×2=15﹣8=7,故答案为:7.【总结归纳】本题主要考查代数式求值,解题的关键是能观察到待求代数式的特点,得到其中包含式子x+y、xy及整体代入思想的运用.15.如图,在菱形ABCD中,∠A=30°,取大于AB的长为半径,分别以点A,B为圆心作弧相交于两点,过此两点的直线交AD边于点E(作图痕迹如图所示),连接BE,BD.则∠EBD的度数为45°.【知识考点】KG:线段垂直平分线的性质;L8:菱形的性质;N2:作图—基本作图.【思路分析】根据∠EBD=∠ABD﹣∠ABE,求出∠ABD,∠ABE即可解决问题.【解题过程】解:∵四边形ABCD是菱形,∴AD=AB,∴∠ABD=∠ADB=(180°﹣∠A)=75°,由作图可知,EA=EB,∴∠ABE=∠A=30°,∴∠EBD=∠ABD﹣∠ABE=75°﹣30°=45°,故答案为45°.【总结归纳】本题考查作图﹣基本作图,菱形的性质,三角形内角和定理等知识,解题的关键是熟练掌握基本知识,属于中考常考题型.16.如图,从一块半径为1m的圆形铁皮上剪出一个圆周角为120°的扇形ABC,如果将剪下来的扇形围成一个圆锥,则该圆锥的底面圆的半径为m.【知识考点】M5:圆周角定理;MP:圆锥的计算.【思路分析】求出阴影扇形的弧长,进而可求出围成圆锥的底面半径.【解题过程】解:由题意得,阴影扇形的半径为1m,圆心角的度数为120°,则扇形的弧长为:,而扇形的弧长相当于围成圆锥的底面周长,因此有:2πr=,解得,r=,故答案为:.【总结归纳】本题考查圆锥的有关计算,明确扇形的弧长相当于围成圆锥的底面周长是解决问题的关键.17.有一架竖直靠在直角墙面的梯子正在下滑,一只猫紧紧盯住位于梯子正中间的老鼠,等待与老鼠距离最小时扑捉.把墙面、梯子、猫和老鼠都理想化为同一平面内的线或点,模型如图,∠ABC =90°,点M,N分别在射线BA,BC上,MN长度始终保持不变,MN=4,E为MN的中点,点D到BA,BC的距离分别为4和2.在此滑动过程中,猫与老鼠的距离DE的最小值为2﹣2.【知识考点】KP:直角三角形斜边上的中线;M8:点与圆的位置关系.【思路分析】如图,连接BE,BD.求出BE,BD,根据DE≥BD﹣BE求解即可.【解题过程】解:如图,连接BE,BD.由题意BD==2,∵∠MBN=90°,MN=4,EM=NE,∴BE=MN=2,∴点E的运动轨迹是以B为圆心,2为半径的弧,∴当点E落在线段BD上时,DE的值最小,∴DE的最小值为2﹣2.故答案为2﹣2.【总结归纳】本题考查点与圆的位置关系,直角三角形斜边中线的性质等知识,解题的关键是灵活运用所学知识解决问题,属于中考常考题型.三、解答题(一)(本大题3小题,每小题6分,共18分)18.(6分)先化简,再求值:(x+y)2+(x+y)(x﹣y)﹣2x2,其中x=,y=.【知识考点】4J:整式的混合运算—化简求值.【思路分析】根据整式的混合运算过程,先化简,再代入值求解即可.【解题过程】解:(x+y)2+(x+y)(x﹣y)﹣2x2,=x2+2xy+y2+x2﹣y2﹣2x2=2xy,当x=,y=时,原式=2××=2.【总结归纳】本题考查了整式的混合运算﹣化简求值,解决本题的关键是先化简,再代入值求解.19.(6分)某中学开展主题为“垃圾分类知多少”的调查活动,调查问卷设置了“非常了解”、“比较了解”、“基本了解”、“不太了解”四个等级,要求每名学生选且只能选其中一个等级,随机抽取了120名学生的有效问卷,数据整理如下:等级非常了解比较了解基本了解不太了解人数(人)24 72 18 x (1)求x的值;(2)若该校有学生1800人,请根据抽样调查结果估算该校“非常了解”和“比较了解”垃圾分类知识的学生共有多少人?【知识考点】用样本估计总体.【思路分析】(1)根据四个等级的人数之和为120求出x的值;(2)用总人数乘以样本中“非常了解”和“比较了解”垃圾分类知识的学生占被调查人数的比例.【解题过程】解:(1)x=120﹣(24+72+18)=6;(2)1800×=1440(人),答:根据抽样调查结果估算该校“非常了解”和“比较了解”垃圾分类知识的学生共有1440人.【总结归纳】本题主要考查用样本估计总体,从一个总体得到一个包含大量数据的样本,我们很难从一个个数字中直接看出样本所包含的信息.这时,我们用频率分布直方图来表示相应样本的频率分布,从而去估计总体的分布情况.20.(6分)如图,在△ABC中,点D,E分别是AB、AC边上的点,BD=CE,∠ABE=∠ACD,BE与CD相交于点F.求证:△ABC是等腰三角形.【知识考点】KD:全等三角形的判定与性质;KI:等腰三角形的判定.【思路分析】先证△BDF≌△CEF(AAS),得出BF=CF,DF=EF,则BE=CD,再证△ABE≌△ACD(AAS),得出AB=AC即可.【解题过程】证明:∵∠ABE=∠ACD,∴∠DBF=∠ECF,在△BDF和△CEF中,,∴△BDF≌△CEF(AAS),∴BF=CF,DF=EF,∴BF+EF=CF+DF,即BE=CD,在△ABE和△ACD中,,∴△ABE≌△ACD(AAS),∴AB=AC,∴△ABC是等腰三角形.【总结归纳】本题考查了全等三角形的判定与性质、等腰三角形的判定;证明三角形全等是解题的关键.四、解答题(二)(本大题3小题,每小题8分,共24分)21.(8分)已知关于x,y的方程组与的解相同.(1)求a,b的值;(2)若一个三角形的一条边的长为2,另外两条边的长是关于x的方程x2+ax+b=0的解.试判断该三角形的形状,并说明理由.【知识考点】二元一次方程组的解;解二元一次方程组;一元二次方程的解;根与系数的关系.【思路分析】(1)关于x,y的方程组与的解相同.实际就是方程组的解,可求出方程组的解,进而确定a、b的值;(2)将a、b的值代入关于x的方程x2+ax+b=0,求出方程的解,再根据方程的两个解与2为边长,判断三角形的形状.【解题过程】解:(1)由题意得,关于x,y的方程组的相同解,就是程组的解,解得,,代入原方程组得,a=﹣4,b=12;(2)当a=﹣4,b=12时,关于x的方程x2+ax+b=0就变为x2﹣4x+12=0,解得,x1=x2=2,又∵(2)2+(2)2=(2)2,∴以2、2、2为边的三角形是等腰直角三角形.【总结归纳】本题考查一次方程组、一元二次方程的解法以及等腰直角三角形的判定,掌握一元二次方程的解法和勾股定理是得出正确答案的关键.22.(8分)如图1,在四边形ABCD中,AD∥BC,∠DAB=90°,AB是⊙O的直径,CO平分∠BCD.(1)求证:直线CD与⊙O相切;(2)如图2,记(1)中的切点为E,P为优弧上一点,AD=1,BC=2.求tan∠APE的值.【知识考点】直角梯形;圆周角定理;切线的判定与性质;解直角三角形.【思路分析】(1)证明:作OE⊥CD于E,证△OCE≌△OCB(AAS),得出OE=OB,即可得出结论;(2)作DF⊥BC于F,连接BE,则四边形ABFD是矩形,得AB=DF,BF=AD=1,则CF=1,证AD、BC是⊙O的切线,由切线长定理得ED=AD=1,EC=BC=2,则CD=ED+EC=3,由勾股定理得DF=2,则OB=,证∠ABE=∠BCH,由圆周角定理得∠APE=∠ABE,则∠APE=∠BCH,由三角函数定义即可得出答案.【解题过程】(1)证明:作OE⊥CD于E,如图1所示:则∠OEC=90°,∵AD∥BC,∠DAB=90°,∴∠OBC=180°﹣∠DAB=90°,∴∠OEC=∠OBC,∵CO平分∠BCD,∴∠OCE=∠OCB,在△OCE和△OCB中,,∴△OCE≌△OCB(AAS),∴OE=OB,又∵OE⊥CD,∴直线CD与⊙O相切;(2)解:作DF⊥BC于F,连接BE,如图所示:则四边形ABFD是矩形,∴AB=DF,BF=AD=1,∴CF=BC﹣BF=2﹣1=1,∵AD∥BC,∠DAB=90°,∴AD⊥AB,BC⊥AB,∴AD、BC是⊙O的切线,由(1)得:CD是⊙O的切线,∴ED=AD=1,EC=BC=2,∴CD=ED+EC=3,∴DF===2,∴AB=DF=2,∴OB=,∵CO平分∠BCD,∴CO⊥BE,∴∠BCH+∠CBH=∠CBH+∠ABE=90°,∴∠ABE=∠BCH,∵∠APE=∠ABE,∴∠APE=∠BCH,∴tan∠APE=tan∠BCH==.【总结归纳】本题考查了切线的判定与性质、全等三角形的判定与性质、直角梯形的性质、勾股定理、圆周角定理等知识;熟练掌握切线的判定与性质和圆周角定理是解题的关键.23.(8分)某社区拟建A,B两类摊位以搞活“地摊经济”,每个A类摊位的占地面积比每个B类摊位的占地面积多2平方米.建A类摊位每平方米的费用为40元,建B类摊位每平方米的费用为30元.用60平方米建A类摊位的个数恰好是用同样面积建B类摊位个数的.(1)求每个A,B类摊位占地面积各为多少平方米?(2)该社区拟建A,B两类摊位共90个,且B类摊位的数量不少于A类摊位数量的3倍.求建造这90个摊位的最大费用.【知识考点】B7:分式方程的应用;C9:一元一次不等式的应用.【思路分析】(1)设每个B类摊位的占地面积为x平方米,则每个A类摊位占地面积为(x+2)平方米,根据用60平方米建A类摊位的个数恰好是用同样面积建B类摊位个数的这个等量关系列出方程即可.(2)设建A摊位a个,则建B摊位(90﹣a)个,结合“B类摊位的数量不少于A类摊位数量的3倍”列出不等式并解答.【解题过程】解:(1)设每个B类摊位的占地面积为x平方米,则每个A类摊位占地面积为(x+2)平方米,根据题意得:,解得:x=3,经检验x=3是原方程的解,所以3+2=5,答:每个A类摊位占地面积为5平方米,每个B类摊位的占地面积为3平方米;(2)设建A摊位a个,则建B摊位(90﹣a)个,由题意得:90﹣a≥3a,解得a≤22.5,∵建A类摊位每平方米的费用为40元,建B类摊位每平方米的费用为30元,∴要想使建造这90个摊位有最大费用,所以要多建造A类摊位,即a取最大值22时,费用最大,此时最大费用为:22×40×5+30×(90﹣22)×3=10520,答:建造这90个摊位的最大费用是10520元.【总结归纳】本题考查了分式方程的应用和一元一次不等式的应用.解决本题的关键是读懂题意,找到符合题意的数量关系.五、解答题(三)(本大题2小题,每小题10分,共20分)24.(10分)如图,点B是反比例函数y=(x>0)图象上一点,过点B分别向坐标轴作垂线,垂足为A,C.反比例函数y=(x>0)的图象经过OB的中点M,与AB,BC分别相交于点D,E.连接DE并延长交x轴于点F,点G与点O关于点C对称,连接BF,BG.(1)填空:k=2;(2)求△BDF的面积;(3)求证:四边形BDFG为平行四边形.【知识考点】GB:反比例函数综合题.【思路分析】(1)设点B(s,t),st=8,则点M(s,t),则k=s•t=st=2;(2)△BDF的面积=△OBD的面积=S△BOA﹣S△OAD,即可求解;(3)确定直线DE的表达式为:y=﹣,令y=0,则x=5m,故点F(5m,0),即可求解.【解题过程】解:(1)设点B(s,t),st=8,则点M(s,t),则k=s•t=st=2,故答案为2;(2)△BDF的面积=△OBD的面积=S△BOA﹣S△OAD=×8﹣×2=3;(3)设点D(m,),则点B(4m,),∵点G与点O关于点C对称,故点G(8m,0),则点E(4m,),设直线DE的表达式为:y=sx+n,将点D、E的坐标代入上式得,解得,故直线DE的表达式为:y=﹣,令y=0,则x=5m,故点F(5m,0),故FG=8m﹣5m=3m,而BD=4m﹣m=3m=FG,则FG∥BD,故四边形BDFG为平行四边形.【总结归纳】本题考查的是反比例函数综合运用,涉及到一次函数的性质、平行四边形的性质、面积的计算等,综合性强,难度适中.25.(10分)如图,抛物线y=x2+bx+c与x轴交于A,B两点,点A,B分别位于原点的左、右两侧,BO=3AO=3,过点B的直线与y轴正半轴和抛物线的交点分别为C,D,BC=CD.(1)求b,c的值;(2)求直线BD的函数解析式;(3)点P在抛物线的对称轴上且在x轴下方,点Q在射线BA上.当△ABD与△BPQ相似时,请直接写出所有满足条件的点Q的坐标.【知识考点】HF:二次函数综合题.【思路分析】(1)先求出点A,点B坐标,代入交点式,可求抛物线解析式,即可求解;(2)过点D作DE⊥AB于E,由平行线分线段成比例可求OE=,可求点D坐标,利用待定系数法可求解析式;(3)利用两点距离公式可求AD,AB,BD的长,利用锐角三角函数和直角三角形的性质可求∠ABD=30°,∠ADB=45°,分∠ABP=30°或∠ABP=45°两种情况讨论,利用相似三角形的性质可求解.【解题过程】解:(1)∵BO=3AO=3,∴点B(3,0),点A(﹣1,0),∴抛物线解析式为:y=(x+1)(x﹣3)=x2﹣x﹣,∴b=﹣,c=﹣;(2)如图1,过点D作DE⊥AB于E,∴CO∥DE,∴,∵BC=CD,BO=3,∴=,∴OE=,∴点D横坐标为﹣,∴点D坐标(﹣,+1),设直线BD的函数解析式为:y=kx+b,由题意可得:,解得:,∴直线BD的函数解析式为y=﹣x+;(3)∵点B(3,0),点A(﹣1,0),点D(﹣,+1),∴AB=4,AD=2,BD=2+2,对称轴为直线x=1,∵直线BD:y=﹣x+与y轴交于点C,∴点C(0,),∴OC=,∵tan∠CBO==,∴∠CBO=30°,如图2,过点A作AK⊥BD于K,∴AK=AB=2,∴DK===2,∴DK=AK,∴∠ADB=45°,如图,设对称轴与x轴的交点为N,即点N(1,0),若∠CBO=∠PBO=30°,∴BN=PN=2,BP=2PN,∴PN=,BP=,当△BAD∽△BPQ,∴,∴BQ==2+,∴点Q(1﹣,0);当△BAD∽△BQP,∴,∴BQ==4﹣,∴点Q(﹣1+,0);若∠PBO=∠ADB=45°,∴BN=PN=2,BP=BN=2,当△BAD∽△BPQ,∴,∴,∴BQ=2+2∴点Q(1﹣2,0);当△BAD∽△PQB,∴,∴BQ==2﹣2,∴点Q(5﹣2,0);综上所述:满足条件的点Q的坐标为(1﹣,0)或(﹣1+,0)或(1﹣2,0)或(5﹣2,0).【总结归纳】本题是二次函数综合题,考查了待定系数法求解析式,一次函数的性质,相似三角形的性质,直角三角形的性质,勾股定理等知识,利用分类讨论思想解决问题是本题的关键.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
计算题1.(2020•铜仁)铜粉中混有少量的铁粉,为了除去铁粉,某校兴趣小组同学,取该铜粉20g 于烧杯中,然后等量分5次加入未知质量分数的某强酸(W )溶液,充分反应后所得数据如下表,请根据相关知识和图表信息回答下列问题。
(1)写出你所选择酸(W )的化学式 。
(2)铜粉中混有铁粉的质量是 。
(3)计算你选择酸(W )的质量分数(写出计算过程)。
解析 (1)H 2SO 4(或HCl )(2)0.98g (3)9.8%或7.3%(详见解析)【解析】解:(1)铁的金属活动性排在氢的前面,会置换出硫酸或盐酸中的氢,所以所选择酸(W )的化学式是:H 2SO 4(或HCl );(2)根据图表信息,共生成氢气的质量为:0.01g+ 0.01g+0.01g+0.005g =0.035g 设参加反应的铁的质量为x , 2442Fe +H SO FeSO +H 5620.035gx↑═56=20.035g x x =0.98g(3)①假设该酸是硫酸,设5g 该硫酸溶液中含H 2SO 4的质量为y , 2442Fe +H SO FeSO +H 9820.01gy ↑═98=20.01gy y =0.49g 该硫酸溶液中溶质的质量分数为0.49g 5g×100%=9.8%; 答:该硫酸溶液中溶质的质量分数为9.8%。
②假设该酸是盐酸,设5g 该盐酸溶液中含HCl 的质量为z ,22Fe +2HCl FeCl +H 7320.01g z═73=20.01gz z =0.365g 该盐酸溶液中溶质的质量分数为0.365g 5g×100%=7.3%。
答:若选择的酸为硫酸,该硫酸溶液中溶质的质量分数为9.8%;若选择的酸为盐酸,则质量分数为7.3%。
2.(2020•河北)20.某小组用粗锌测定某稀硫酸中溶质的质量分数。
取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。
请计算:(1)生成氢气的总质量为 g 。
(2)稀硫酸中溶质的质量分数。
答案 (1)0.2g ;(2)9.8%【解析】(1)由图可知,先加入8g 粗锌,反应后,天平显示的质量是213.4g ,再加入2g 粗锌,天平显示的质量是215.4g ,故第一次加入8g 粗锌,已经完全反应。
生成氢气的总质量为:205.6g+8g-213.4g=0.2g ;(2)解:设稀硫酸中溶质的质量分数为x加入稀硫酸的质量为:205.6g-105.6g=100g ;2442Zn +H SO =ZnSO +H 982100g 0.2gx↑98100g =20.2gx x =9.8%答:稀硫酸中溶质的质量分数为9.8%。
3.(2020•荆州)现有盛88.4gNa 2CO 3,和NaOH 混合溶液的大烧杯,向其中滴加质量分数为9.8%的H 2SO 4溶液,充分搅拌,烧杯中溶液的质量与滴加H 2SO 4溶液的质量关系如图所示,回答下列问题:(1)写出AB 段发生反应的化学方程式 。
(2)BC 段可以观察到大烧杯的溶液中有气泡产生,则生成气体的质量为 g 。
(3)B 点时,大烧杯中的溶液pH 7(填”>”、“=”或“<”)。
(4)C 点时,所得溶液为不饱和溶液,求溶液中溶质的质量分数。
(写出计算过过程) 答案 (1)2NaOH+H 2SO 4=Na 2SO 4+2H 2O (2)4.4(3)>(4)设:氢氧化钠和硫酸反应硫酸钠的质量为z 。
242422NaOH H SO =Na SO 2H O 98142100g 9.8%z 98100g 9.8%=z=14.2g 142z++⨯⨯,反应后硫酸钠的质量包括碳酸钠和硫酸反应生成的硫酸钠以及氢氧化钠和硫酸反应生成的硫酸钠等于14.2g+14.2g=28.4g ,反应后溶液质量为88.4g+200g-4.4g=284g故溶质质量分数为28.4g 100%=10%284g⨯ 答:溶质质量分数10%。
【解析】(1)烧杯中滴加H 2SO 4溶液氢氧化钠和稀硫酸优先反应,碳酸钠再和硫酸反应,AB 段表示氢氧化钠和硫酸反应生成硫酸钠和水,化学方程式为2NaOH+H 2SO 4=Na 2SO 4+2H 2O ,故填:2NaOH+H 2SO 4=Na 2SO 4+2H 2O 。
(2)生成气体质量为x ,生成硫酸钠质量为y 。
()()()23242422Na CO H SO =Na SO CO H O9814244200g -100g 9.8%y x 200g -100g 9.8%200g -100g 9.8%9898==44x142yx=4.4g y=14.2g++↑+⨯⨯⨯,,故填:4.4。
(3)B 点时,表示氢氧化钠和稀硫酸恰好反应生成硫酸和水,大烧杯中的溶液溶质为硫酸钠和碳酸钠,碳酸钠显碱性,pH>7,故填:>。
(4)设:氢氧化钠和硫酸反应硫酸钠的质量为z 。
242422NaOH H SO =Na SO 2H O 98142100g 9.8%z 98100g 9.8%=z=14.2g 142z++⨯⨯,反应后硫酸钠的质量为:14.2g+14.2g=28.4g ,反应后溶液质量为:88.4g+200g-4.4g=284g 故溶质质量分数为28.4g 100%=10%284g⨯ 答:溶质质量分数10%。
4.(2020•怀化)随着人类现代化程度迅速提高,温室气体(CO 2)排放日益增加,为降低温室气体含量,科学家正在研究一种新型的“人造树叶”。
假设每1升“人造树叶”每天可从空气中吸收二氧化碳880g 并转化为乙醇(C 2H 5OH ),对应化学方程式为222522CO +3H O C H OH+3O 一定条件 。
请回答:(1)写出该研究的一点意义 。
(2)若每天一棵树平均可吸收44g CO 2,则一升“人造树叶”一天吸收的CO 2相当于多少棵树吸收的CO 2。
(3)1升“人造树叶”工作一个月(按30天计)可得到乙醇多少克?(写出计算过程)。
答案 (1)降低温室气体含量,缓解温室效应;(2)20;(3)13800【解析】(1)该研究可将二氧化碳转化为乙醇,可以降低温室气体含量,缓解温室效应; (2)每1升“人造树叶”每天可从空气中吸收二氧化碳880g ,每天一棵树平均可吸收44g CO 2,880g ÷44g=20g ,故一升“人造树叶”一天吸收的CO 2相当于20棵树吸收的CO 2; (3)每1升“人造树叶”每天可从空气中吸收二氧化碳880g ,一个月可吸收二氧化碳的质量为:880g ×30=26400g解:设1升“人造树叶”工作一个月(按30天计)可得到乙醇的质量是x222522CO +3H OC H OH +3O 884626400g x 一定条件8826400=46g xx =13800g 。
答:1升“人造树叶”工作一个月(按30天计)可得到乙醇13800g 。
5.(2020•长沙)为了测定某小苏打样品中碳酸氢钠的质量分数,小兰同学进行了如下实验:向盛有10g 样品的烧杯中加入稀硫酸,恰好完全反应时,加入稀硫酸的质量为90g ,反应后烧杯内物质的总质量为95.6g 。
(杂质不溶于水也不与酸发生反应)已知反应的化学方程式如下:2NaHCO 3+H 2SO 4═Na 2SO 4+2CO 2↑+2H 2O(1)该反应生成二氧化碳的质量为 g 。
(2)求该样品中碳酸氢钠的质量分数(写出计算过程)。
答案 (1)4.4(2)84%【解析】(1)根据质量守恒定律,反应物的总质量等于生成物的总质量,因此该反应生成二氧化碳的质量为:10g+90g ﹣95.6g =4.4g ;(2)设碳酸氢钠质量为x32424222NaHCO +H SO Na SO +2CO +2H O16888x4.4g 168x =x=8.4g 88 4.4g↑⇒═ 该样品中碳酸氢钠的质量分数是:8.4g 10.0g×100%=84%, 答:该样品中碳酸氢钠的质量分数是84%。
6.(2020•江西)“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。
(杂质不参加反应)(1)实验时需配制50g5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制,则需称量氢氧化钠固体的质量为_____g 。
(2)取20g 废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16g 。
计算废液中盐酸的溶质质量分数。
(写出计算过程)(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na +_____Cl -。
(填“>”、“=”或“<”)答案 (1)2.5;(2)3.65%(过程见解析(;(3)<【解析】(1)氢氧化钠质量:50g ×5%=2.5g ,故填:2.5。
(2)设:盐酸溶质质量分数为x 。
2NaOH HCl =NaCl H O4036.516g 5%20gx4016g 5%=36.520gxx=3.65%++⨯⨯,答:废液中盐酸的溶质质量分数3.65%。
(3)实验室用稀盐酸和石灰石或大理石制取二氧化碳,废液中还有氯化钙,故氯离子数目大于钠离子数目,故填:<。
7.(2020•泰安)请你仔细分析如图所示的实验过程和提供的数据,并进行计算。
(1)反应后烧杯中溶液质量为_____g 。
(2)应后所得溶液中溶质的质量分数是多少_____?(写出计算过程,精确到 0.1%) 答案 200 12.7%【解析】解:(1)设反应生成氯化亚铁质量为x ,生成氢气为y ,22=Fe +2HCl Fe 56127211.2g x Cl +H yx 127=11.2g 56x =25.4g , y 2=11.2g 56y =0.4g , 反应后烧杯中溶液质量为:11.2g+189.2g ﹣0.4g =200g ;(2)反应后所得溶液中溶质的质量分数是:25.4g 200g×100%=12.7%, 答:反应后所得溶液中溶质的质量分数是12.7%。
8.(2020•陕西)为测定某赤铁矿中Fe 2O 3的含量,取10g 该赤铁矿样品于烧杯中,向其中加入100g 盐酸,恰好完全反应,测得剩余固体的质量为2g 。
(杂质不溶于水也不与酸反应) 请完成下列分析及计算:(1)10g 样品中杂质的质量为 g 。
(2)计算稀盐酸中溶质的质量分数。
答案 (1)2;(2)10.95%【解析】设100g 稀盐酸中溶质的质量为x。
3232+6HCl 16063Fe O 2FeCl 6.5g 3H O8x⨯=+1608g 636.5x=⨯x=10.95g稀盐酸中溶质的质量分数=10.95100%10.95% 100gg⨯=(其它合理的解法均照上述标准给分)答:稀盐酸中溶质的质量分数10.95%。
