九年级化学知识网络图-12页精
九年级化学各单元知识网络图
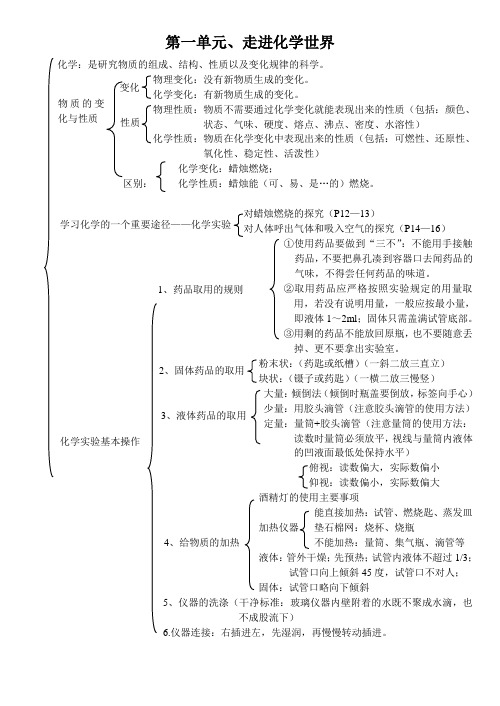
第一单元、走进化学世界化学:是研究物质的组成、结构、性质以及变化规律的科学。
物理变化:没有新物质生成的变化。
化学变化:有新物质生成的变化。
物理性质:物质不需要通过化学变化就能表现出来的性质(包括:颜色、状态、气味、硬度、熔点、沸点、密度、水溶性)化学性质:物质在化学变化中表现出来的性质(包括:可燃性、还原性、氧化性、稳定性、活泼性)化学变化:蜡烛燃烧;区别: 化学性质:蜡烛能(可、易、是…的)燃烧。
对蜡烛燃烧的探究(P12—13)对人体呼出气体和吸入空气的探究(P14—16) ①使用药品要做到“三不”:不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道。
②取用药品应严格按照实验规定的用量取用,若没有说明用量,一般应按最小量,即液体1~2ml ;固体只需盖满试管底部。
③用剩的药品不能放回原瓶,也不要随意丢掉、更不要拿出实验室。
粉末状:(药匙或纸槽)(一斜二放三直立) 块状:(镊子或药匙)(一横二放三慢竖)大量:倾倒法(倾倒时瓶盖要倒放,标签向手心) 少量:用胶头滴管(注意胶头滴管的使用方法) 定量:量筒+胶头滴管(注意量筒的使用方法:读数时量筒必须放平,视线与量筒内液体的凹液面最低处保持水平)俯视:读数偏大,实际数偏小 仰视:读数偏小,实际数偏大 酒精灯的使用主要事项能直接加热:试管、燃烧匙、蒸发皿 加热仪器 垫石棉网:烧杯、烧瓶 不能加热:量筒、集气瓶、滴管等 液体:管外干燥;先预热;试管内液体不超过1/3;试管口向上倾斜45度,试管口不对人;固体:试管口略向下倾斜5、仪器的洗涤(干净标准:玻璃仪器内壁附着的水既不聚成水滴,也不成股流下)6.仪器连接:右插进左,先湿润,再慢慢转动插进。
变化 物质的变化与性质 性质 学习化学的一个重要途径——化学实验 1、药品取用的规则2、固体药品的取用3、液体药品的取用4、给物质的加热 化学实验基本操作第二单元、我们周围的空气1、物性:无色无味的气体,密度比空气略小,难溶于水2、化性:不能燃烧,不支持燃烧,不能呼吸3、用途:1、氧气含量的实验测定(用红磷在空气中燃烧)实验现象:①红磷燃烧,产生大量白烟;②水进入瓶中大约占瓶体积的1/5化学方程式:4P + 5O 2 ===== 2P 2O 5结论:氧气约占空气体积的1/5①红磷量不足②装置漏气 ③瓶未冷却就打开夹子2、物性:无色无味的气体,密度比空气大,不易溶于水,在一定条件下可液化为淡蓝色液态氧,也可固化为淡蓝色的固态氧。
中考化学|人教版九年级化学下册知识点框架图,复习一定用得上!

中考化学|人教版九年级化学下册知识点框架图,复习一定用得上!人教版九年级化学下册知识点框架图8.1金属材料第一节金属材料金属材料:金属材料包括纯金属以及它们的合金。
金属的物理性质在常温下一般为固态(汞为液态),有金属光泽(大多数金属呈银白色,铜呈紫红色,金呈黄色);导电性、导热性、熔点较高、有延展性、能够弯曲、硬度较大、密度较大。
金属之最地壳中含量最多的金属元素——铝人体中含量最多的金属元素——钙目前世界年产量最多的金属——铁(铁>铝>铜)导电、导热性最好的金属——银(银>铜>金>铝)熔点最高的金属——钨熔点最低的金属——汞硬度最大的金属——铬密度最大的金属——锇密度最小的金属——锂金属的分类金属的应用物质的性质在很大程度上决定了物质的用途,但这不是唯一的决定因素。
在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。
铜、铝——电线——导电性好、价格低廉钨——灯丝——熔点高铬——电镀——硬度大铁——菜刀、镰刀、锤子等汞——体温计液柱银——保温瓶内胆铝——“银粉”、锡箔纸合金:由两种或两种以上的金属或金属与非金属经一定方法所合成的具有金属特性的物质。
合金是混合物。
金属氧化物不是合金。
目前已制得的纯金属只有90多种,而合金已达几千种。
合金的硬度一般比组成它的纯金属的硬度大,抗腐蚀性强。
合金的熔点一般比组成它的纯金属的熔点低。
常见的合金:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体具有良好的“相容性”,可用来造人造骨。
钛和钛合金的优点:① 熔点高、密度小;② 可塑性好、易于加工、机械性能好;③ 抗腐蚀性能好。
生铁和钢性能不同的原因:含碳量不同。
8.2金属的化学性质第二节金属的化学性质金属与氧气的反应镁、铝:在常温下能与空气中的氧气反应:2Mg+O2点燃2MgO 4Al+3O2=2Al2O3铝的抗腐蚀性能好的原因:铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。
九年级化学知识网络图

第一单元走进化学世界走进化学世界化学研究的领域:①制造新物质②合成新药物③开发新能源④防止环境污染。
物质变化性质化学一门实验基础科学化学验的本操作第二单元我们周围的空气我们周围的空气氮气(N2)(78%)性质用途:作化工原料;作保护气;作冷冻剂;制造低温环境。
物理性质:无色无味气体,不易溶于水。
化学性质:不活泼,一般不能燃烧,也不支持燃烧。
稀有气体(0.94%)性质:无色无味气体,化学性质不活泼。
用途:作保护气;作电光源;激光技术;冷冻剂;麻醉剂。
二氧化碳(0.03%);其他气体和杂质(0.03%)氧气(O2)(21%)物理性质:无色无味的气体,密度比空气大,不易溶于水。
化学性质(比较活泼,具有氧化性,是常用的氧化剂)C + O2点燃CO22C + O2点燃2COS + O2点燃SO24P + 5O2点燃2P2O53Fe + 2O2点燃Fe3O42Mg + O2点燃2MgO4Al + 3O2点燃2Al2O32H2 + O2点燃2H2O2CO + O2点燃2CO24+ 2O2点燃CO2 + 2H2O(白光、放热、澄清的石灰水变浑浊)(蓝紫色火焰、放热、有刺激性气味)(产生白烟、放热、白色固体)(剧烈燃烧,火星四射、黑色固体)(耀眼的白光、放热、白色固体)(耀眼的白光、放热、白色固体)(淡蓝色或蓝色火焰,干冷烧杯壁有无水滴,沾石灰水的烧杯壁是否浑浊)制法工业制法:分离液态空气法(物理变化)实验室制原理2H2O22H2O+O2↑2KClO32KCl + 3O2 ↑2KMnO4K2MnO4 + MnO2 + O2↑发生装置:固体+液体反应不需加热或固体+固体反应需要加热收集装置大)实验步骤:查、装、定、点、收、离、熄注意事项:先撤导管,后熄灭酒精灯等7点。
检验:将带火星的木条放入瓶中,木条复燃。
验满:将带火星的木条放入瓶口,木条复燃。
用途供给呼吸:动植物呼吸、潜水、登山、医疗、宇航。
支持燃烧:炼钢、气焊、化工生产、宇航。
九年级化学各单元知识框架图

化学研究的对象是物质的初中化学知识框架图第一单元走进化学世界粗成(物质都星由元素组成的)结构(分手,原子、离子及其内部结构〉〈性质(物理性质、化学性质)化学学习的特点是关注物质的性质、变化、变化的过稈及其现象。
变化规律J物理变化1[化学变化一^合、分解、置换、复分解」"本质区别走逬化学世研究化学的重要途径是科学探究,而其重要手段是化学实验〔提出间题後计实验方案,确症概步曝观察描述和记录「交流L体验进行实验iis f r u■Blilr11前时启燃燃灭点点熄化学实验基本操作分析与讨论・结论<间题艮律议人们呼出气体的探究-氧气减少二氧化碳增多水蒸气增多广认识常用的九种仪器(名称、实物、示盍图*用途及其注盍事项)药品的取用规则(三不原则,节约原则、剩余药品处理原则〉「块状固体(镰子〉取药&固体-粉末状固体(药匙):定量(托盘天平:精确到O.lg)「多墾T倾倒(标签、容器口)I潑体,少壘一用胶头滴管(垂直、悬空,不能横放或倒置)I定壘T童筒(平稳、平视)(注意规格的选择)<0. 5L)侬用方法(火柴点燃,外焰加热).注意事项(使用前、使用时、使用启)•仪器(试管、蒸发皿、烧杯、烧瓶)液体(1/3、短柄、移动、管口)固体(管口)「酒精烁物质的加热.I注意事项(都要笊热、外壁擦干等等)「方法0K矗刷矗酸湍或洗涤剂)洗涤仪器*注意事项(热的玻璃仪器不能用冷水洗、不能用力刷洗等)丄玻璃仪器啟涤干净的标准:不聚水滴*不成股流下第二单元我们周围的空气夢諜勰驚作霹悉囉牖不敬一般稀有气体(氐、帕肛等h 占0.94恥很不活源 作保护气,通电发不同颜色光。
二氧化碳(COD :占0.0带°详见第六单元° 其他气体和杂處:占0. 03% o物理性质: 活有,的>较具剂 比,化常化 {«氧是氧无色,无味、气体,密度比空气略大,不易溶于水。
厂c + 5 瞿CO £ (白光、放如 澄清石灰水变浑浊〉 占瑕 2C + 0£ = 2 COS +°2 = 史2(蓝紫色火焰、放热、刺激性气味气体) 占饿4P+5@ = 2P 205(白光、放热、浓厚白烟、白色固体) 3陀+伦=吗0讥火星四射、放热、黒色固体厳]2 + 0£ = 2虺0 (耀眼白光、放热’白色固体)宓°4A1 +302 =肚1刃3〈耀眼白光、放热、白色固体) 占燃 2H 2 + 02 = 2H £0 2 CO + 02 = 2C02V J CH 4 + 2O 2 =C02+2H 20(淡蓝色或蓝色火焰,放热, 干冷烧杯壁有无水滴,沾石灰 水的烧杯壁是否浑浊)'氧气 (占 2D0 C 工业制祛:分离液态空气,(发生物理变化)((2H 202 2H 20 + 0£ f原理{ 2KMnO 4 = K/ng + Mn02 +0£t 12KC103 竽 2KC1 + 302f 炜半聲晉J 固体加热制駆气体〔棉花>,或 友生叢直]固体与液体舊温下制取气体5验宰制注丿收集奘詈『排水法(氧气不易溶于水) 沁至耐冷恫裁直I向上排空气憧(氧气密度比空气大) 实验步骤:査、装、定、点、收、离、熄* 津音事顼J 加热固体制氧气并用排水法收集完 汪启畢项[毕,应先撤导管,后停止加热等。
九年级化学上册知识点梳理网络图
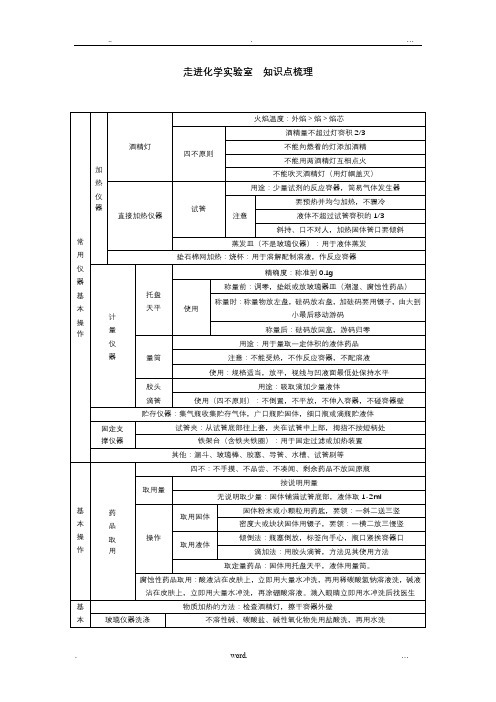
走进化学实验室知识点梳理我们周围的空气知识点梳理点铁夹夹在离管口约1/3处导管应稍露出橡皮塞:便于气体排出试管口应放一团棉花:防止高锰酸钾粉末进入导管排水法收集时,待气泡均匀连续冒出时再收集(刚开始排出的是空气)实验结束时,先移导管再熄灭酒精灯:防止水倒吸引起试管破裂用排空气法收集气体时,导管伸到集气瓶底部用途供呼吸如潜水、医疗急救支持燃烧如燃料燃烧、炼钢、气焊自然界的水知识点梳理水物理性质无色、无味的液体,4℃时=1ɡ/cm3,101kPa时,凝固点是0℃,沸点是100℃电解氢气(负极)无色、无味、难溶于水,密度最小气体,燃烧时产生淡蓝色的火焰氧气(正极)无色、无味、不易溶于水,能使带火星的木条复燃,支持燃烧净化方法静置沉淀、过滤、吸附、蒸馏硬水含有较多可溶性钙、镁化合物的水软水不含或含较少可溶性钙、镁化合物的水分布、储量分布:地面水,地下水,大气水,生物水,其中地球表面71%被水覆盖,但供人类利用的淡水小于1% ,我国水资源的状况分布不均,人均量少爱护水资源水污染原因工业“三废”(废渣、废液、废气)生活污水的任意排放农药、化肥的不合理施用水污染危害人饮用中毒、致病、甚至死亡工农业生产使用被污染的水,会降低产品的质量消除水污染工业三废要经处理达标排放、提倡零排放生活污水要集中处理达标排放、提倡零排放合理施用农药、化肥,提倡使用农家肥物质组成物质(纯净物)由元素组成构成原子:金属、稀有气体、碳、硅等。
分子:如氯化氢由氯化氢分子构成。
H2、O2、N2、Cl2。
离子:NaCl等离子化合物,如氯化钠由钠离子(Na+)氯离子(Cl-)构成分类混合物由两种或多种物质混合而成的物质纯净物单质(同种元素):金属、非金属、稀有气体化合物(不同种元素):CuO HCl NaOH NaCl分定分子是保持物质化学性质最小的微粒物质构成的奥秘知识点梳理质量守恒定律知识点梳理碳和碳的氧化物知识点梳理燃烧及其利用知识点梳理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一单元走进化学世界走进化学世界化学研究的领域:①制造新物质②合成新药物③开发新能源④防止环境污染。
物质变化性质化学一门实验基础科学化学验的本操作第二单元我们周围的空气我们周围的空气氮气(N2)(78%)性质用途:作化工原料;作保护气;作冷冻剂;制造低温环境。
物理性质:无色无味气体,不易溶于水。
化学性质:不活泼,一般不能燃烧,也不支持燃烧。
稀有气体(0.94%)性质:无色无味气体,化学性质不活泼。
用途:作保护气;作电光源;激光技术;冷冻剂;麻醉剂。
二氧化碳(0.03%);其他气体和杂质(0.03%)氧气(O2)(21%)物理性质:无色无味的气体,密度比空气大,不易溶于水。
化学性质(比较活泼,具有氧化性,是常用的氧化剂)C + O2点燃CO22C + O2点燃2COS + O2点燃SO24P + 5O2点燃2P2O53Fe + 2O2点燃Fe3O42Mg + O2点燃2MgO4Al + 3O2点燃2Al2O32H2 + O2点燃2H2O2CO + O2点燃2CO24+ 2O2点燃CO2 + 2H2O(白光、放热、澄清的石灰水变浑浊)(蓝紫色火焰、放热、有刺激性气味)(产生白烟、放热、白色固体)(剧烈燃烧,火星四射、黑色固体)(耀眼的白光、放热、白色固体)(耀眼的白光、放热、白色固体)(淡蓝色或蓝色火焰,干冷烧杯壁有无水滴,沾石灰水的烧杯壁是否浑浊)制法工业制法:分离液态空气法(物理变化)实验室制原理2H2O22H2O+O2↑2KClO32KCl + 3O2 ↑2KMnO4K2MnO4 + MnO2 + O2↑发生装置:固体+液体反应不需加热或固体+固体反应需要加热收集装置大)实验步骤:查、装、定、点、收、离、熄注意事项:先撤导管,后熄灭酒精灯等7点。
检验:将带火星的木条放入瓶中,木条复燃。
验满:将带火星的木条放入瓶口,木条复燃。
用途供给呼吸:动植物呼吸、潜水、登山、医疗、宇航。
支持燃烧:炼钢、气焊、化工生产、宇航。
测定空气中氧气的含量现象:红磷燃烧产生大量白烟,放出热量,打开止水夹烧杯中的水进入集气瓶中约占1/5。
气体减少的体积少于1/5原因:①装置的气密性不好②红磷的量不够③瓶子没冷却就打开止水夹。
MnO2△MnO2第三单元 物质构成的奥秘物 质组成——元素定义:具有相同核电荷数(即质子数)的一类原子的总称。
地壳中含量居前四位的元素:氧(O )、硅(Si)、铝(Al )、铁(Fe )表示 元素 符号 写法:一个字母大写,两个字母一大二小。
意义 ①表示一种元素;②表示该元素的一个原子;③由原子构成的物质,元素符号还表示这种物质。
分类:金属元素、非金属元素、稀有气体元素。
构成 分子:用化学式表示(详见第四单元)原子 (不显电性) 结构原子核 核外电子(带负电)质子(带正电)中子(不带电) 电性关系:核电荷数=质子数=核外电子数=原子序数表示方法:元素符号(前面加系数表示原子个数) 相对原子质量≈质子数+种子数离子核外电子排布排布规律:第一层最多排2个电子;第二层最多排8个电子;最外层最多排8个电子。
原子结构示意图:圆圈、弧线、数字的意义原子结构与元素化学性质的关系①最外层有8个电子,不易得失电子,属于相对稳定结构。
②最外层电子数<4个,易失电子,形成阳离子。
③最外层电子数≥4个,易得电子,形成阴离子。
定义:带电的原子或原子团。
分类阳离子:原子失去电子,带正电(质子数>电子数)阴离子:原子得到电子,带负电(质子数<电子数)表示离子符号) ①写法:离子符号右戴帽,先写数字后写号。
(离子所带的电荷数与元素化合价的数值相等。
) ②意义:右上角数字表示一个离子所带电荷数,离子符号前面数字表示离子个数。
物质构成分子概念:保持物质化学性质的最小粒子。
性质:质量和体积都很小;不断运动;有间隔。
原子概念:化学变化中的最小粒子。
性质与分子相同。
原子与分子的区别与联系区别:在化学变化中,分子可分,原子不可分。
联系:分子由原子构成;分子、原子都能构成物 质。
都既讲种类,又讲个数。
分类混合物:由两种或两种以上物质组成。
(由不同种分子组成的物质)纯净物 单质:由同种元素组成的纯净物。
分为金属、非金属和稀有气体。
化合物 由两种或两种以上元素组成的纯净物。
氧化物 酸、碱、盐 由两种元素组成,其中一种是氧元素的化合物。
第四单元 自然界的水自然界的水电解 原理:2H 2O 通电2H 2↑+ O 2 ↑(氢气与氧气的体积比为2:1)正极:氧气 负极:氢气 两电极上有气泡产生,正、负两极的体积比为1:2。
正氧负氢,氧一氢二。
① 水电解生成了氢气和氧气。
② 水是由氢元素和氧元素组成的化合物。
③ 在化学变化中,分子可分,原子不可分。
净化 沉淀:包括静置沉淀和吸附沉淀(除去水中的不溶性杂质) 过滤:除去水中的不溶性杂质,过滤时注意“一贴、二低、三靠”。
吸附:常用吸附剂活性炭,可除去不溶性杂质、可溶性杂质、色素和臭味。
方法 蒸馏:可将不纯的水变为纯净水,单一操作净化程度最高的方法。
硬水 概念:含有较多可溶性钙、镁化合物的水。
① 硬水洗衣服不仅洗不干净也浪费肥皂,时间长还会变硬。
② 锅炉用硬水不仅浪费燃料,还可能引起爆炸。
危害 软化方法生活中:煮沸 实验室:蒸馏软水:不含或含较少可溶性钙、镁化合物的水。
肥皂水区分① 生活中,使用节水笼头,节水马桶,洗菜的水用于浇花等。
② 农业上,改大水漫灌为喷灌和滴灌。
③工业上水的重复利用。
节约用水防止水体污染水污染的来源工业“三废”未经处理任意排放;生活污水的任意排放;农药、化肥的不合理使用。
水污染的危害:影响工农业、渔业生产,破坏水生生态系统,危害人体健康。
防治措施工业三废处理达标后再排放;生活污水集中处理后再排放;农业上合理使用化肥农药。
化学式意义①表示一种物质②表示该物质的元素组成③表示物质的一个分子④表示物质的分子构成。
注:化学式前面的数字表示分子个数。
读法与写法化合价应用①已知化合价写化学式(一排序、二标价、三约简、四交叉、五检查)。
②已知化学式标化合价(在化合物里正负化合价代数和为0)。
相对分子质量 爱护水资源化学式与化合价定义:用元素符号和数字的组合表示物质组成的式子。
(1)单质:①由原子构成的物质用元素符号表示,如金属单质(Fe 、Al );固态非金属单质(C 、S );稀有气体单质(He 、Ne );②一般气体用“X n ”表示,如:H 2、O 2。
(2)化合物:金前非后,氧一般在后,先读后写,后读先写,读作某化某或某酸某。
写法:在元素符号的正上方标出正负号与数字。
识记常见元素化合价及酸根化合价。
(注:离子所带电荷数与元素化合价数值相同)①计算相对分子质量;②计算物质中各元素的质量比;③计算化合物中某元素的质量分数;④计算化合物中的原子个数比;⑤计算化合物中某元素的质量。
第五单元化学方程式化学方程式质量守恒定律内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(只适用于化学变化)宏观:元素种类变;反应前后总质量不变。
原子种类不变;原子个数不变;原子质量不变。
五不变两变微观:分子种类改变。
宏观:物质种类改变。
一个可能变:分子个数可能改变。
概念:用化学式表示化学反应的式子。
意义①表示反应物、生成物和反应条件。
②表示反应物和生成物之间存在的粒子个数比。
③表示各物质之间的质量比。
书写原则①以客观事实为基础。
②遵守质量守恒定律。
书写步骤⑴写:写出反应物和生成物的化学式;⑵标:标出反应条件和生成物的状态(注:反应物中没有气体,生成物中有气体要标“↑”,反应物中没有固体,生成物中有固体要标“↓”。
)⑶配:配平①奇数配偶法:选择化学方程式两端出现次数最多,且一端为奇数一端为偶数的原子为突破口,然后把奇数配成偶数,再依次推断。
②观察法⑷等:短线改等号。
化学方程式计算设:设未知量写:写出化学方程式标:标出已知量和未知量列:列出比例式算:根据比例式求解未知量答:简答第六单元碳和碳的氧化物碳和碳的氧化物金刚石:很硬,不导电;作玻璃刀、钻头、钻石。
石墨:很软,有滑腻感,具有导电性;作铅笔芯、润滑剂、电极。
木炭用途:吸附食品和工业产品里的色素;作冰箱除味剂。
碳的化学性质常温下,碳的化学性质不活泼。
(书写或绘画)可燃性(作燃料)C + O2点燃CO2(氧气不充足)2C + O2点燃2CO(氧气不充足)还原性(冶炼金属) C+ 2CuO高温2Cu + CO2↑3C+ 2Fe2O3高温4Fe + 3CO2↑碳的氧化物二氧化碳物理性质:无色无味的气体,密度比空气大,能溶于水。
化学性质①不能燃烧,也不能支持燃烧;不能供给呼吸。
(灯火实验)②与水反应:CO2 + H2O === H2CO3(能使石蕊变红)碳酸不稳定,易分解:H2CO3 == H2O + CO2↑③与石灰水(又叫石灰浆、石灰乳)反应:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O④与灼热的碳反应:C+CO2高温2CO实验室制法①药品:石灰石或大理石与稀盐酸②原理:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑③发生装置:固体+液体反应不需要加热④收集装置:只能用向上排空气法收集⑤检验:将气体通入澄清的石灰水中,若澄清石灰水变浑浊,则证明是二氧化碳气体。
⑥验满:将燃着的木条放在集气瓶口,若木条熄灭,则证明已收满。
工业制法——高温煅烧石灰石:CaCO3高温CaO + CO2↑用途:作制冷剂、人工降雨、形成人工云雾(干冰的用途)绿色植物光和作用、灭火、化工原料、气体肥料。
产生温室效应(CO2 、臭氧、甲烷、氟氯代烷):危害与防治措施一氧化碳物理性质:无色无味的气体,密度比空气略小,难溶于水。
化学性质可燃性(需验纯):2CO + O2点燃2CO2 (蓝色火焰、放热)还原性CO+ CuO△Cu + CO23CO+ Fe2O3高温2Fe + 3CO2用途:作燃料、冶炼金属碳单质第七单元燃料及其利用燃料及其利用燃烧与灭火燃烧的条件具有可燃物;可燃物与空气或氧气接触;温度达到可燃物的着火点。
(缺一不可)灭火的方法清除或隔绝可燃物;隔绝空气或氧气;降温至着火点以下。
常见灭火器泡沫灭火器:扑灭木材、棉布等燃烧引起的失火。
干粉灭火器:扑灭一般失火和油、气燃烧引起的失火。
二氧化碳灭火器:扑灭图书、档案、贵重设备、精密仪器等处的失火。
燃料的种类化石燃料(不可再生)煤煤属于混合物,主要含碳元素。
被称为“工业的粮食”。
煤的综合利用:隔绝空气加强热——干馏(化学变化),使煤分解成焦炭,煤焦油,煤气(H2、CH4、CO、其他气体)。
石油石油属于混合物,主要含碳、氢元素。
被称为“工业的血液”。
石油的综合利用:根据石油中各成分沸点的不同分离出各种石油产品——分馏(物理变化)。
