2005年高考化学(江苏卷)
2005年全国各省市高考化学试汇编--有机化学
2005年高考化学试题-----有机化学(05上海)1、下列化学名词正确的是( )A 、三溴笨酚B 、烧碱C 、乙酸乙脂D 、石碳酸(05上海)2、有关化学用语正确的是( )A 、乙烯的最简式C 2H 4B 、乙醇的结构简式C 2H 6O C 、四氯化碳的电子式Cl :C ..Cl ..Cl:ClD 、臭氧的分子式O 3(05广东)18、背景材料:①2004年夏季,特氟隆不粘锅事件引起公众关注;②2004年冬季,诺贝尔化学奖授予研究蛋白质的科学家;③2005年初春,广东大部分地区进行人工降雨;④2005年春末,某高速公路发生液氯运输车翻倒泄露事故。
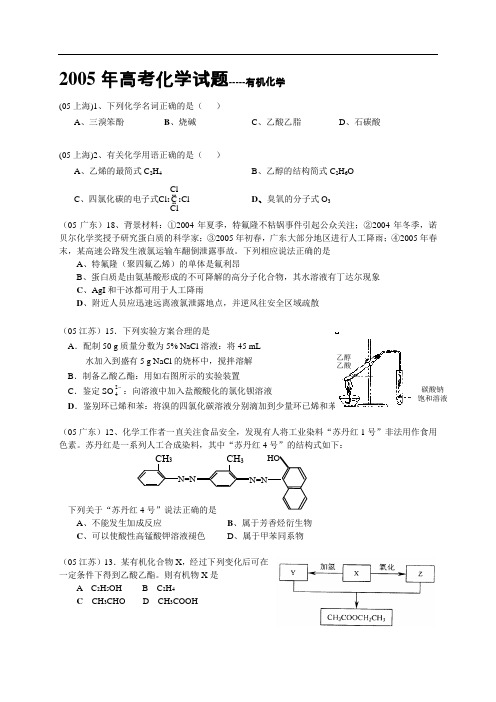
下列相应说法正确的是A 、特氟隆(聚四氟乙烯)的单体是氟利昂B 、蛋白质是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔现象C 、AgI 和干冰都可用于人工降雨D 、附近人员应迅速远离液氯泄露地点,并逆风往安全区域疏散(05江苏)15.下列实验方案合理的是A .配制50 g 质量分数为5% NaCl 溶液:将45 mL水加入到盛有5 g NaCl 的烧杯中,搅拌溶解 B .制备乙酸乙酯:用如右图所示的实验装置C .鉴定SO24:向溶液中加入盐酸酸化的氯化钡溶液 D .鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中(05广东)12、化学工作者一直关注食品安全,发现有人将工业染料“苏丹红1号”非法用作食用A 、不能发生加成反应B 、属于芳香烃衍生物C 、可以使酸性高锰酸钾溶液褪色D 、属于甲苯同系物(05江苏)13.某有机化合物X ,经过下列变化后可在一定条件下得到乙酸乙酯。
则有机物X 是A C 2H 5OHB C 2H 4 C CH 3CHO D CH 3COOH乙醇乙酸碳酸钠 饱和溶液(05广东)23、橙花醛是一种香料,结构简式为:(CH 3)2C=CHCH 2CH 2C(CH 3)=CHCHO 。
下列说法正确的是A .橙花醛不可以与溴发生加成反应B .橙花醛可以发生银镜反应C .1mol 橙花醛最多可以与2mol 氢气发生加成反应D .橙花醛是乙烯的同系物(05江苏)1.2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星——土卫六。
20052005年高考理综化学试题分析和

09年高考化学试题分类汇编——物质的量1.(09年福建理综〃8)设N A为阿伏伽德罗常数,下列叙述正确的是A.24g镁的原子量最外层电子数为N AB.1L0.1mol·L-1乙酸溶液中H+数为0.1N AC.1mol甲烷分子所含质子数为10N AD.标准状况下,22.4L乙醇的分子数为N A答案:C2.(09年广东化学〃6)设N A 代表阿伏加德罗常数(N A )的数值,下列说法正确的是A.1 mol 硫酸钾中阴离子所带电荷数为N AB.乙烯和环丙烷(C3H6 )组成的28g混合气体中含有3N A 个氢原子C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为N AD.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1N A Fe3+答案:C3.(09年广东理基〃20)设N A代表阿伏加德罗常数(N A)的数值,下列说法正确的是A.22.4 L Cl2中含有N A个C12分子B.1 L 0.1 mol〃L-1 Na2SO4溶液中有0.1 N A 个Na+C.1 mol H2与1 mol C12反应生成N A个HCl分子D.1 mol Ca变成Ca2+时失去的电子数为2N A答案:D4.(09年海南化学〃8)下列叙述正确的是(用N A代表阿伏加德罗常数的值)A.2.4g金属镁变为镁离子时失去的电子数为0.1N AB.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 N AD.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等答案:C5.(09年江苏化学·4)用N A表示阿伏加德罗常数的值。
下列叙述正确的是A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2N AB.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2N AC.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5N AD.标准状况下,22.4L 甲醇中含有的氧原子数为1.0N A答案:C6.(09年宁夏理综〃7)将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L (体积均在相同条件下测定),则该氮氧化合物的化学式为A.NO2B.N2O2C.N2OD.N2O4答案:A7.(09年山东理综·10)下列关于氯的说法正确的是A .Cl 2具有很强的氧化性,在化学反应中只能作氧化剂B .若35 17Cl 、3717若Cl 为不同的核素,有不同的化学性质学科 C .实验室制备Cl 2,可用排放和食盐水集气法收集D .1.12LCl 2含有1.7N A 个质子(N A 表示阿伏伽德罗常数)答案:C8.(09年上海化学·10)9.2g 金属钠投入到足量的重水中,则产生的气体中含有A.0.2mol中子B.0.4mol电子C.0.2mol质子D.0.4mol分子答案:B9.(09年上海化学·12)N A代表阿伏加德罗常数。
2005年高考理综试卷化学试题答题情况分

2005年高考理综试卷化学试题答题情况分析与高中化学教学相应策略一.2005年高考试题及评分细则26.(15分)已知A、B、C、D为气体,E,F为固体,G是氯化钙,它们之间的转换关系如下图所示:(1)D的化学式(分子式)是,E的化学式(分子式)是(2)A和B反应生成C的化学方程式是(3)E和F反应生成D、H和G的化学方程式是评分标准:(1)NH3(3分)NH4Cl(3分)(2)H2+Cl2点燃2HCl(4分)或光照、加热、高温、h(3)2NH4Cl+Ca(OH)2△2NH3↑+2H2O + CaCl2 (5分)2NH4Cl+CaO △2NH3↑+H2O + CaCl2 (5分)其余不给分注:①未配平扣1分②缺条件扣1分③分子式错误不给分④反应物中有H2O不给分27.(15分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。
已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:(3)在一定条件下,甲与O2反应的化学方程式是(4)丁的元素符号是,它的原子结构示意图为。
(5)丁的氧化物的晶体结构与的晶体结构相似。
评分标准:(1)CaC2+2H2O C2H2↑+Ca(OH)2 (3分)①“”写成“→”不扣分②“C2H2↑”箭头不标不扣分;加条件“加热”、“高温”等不扣分③方程式未配平扣1分④分子式错不给分(2)CO与金属氧化物(在金属活动性顺序中排在Zn或Zn以后的金属氧化物)①不写条件或条件错误不扣分(条件已经在题中说明)②CO+H2O=CO2+H22CO+SiO2=2CO2+Si2CO+O2点燃2CO2也给分③只要能说明CO具有还原性,且方程式正确都给分①方程式未配平扣1分②分子式错不给分(3)N2+O2放电2NO(3分)或高温、高温高压、催化剂、通电①“”写成“→”不扣分②未配平扣1分③不写条件扣1分(4) 第一空:Si (2分)其余不给分;硅不给分第二空:+14284或+14284(1分)(5) 金刚石或C 金(3分)或晶体硅、硅、Si 、丁①写“金钢石”扣1分 ②写C 、“金铜石”、碳不给分28.(15分)已知某纯碱试样中含有NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
2005年全国各省市高考化学试题汇编2

2005年全国各省市高考化学试题汇编--------基本概念、基本理论(05广东)19、关于小苏打水溶液的表述正确的是A 、c (Na +)=c (HCO 3-) + c (CO 32-) + c (H 2CO 3)B 、c (Na +) + c (H +) = c (HCO 3-) + c (CO 32-) +c (OH -)C 、HCO 3- 的电离程度大于HCO 3-的水解程度D 、存在的电离有:NaHCO 3 = Na + + HCO 3-, HCO 3-H + + CO 32- H 2O H ++OH -(05广东)17、对可逆反应4NH 3(g ) + 5O 2 (g4NO (g ) + 6H 2O (g ),下列叙述正确的是A 、达到化学平稳时,4υ正(O 2)= 5υ逆(NO )B 、若单位时间内生成x mol NO 的同时,消耗x mol NH 3 ,则反应达到平稳状态C 、达到化学平稳时,若增加容器体积,则正反应速率减少,逆反应速率增大D 、化学反应速率关系是:2υ正(NH 3)= 3υ正(H 2O )(05广东)16、下列各组离子一定能大量共存的是A 、含有大量Fe 3+的溶液中:NH 4+、Na +、CI -、SCN -B 、在强碱溶液中:Na +、K +、AlO 2-、CO 32-C 、在c(H +)=10-13mol ·L -1的溶液中:NH 4+、Al 3+、SO 42-、NO 3-D 、在pH=1的溶液中:K +、Fe 2+、Cl -、NO 3-(05广东)15、一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y 2O 3)的氧化锆(Z r O 2)晶体,在熔融状态下能传导O 2-。
下列对该燃料说法正确的是A 、在熔融电解质中,O 2-由负极移向正极B 、电池的总反应是:2C 4H 10 + 13O 2 → 8CO 2 + 10H 2O C 、通入空气的一极是正极,电极反应为:O 2 + 4e - = 2O 2-D 、通入丁烷的一极是正极,电极反应为:C 4H 10 + 26e - + 13O 2 = 4CO 2 + 5H 2O(05广东)14、在一定条件下,固定容积的密闭容器中反应:2NO 2(gO 2(g ) + 2NO (g );ΔH >0, 达到平稳。
2005年全国各省市高考化学试题汇编--碱金属

①>35℃NH4HCO3 会有分解 请回答: ⑴ 反应温度控制在 30—35℃,是因为若高于 35℃,则_____________________________, 若低于 30℃,则_____________________________,为控制此温度范围,采取的加热方法 为_________________。 ⑵ 加料完毕后,继续保温 30 分钟,目的是________________________________________。 静置后只析出 NaHCO3 晶体的原因是___________________________________________。 用蒸馏水洗涤 NaHCO3 晶体的目的是除去_______________杂质(以化学式表示)
⑶ 过滤所得的母液中含有___________________________(以化学式表示) ,需加入_______, 并作进一步处理,使 NaCl 溶液循环使用,同时可回收 NH4Cl ⑷ 测试纯碱产品中 NaHCO3 含量的方法是:准确称取纯碱样品 W g,放入锥形瓶中加蒸馏水 溶解,加 1—2 滴酚酞指示剂,用物质的量浓度为 c( mol/L)的 HCl 溶液滴定至溶液由 — — 红色到无色(指示 CO32 +H+==HCO3 反应的终点) ,所用 HCl 溶液的体积为 V1 mL,再 加 1—2 滴甲基橙指示剂,继续用 HCl 溶液滴定至溶液由黄变橙,所用 HCl 溶液总体积 为 V2 mL。写出纯碱样品中 NaHCO3 质量分数的计算式: NaHCO3% = ______________________________。 28.⑴ NH4HCO3 分解 反应速率降低 水浴加热 ⑵ 使反应充分进行 NaHCO3 的溶解度最小 NaCl NH4Cl NH4HCO3 ⑶ NaHCO3 NaCl NH4Cl NH4HCO3 HCl
2005年高考化学试卷(江苏省)

2005年普通高等学校招生全国统一考试(江苏卷)化学可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Ag 108 Ba 137一、选择题(本题包括8小题,每小题4分,共32分。
每小题只有一个....选项符合题意)1.2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星——土卫六。
科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。
下列关于碳氢化合物的叙述正确的是A.碳氢化合物的通式为C n H2n+2B.石油的主要成分是碳氢化合物C.乙炔是含碳量最高的碳氢化合物D.碳氢化合物中的化学键都是极性键2.保护环境是每一个公民的责任,下列做法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。
其中有利于保护环境的是A.①②④⑤B.②③④⑥C.①②④⑥D.③④⑤⑥3.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。
在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 高温2 AlN + 3 CO 下列叙述正确的是A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂B.上述反应中每生成2 mol AlN,N2得到3 mol电子C.氮化铝中氮元素的化合价为—3D.氮化铝晶体属于分子晶体4.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g) + 1/2O2(g) = H2O(l);△H=—285.8 kJ/molCO(g) + 1/2O2(g) = CO2(g);△H=—283.0 kJ/molC8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H=—5518 kJ/molCH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H=—890.3 kJ/mol相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)5.下列叙述不正确...的是A.硝酸银溶液通常保存在棕色试剂中,是因为硝酸银见光分解B.乙醇的沸点比甲醚(CH3—O—CH3)高,主要原因是乙醇分子间能形成氢键C.反应AgCl + NaBr = AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应6.下列除去杂质的实验方法正确的是A.除去CO中少量O2:通过灼热的Cu网后收集气体B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热C.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置7.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。
2005年高考试题高一部分化学试题

2005年高考试题高一部分化学试题一、选择题(每题6分,共180分)1.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是()A.12 B.14 C.16 D.182.下列说法正确的是()A.常温常压下,只有一种元素的单质呈液态B.周期表中所有元素都有从自然界中发现的C.过渡元素不全是金属元素D.常温常压下,气态单质的分子都是由非金属元素的原子形成的3.下列单质中,最容易跟氢气发生反应的是()A.O2B.N2C.F2D.Cl24.N A代表阿伏加德常数,下列说法正确的是()A.在同温同压时,相同体积的任何气体单质所含的原子数目相同B.2g氢气所含原子数目为N AC.在常温常压下,11.2L氮气所含的原子数目为N AD.17g氨气所含电子数目为10N A5.近期,北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。
下列叙述正确的是()A.硫化氢分子很稳定,受热难分解B.硫化氢分子中所有原子的最外电子层都达到8电子结构C.将硫化氢通人溴水,溴水褪色D.硫化氢是电解质,其电离方程式是H2S =2H++S 2-6.某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是()A.用食醋除去暖水瓶中的薄层水垢B.用米汤检验含碘盐中的碘酸钾(KIO3)C.用食用碱(Na2CO3)溶液洗涤餐具上的油污D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物7.下列叙述中指定粒子的数目大于6.02×1023的是()A.2 g重水(D20,D为21 H)中含有的中子数B.0.1 mol F-中含有的电子数C.标准状况下,11.2 L N2和NO混合气体中的原子数D.1 L 1mol·L - 1Na2SO4溶液中的Na+离子数8.下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是()A.氯化镁、氢氧化钠 B.硫酸钠、氢氧化钡C.氯化铝、氨水 D.溴化亚铁、氯水9.甲、乙两元素原子的L层电子数都是其它层电子总数的2倍。
2005年全国各省市高考化学试题汇编--几种重要的金属

2005年高考化学试题-----几种重要的金属(05江苏)6.下列除去杂质的实验方法正确的是A .除去CO 中少量O 2:通过灼热的Cu 网后收集气体B .除去K 2CO 3固体中少量NaHCO 3:置于坩埚中加热C .除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤D .除去FeCl 3酸性溶液中少量的FeCl 2:加入稍过量双氧水后放置(05天津)10.下列除杂质的方法不可行...的是 A .用过量氨水除去Al 3+溶液中的少量Fe 3+B .将混合气体通过灼热的铜网除去N 2中的少量O 2C .用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水D .用盐酸除去AgCl 中少量的Ag 2CO 3(05上海)4、下列金属冶炼的反应原理,错误的是( )A 、2NaCl(熔融) →通电2Na + Cl 2↑B 、MgO + H 2 →△Mg + H 2O C 、Fe 3O 4 + 4CO →高温 3Fe + 4CO 2D 、2HgO →△ 2Hg + O 2↑ (05广东)2、将钠、镁、铝0.3mol 分别放入100mL1mol ·1 L 的盐酸中,同温同压下产生的气体体积比是A 、1︰2︰3B 、6︰3︰2C 、3︰1︰1D 、1︰1︰1(05江苏)22.下图中,A 、C 是工业上上用途很广的两种重要化工原料,B 为日常生活中常见的金属,H 、G 是正四面体结构的非极性分子,H 是一种重要的能源,J 是一种耐高温材料,K 是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:(1)写出B 的化学式 ,G 的电子式 。
(2)反应①的离子方程式 ; (3)反应②进行的条件是 , ;(4)反应③的化学方程式为 。
22.(共10分)(1)Al(2)Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓(3)光照过量Cl2(4)Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑(05江苏)30.(9分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E 为Fe单质,其余为化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2005年普通高等学校招生全国统一考试(江苏卷)化学可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Ag 108 Ba 137一、选择题(本题包括8小题,每小题4分,共32分。
每小题只有一个....选项符合题意)1.2005年1月,欧洲航天局的惠更斯号探测器首次成功登陆土星的最大卫星——土卫六。
科学家对探测器发回的数据进行了分析,发现土卫六的大气层中含有95%的氮气,剩余的气体为甲烷和其他碳氢化合物。
下列关于碳氢化合物的叙述正确的是A.碳氢化合物的通式为C n H2n+2B.石油的主要成分是碳氢化合物C.乙炔是含碳量最高的碳氢化合物D.碳氢化合物中的化学键都是极性键2.保护环境是每一个公民的责任,下列做法:①推广使用无磷洗涤剂;②城市生活垃圾分类处理;③推广使用一次性木质筷子;④推广使用清洁能源;⑤过量使用化肥、农药;⑥推广使用无氟冰箱。
其中有利于保护环境的是A.①②④⑤B.②③④⑥C.①②④⑥D.③④⑤⑥3.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。
在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 高温2 AlN + 3 CO 下列叙述正确的是A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂B.上述反应中每生成2 mol AlN,N2得到3 mol电子C.氮化铝中氮元素的化合价为—3D.氮化铝晶体属于分子晶体4.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g) + 1/2O2(g) = H2O(l);△H=—285.8 kJ/molCO(g) + 1/2O2(g) = CO2(g);△H=—283.0 kJ/mol C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H=—5518 kJ/molCH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H=—890.3 kJ/mol相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)5.下列叙述不正确...的是A.硝酸银溶液通常保存在棕色试剂中,是因为硝酸银见光分解B.乙醇的沸点比甲醚(CH3—O—CH3)高,主要原因是乙醇分子间能形成氢键C.反应AgCl + NaBr = AgBr + NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应6.下列除去杂质的实验方法正确的是A.除去CO中少量O2:通过灼热的Cu网后收集气体B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热C.除去苯中溶有的少量苯酚:加入适量浓溴水反应后过滤D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置7.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。
下列反应在水溶液中不可能...发生的是A.3 Cl2 + 6 FeI2= 2FeCl3 + 4 FeI3B.Cl2 + FeI2= FeCl2 + I2C .Co 2O 3 + 6 HCl = 2CoCl 2 + Cl 2↑+ 3H 2OD .2Fe 3++ 2I —= 2Fe2++ I 28.在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO 4溶液,当溶液中的Ba 2+恰好完全沉淀时,溶液pH = 11。
若反应后溶液的体积等于Ba(OH)2溶液与NaHSO 4溶液的体积之和,则Ba(OH)2溶液与NaHSO 4溶液的体积比是 A .1∶9 B .1∶1 C .1∶2 D .1∶4二、选择题(本题包括10小题,第9 ~ 16小题每小题4分,第17、18小题每小题5分,共42分。
每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分) 9.下列离子方程式正确的是A .碳酸氢钠溶液与少量石灰水反应 HCO -3+ Ca 2+ + OH — = CaCO 3↓ + H 2OB .氯化铵与氢氧化钠两种浓溶液混合加热OH — + NH +4 △ H 2O + NH 3↑C .氢氧化镁与稀硫酸反应 H + + OH — = H 2OD .单质铜与稀硝酸反应 Cu + 2 H ++ 2NO -3 = Cu 2++ 2NO ↑+H 2O10.阿伏加德罗常数约为6.02×1023 mol —1,下列叙述中正确的是A .常温常压下,18.0 g 重水(D 2O)所含的电子数约为10×6.02×1023B .室温下,42.0 g 乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023C .标准状况下,22.4 L 甲苯所含的分子数约为6.02×1023D .标准状况下,a L 甲烷和乙烷混合气体中的分子数约为4.22a ×6.02×1023 11.2002年瑞典科学家发现,某些高温油炸食品中含有一定量的 CH 2=CH —C —NH 2(丙烯酰胺)。
食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。
关于丙烯酰胺有下列叙述:①能使酸性KMnO 4溶液褪色;②能发生加聚反应生成高分子化合物只③有4种同分异构体;④能与氢气发生加成反应。
其中正确的是A .①②③B .②③④C .①③④D .①②④ 12.常温下将稀NaOH 溶液与稀CH 3COOH 溶液混合,不可能...出现的结果是 A .pH > 7,且c (OH —) > c (Na +) > c (H +) > c (CH 3COO —)B .pH > 7,且c (Na +) + c (H +) = c (OH —) + c (CH 3COO —)C .pH < 7,且c (CH 3COO —) >c (H +) > c (Na +) > c (OH —)D .pH = 7,且c (CH 3COO —) > c (Na +) > c (H +) = c (OH —)13.A 、B 、C 、D 四种短周期元素的原子半径依次减小,A 与C 的核电荷数之比为3∶4,D 能分别与A 、B 、C 形成电子总数相等的分子X 、Y 、Z 。
下列叙述正确的是 A .X 、Y 、Z 的稳定性逐渐减弱 B .A 、B 、C 、D 只能形成5种单质C .X 、Y 、Z 三种化合物的熔沸点逐渐升高D .自然界中存在多种由A 、B 、C 、D 四种元素组成的化合物14.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。
高铁电池的总反应为 3Zn + 2K 2FeO 4 + 8H 2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH 下列叙述不正确...的是 A .放电时负极反应为:Zn —2e — +2OH —= Zn(OH)2B .充电时阳极反应为:Fe(OH)3 —3e — + 5 OH — = FeO -24 + 4H 2O C .放电时每转移3 mol 电子,正极有1mol K 2FeO 4被氧化放电充电OD .放电时正极附近溶液的碱性增强 15.下列实验方案合理的是A .配制50 g 质量分数为5% NaCl 溶液:将45 mL水加入到盛有5 g NaCl 的烧杯中,搅拌溶解 B .制备乙酸乙酯:用如右图所示的实验装置C .鉴定SO -24:向溶液中加入盐酸酸化的氯化钡 溶液D .鉴别环已烯和苯:将溴的四氯化碳溶液分别滴加到少量环已烯和苯中16.某溶液既能溶解Al(OH)3,又能溶解H 2SiO 3,在该溶液中可以大量共存的离子组是A .K +、Na +、HCO -3、NO -3B .Na +、SO -24、Cl —、ClO —C .H +、Mg 2+、SO -24、NO -3 D .Ag +、K +、NO -3、Na +17.Cu 2S 与一定浓度的HNO 3反应,生成Cu(NO 3)2、CuSO 4、NO 2、NO 和H 2O ,当NO 2和NO 的物质的量之比为1∶1时,实际参加反应的Cu 2S 与HNO 3的物质的量之比为 A .1∶7 B .1∶9 C .1∶5 D .2∶918.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A 和2 mol B ,达平衡后A 的体积分数为a %。
其他条件不变时,若按下列四种配比作为起始物质,平衡后A 的体积分数大于a %的是A .2 mol CB .2 mol A 、1 mol B 和1 mol He (不参加反应)C .1 mol B 和1 mol CD .2 mol A 、3 mol B 和3 mol C第二卷(非选择题 共76分)三、(本题包括2小题,共22分)19.(10分)请按要求填空:(1)下列实验操作或对实验事实的叙述正确的是 (填序号)①用稀HNO 3清洗做过银镜反应实验的试管; ②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌; ③用碱式滴定管量取20.00 mL 0.1000 mol/L KMnO 4溶液; ④用托盘天平称取10.50 g 干燥的NaCl 固体; ⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;⑥用瓷坩埚高温熔融Fe(CrO 2)2和Na 2CO 3的固体混合物;⑦向沸腾的NaOH 稀溶液中滴加FeCl 3饱和溶液,以制备Fe(OH)3胶体;⑧配制Al 2(SO 4)3溶液时,加入少量的稀硫酸。
(2)为了确定乙醇分子的结构简式是CH 3—O —CH 3还是CH 3CH 2OH ,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H <0)生成氢气的体积, 并据此计算乙醇分子中能与金属钠反应的氢原子的数目。
试回答下列问题:①指出实验装置中的错误 ②若实验中用含有少量水的乙醇代替相同质量的无水 乙醇,相同条件下,测得的氢气体积将 (填“偏大”、“偏小”或“不变”)乙醇乙酸碳酸钠 饱和溶液无水乙醇导管A 钠广口瓶 量筒 导管B水③请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)。
20.(12分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。
