第十二章 簇状配合物
簇合物化学

簇合物结构规则 --------硼烷结构规则
Wade规则(多面体骨架电子对理论) 硼烷有效骨架电子对数比该硼烷骨架所 对应完整的基础三角面多面体的顶点数 多1
簇合物结构规则 --------硼烷结构规则
硼烷拓扑结构规则
醛基化
环合 氧化
2、铁硫和钼(钨)铁硫簇合物
铁硫和钼铁硫簇合物化学是在铁氧还蛋 白和固氮酶生物化学研究和化学模拟研 究的推动下,近几十年来发展起来的
在某些蛋白和酶中存在着含两个以上金属原子 的原子簇,这些金属原子被硫原子桥联,并以 端基方式连接着组成多肽链的氨基酸残基
铁氧还蛋白的2Fe辅基和4Fe辅基
杂笼富勒烯
富勒烯骨架上存在骨架碳原子被非碳原 子取代的富勒烯
碳原子被硼取代,生成具有强Lewis酸 性的硼杂笼富勒烯,能与NH3反应
用电弧法蒸发掺BN的石墨棒,得到 C59N
C60-x-yBxNy
VBO=4n-F
F=f+3(s+1) 其中,F为反键轨道数、f为面数、s为 几何构型偏离完整基础三角面多面体的 程度。对于封闭型硼烷s=0, 对于巢穴型 硼烷s=1
4、碳簇C60
发现:在超声氦气流中以激光蒸发石墨,形成n < 200的Cn原子簇,其中C60具有较高的稳定性
结构:由60个C原子构成的球形32面体,即由12个 五边形和20个六边形组成。其中五边形彼此不相 连只与六边形相邻。每个碳原子以sp2杂化轨道与 相邻的三个碳原子成键,剩余的p轨道在C60分子 的外围和内腔形成π键
C60、C70等形成封闭笼状结构,统称为富勒烯 (Fullerenes)
富勒烯笼外配合物的合成
配合物的基本概念与命名

O-C=S K2 O-C=S Ni
S-C=O S-C=O
如:二硫代草酸根的氧和硫均可能是配 位原子,若S为配位原子,则用(-S、S’)表 示。
二(二硫代草酸根- S、S’)合镍(II)酸钾
二、几何异构体的命名
1、用结构词头:顺-(cis-)、反-(trans-)、面-(fac -)、经-(mer-)对下列构型的几何异构体进行命名。 a a a b a b b a b b
Cl Py Py Co NH3
af-二氨· bc-二水· de-二(吡啶)合钴(III)离
OH2
OH2
氯化a-硝基· b-氨· c-羟氨d · - (吡啶)合铂(II) 子
3、桥基多核配合物的命名
1、在桥联基团或原子的前面冠以希腊字母μ- ,并加中圆点 与配合物其它部分隔开。两个或多个桥联基团,用二(μ- ) 等表示
根据“中国化学会无机化学命名原则”(1980年),
(3)
同类配体(无机或有机类)按配位原子元 素
符号的英文字母顺序排列。
[Co(NH3)5H2O]Cl3
三氯化五氨· 一水合钴(III)
(4)
同类配体同一配位原子时,将含较少原
子数的配体排在前面。 [Pt(NO2)(NH3)(NH2OH)(Py)]Cl
H2N
H N
N H
NH2
单齿配位
N N N N N N N
螯合作用
大环作用
N O O O N O O
穴合作用
N
O
酞菁 大环配体
穴醚[2,2,2] 穴状配体
2,2,2-
B、根据键合电子的特征分为三种:
σ-配体:凡能提供孤对电子对与中心原子形成σ-配 键的配体。如:X-,NH3,OHπ-酸配体: 除能提供孤对电子对与中心原子形成σ-配键外, 同时还有与金属离子(或原子)d轨道对称性匹配的 空轨道(p,d或π*),能接受中心离子或原子提供的
等瓣类似性原理与簇状配合物

1簇状配合物的概念
簇状配合物是指含有金属—金属键(M-M)的多面体分子,它
们的电子结构是以离域的多心键为特征。
目前,对它们的研究大致有两方面: 第一:基础工作侧重于新型簇状配合物的合成及其结构 规律和成键理论的研究。
第二:应用方面则侧重于反应活动的研究,希望为催化领域提供催 化新途径。
2簇状配合物的分类
ML6 为18电子 构型,与一条 可用于成键的 轨道d2sp3轨道。
• 举例: Mn(CO)5 17e碎片 • 在Mn(CO)5碎片中,它是包含1可用轨道及1e空穴的碎片。即在这 一点上与CH3相似。
• Mn(CO)5与CH3在化学上成为可相互替代的基团。
• Mn(CO)5可替代CH3CH3中的一个到两个甲基,生成 CH3Mn(CO)5和 (CO)5Mn-Mn(CO)5 • Mn(CO)5与CH3并非等电子基团,但它们用于与其他 基团成键的有意义的轨道在对称性和电子占有情况 是相同的。 • 这种相似被Hoffmann称为等瓣相似。Me-Me Me-Mn(CO)5 (CO)5Mn-Mn(CO)5
八面体配位的基础轨道数是6;平面四方配位则为4,对平面四方配 位配体等瓣类似性同样适用。所谓的等瓣相似,指得是两个等瓣 相似基团的成键能力的某种相似性。
判断等瓣相似方法
1、确定金属碎片中金属配位几何构型,八面体轨道数为6, 平面四边形轨道数为4. 2、确定金属碎片应有的电子数(18e或16e) 3、判断电子空穴与可利用的轨道数 实际上,对金属有机碎片而言,更重要的是考虑它的电子空 穴与有机基团的相似
H
电子空穴指的是 这些基团与八电 子构型的CH4相 比所缺的电子数
CH3- 有类似甲烷 的四面体结构
CH2:2个电子 空穴,2条可用 轨道
第十二章 簇状配合物
第二节 各类簇状配合物简介
一、双核配合物 这类配合物研究得较多,尤以卤合物及羰合物较为普遍,如: [Re2Cl8]2-、[Mo2(SO4)4]3-、Cr2(O2CCH3)4等。
1、金属-金属多重键 M—M多重键的概念由美国学者F. A. Cotton首先提出。研究的 最充分的是:[Re2Cl8]2-和[Mo2Cl8]4-。 结构特点:M—M键极短:Re—Re为2.24 Å,Mo—Mo为2.14Å。 相应金属本身为:Re—Re为2.741Å和Mo—Mo为2.725 Å。
再如:B4H46-(n=4) b=(2×4+6)/2=7
m=n+2 网 B5H54-(n=5) b=(2×5+4)/2=7 m =6 m=n+1 巢(四方锥) B6H62-(n=6) b=(2×6+2)/2=7 八面体 m=n 封(八面体)
四、 簇状配合物的结构特点 与经典配合物相比,簇状配合物有如下特点: 1)簇状配合物的结构是以成簇的原子所构成的金属骨架 (framework or skeleton)为特征的。骨架中的金属原子以一种多 角形或多面体排列。如:
三角形
四面体
三角双锥
四方锥
2) 簇的结构中心多数是“空”的,无中心金属原子存在,只有少 数例外。如Au11I3[P(p-ClC6H4)3]7结构中,11个Au中,有一个在中 心。 3) 簇的金属骨架结构中的边并不代表经典价键理论中的双中心 电子对键。骨架中的成键作用以离域的多中心键为主要特征。
(O C )3 Ir
Ir (C O ) 3
Ir (C O ) 3
CO
CO
M 4 (C O ) 1 2 (M = C o , R h )
再如 :四面体杂原子簇Co3(CO)9C—R
有机化学第十二章ppt课件教案

OH
N
N
O
HN
N
H2N
NN H
鸟嘌呤
H2N
2-氨基-6-羟基嘌呤
NN H
第二节 生 物 碱
一、生物碱的概述 含义: 二、生物碱的一般性质 生物碱试剂: 1.沉淀反应:苦味酸、碘的碘化钾溶液 2.颜色反应: 浓硫酸和浓硝酸等
三、重要的生物碱
+ KOH N H
+ H2O NK+
在吡啶分子中,氮原子上的未共用电子对未参与 环上的共轭体系,与质子的结合能力比较强,因此
吡啶显碱性,与酸能形成盐。
+ HCl N
苯胺
pKb
9.4
ClN H 吡啶盐酸盐
吡啶
三乙胺
8.64
3.4
§4 五元杂环化合物 一、 呋喃及其衍生物 1.呋喃
呋喃与盐酸浸过的松木片呈绿色,可用来鉴定呋喃 的存在。
N H
N H
三、氧化反应 五元杂环是富电子的芳杂环,和氧化剂作用,常导致 环的破裂或发生聚合作用得到焦油状聚合物。
六元杂环是缺电子的芳杂环,一般对氧化剂相当稳定。
CH3
HNO3
N
COOH N
HNO3
COOH
回流
COOH
N
N
四、酸碱性
在吡咯分子中,由于氮上未共用的孤对电子参与环上的 共轭体系,使氮上电子云密度降低而减弱对质子的吸引 力,使得这个氢原子能以质子的形式解离,所以吡咯表 现出一定的弱酸性(pKa=15)。
二、六元杂环化合物的结构
N
2P
SP2杂化
P
2S
SP2
N 符合休克尔规则,具有芳香性。
吡啶 (pyridine)
第一章 配位化学导论

CoCl3.6NH3 CoCl3.5NH3
[Co(NH3)6]Cl3 [Co(NH3)5Cl]Cl2
CoCl3.4NH3
IrCl3.3NH3
1
0
[Co(NH3)4Cl2]Cl
[Ir(NH3)3Cl3]
2)电导率测定
配合物 摩尔电导(Ω-1) 离子数目 现在化学式 5 [Pt(NH3)6]Cl4
PtCl4.6NH3 523
π-配体:既能提供π电子(定域或离域π键中的电子) 与中心离子或原子形成配键,又能接受中心原子提 供的非键d电子对形成反馈π键的不饱和有机配体。 可分为链状(烯烃、炔烃、 π-烯丙基等)和环状
广义:凡是由原子B或原子团C与原子A结合形成的,
在某一条件下有确定组成和区别于原来组分(A、B或
C)的物理和化学特性的物种均可称为配合物。
二、配合物的组成
1、内界、外界、中心体、配体、配位原子 内界:中心体(原子或离子)与配位体,以配位键成键 外界:与内界电荷平衡的相反离子
[Co(NH3)6]Cl3
现在称为配位化合物(Coordination compounds),简称配 合物,是由中心原子或离子和围绕在它周围的一组离子或 分子所组成的化合物,在溶液中虽然部分离解,但仍趋向 于保持其本体(较确切的定义见后)。
例如:配合物[Co(NH3)6]Cl3 [Co(NH3)6]3Co3+ + 6NH3
1-1 配位化学发展简史
1、单一固定化合价理论不能应用于钴和其他类似的金属。大多数 元素表现有两种形式的价——主价和副价。主价或电离价态为中心 原子的氧化数,副价为中心原子的配位数(由空间稳定的 几何位 置决定)。 2、每种元素都倾向于既满足它的主价又要满足它的副价。
簇状配合物.
③ 两个Re的dxz和dyz分别形成2个d—dπ键,一个在 xz平面,另一个在yz平面。
④ 每个Re原子剩下的dxy轨道重叠形成d-dδ键。重 叠构型δ重叠最大;交错构型则δ重叠趋于零,所以 δ键较弱,由于δ形成,有利于重叠构型。
总之,Re—Re之间作用结果生成1个σ键2个π 键和1个δ键。为四重建。
[Re3Cl12]3-
[Re2Cl8]2-
Re-Re 多重键的数目
3.02埃 2.47埃
2.24埃
单键 推断此化合物中 Re-Re为双重键
四重键
采用分子轨道的一种简单近似方法来处理 将Re3X9L3结构中按Re原子分为三组,每一组Re 原子有5个配体,在八面体的5个顶点。
Re3X9L3的结构
每个Re原子有9个价轨道,其中用5个适当的轨道与 配体成键,则每个Re剩下4个未用的原子轨道。 假定:余下的轨道是纯的d轨道。3个Re原子剩下 的12原子轨道, 原子轨道重新组合形成12个分子 轨道,分子轨道的能级次序近似如图:
③生成M—M键能力与该金属的标准原子化能成正 比。具有高原子化能的金属,即具有高熔点和高沸 点的金属,生成M-M键的倾向也大,这些耐熔金 属大多在第二、三过渡系列。
2. 配体
(1)饱和配体
饱和配体只与周期表左下边的过渡金属形成的簇状 配合物较多。例如:Nb、Ta、Mo、W向右到第8副 族则颇难形成。 原因:轨道收缩而且价层中电子数增多,空位减少, 不利于M—M成键。
Cr2Cl93-(a)和W2Cl93-(b)结构
对于一个正常的共面八面体,M处于八面体中心, M—M距离为2.80埃。
Cr2Cl93-
Mo2Cl93-
M—M 磁性
3.12
2.67
无机化学第12章配位化学基础习题及全解答
第12章 配位化学基础1 M 为中心原子,a, b, d 为单齿配体。
下列各配合物中有顺反异构体的是 (A )(A ) Ma 2bd (平面四方)(B ) Ma 3b (C ) Ma 2bd (四面体)(D ) Ma 2b (平面三角形)2 在下列配合物中,其中分裂能最大的是 (A )(A ) Rh(NH 3)36+ (B )Ni(NH 3) 36+ (C ) Co(NH 3)36+ (D ) Fe(NH 3)36+3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为(B ) (A ) 9 , (B ) 6 , (C )5 , (D )34 化合物[Co(NH 3)4Cl 2]Br 的名称是 溴化二氯•四氨合钴(III ) ; 化合物[Cr(NH 3)(CN)(en)2]SO 4的名称是 硫酸氰•氨•二乙二胺合铬(III )。
5 四硫氰·二氨合铬(Ⅲ)酸铵的化学式是 NH4[Cr(SCN)4(NH3)2] ;二氯·草酸根·乙二胺合铁(Ⅲ)离子的化学式是[Fe Cl2(C2O4)en]-4。
6. 下列物质的有什么几何异构体,画出几何图形(1)[Co(NH3)4Cl2]+(2)[Co(NO2)3(NH3)3]答:(1)顺、反异构(图略),(2)经式、面式异构(图略)。
7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物(内/外轨型。
(1)[Cd (NH3)4]2+ μm=0 ;(2)[Ni(CN)4]2-μm=0 ;(3)[Co(NH3)6]3+μm=0 ;(4)[FeF6]3-μm=μB;答:8判断下列配离子属何类配离子9 配合物K3[Fe(CN)5(CO)]中配离子的电荷应为 -3 —,配离子的空间构型为八面体,配位原子为 C(碳),中心离子的配位数为 6 ,d 电子在t2g 和e g轨道上的排布方式为 t2g6 e g0—,中心离子所采取的杂化轨道方式为 d2sp3,该配合物属反磁性分子。
金属原子簇化学
Aprotic Synthesis and Structural Determination of the Nanosized 6- Hexaanion Nonprotonated 3-Octahedral [Pt6Ni38(CO)48] Stabilized as a Cubic Solvated [NMe4]+ Salt Namal de Silva and Lawrence F. Dahl IC 2006 pp 8814 - 8816
CO CO CO
CO
例
推测Co4(CO)12的可能结构 9 4 + 2 12 = 60 每个中心Co的平均外层电子数 = 60/4 = 15 每个Co缺3个电子必定形成3个Co-Co键
理想结构为:
OC OC OC Co CO Co CO CO
测定结构为:
OC OC
Co
Co OC
CO CO
CO
p M L
M L
1、羰基化合物的合成与性质
合成
1)直接反应法
Ni+4CO Fe+5CO
Ni(CO)4 Fe(CO)5
1890年 第一个 200℃ 200 atm V(CO)6 Cr(CO)6
2)还原法
VCl3 + Na +CO CrCl3 + RMgX + CO
反应 1) 简单取代
Re2O7 + CO
Comparative Bonding Behavior of Functional Cyclopentadienyl Ligands and Boron-Containing Analogues in Heterometallic Complexes and Clusters P. Croizat, N. Auvray, P. Braunstein, R. Welter IC 2006 pp 5852 - 5866
配合物和簇合物的结构与性质.pptx
配位化学的奠基人—维尔 纳• 苏黎世大学年仅25岁的A. Werner从1891年起发表了“对于无机化合物的结构贡献
“等一系列论文,并于1893年在“关于无机化合物的结构问题”的论文中,将其结 构观点系统化、理论化。这就是在当今称之为“配位学说”的伟大发现。
第8页/共83页
配位学说
第9页/共83页
Werner提出副价概念,藉以补充当时不完善 的原子价理论,这是他的重要贡献之一。正 是为了满足副价的要求,主价已经饱和的分 子、离子可以进一步反应生成配合物。
内界、外界的概念说明了配合物的结构和物 理、化学性能。而Werner创造性地把有机化 学的空间结构理论扩展到无机化合物领域, 奠定了配合物立体化学的基础,这是他的又 一重大贡献。由于Werner对配位学说的杰出 贡献,1913年获得Nobel化学奖,成为获得 此项科学奖金的第一位无机化学家。
第15页/共83页
① 正八面体场
6个配位体,沿x,y,z轴接近金属原子。dz2,dx2- y2与配 体的斥力大,轨道能量上升多;dxy,dxz,dyz与配体的斥 力小,轨道能量上升少 。
接近方式如图:
z
z
z
y
x
y
x
dxz z
dyz
dxy
y
y
x
x
x
dx2-y2
dz2
第16页/共83页
d轨道分裂 为:
△ P,弱场, HS
d4
d5 d6 d7
-0.4
-0.8 -1.2
-0.6 0
-0.4
-0.8
-0.6
-1.2
d1
d2 d3
d1 d 3, d 8 d10
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(O C ) OC (C O )
(C O ) (C O )
3、某些六原子以上的金属簇常以八面体结构为基础。如 [Rh7(CO)16]3-,可以看作是单冠八面体结构
Rh Rh Rh Rh Rh Rh Rh
第三节 簇状配合物的合成 1、还原聚合 这是一种用于产生M—M键的最普通的方法。由一种较高氧化态 的化合物还原到较低氧化态,便有利于M—M键的形成。 如:1)ReO4- + Cl- + H+ + PO23-(次磷酸) [ReCl8]2甲醇 2) RuCl3 + Zn + CO Ru3(CO)12
d yz- d y z
两个Re原子剩下的dxy轨道重叠形成一个δ 键:
y
z x
x
y
δ 键的重叠取决于转动角,重叠构型δ 重叠最大,交叉构型则δ 重 叠趋向于0。由于四重键的形成,使Re—Re键具有极短的键长。 2、金属对稳定性的影响 同一族过渡金属中,较重的元素易生成M—M键。 例:[M2Cl9]3-(M=Cr、Mo、W),结构如下:
2、六原子簇以八面体结构为特征: 如:Rh6(CO)12(μ 3—CO)4
(C O ) 2 OC (C O ) 2 (O C ) 2 (C O ) 2 (C O ) 2 OC (C O ) 2 CO CO
再如:[Pt6(CO)6(μ 2—CO )6]2-为三角棱柱结构
O C (O C ) (O C ) (C O ) O C (C O ) (C O )
簇状配合物的反应
2、取代反应
C H3 C H3
Cl Cl Re
Cl Cl Re C H 3C O 2H Cl
O
O O
O O
Re
O O C H3 C H3
Re
O
Cl
Cl Cl
Cl Cl
Ru6(CO)17C + PPh3
Ru6(CO)16(PPh3)C + CO
3、氧化还原反应 1)骨架不变的氧化还原反应 Na/THF Na/THF 还原反应:Co6(CO)16 [Co6(CO)15]2[Co6(CO)14]4KOH/H2O Rh6(CO)16 K4[Rh6(CO)14] + K2CO3 + H2O 25℃
氧化反应: CO [Ir6(CO)15]2-+2H+ Ir6(CO)16 + H2 CH3CO2H THF [Rh6(CO)15]2-+I2 [Rh6(CO)15I] - + I2)骨架发生变化的氧化还原反应 还原: Na/THF Co4(CO)12 [Co6(CO)15]2THF Ru3(CO)12+NaBH 4 H2Ru4(CO)13 + H4Ru4(CO)12
3) 氧化还原缩合 这是配位化合物在不同氧化态之间的反应 THF [Fe3(CO)11]2-+Fe(CO)5 [Fe4(CO)13]2- + CO THF [Rh6(CO)15]2-+Rh6(CO)16 [Rh12(CO)30]2-+CO 第四节 1、加合反应
C H3 C H3 O O Mo O O C H3 C H3 O O Mo O O + N N O O C H3 C H3 Mo O O O O Mo C H3 C H3 O O N
CL CL CL CL CL CL CL CL
M
M
CL
CL
它由两个ReCl4结合而成,上下氯原子对齐成四方柱型,Cl—Cl 键长为3.32 Å,小于其范德华半径之和(3.40—3.60 Å),为什么上下 两组氯原子完全重叠,而不是反交叉型,且Re—Re很短。1964年, Cotton提出了四重键理论加以解释: 1)Re用dsp2杂化轨道(dx2-y2、s、px、py)与四个Cl原子成键,近似于 平面正方形(Re位于Cl原子组成的平面外0.50 Å).
N i (C O ) 3 (O C ) (O C ) N i N i (C O ) (C O ) N i (C O )
(O C )
N i (C O ) 3
Fe5(CO)15C为四方锥结构:
F e (C O ) 3
(O C ) 3 F e C (O C ) 3 F e
F e (C O ) 3
F e (C O ) 3
4) 占据骨架结构中顶点的不仅可以是同种或异种过渡金属原子 ,也可以是主族金属原子,甚至非金属原子C、B、P等。 5) 簇状配合物的结构绝大多数是三角形或以三角形为基本结构 单元的三角形多面体。 五、 配合物中配体(L)的结合状态 1、 端基:仅与一个金属原子结合M—L; 2、 线桥基:与两个金属原子结合(M—L—M),简称桥基,表示为 u2—L; 3、面桥基:结合在金属原子面的中心上(MxL,x≥3),称为面桥基 。以“ux-L” Cl M
Cl Cl Cl
Cr—Cr,3.12 Å。磁性测试表明,Cr3+存在三个未成对电子, 因此可认为不存在Cr—Cr键。 W—W,2.41Å。反磁性,无成单电子,可证明存在强W—W健。 Mo—Mo,2.67Å。磁矩为0.6-0.7B.M.,表明Mo原子间存在较 强的自旋—自旋偶合作用,说明存在中等强度的Mo—Mo键。 二、三原子簇 这些配合物的金属骨架大多是三角形的,最熟知的配合物是 [Re3Cl12]3-。其中Re原子按三角形直接键合并借卤桥间接键合。 Re—Re距离为2.47Å,比[Re2Cl8]2-(2.24 Å)要长。
第二节 各类簇状配合物简介
一、双核配合物 这类配合物研究得较多,尤以卤合物及羰合物较为普遍,如: [Re2Cl8]2-、[Mo2(SO4)4]3-、Cr2(O2CCH3)4等。
1、金属-金属多重键 M—M多重键的概念由美国学者F. A. Cotton首先提出。研究的 最充分的是:[Re2Cl8]2-和[Mo2Cl8]4-。 结构特点:M—M键极短:Re—Re为2.24 Å,Mo—Mo为2.14Å。 相应金属本身为:Re—Re为2.741Å和Mo—Mo为2.725 Å。
2)剩下的dz2、dxy、dxz、dyz轨道与另一个Re原子的相同轨道成键。 设z轴为两个原子的连线轴,则两个Re原子的dz2轨道的成单电子 配对,形成σ键;两个Re原子的dxz和dyz轨道分别重叠,形成两个 d-dπ键,一个在xz平面,另一个在yz平面。
z x x y y z
d x z -d xz
再如:B4H46-(n=4) b=(2×4+6)/2=7
m=n+2 网 B5H54-(n=5) b=(2×5+4)/2=7 m =6 m=n+1 巢(四方锥) B6H62-(n=6) b=(2×6+2)/2=7 八面体 m=n 封(八面体)
(O C )3 Ir
Ir (C O ) 3
Ir (C O ) 3
CO
CO
M 4 (C O ) 1 2 (M = C o , R h )
再如 :四面体杂原子簇Co3(CO)9C—R
R C
(O C )3 C o
C o (C O ) 3
C o (C O ) 3
四、四原子以上的簇状配合物 1、五原子羰基簇有三角双锥和四方锥两种构型。 如:[Ni5(CO)12]2-为三角双锥结构:
对称类型: 三角双锥 八面体 五角双锥 封闭型 巢穴型 网兜型 Wade规则指出: 1)硼烷结构具有三角面多面体对称类型。 2)顶点全占据为封闭型,空一个为巢穴型,空两个为网兜型。 3)每个B原子上有一个H端基连在上面,一对电子定域在B—H键上 ,其余电子均为骨架成键电子(b对)。 4)骨架成键分子轨道数(b)与结构对称性的关系为: m=b-1(m为三角面多面体顶点数目) 5)若骨架中B原子数为n, 则m=n为封闭型,m=n+1为巢穴型, m=n+2为网兜型。 例:B5H11(n=5), b=(2×5+6)/2=8 m=b-1=7五角双锥(对称类 型),m=n+2 网兜型
第十二章 簇状配合物
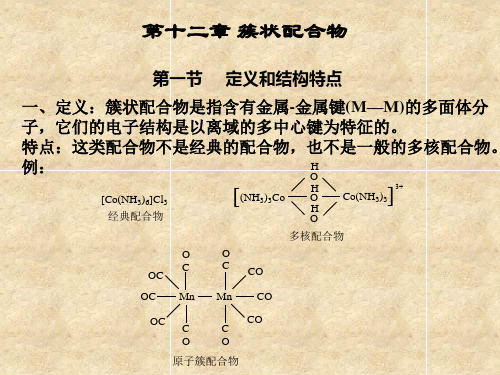
第一节 定义和结构特点
一、定义:簇状配合物是指含有金属-金属键(M—M)的多面体分 子,它们的电子结构是以离域的多中心键为特征的。 特点:这类配合物不是经典的配合物,也不是一般的多核配合物。 H 例: O
[C o (N H 3 ) 6 ]C l 3 经典配合物
[ (N H
3)3 C o
H O H O 多核配合物
C o (N H 3 ) 3
]
3+
O C OC OC OC Mn
O C
CO CO CO
Mn
C O
C O
原子簇配合物
二、M—M键的形成条件 能形成M—M键化合物的金属元素可分为两类:一类是某些 主族金属元素,它们生成无配体结合的“裸露”金属原子簇离子。 如:Ge92-、Sn94-、Pb94-等。它们不属于配合物。 另一类是某些金属元素在形成M—M键的同时,还与卤素、 CO、RNC、膦等发生配位,即为簇状配合物。 1、金属对M—M键形成的影响 M—M键越强(高熔点、高沸点金属)→趋向于生成M—M键 (第二、第三过渡系); 金属氧化态越低,越易形成M—M键。这是由于高氧化态 价 轨道收缩(电子密度减小) 不利于形成M—M键。 2、 配体对M—M键形成的影响 经典饱和配体(X—、O、S) 与周期表左下过渡金属形成簇合 物, 如Nb、Ta、Mo、W等。 π 电子接受配体(CO、CN-、PR3),CO最为重要,除Hf外, 其他过渡金属元素羰基簇合物均有报道。
2、氧化聚合 此法多用于简单的羰基金属阴离子的氧化反应。 如:Fe(CO)5 + OH- + MnO2 Fe3(CO)12 + HCO3- + MnO 3、缩合反应 1)羰基化合物的热解 60℃ Co2(CO)8 Co4(CO)12 + CO 60—80℃ Rh4(CO)12 Rh6(CO)16 + CO 2)光辐射 hυ Fe(CO)5 Fe2(CO)9 + CO 冰醋酸 hυ Re2(CO)10+Fe(CO)5 [ReFe2(CO)12]Et2O
