第6章 过渡金属羰基配合物及原子簇合物
《结构化学第六章》
产生磁性的原因: 物质具有不同的磁性,首先是源于物质内部的电子组
态,即电子在原子轨道和分子轨道上的排布情况;其次是 源于化学成分、晶体结构、晶粒组织和内应力等因素,这 些因素引起磁矩排列的情况不同。
.
物质的磁结构分类:
.
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合物、 自由基和含有奇数电子的分子等顺次性物质结构的一种重 要方法,它又称为电子顺磁共振(EPR)或电子自旋共振 (ESR)。 原理:
.
三种成键方式(自由基反应):
6.5.3 簇合物的催化性能(自学)
.
6.6 物质的磁性和磁共振
磁性是普遍存在的一种物质属性,任何一种物质材料 都有磁性,只不过表现形式和程度有所不同。物质的磁性 常用磁化率х或磁矩μ表示。磁化率是在外磁场H中物质 磁化强度M和磁场强度H的比值:
M/H
Χ是一个无量纲的量。
因子是为了使δ得到一个便于表达的数值。
对于扫频仪器,δ可以如下表达成
Δ是i 无量v纲 v参的,1由0于6 乘10v6因i v子参v,参所以1单0位6为ppm。
.
影响化学位移的因素: (1)核外电子分布 (2)抗磁各向异性效应 (3)溶剂效应和氢键的影响
.
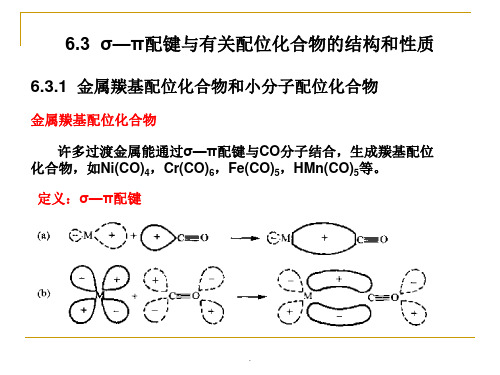
3.磷、砷、锑、铋的三价化合物,如PF3、PCl3、AsCl3、 SbCl3、PR3等也可作为配位体形成σ—π配键。P、As等原子除 有一孤对电子可以作为电子对的供给者,与M形成σ键外,它还 有空的d轨道可和M形成反馈π键,使配位化合物稳定存在,例如 Pd(PF3)4、HCo(PF3)4、Ni(PF3)4、(R3P)4Mo(CO)2等。
.
6.3.2 不饱和烃配位化合物
以不饱和烃为配位体,通过σ—π配键与过渡金属形成的 配位化合物,在石油化工中占有重要地位。
第6章 过渡金属羰基配合物及原子簇合物

6.4.1 硼烷及杂硼烷的结构理论 1. 硼烷簇合物的结构 硼烷簇合物可以分成三大类 (1)BnHn2-(BnHn+2),顶点全被硼原子占据,构 成“闭式”多面体笼形结构,用closo表示。 (2)BnHn4-(BnHn+4),空出一个顶点形成的笼开 一个口子,称“巢式”结构,用nido表示。 (3)BnHn6-(BnHn+6),空出两个顶点,称“网式” 结构,用arachno表示。
表6-2 过渡金属羰基配合物的红外光谱数据
CO类型
游离CO 端基CO μ2-CO μ3-CO
IR(cm-1)
2143 1850-2120 1700-1860 1600-1700
6.4 原子簇合物的结构理论与Wade规则 过渡金属羰基簇合物一般是由三角形面构成 的多面体,由成簇的过渡金属原子构成骨架,两个 过渡金属原子之间构成骨架边。对于那些由4个以 下的过渡金属原子组成的簇合物,骨架边是由两电 子双中心构成的化学键,它们都符合EAN规则。但 是,对于含有5个或5个以上的过渡金属原子组成的 簇合物,金属-金属成键的数目增加,明显偏离EAN 规则。随着研究的深入,人们发现,过渡金属羰基 簇合物与多面体硼烷,杂硼烷等的电子结构上有共 性。七十年代,Wade等人提出的解决多面体硼烷, 杂硼烷结构问题的骨架成键电子对理论,它同样也 适合于过渡金属羰基簇合物。
1 光照或加热法
2Fe(CO)5
3Fe2(CO)9
hv
Fe2(CO)9
2Fe3(CO)12 +
+
CO
hv或
3CO
2Os(CO)5
hv或
Os2(CO)9
+
CO
2 还原偶联法:
Na/Hg 5Ni(CO)4 NaOH/MeOH
金属羰基配合物

Mn(CO)4(3-CH2=CH2-CH3) 4CO=8, (3-CH2=CH2-CH3)=3, Mn=7, 电子总数=8+3+7=18
Cr(6-C6H6)2 2(6-C6H6)=12,Cr=6, 电子总数=12+6=18
Ni+4CO 常温常压 Ni(CO)4(m.p.-25℃) △ Ni+4CO
由于Fe、Co、Ni的相似性,它们常常共存。但是 由于金属Co与金属Ni同CO的作用条件不同(Co和Fe必 须在高压下才能与CO化合,Ni在常温常压就可作用) ,从而利用上述反应就可分离Ni和Co,以制取高纯度 的Ni。
1891年,Mond还发现CO在493 K和2×107 Pa
④ 对NO等三电子配体:
Mn(CO)4(NO)
NO
3,
4CO
8,
+) Mn
7,
3+8+7=18
⑤ 含M-M和桥联基团M-CO-M。其中的化学键表示 共用电子对,规定一条化学键给一个金属贡献一个电子。
如 Fe2(CO)9 其中有一条Fe-Fe金属键和3条M-CO-M桥 键对每一个Fe :
Fe=8,(9-3)/2 CO=6, 3 M-CO =3,1 Fe-Fe=1,
[Mn(CO)5]- + Na+
③ 估算多原子分子中存在的M-M键数,并推 测其结构
如 Ir4(CO)12 4Ir=4×9=36,12CO=12×2=24, 电子总数=60,平均每个Ir周围有15e。
按EAN规则,每个Ir还缺三个电子,因而每个Ir必 须同另三个金属形成三条M-M键方能达到 18e 的要求
王顺荣编高教版社结构化学习题答案第6章

(dxy)
(dz2)
(dxz,dyz) LFSE(D4h)=-[2× 0.228+2× (-0.428)+4× (-0.514)] =2.456 所以,LFSE(D4h)>LFSE(Td),即 Ni2+的低自旋配合物通常为正四方形构型。 若 Ni2+的高自旋配合物呈四面体构型,则 d 电子排布如图:
14、为什么羰基配合物中过度金属原子可以是零价(例如 Fe(CO)5) ,甚至是负 价(例如[Co(CO)4]-)? 答:CO 分子的结构为:KK(3σ)2(4σ)2(1π)4(5σ)2(2π)0 可见 CO 分子 中既有低能的 π 占有轨道----1π,又有高能的 π 空轨道----2π,CO 被占用的分子 轨道中,3σ 轨道中电子云大部分密集于 C 和 O 核之间,电子不易给出。4σ 轨道 中电子云主要集中于氧原子一侧, 由于氧的电负性较大, 电子也不易给出。 所以, 能对中心离子给予电子对而形成 σ 键的 CO 的分子轨道只有 1π 和 5σ 轨道。 在 Fe(CO)5 中,中心原子与配位体 σ 轨道,即 CO 的 5σ 轨道可形成 a1g t1u 和 eg 成键 σ 轨道,有 5 个 CO 共 10 个电子填充。这相当于配位体上的电子部分与中
结构化学第六章 配位化合物和簇合物的结构与性质习题解答
组员:林景 070601332 邱丽清 070601327 王华 070601328 林培海 070601349
黄水英 070601329 余建红 070601330 刘梅丽 070601331
1、为什么大多数配合物都有鲜艳的颜色,而四面体 Zn2+的配合物却例外? 答: 配合物中心金属原子或离子的 d 轨道分裂后,在光照下 d 电子可从能级低的 d 轨道跃迁到能级高的 d 轨道,产生 d—d 跃迁和吸收光谱。由于 d—d 跃迁对应 的光子频率在近紫外和可见光区,故过渡金属配合物通常都有颜色。Zn2+的 3d 轨道已充满电子,它通常以 sp3 杂化 轨道形成配建,无 d—d 能级跃迁,电子跃 迁只能发生在 σ—σ*之间,能级差大,在可见光的短波之外。因此,在配位化合 物一般是无色的。
第六章 配位化合物和簇合物的结构与性质

d 轨道与配体间的作用:
图1-1
图1-2 d 轨道在 Oh 场中的能级分裂
2.正四面体场
中心离子位于立方体的中心,在立方体的八个角上每 隔一个角(上下错开)放一个配体。 与八面体场相 反,dz2,dx2- y2的角度极大值指向立方体的面心; 而dxy,dxz,dyz的极大值指向立方体四个边线的中心. 前者离配体较远,斥力小,轨道能量上升少;后者 与配体的斥力大,轨道能量上升多。图形如1-3所示
1. 离子水化热和MX2的点阵能
➢ 考察第一系列过渡金属二价离子由Ca2+— —Zn2+,由于3d电子层受核吸引增大,水合热 理应循序增加,但实际受LFSE(配位场稳定化 能)的影响,出现如图所示形状,它是按弱场 情况变化的。
Ca2+——Zn2+ 由于电子层数3d不变,而核电荷递增, 使3d电子壳层收缩,二价金属离子半径递减。
eg* ,半径又增加,这样便得到一个乡下的双峰曲线,
低自旋6配位的配合物离子半径变化应该是向下的单峰 曲线 。
• ★ 在对称的非线性分子中,系统不可能
在轨道简并状态下保持稳定,而必然要 发生畸变使得轨道能级发生分裂,以消 除这个简并性,这就是姜-泰勒效应。
• 例如:[d(x2-y2)] 2[d(z2)]1和[d( x2-y2)] 1[d
9 10 n
第一序列二价和三价金属离子的6配位化合物离子的半 径随原子序数增大而递减,对高自旋配位化合物而言,从d (0)到(3)离子,d电子逐步进入 t2g轨道,因有效核电 荷逐步增加,故半径逐渐减小,但d(4)d(5)离子中电子 进入eg*轨道,使配位体受到的电子云斥力增加,因此半径 反而增加,d(6)d(7)d(8)离子中电子又进入 t2g轨道, 离子半径又逐渐下降,到d(9)d(10)离子电子又进入
《N杂芳环配位的过渡金属及稀土—过渡金属羰基配合物的合成、CO释放和发光性质研究》范文

《N杂芳环配位的过渡金属及稀土—过渡金属羰基配合物的合成、CO释放和发光性质研究》篇一N杂芳环配位的过渡金属及稀土-过渡金属羰基配合物的合成、CO释放和发光性质研究一、引言随着对配合物研究的深入,杂芳环配位的过渡金属和稀土-过渡金属羰基配合物因其独特的物理化学性质和潜在的应用价值,已成为化学领域的研究热点。
本文旨在研究此类配合物的合成方法、CO释放行为以及发光性质,以期为相关领域的研究和应用提供理论依据。
二、N杂芳环配位的过渡金属羰基配合物的合成(一)实验材料及仪器本文实验所使用的试剂包括N杂芳环配体、过渡金属盐、羰基前驱体等。
实验仪器包括分光光度计、热重分析仪、X射线衍射仪等。
(二)合成方法以N杂芳环配体和过渡金属盐为原料,通过溶液法或固相法合成目标配合物。
在反应过程中,控制反应温度、时间、溶剂等因素,得到纯度较高的目标配合物。
(三)合成结果与讨论通过分光光度计、X射线衍射仪等手段对合成的配合物进行表征,确定其结构。
同时,通过热重分析仪研究配合物的热稳定性。
结果表明,合成的配合物具有较高的纯度和良好的热稳定性。
三、稀土-过渡金属羰基配合物的合成(一)实验材料及仪器本文实验所使用的试剂包括稀土盐、过渡金属羰基前驱体等。
实验仪器与上文相同。
(二)合成方法以稀土盐和过渡金属羰基前驱体为原料,采用类似的方法合成稀土-过渡金属羰基配合物。
在反应过程中,需注意控制稀土与过渡金属的比例以及反应条件。
(三)合成结果与讨论通过表征手段确定合成的稀土-过渡金属羰基配合物的结构。
结果表明,该类配合物具有独特的结构和性质,为进一步研究其性质提供了基础。
四、CO释放行为研究(一)实验方法利用分光光度计、质谱仪等手段,研究CO从配合物中释放的行为。
通过改变温度、压力等条件,观察CO的释放情况。
(二)实验结果与讨论结果表明,CO的释放与温度、压力等因素密切相关。
在一定的温度和压力下,CO能够从配合物中稳定地释放出来。
此外,不同类型和结构的配合物其CO释放行为也存在差异。
第6章-成键

Fe
CO
Re
Co Co
Co
OC
CO
Os Os
Os
H
H
与三原子簇相同的另一个规律性是配合物颜色变化的趋势,即同 族元素,由上到下颜色越淡,就同一种金属而言,簇中金属原子数越 多,颜色越深 Fe(CO)5 淡黄色l Co2(CO)8 橙红色s Fe2(CO)9 金黄色s Co4(CO)12 黑色s 深 Fe3(CO)12 墨绿色s Rh4(CO)12 红色s Fe4(C5H5)4(CO)4 墨绿色s 加深 Ir4(CO)12 黄色s 淡
缩短
b.
c.
同族的簇状配合物稳定性变化: 较重的元素易生成M-M键
3.氧化态为0的双核金属配合物
CO配合物 如 Mn2(CO)10为非桥结构 Fe2(CO)9为三桥式结构 Co2(CO)8 固态--桥结构 O
OC OC OC Co C O C CO Co CO CO
溶剂中(烃类)--非桥
OC
CO Co OC CO
Cl
Re
Cl
Cl
Cl
Cl
Cl
Cl Re
Cl
Re Cl
Cl
Cl
Cl
Re−Re键能根据振动光谱数据估计为114−130 Kcal/mol, 此
值除了C≡C三键和N≡N三键外比其它双原子键能都高.
如[ReCl8]2−、[MoCl8]4−, 它们有两个结构特点:
(1) M−M距离极短, Re−Re为2.24 Å ,相应的金属键本身的 平均值为2.74 Å;Mo−Mo为2.14 Å ,对应的金属键本身的 平均值为2.75 Å 。 (2) 有两种可能的构型: 即两个MCl4重叠取向与交错取向。
co五六及其它多核具有五金属原子以上的簇合物大多以金属羰合物为基础有的则以金属羰基簇衍生而来目前已合成的最大金属簇合物可多达30个铂原子或以上如pt1五核羰基簇的已知结构框架结构框架有三角双锥和四方锥两种co15c在底面中心处nininininicooccofefefefefeco18这样组成新四面体冠八面体加冠与未加冠的八面体部分rhrh距离平均值很相近约为276而加冠的八面体部分rhrh距离平均距离则为293说明加冠的rhrh键弱些
第6章+3节+类似羰基化合物

能够生成稳定配合物的金属
• 制备方法:低温基质隔离技术。
Ti Zr Hf V Nb Ta Cr Mo W Mn Te Re Fe Ru Os Co Rh Ir Ni Pd Pt
稳定性差
Cu Ag Au
在类似羰基有机金属化合物中,金属一般处于低 氧化数,同时还有其他配体(如NH3、膦等)存在。
2.N2分子的分子轨道和键性质
CH2=CH2 + H2
Rh(PPh3)3Cl Wilkinson催化剂
CH3-CH3 金属离子作用
与 氢 结 合 削 弱 键
与 烯 烃 结 合 削 弱 键
提 供 H 原 子 转 移 通 道
H-H
C-C
(2).烯烃醛基化
• 即:CO、H2和烯烃在Co和Rh反应生成醛。
RHC=CH2 + CO + H2
[Ru(NH3)5(N2)]Cl2
[RhCl(N2)(ppr3)2] {[η5-C5M5)2Ti]2(N2)} {[(PCy3)2Ni](N2)} 自由N2
210
255 200.5 117
112
83 116.6 112 109.8
直线
176.8 178.2
Ⅰ
Ⅱ Ⅲ Ⅴ
2105
2100
2330
二.亚硝酰基(NO)配合物
N2分子的最高占有 轨道能量更低,故 氧化比CO难。 即:N2生成的配合 物不如CO稳定。
-14.0ev
-15.6ev杂。
分为三类:端基配位;桥基配位;侧基配位;
4.分子氮配合物中M-N2键的本质
• (1)端基配位
N2用最高占有3g轨道与 金属轨道成键,即配体为 电子给予体; N2用最低空1*g轨道接受 金属d电子,即配体为电 子接受体;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
n=8 BnHn4-
nido
n=7 BnHn6-
arachno
图6-5 三类硼烷簇合物的结构(•代表硼原子,省略H)
Wade根据量子化学定量计算结果得出结论:
硼烷、硼烷衍生物及其它原子簇配合物的结构,
由其骨架成键电子对数决定,因而也称为骨架
成键电子对理论。若骨架成键电子对数以b表示, 形成骨架的硼原子数以n表示,那么
2Os(CO)5
hv或
Fe2(CO)9
+
CO
2Fe3(CO)12 + 3CO
Os2(CO)9
+ CO
2 还原偶联法:
5Ni(CO)4
Na/Hg NaOH/MeOH
[Ni5(CO)12]Na2
M(CO)6 + M=Cr,Mo,W
NaBH4
60℃ THF
Na2[M2(CO)10]
3 缩合法
(CO)5ReBr + NaMn(CO)5 → (CO)5Mn-Re(CO)5 + NaBr 2 NaMn(CO)5 + HgSO4 → (CO)5Mn-Hg-Mn(CO)5 + Na2SO4
σ
* 2p
2P
2s C
π
* 2p
2P
σ 2p
π 2p
σ
* 2s
2s
σ 2s
CO
O
图3-18 CO分子轨道的能级示意图
M
+
CO
M
CO
(a) M
C σ-键
M
+
CO
M
(b) M
C π- 键 ( 反 馈 键 )
CO
图3- 23 M-CO的化学键
6.3.2 过渡金属羰基配合物及羰基簇合物的 结构
1 过渡金属单核羰基配合物[M(CO)x]
CO
M
OC CO
OC
M=Ni,Pd
CO OC
M CO
OC CO
M=Fe,Ru,Os
CO CO
OC M CO
OC CO
M=V,Cr,Mo,W
2 过渡金属双核羰基簇合物[M2(CO)x]
CO CO OC OC Co Co CO
OC OC CO
O
OC
C
CO
Co Co CO OC
OC C CO O
Co2(CO)8(溶 液 )
b = (3n+n+m-2n)/2 = (2n+m)/2
根据骨架成键电子对数b与多面体顶点n的关系,参考表 6-3原子簇的结构及其对称性,即可以知道某一特定硼烷离 子或分子的结构,如:
B6H62- b=(2×6+2)/2=14/2=7 n=6 7=n+1
八面体(Oh) 闭式
如果配合物不是八面体对称而是其它几何构型,成键电 子对数就不会是7,如
B6
eg*
6×SPz
t1u*
a1g
Px
骨架成键
t1g*
6×Pπ
t2u*
Py
tIu
t2g
2. Wade规则的分子轨道理论
H H
B
B H
HB
B B
BH
H
B
H
a
b
图6-6 B6H62-的八面体结构
6个sp 杂化AO
e*( σ) t*2u(π) t*1g(π) t1u(σ*/π)
t1u(π/σ*) t2gπ( ) a1g(σ)
M
M
M
M
M4(CO)12,M=Co,Rh
M
M
M
M
M
M
Ir
Ir
Ir
Ir
Ir4(CO)12
Fe Fe
Fe
Fe3(CO)12
M M
M
M3(CO)12,M=Ru,Os
图6-3 过渡金属多核羰基簇合 物结构(图中“·”表示CO配体)
M6(CO)16,M=Co,Rh
O C MM
μ2-CO
O C
M MM
μ3-CO
Os(CO)5 + H2
8MPa 100~300℃
H2Os(CO)4 + CO
6.2.2过渡金属羰基簇合物的反应 1 置换反应
Mn2(CO)10 + PH3
hv
hv Fe2(CO)9 + bipy
Fe2(CO)9 + PH3
Mn2(CO)9PH3 + CO Fe2(CO)7(bipy) + 2CO Fe(CO)4PH3 + Fe(CO)5
成“闭式”多面体笼形结构,用closo表示。 (2)BnHn4-(BnHn+4),空出一个顶点形成的笼开
一个口子,称“巢式”结构,用nido表示。 (3)BnHn6-(BnHn+6),空出两个顶点,称“网式”
结构,用arachno表示。
5 n=5
6 n=6
n=4
n=3
n=5
n=4
9
n=9 BnHn2-
图6-4 CO的桥式配位
表6-2 过渡金属羰基配合物的红外光谱数据
CO类型
游离CO 端基CO μ2-CO μ3-CO
IR(cm-1)
2143 1850-2120 1700-1860 1600-1700
6.4 原子簇合物的结构理论与Wade规则
过渡金属羰基簇合物一般是由三角形面构成
的多面体,由成簇的过渡金属原子构成骨架,两个 过渡金属原子之间构成骨架边。对于那些由4个以 下的过渡金属原子组成的簇合物,骨架边是由两电 子双中心构成的化学键,它们都符合EAN规则。但 是,对于含有5个或5个以上的过渡金属原子组成的 簇合物,金属-金属成键的数目增加,明显偏离EAN 规则。随着研究的深入,人们发现,过渡金属羰基
第6章 过渡金属羰基配合物及 原子簇合物
CO与过渡金属组成的配合物称之为 过渡金属羰基配合物。含一个过渡金属 的单核羰基配合物及含两个以上过渡金 属并存在金属-金属键的多核配合物, 也称之为羰基簇合物。
表6-1 过渡金属羰基配合物
ⅣB ⅤB
ⅥB
ⅦB
ⅧB
ⅨB
Ti V(CO)6 Cr(CO)6 Mn2(CO)10 Fe(CO)5
ⅩB ⅪB Ni(CO)4 Cu
Fe2(CO)9 Co2(CO)8
Fe3(CO)12 Co4(CO)12
Zr Nb Mo(CO6 Tc2(CO)10 Ru(CO)5 Rh2(CO)8 Pd
Ag
Rh4(CO)12
Ru3(CO)12 Rh6(CO)16
Hf Ta W(CO)6 Re2(CO)10 Os(CO)5 Ir2(CO)8
簇合物与多面体硼烷,杂硼烷等的电子结构上有共 性。七十年代,Wade等人提出的解决多面体硼烷, 杂硼烷结构问题的骨架成键电子对理论,它同样也 适合于过渡金属羰基簇合物。
6.4.1 硼烷及杂硼烷的结构理论 1. 硼烷簇合物的结构
硼烷簇合物可以分成三大类 (1)BnHn2-(BnHn+2),顶点全被硼原子占据,构
表6-4 非过渡金属簇单位可能提供的电子数(V-2+X)
簇单位
V
E
M(X =0)
MH ML(X=1)
MH2 ML(X=2)
1
Li, Na
0
1
2 Be, Mg, Zn, Cd, Hg 0
1
2
3
B, Al, Ga, In, Tl
1
2
3
4 C, Si, Ge, Sn, Pd 2
3
4
5
N, P, As, Sb, Bi
b = n+1 b = n+2 b = n+3
n个顶点的闭式多面体 n+1个顶点的巢式多面体 n+2个顶点的网式多面体
BnHn2-(BnHn+2) BnHn4-(BnHn+4) BnHn6-(BnHn+6)
(2)分子轨道理论 以 B6H62- 为例
B
S
S Pz
Pz
S Pz
B 价电子组态 2S22P1
Co2(CO)8(固 体 )
OC
O C
CO
OC OC
CO Fe Fe
C
O
C
CO
O
Fe2(CO)9
O
C OC
CO
COOC
OC
CO
OC Os Os CO
OC M M CO
OC COOC
CO
OC
CO
COOC
Os2(CO)9
M2(CO)10,M=Mn,Tc,Re
图6-2过渡金属双核羰基簇合物结构
3 过渡金属多核羰基簇合物
CrCl3 + Al + 6CO 3A0lMCPl3aCr(CO)6 + Al Cl3
300℃ OsO4 + 9CO 30.4MPa
Os(CO)5 + 4CO2
6.1.2过渡金属羰基簇合物的合成
过渡金属羰基簇合物也可用直接羰 化法和还原羰化法来合成。
150℃ 2Co + 8CO 5MPa
Co2(CO)8
b=[2×3+7×2+4]/2=12
Re2O3 + 16 CO 250℃ 35MPa
Re2(CO)10 + 6CO2
150℃ 3Ru(acac)3 + 12CO + 1.5H2 20MPa
Ru3(CO)12 + 3Hacac
以单核过渡金属羰基配合物为原料合成簇合物 更普遍。
1 光照或加热法
hv 2Fe(CO)5
3Fe2(CO)9
hv或
