过渡金属簇合物中金属-金属键
金属四重键和五重键

含
其他簇合物
原子簇化合物的反应性能
配位体置换反应 (1)
M M' M
+CO,NO RNC (8)配位 (7)氧化还原
(2)加成 +M’
M
σ2π4δ2
M
(3)环化
+M M
M M
M M
低键级化合物
±e
(6)催化 hν
(4)加成 +H+
M
H M
★具有 M
M四重键的化合物,可以进行置换、加成、环化、氧化还原多种形式
上述 Cr原子的成键方式与分子的结构及其 性质相符合。实验测定Cr~ Cr间的键长 183.51pm 比已测定结构 的c-cr四重键 的键 长要 短在 2 —300K 温度下测定的Ar CrCrAr 磁化率不随温度改变以及数值很小等数据, 符合两个 cr原子的d5-d5成键配对结合成五重 共价键的结构。
+
+
+
+
+
+
dxz
+
-
-
+
d z2
z
+
+
+
+
+
+
x
y
为什么是重叠型而不是交错型?因为重叠型使 dxy和dxy(或dx2-dy2与dx2-dy2)能进行有效的δ重 叠,但交错型时,这种重叠趋势趋于0,重叠型的 δ重叠结果使Re与Re之间形成一条δ、两条π和一 条δ四重键,因而键距很短,键能很大,约为300 到500kJ.mol-1,比一般单键或双键能都大,故能稳 定存在。
综合上所
述结构所 得的分子 化学结构 式示于右 图
第9章金属原子簇和金属-金属键

每个Nb为40/6, 同样很难用18或
16e规则描述。
如果把12个Cl-去掉,则6个Nb还剩 下16个价电子。八面体有八个面,相当 于每个面只有2个e-,即形成的是三中心
2e- 键。
Nb
Nb 2eNb
Synthesis and Structural Characterization of Compounds Containing the [Zr6Cl18H5]3Cluster Anion. Determination of the Number of Cluster Hydrogen Atoms Linfeng Chen, F. Albert Cotton,* and William A. Wojtczak
(1)氧化还原
6[RhC16]3-+23OH-+26 CO+CHC13
0.1MPa, 298K CH3OH
[Rh6(CO)15C]2-+11CO2+39C1-+12H2O 14 NbC15+16Nb+20NaC1
1123K
5 Na4Nb6C118
(2)氧化还原缩合
Rh4(CO)12 +Rh(CO)4
Mo6C184+:
Mo612+ = 6×6-12 = 24;
8C1- = 16; 总数= 40,每个Mo为40/6,这很难用
18或16e规则描述。
其中六个钼原子构成一个八面体,在 八面体的每个面上方有一个氯原子。因 此,Cl- 离子应为面桥基配位,Mo6C184+ 应写作Mo6(3-C1)84+。
Mo6S84–
9.1.4 无配体金属原子簇
无配体金属原子簇(non-ligang
metal ciuster)也称为裸原子簇(naked
第6章 过渡金属羰基配合物及原子簇合物

6.4.1 硼烷及杂硼烷的结构理论 1. 硼烷簇合物的结构 硼烷簇合物可以分成三大类 (1)BnHn2-(BnHn+2),顶点全被硼原子占据,构 成“闭式”多面体笼形结构,用closo表示。 (2)BnHn4-(BnHn+4),空出一个顶点形成的笼开 一个口子,称“巢式”结构,用nido表示。 (3)BnHn6-(BnHn+6),空出两个顶点,称“网式” 结构,用arachno表示。
表6-2 过渡金属羰基配合物的红外光谱数据
CO类型
游离CO 端基CO μ2-CO μ3-CO
IR(cm-1)
2143 1850-2120 1700-1860 1600-1700
6.4 原子簇合物的结构理论与Wade规则 过渡金属羰基簇合物一般是由三角形面构成 的多面体,由成簇的过渡金属原子构成骨架,两个 过渡金属原子之间构成骨架边。对于那些由4个以 下的过渡金属原子组成的簇合物,骨架边是由两电 子双中心构成的化学键,它们都符合EAN规则。但 是,对于含有5个或5个以上的过渡金属原子组成的 簇合物,金属-金属成键的数目增加,明显偏离EAN 规则。随着研究的深入,人们发现,过渡金属羰基 簇合物与多面体硼烷,杂硼烷等的电子结构上有共 性。七十年代,Wade等人提出的解决多面体硼烷, 杂硼烷结构问题的骨架成键电子对理论,它同样也 适合于过渡金属羰基簇合物。
1 光照或加热法
2Fe(CO)5
3Fe2(CO)9
hv
Fe2(CO)9
2Fe3(CO)12 +
+
CO
hv或
3CO
2Os(CO)5
hv或
Os2(CO)9
+
CO
2 还原偶联法:
Na/Hg 5Ni(CO)4 NaOH/MeOH
簇状配合物.

③面桥基:与多面体中同一面的几个金属原子相连 的配体称为“面桥基”以μx—L表示。 由于簇状配合物的结构多以三角面为基本结构单元, 故面桥基以μ3—L最为常见。
例如:
[Fe4(µ3-CO)(µ2-CO)3(CO)9]2- M4(µ2-CO)3(CO)9(M=Co,Rh)
3. 键能 一般规定M—M键能达到20Kcal∕mol附近即认
为金属键存在。
注意:不同金属M-M键能的比较一般须在同 类配合物及同种测定方法的情况下进行比较判断。
三、结构特点及表示形式 1. 结构特点
(1)簇状配合物的结构是以成簇的金属原子所 构成的金属骨架为特征,骨架中的金属原子以一种 多角形或多面体排列着。
在簇状配合物中三种键合状态的羰基——端羰基、桥 基、面桥基可由红外光谱的羰基伸缩频率来区别。
C-O基类型 C-O键长(埃) 频率(cm-1)
端基
1.12-1.19
2150-1950
桥基
1.165-1.20
1900-1750
面基
1.19-1.22
1800-1700
由端基→桥基→面基红外光谱的羰基伸缩频率逐 渐减小。
Re3X9L3类三原子簇中M—M成键分子轨道
在Re3X9L3中1个Re3+为5d4,3个Re3+离子共有 12个电子,这12个电子全部填充在成键轨道上, 因此成键轨道全部占满。具有最大的M—M键合 为双键,成键电子都配对,化合物是反磁性的。
若从电子配对法来看,由于有6对电子配给Re3三 角形的3个Re—Re边,每个边可分到2对电子。所 以每个Re—Re键是一个双键,组成一个σ键和一个 垂直于Re3平面的π键。
第五章有机过渡金属化合物和过渡金属簇合物教材

Os(CO)5 Ir2(CO)8
Hf
Ta W(CO)6 Re2(CO)10
Pt
Au
Os3(CO)12 Ir4(CO)12
不稳定的羰基化合物如Ti(CO)6,Pb(CO)4,Pt(CO)4,Fe(CO)4,Ni(CO)3 等,可利用CO与金属原子在稀有气体基质中低温合成,这种技术称为基 质隔离法,在类似的条件下使稳定的羰基化合物发生光分解作用也能够制 备这类化合物。
17
§5.2 过渡金属羰基化合物
1. 概 述
过渡金属及其化合物与一氧化碳反应(直接或在还原剂存在
下),生成羰基化合物,一些典型的二元羰基化合物的合成:
Fe + 5CO
200℃ 高压
Fe(CO)5
250℃
OsO4 + 5CO 3.5 MPa Os(CO)5 + 2O2
115℃,7 MPa
2CrCl3 + 12CO + LiAlH4 乙醚 2Cr(CO)6 + LiCl + AlCl3 + Cl2 + H2
若只考虑价层电子,则金属价电子数加上配体σ电子数 的总和等于18的分子是稳定的,EAN规则亦称为18电子规则。
对于第二、第三系列过渡金属d8组态离子,它们的p轨 道能量较高,不能全部参加成键,以致生成平面正方形配合 物时16或14电子比18电子更稳定。
9
3. 配体分类和电子数计算
根据配体与金属键合的本质将配体分为:
挥发性
[LiMe]4 [BeMe2]x [AlMe3]2
21.96 39.08 72.09
四面体型聚合物
难熔
线型聚合物
在200℃升华
二聚物
在15.4 ℃熔化
化学竞赛 过渡金属元素为骨架的原子簇合物
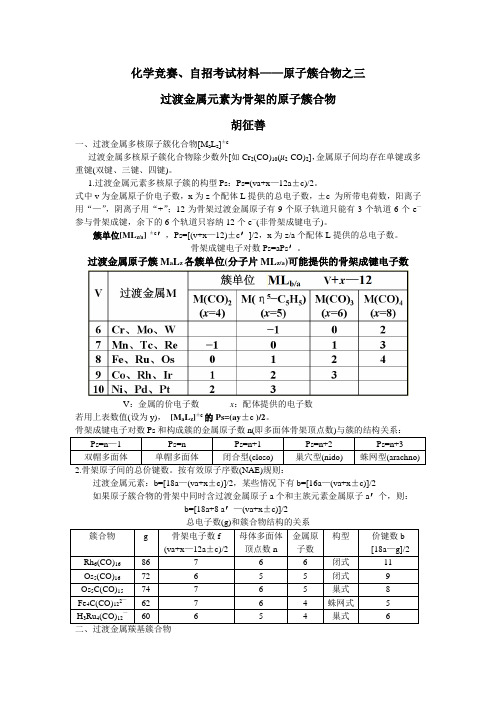
簇单位[MLz/a] ±c′,Ps=[(v+x—12)±c′]/2,x 为 z/a 个配体 L 提供的总电子数。 骨架成键电子对数 Ps=aPs′。
【例 3】Fe5(CO)15C Wade 规则:写作[Fe(CO)3]5C,f{[Fe(CO)3]5C}=[5×(8+6—12)+4]/2=7=5+2,属开(巢)式。 NAE 规则:5Fe 满足 18e—需 90e—,而 5Fe 提供 40e—,15CO 提供 30e—,C 提供 4e—,缺 90 —40—30—4=16e—,5 个 Fe 原子间需共用 8 对电子(Fe—Fe 金属键)。Fe5(CO)15C 结构如图
(2)Re3Cl123—:3 个 Re 过程三角骨架,含 9 个 μ1-Cl 键、3 个氯桥 μ2-Cl 键。 (3)(M6X8)4+(M=Mo、W)型的(Mo6Cl8)4+:[Mo6(μ3-Cl8)]4+
(Mo6Cl8)4+中 Mo 的价电子数:Mo612+=6×6—12=24,8Cl—=16,总数 40,每个 Mo 分摊 40/6。 很难用 18e—或 16 e—规则说明。6 个 Mo 原子构成一个八面体,在八面体的每个面正上方有 一个 Cl—以面桥基配位(μ3-Cl)。若把 8 个 Cl—取走,Mo612+=24e—,八面体的棱边正好是 12 个 Mo—Mo 键。 (4)(M6X12)2+型(M=Nb、Ta)的(Nb6Cl12)2+:[Nb6(μ2-Cl12)]2+
金属有机化学2过渡金属络合物的性质
化合物
CH2=CH2 K[Pt(CH2=CH2)Cl3] [Pt(CH2=CH2)Cl2]2 反式[Pt(C2H4)(NH3)Cl2] 反式[Pt(C2H4)(NH3)Br2] [Pd(C2H4)Cl2]2 K[Pd(C2H4)Cl3] [Ag(C2H4)]+ [(C2H4)Mn(CO)3]+AlCl4[(C2H4)Fe(C5H5)(CO)2]+ [(C2H4)Mo(C5H5)(CO)3]+ [(C2H4)W(C5H5)(CO)3]+
很早以前,N.V.Sidgwick提出了一个经验规则: 稳定的过渡金属有机络合物中,金属的电子数与配位体提供的 电子数总和与本周期中的惰性气体的电子数相同。 例如: Ni(CO)4
Ni 原子序数 28,外围28个电子。 4 个CO 2×4=8 个电子 EAN=36,与惰性气体Kr的电子构型相同。 [Ag(NH3)4]+ Ag 原子序数 47,外围46个电子。 4 个NH3 2×4=8 个电子 EAN=54,与惰性气体Xe的电子构型相同。
这种成键的结果,使烯烃的π轨道中电子云密度 降低,而烯烃的反键轨道π*中电子云密度增加, 意味着烯烃键的削弱,或活化。这可从键长数据 看出,正常的C-C双键键长为1.34Å ,而在烯烃 的过渡金属络合物中,烯烃的键长为1.40-1.47 Å ,说明此双键已具有某些单键的性质,即被活 化了。
烯烃-过渡金属络合物红外光谱数据
M
CO
❖ 实验表明这些络合物C-O键比CO中的C-O键长,红外光谱伸 缩振动频率变小,说明被配位的CO中C-O键被削弱,M-C键 键长要比正常单键短。
V(CO)6- Cr(CO)6 Mn(CO)6+ Fe(CO)5
IR(cm-1)
64 金属-金属四重键
(1)Mn2(CO)10
每个锰原子有五个空的d2sp3杂化轨道, 可容纳来自五个羰基的孤对电子,含有成单 电子的第六个轨道则与另一个锰原子的同样 的轨道重叠形成Mn-Mn键。
(2)Co2(CO)8
两个CO分别桥接两个钴原子,除此之外, 每个钴原子还和三个端羰基相连。由于两个 钴原子之间还形成Co-Co金属键,所以钴的 配位数也是6。显然,钴与钴是以d2sp3杂化轨 道不寻常的方式重迭,故Co-Co键呈弯曲形。
4(4 2) e 4.90 e
6.6.2 顺磁共振
顺磁共振是研究具有未成对电子的物质,如配合 物.自由基和含有奇数电子的分子等顺磁性物质结构 的一种重要方法,它又称为电子顺磁共振(EPR)或 电子自旋共振(ESR)。 电子的自旋磁矩μ s在磁场方向的分量μ sz为
SZ gmS e
P 1.348 (0.022 ) 10 7 m 3 mol 1
7 3 1
1.370 10 m mol
可判断在该配合物中Mn3+处于高自旋态,有4个未 成对电子,磁矩为:
797 .7 295 1.370 10 7 e 5.07 e
2.核磁共振波谱法的发展概况
6.4 金属-金属四重键
6.4 金属-金属四重键
在过渡金属配位化合物中,金属 原子之间可以形成单键,双键,三重 键和和四重键,四重键的形成必须有d 轨道参加,所以它只能在过渡金属原 子之间形成:今以K2 (Re2Cl8 )· 2O 2H 晶体中的Re2Cl82-离子结构为例:
最早发现金属-金属之间存在四重键的化合物是, 金属Re晶体中Re-Re间距276pm,但离子中Re-Re间距 仅224 pm,每个Re与四个Cl形成的四边形配位,一般 情况下两组ReCl4应交错排列,可获得较小的核排斥能, 如C2H6中两组CH3是交错排列,而实验证明在中,两 组却是正重迭排列,这是由于Re-Re 间有多重键存在。 Re原子的电子组态为[Xe]5d56s2,Re以dsp2杂化轨 道与四个Cl-形成σ键外,还有四个d轨道四个d电子, 当两组ReCl4沿z轴方向靠近时,两个dz2轨道重叠形成σ 键,dyz-dyz,dxz-dxz相互重叠形成简并的π键,dzydzy形成δ键。 后来发现Cr2(OCR)4, Mo2(OCR)4等金属簇合物也存 在金属四重键,金属间三重键外,四个羧基与双金属 还形成一个大δ键。
过渡金属簇合物
-------------------------键 M-M 键长(Å)
[Re2Cl8]2双核 四重键 2.24 [Re3Cl12]3- 三核 双键 2.48 [Re3Cl9] 三核 双键 2.48 [Mo6Cl8]4+ 六核 单键 2.61 [Nb6Cl12]2+ 六核 2/3 键 2.82 ---------------------------------------------------------------------------
= 10, 二帽四方棱柱体 = 11, 十八面体 = 12, 二十面体. -----------------------------------------------------------b= n= 结构类型 -----------------------------------------------------------n+1 Vclo 闭合 n+2 Vclo-1 巢式 n+3 Vclo-2 网式 n+4 Vclo-3 敞网式 n+0 Vclo+1 单帽 n-1 Vclo+2 二帽
2) 金属-金属键 ⅰ) 第二和第三系列过渡金属比第一系列过渡金 属更容易形成金属-金属键, 例如 对 M6X12n+, 只有 Nb 和 Ta 的例子 对 M3-簇,有 Mo3, W3; 但无 Cr3 簇;有 Tc2Cl82-, Re2Cl82-,但无 Mn2Cl82- 的报道 ⅱ) 金属处于低氧化态有利于形成 M-M 键, 因 此多核金属羰基化合物总是含有 M-M 键; ⅲ) 桥联配体有助于形成 M-M 键,这些配体有 如 –O CCH , Cl- 和 CO 2 3
3) 原子簇与催化作用 M2[Rh12(CO)30] (M= Ag+, Tl+) Rhcat 3CO + 5H2 HOCH2CH2OH + CH3OH 2 多核羰基、亚硝酰基及相关化合物 例如, Mn2(CO)10, Co2(CO)8, Fe3(CO)12, CO 在多核金属羰基化合物中有两种结合方式: 端基和桥联方式。 利用 IR 鉴别 CO 在金属羰基化合物中的键合方 式: 游离 CO, υCO= 2143 cm-1 端基 υCO= 2000 ±100 cm-1
金属团簇的研究与应用
金属团簇的研究与应用随着人们对金属材料的需求不断增长,金属团簇的研究逐渐成为了各大科研机构和企业的热门话题。
金属团簇,是由几个或几十个金属原子组成的微小物体,其尺寸一般介于1纳米到10纳米之间。
金属团簇表现出与其它材料不同的独特性质,具有很高的应用价值,在生物医学、电子、电化学、光电子学、能源等领域均有广泛应用。
一、金属团簇合成方法金属团簇合成方法有多种,其中主要包括溶液化学方法、气相合成方法、离子束法、溅射法、聚集诱导方法、超声波辅助合成法、光化学合成法等。
溶液化学法是最常用的方法之一,它可以通过调整反应物浓度、温度、pH值、还原剂浓度以及添加剂等方法,控制金属团簇的尺寸和形貌。
二、金属团簇的结构与性质金属团簇的结构复杂多样,其结构和性质受到金属原子种类、尺寸、表面修饰以及配位原子等因素的影响。
金属团簇通常有两种主要结构,一种是核壳结构,核心是高对称性的金属原子团簇,外围由低对称性的金属原子包裹;另一种是毛刺结构,由较小的金属原子集聚形成过渡金属簇,原子间的成键主要是金属-金属键和金属-配体键。
金属团簇的性质包括光学、电学、磁学、热学、力学等。
三、金属团簇在生物医学中的应用金属团簇在生物医学领域的应用主要包括医学成像、治疗性物质传递、分子诊断和分子探针等方面。
其中,金属团簇在MRI成像中有着很大的应用前景。
相比传统MRI造影剂,金属团簇具有更好的生物相容性、较高的核磁共振信号、较低的毒性和更长的循环时间。
此外,金属团簇还可以用于生物标记、光学成像、药物载体等方面,取得了不错的研究进展。
四、金属团簇在电子、光电子学和能源方面的应用金属团簇在电子和光电子学领域的应用主要包括电化学传感器和沟通器、光场、光电转换器和纳米激光器等方面。
通过与有机分子的结合,可以提高电子转移速度和电子响应灵敏度。
在能源领域,金属团簇的应用主要集中在太阳能电池、燃料电池、超级电容器、锂离子电池和热电材料等方面。
其中,金属团簇在燃料电池方面的应用,具有优异的催化性能和高的能源转换效率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
b=16 8个3c-2e
Nb
键
Nb Nb
Rh6(3-CO)4(CO)12 g=69+42+122
=86
b=11 3个2c-2e Rh-Rh键
4个3c-2e
Rh
键
Rh Rh
5. 六核以上
三、等同键价和等同结构
8电子规则(八隅律):主族元素
18电子规则
:过渡金属元素
结合起来
含n1个过渡金属原子 n2个主族元素原子
291~336pm (d) Ag2C2·5AgNO3
271~336pm (e) Ag2C2·6AgNO3
295~305pm (f) Ag2C2·8AgF
郭国聪,周公度,麦松威,JACS, 121, 3136~3141(1999)
3. 金属线分子
(a) 镍线
(b) 金线 (c) 铬线 [Cr5(tpda)4Cl2]·2Et2O·4CHCl3
4个3c-2e 键
M
M M键
和Rh6(3-CO)4(CO)12相似
其他等同键价和等同结构系列举例
四、簇合物的催化功能
金属簇(Mn)键价(b)不变,几何形状不变,为反应 物分子提供活动的舞台。具有不断接纳反应物放出产物 的催化功能。
例1 Ru3(CO)12催化水煤气反应 CO + H2O CO2 + H2
反键轨道Βιβλιοθήκη LUMO能隙较大非键、成键轨道
HOMO
2. 簇合物中金属簇的键价及其计算
簇合物:[MnLp]q金属簇:Mn 即n个金属原子 键价(b):n个M原子间形成共价键的总数
二中心二电子键 2c-2e
MM
三中心二电子键 3c-2e
M
MM
补偿2个电子
(CO)5Mn-Mn(CO)5 b=1
补偿4个电子 [Nb6Cl18]4-中的三角形面
2. 亲银作用(argentophilicity)
和亲金作用相似,在银簇合物和金银混合簇合物中呈现亲银作用。
乙炔银复盐中包藏C22-的 银多面体结构 (a) Ag2C2·2AgClO4·2H2O
Ag···Ag(实线) (b) Ag2C2·2AgNO3
292.5pm (c) Ag2C2·5.5AgNO3
Re4(CO)162g=62 b=5
Os4(CO)16 g=64 b=4
3. 五核
4. 六核
3种六核簇合物的结构和化学键
[Mo6(3-Cl)8Cl6]2g=66+85+61+2
=84
b=12 12个2c-2e Mo-Mo键
[Nb6(2-Cl)12Cl6]4g=65+123+61+4
b=2
键价 b= (18n-g)/2 g包括: (1) n个M原子的价电子
(2) 配位体提供的价电子 (3) 簇合物的净电荷
配位体提供给分子骨干的电子数目 (骨干原子作不带净电荷计算)
二、键价和几何构型
1. 三核
2. 四核
3种四核过渡金属簇合物的键价和结构
Ir4(CO)12 g=60 b=6
组成的簇合物骨干的键价
b
1 2
(18n1
8n2
g
)
金属碳硼烷
(BH)
(CH)
Ru(CO)3
(BH)62g=26
(BH)4(CH)2 g=26
[Ru(CO)3]4(CH)2 [Ru(CO)3]62-
g=66
g=86
b=11
b=11
b=11
b=11
3个2c-2e 键 M-M 键 (M=B, C, Ru)
例2 [Ru3H(CO)11]-1 催化羰基化反应
RHC=CH2 + CO + H2 RCH2CH2CHO
例3 Ni4(CNCMe3)7 催化乙炔合成苯
3C2H2 C6H6
五、金属-金属相互作用
1. 亲金作用(aurophilicity) 亲金作用指在一价金的簇合物分子中,非键的Au(I)原子间 的相互吸引作用。
通过Au···Au相互吸引作用聚合
一价金的电子组态为闭壳层结构Au(I): [Xe]4f145d106s0 按常理,非键的同类原子应相互推斥,原子间距离大于范德华 半径和: 2 166pm = 332pm 是什么原因导致亲金作用,使 Au···Au 距离缩短?是相对论效 应导致 6s 轨道收缩形成(6s5d)10不呈现闭壳层结构
过渡金属簇合物中 金属-金属键
北京大学化学学院 周公度
过渡金属簇合物中 金属-金属键
过渡金属簇合物是由3个或3个以上过渡 金属原子直接成键,形成多面体或缺顶 多面体的骨架,周围连接配体的化合物。
一、18电子规则和M-M键的键价
1. 18电子规则
在簇合物分子中,每个过渡金属原子倾向于在9个价 轨道[5个(n-1)d, 1个ns, 3个np]中填满18个电子。即分 子的全部成键分子轨道和非键轨道都填满电子, HOMO和LUMO间有较大能隙。
